青稞俗称裸大麦,是青藏高原一种常见的粮食作物,具有耐高寒、适应性强、高产早熟等特点[1]。特殊的生长环境赋予其高蛋白、高纤维、高维生素和低脂肪、低糖的三高两低特性和富含β-葡聚糖等功能因子,具有很好的营养功能[2-3],对预防心血管疾病、糖尿病等有显著作用[4-6]。
淀粉是青稞的重要组成成分,被人体分解利用,供给人体热量,因其消化性不同可以分为快消化淀粉(ready digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)三类[7],快消化淀粉是指在小肠中20 min内消化;慢消化淀粉是指能在小肠中20~120 min内才能被消化;抗性淀粉指120 min内无法在小肠中消化吸收。研究表明,快消化淀粉(RDS)作为日常主食的主要成分,使人很快饥饿增加食欲从而容易引致肥胖和影响脂类新陈代谢;慢消化淀粉(SDS)能够缓慢释放能量,可以保证饭后血糖的相对稳定,避免造成大幅度的波动引起血糖过高和过低的现象,有益于高血压、糖尿病和肥胖患者病情调控[8-9];抗性淀粉(RS)作为一种新型的膳食纤维功能性成分,具有降低血糖指数、改善结肠微生物群落的潜力[10]。因此,降低快消化淀粉含量、提高慢消化淀粉含量的研究对人体健康有重要意义。青稞淀粉约占青稞籽粒干质量的70%左右[11],而快消化淀粉占青稞淀粉的75.17%、慢消化淀粉占青稞淀粉的12.32%、抗性淀粉占青稞淀粉的12.51%。可通过改性而改变淀粉的分子结构、功能性、消化性等,制备成为青稞改性淀粉,从而扩大青稞淀粉的应用[12]。改变淀粉结构的方法有物理法、化学法、酶法、加工处理(如常压、高压蒸煮)等[13]。其中酶法具有效率高、能耗低、污染小等特点[14]。安攀宇[15]使用α-淀粉酶、β-淀粉酶、普鲁兰酶制备青稞慢消化淀粉,发现当普鲁兰酶添加量为200 U时慢消化淀粉含量达到最高值;张倩倩[11]利用酶解法制备青稞慢性消化淀粉并进行工艺优化研究,发现普鲁兰酶的添加量200 U,酶解时间10 h,冷藏回生时间1 d,淀粉含量为15%时,慢消化淀粉含量为32.72%。GURAYA H S等[16]利用普鲁兰酶处理大米淀粉,结果显示慢消化淀粉的含量增加。
本试验以青稞为原料,通过普鲁兰酶协同α-葡萄糖苷酶降低青稞快消化淀粉(RDS)含量。考察酶添加量、料液比、酶解时间和温度对青稞快消化淀粉含量的影响,在单因素试验基础上,以快消化淀粉含量为响应值,选择3因素3水平的响应面试验探究最优酶解工艺参数,以期拓展青稞在食品上的应用,推进高原健康食品的发展,对糖尿病患者及需低糖饮食人群有一定意义。
1 材料与方法
1.1 材料与试剂
萌芽黑青稞粉:青海汉和生物科技股份有限公司;普鲁兰酶(酶活力1 500 U/mL)、糖化酶(酶活力10万U/mL):江苏锐阳生物科技有限公司;α-葡萄糖苷酶(酶活力70万U/mL):上海吉至生化科技有限公司;猪胰α-淀粉酶(酶活力50 U/mg):合肥博美生物科技有限责任公司;淀粉含量检测试剂盒(50T/48S):北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LR10M 冷冻离心机、H/T16MM 台式高速离心机:湖南赫西仪器装备有限公司;THZ-82恒温振荡器:国华实业有限公司;UV-1780紫外可见分光光度计:岛津仪器(苏州)有限公司;Tissuelyser-96多样品组织研磨仪:上海净信实业发展有限公司;MULTISKAN Sky全波长酶标仪:北京平利洋经贸有限公司。
1.3 试验方法
1.3.1 改性青稞粉的制备
酶改性青稞粉的制备参照王晓燕等[17]的方法并稍作修改。称取6 g青稞粉溶于50 mL蒸馏水中并搅拌至无结块,加入1 mol/L pH 5.2的乙酸钠缓冲溶液(称取6.804 g乙酸钠蒸馏水溶解,后加入1.118 5 mL的乙酸,定容至50 mL)5 mL,加入一定量的普鲁兰酶和α-葡萄糖苷酶,然后立即放入温度为65 ℃、转速150 r/min的恒温振荡器中振荡2 h。反应结束后立即将锥形瓶放入沸水浴锅里灭酶10 min,冷却后将锥形瓶中的样品转移到300 mL离心管中再入50 mL洗涤液,放入离心机中5 000 r/min离心10 min,得到的固体用蒸馏水洗涤并再次离心,重复2次,结束后取出沉淀物于平皿中,然后放入60 ℃的鼓风干燥箱中烘干,采用多样品组织研磨仪,在50 Hz条件下研磨70 s,备用。
1.3.2 酶添加量的确定
普鲁兰酶添加量的确定:在酶解温度为65 ℃、料液比为1∶10(g∶mL)、酶解时间为2 h条件下,分别测定普鲁兰酶添加量分别为120 U/g、160 U/g、200 U/g、240 U/g、280 U/g时的快消化淀粉含量。
α-葡萄糖苷酶添加量的确定:选取最适普鲁兰酶添加量,在酶解温度为65 ℃、料液比为1∶10(g∶mL)、酶解时间为2 h条件下,分别测定葡萄糖苷酶添加量分别为20 U/g、50 U/g、80 U/g、110 U/g、140 U/g时的快消化淀粉含量。
1.3.3 酶解工艺优化单因素试验
在选出最佳双酶添加量基础上,以快消化淀粉含量为评价指标,分别考察酶解温度(45℃、55℃、65℃、75℃、85℃)、酶解时间(1 h、2 h、3 h、4 h、5 h)及料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))对酶解效果的影响。
1.3.4 酶解工艺优化响应面试验
在单因素试验基础上,固定普鲁兰酶添加量为200 U/g,酶解温度为55 ℃,选取α-葡萄糖苷酶添加量(A)、料液比(B)以及酶解时间(C)3个因素为自变量,以快消化淀粉含量(Y)为响应值,采用3因素3水平中心组合设计,优化酶降解青稞快消化淀粉酶解工艺,响应面试验设计因素与水平见表1。
表1 响应面试验设计因素与水平
Table 1 Factors and levels of response surface experimental design

1.3.5 总淀粉含量的测定
采用淀粉含量检测试剂盒法测定总淀粉(total starch,TS)含量。以0.10mg/mL、0.05mg/mL、0.04mg/mL、0.03mg/mL、0.02 mg/mL、0.01 mg/mL葡萄糖标准溶液质量浓度(x)为横坐标,以波长620 nm处测定的吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到标准曲线线性回归方程:y=12.192x+0.002,相关系数R2=0.999 2。总淀粉含量计算公式如下:
式中:TS为总淀粉含量,mg/g;X为测得的吸光度值对应标准曲线的葡萄糖含量,mg/mL;D为稀释倍数1 000;V为提取后总体积,mL;W为称取的改性青稞粉质量,g。1.11为换算系数。
1.3.6 快消化淀粉含量的测定
快消化淀粉含量体外模拟消化参考缪铭等[18]的方法,并稍作修改。称取酶改性青稞粉0.2 g,加入0.2 mol/L pH 5.2的乙酸钠缓冲溶液(称取6.804 g乙酸钠蒸馏水溶解,后加入1.118 5 mL的乙酸,定容至250 mL)15 mL,同时加入5颗玻璃珠,加入混酶液10 mL。立即放入37 ℃的恒温振荡锅中150 r/min分别反应0、20 min后,取出沸水浴灭酶10 min,放入冷水中冷却至常温。取体外模拟消化后的溶液2 mL于离心管中,放入离心机4 500 r/min离心15 min,取上清液100 μL,加入900 μL蒸馏水后,加2 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),沸水浴反应5 min后,冷水循环冷却至室温后加入12 mL蒸馏水,混匀,使用紫外分光光度仪在波长540 nm处测定吸光度值,每个样品分别做3组平行,并设置空白对照组,取平均值,快消化淀粉含量计算公式如下:
式中:G20为样品酶解20 min时的葡萄糖含量,mg/g;G0为样品酶解0 min 时葡萄糖的含量,mg/g;0.9为还原糖(以葡萄糖计)换算成淀粉的换算系数;TS为总淀粉含量,mg/g。
式中:G为葡萄糖含量,mg/g;At为吸光度值;D为稀释倍数1 500;W为测定时称取的青稞粉质量,g。
1.3.7 改性青稞粉体外降血糖活性测定
(1)α-淀粉酶抑制率测定
参照梁宗瑶等[19]的方法,准备150 μL的样品液和0.5 mg/mL的α-淀粉酶液150 μL,混合均匀后于37 ℃孵育10 min,然后将250 μL的1%的可溶性淀粉溶液加入混合液中,并在37 ℃继续孵育10 min,加入500 μL的DNS停止反应,在沸水浴中反应5 min。冷却后取200 μL于96孔板中,使用酶标仪在波长540 nm处测定吸光度值,每个样品做3个平行,并设置空白对照,取平均值,α-淀粉酶抑制率计算公式如下:
式中:a为含有α-葡萄糖苷酶溶液和待测样品的测定吸光度值;b为不含α-葡萄糖苷酶溶液含有待测样品的测定吸光度值;c为含有α-葡萄糖苷酶溶液却不含待测样品的测定吸光度值。
(2)α-葡萄糖苷酶抑制率测定
参照赖晓桦等[20]的方法,称取0.05 g改性青稞粉,加入0.05 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)(pH 6.8)600 μL,滴加300 μL 20 mmol/L的对硝基苯-α-D-吡咯葡萄糖苷(p-nitrophenyl α-D-glucopyranoside,pNPG)溶液;并在37 ℃振荡水浴锅中反应20 min,后滴加0.2 U/mL的α-葡萄糖苷酶溶液200 μL,室温反应10 min后,加入反应终止液0.1 mol/L Na2CO3 1.65 mL,并在3 000 r/min的转速条件下离心10 min,吸取200 μL上清液于96孔板中,用酶标仪于波长405 nm处测定其吸光度值。本试验中的空白对照为pH 6.8、0.05 mol/L PBS溶液。α-葡萄糖苷酶抑制率计算公式如下[18]:
式中:a为含有α-葡萄糖苷酶溶液和待测样品的测定吸光度值;b为不含α-葡萄糖苷酶溶液含待测样品的测定吸光度值;c为含有α-葡萄糖苷酶溶液不含样品的测定吸光度值;d为不含α-葡萄糖苷酶溶液和待测样品的测定吸光度值。
2 结果与分析
2.1 普鲁兰酶添加量的确定
由图1可知,当普鲁兰酶添加量在120~200 U/g时,快消化淀粉含量随着普鲁兰添加量的增大而下降;当普鲁兰酶添加量在200 U/g时,快消化淀粉含量最低,为57.14%;当普鲁兰酶添加量>200 U/g之后,快消化淀粉含量有所上升。酶解产物积累至一定程度会反向抑制酶解,随着添加量的增加,快消化淀粉含量逐渐增加,增加趋势较大。普鲁兰酶酶解会增加直链淀粉含量[21],直链淀粉比例与抗性淀粉含量呈正相关[22-24],从而造成快消化淀粉含量减少。综上,确定最适的普鲁兰酶添加量为200 U/g。
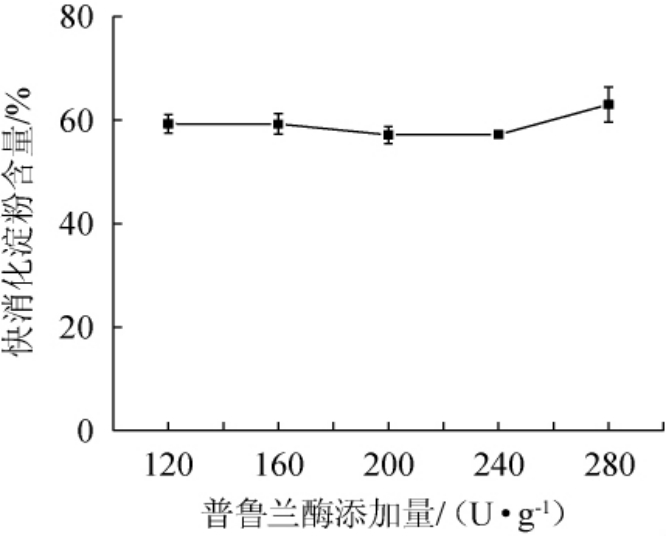
图1 普鲁兰酶添加量对青稞快消化淀粉含量的影响
Fig.1 Effect of pullulanase addition on rapid digestible starch contents of highland barley
2.2 α-葡萄糖苷酶添加量的确定
由图2可知,在α-葡萄糖苷酶添加量为20~80 U/g时,随着α-葡萄糖苷酶添加量的增加,快消化淀粉的含量减少;当普鲁兰酶添加量在80 U/g时,快消化淀粉含量最低,为57.01%;当普鲁兰酶添加量>80 U/g之后,快消化含量有所上升。因为α-葡萄糖苷酶可将游离的葡萄糖基转移到其他底物上,并形成α-1,6-糖苷键,得到非发酵性的低聚异麦芽糖或糖酯、糖肽等[25]。因此,最佳α-葡萄糖苷酶的添加量为80 U/g。
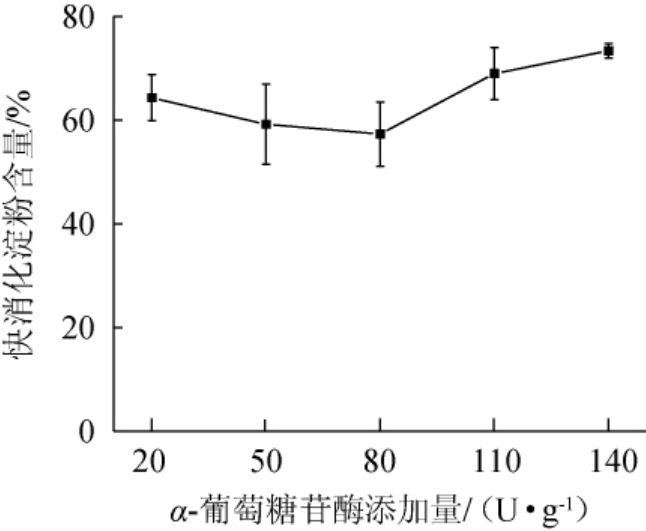
图2 α-葡萄糖苷酶添加量对青稞快消化淀粉含量的影响
Fig.2 Effect of α-glucosidase addition on rapid digestible starch contents of highland barley
2.3 酶解工艺优化单因素试验结果
2.3.1 料液比对青稞快消化淀粉含量的影响
由图3可知,当料液比为1∶5~1∶15(g:mL)时,快消化淀粉含量随之减少;当料液比为1∶15(g∶mL)时,快消化淀粉含量最低,为60.21%;当料液比为1∶15~1∶25(g∶mL)时,随着料液比的减小,酶解效果减弱。可能是因为料液比过小时,导致溶液中的酶浓度降低,酶与淀粉的接触机率减少;当料液比较大时,酶与淀粉之间的流动性较低,不易酶解,快消化淀粉含量降低较少[26]。因此,确定最佳酶解料液比为1∶15(g∶mL)。
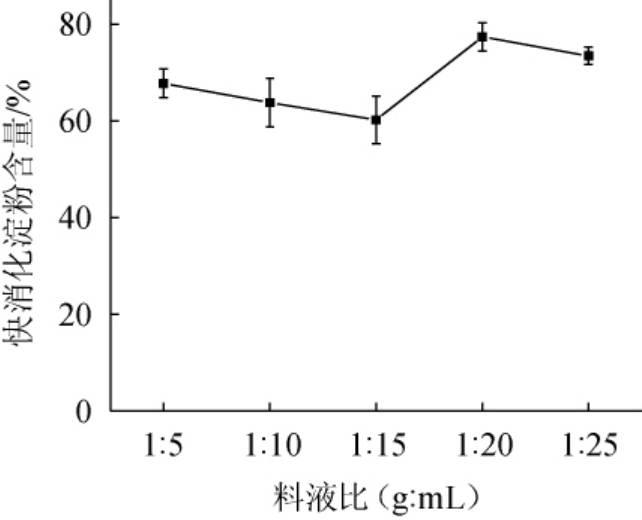
图3 料液比对青稞快消化淀粉含量的影响
Fig.3 Effect of solid and liquid ratio on rapid digestible starch contents of highland barley
2.3.2 酶解温度对青稞快消化淀粉含量的影响
由图4可知,快消化淀粉的含量随着酶解温度在45~85 ℃内的升高呈现先降低后增加的趋势。当酶解温度为45~55 ℃时,快消化淀粉含量随之减少;当酶解温度达到55 ℃时,青稞快消化淀粉的含量最低,为59.09%。当酶解温度高于55 ℃之后,随着酶解温度升高,快消化淀粉含量升高,可能是因为温度过高导致了淀粉的降解造成[27]。因此,确定最佳酶解温度为55 ℃。
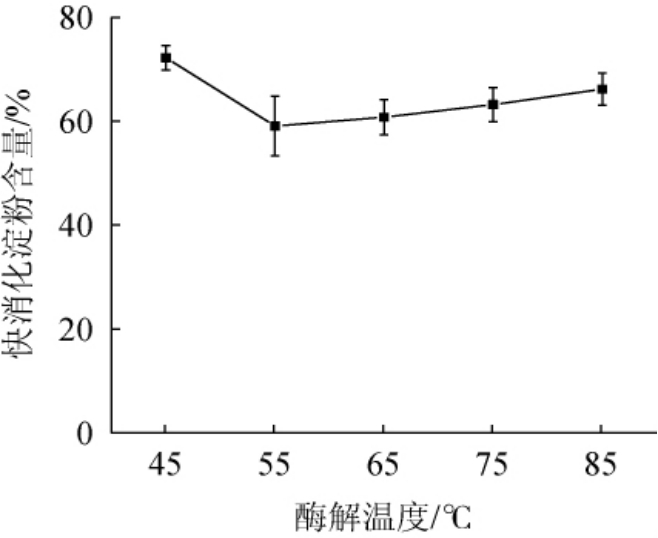
图4 酶解温度对青稞快消化淀粉含量的影响
Fig.4 Effect of enzymolysis temperature on rapid digestible starch contents of highland barley
2.3.3 酶解时间对青稞快消化淀粉含量的影响
由图5可知,当酶解时间为1~3 h时,青稞快消化淀粉的含量逐渐降低;当酶解时间为3 h时,快消化淀粉含量最低,为56.39%;当酶解时间>3 h之后,青稞快消化淀粉含量逐渐升高。可能是因为酶解时间过长,支链淀粉含量减少,后期快消化淀粉酶解的速度大于慢消化淀粉,导致快消化淀粉的含量增加[28]。因此,确定最佳酶解时间为3 h。
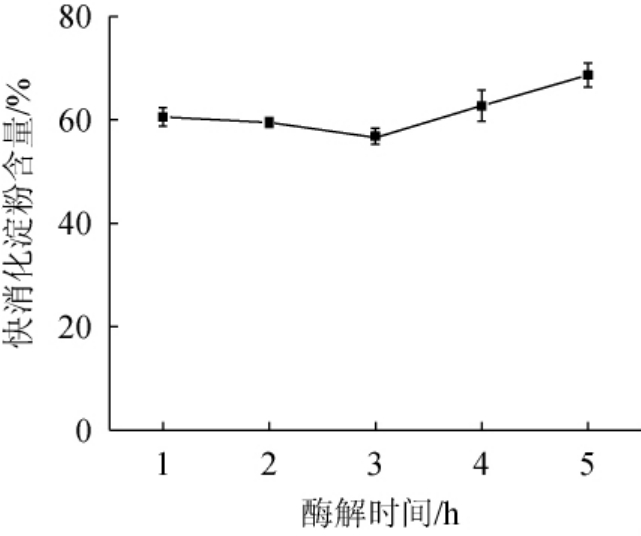
图5 酶解时间对青稞快消化淀粉含量的影响
Fig.5 Effect of enzymolysis time on rapid digestible starch contents of highland barley
2.4 响应面试验结果
基于单因素试验结果,以α-葡萄糖苷酶添加量(A)、料液比(B)、酶解时间(C)为自变量,以快消化淀粉含量(Y)为响应值,采用Box-Behnken模型设计出包括17个试验点的试验方案,响应面试验方案及结果见表2。
表2 响应面试验设计及结果
Table 2 Design and results of response surface experiments
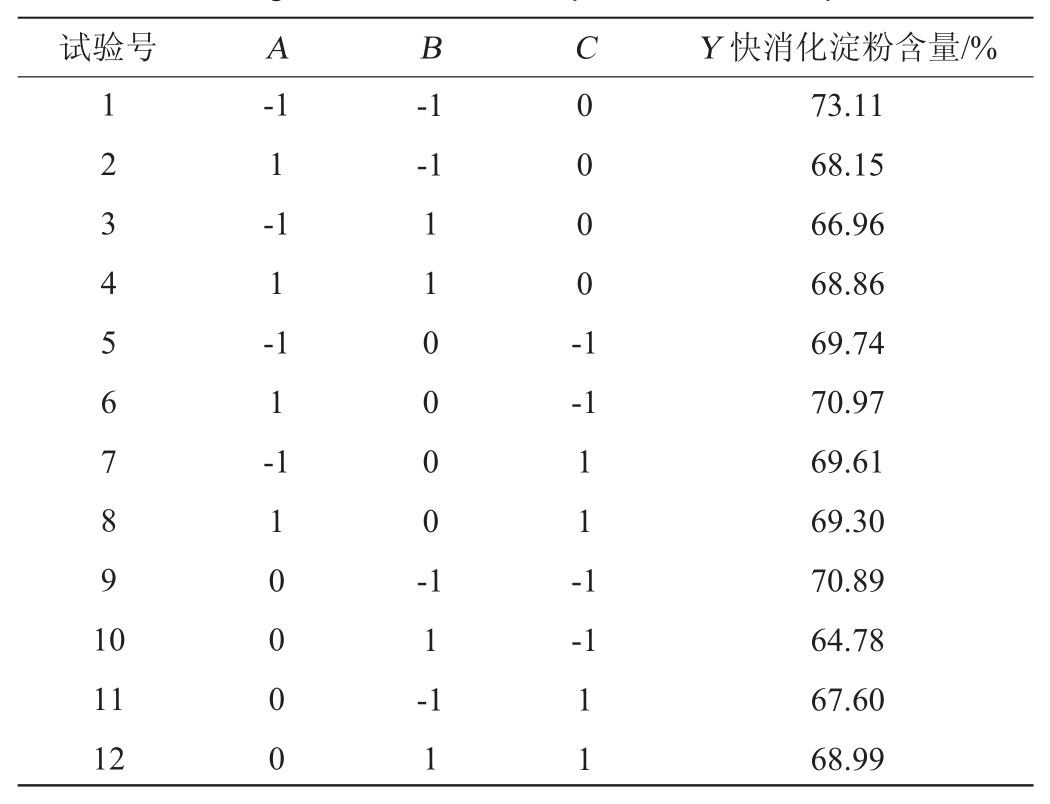
续表
2.4.1 回归模型的建立与显著性分析
对表2数据用Design-Expert 8.0.6软件进行回归拟合得到回归模型方程如下:
对上述回归模型进行显著性检验,方差分析结果见表3。由表3可知,该模型F值等于26.55,且P值<0.000 1,表明拟合模型具有显著性。失拟项是模型数据变异的体现,失拟项P值=0.791 3>0.05,不显著,说明该回归方程无失拟因素,试验结果的拟合度是比较好的[28]。变异系数(coefficient of variation,CV)表示试验的精确度,CV越大越不可靠,本试验中CV值(2.17%)较小,结果可靠。模型的决定系数R2为0.972 5,调整决定系数R2Adj为0.935 0,说明该模型可以解释大概94%响应值的变化。由P值可知,该模型的二次项A2、B2、C 2对青稞快消化淀粉含量影响极显著(P<0.01),一次项B、交互项AB、BC对青稞快消化淀粉含量影响显著(P<0.05),一次项A、C和交互项AC对青稞快消化淀粉含量影响不显著(P>0.05)。由F值可知,影响青稞快消化淀粉含量因素顺序为B(料液比)>A(α-葡萄糖苷酶添加量)>C(酶解时间)。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
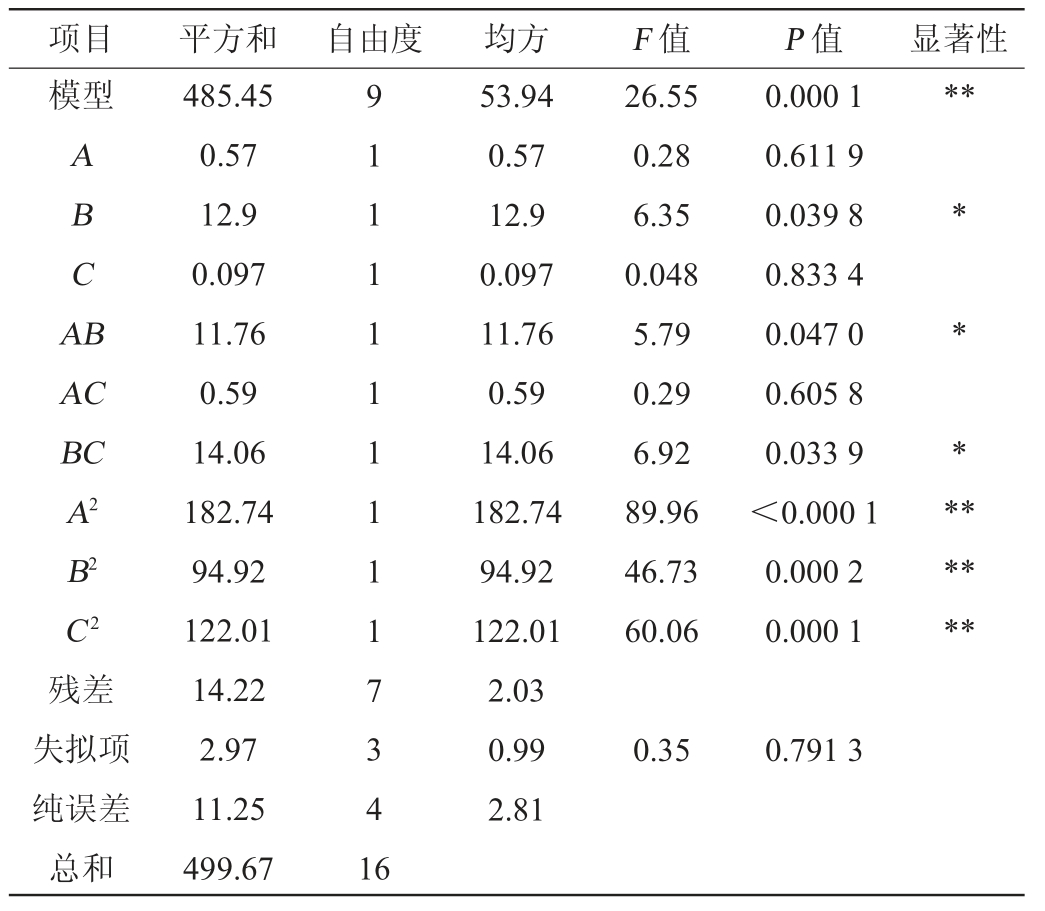
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
2.4.2 响应面试验结果分析
由图6可知,α-葡萄糖苷酶添加量和料液比、料液比和酶解时间对青稞快消化淀粉含量有显著影响(P<0.05),α-葡萄糖苷酶添加量和酶解时间对青稞快消化淀粉含量影响不显著(P>0.05),这与表3的方差分析结果一致。
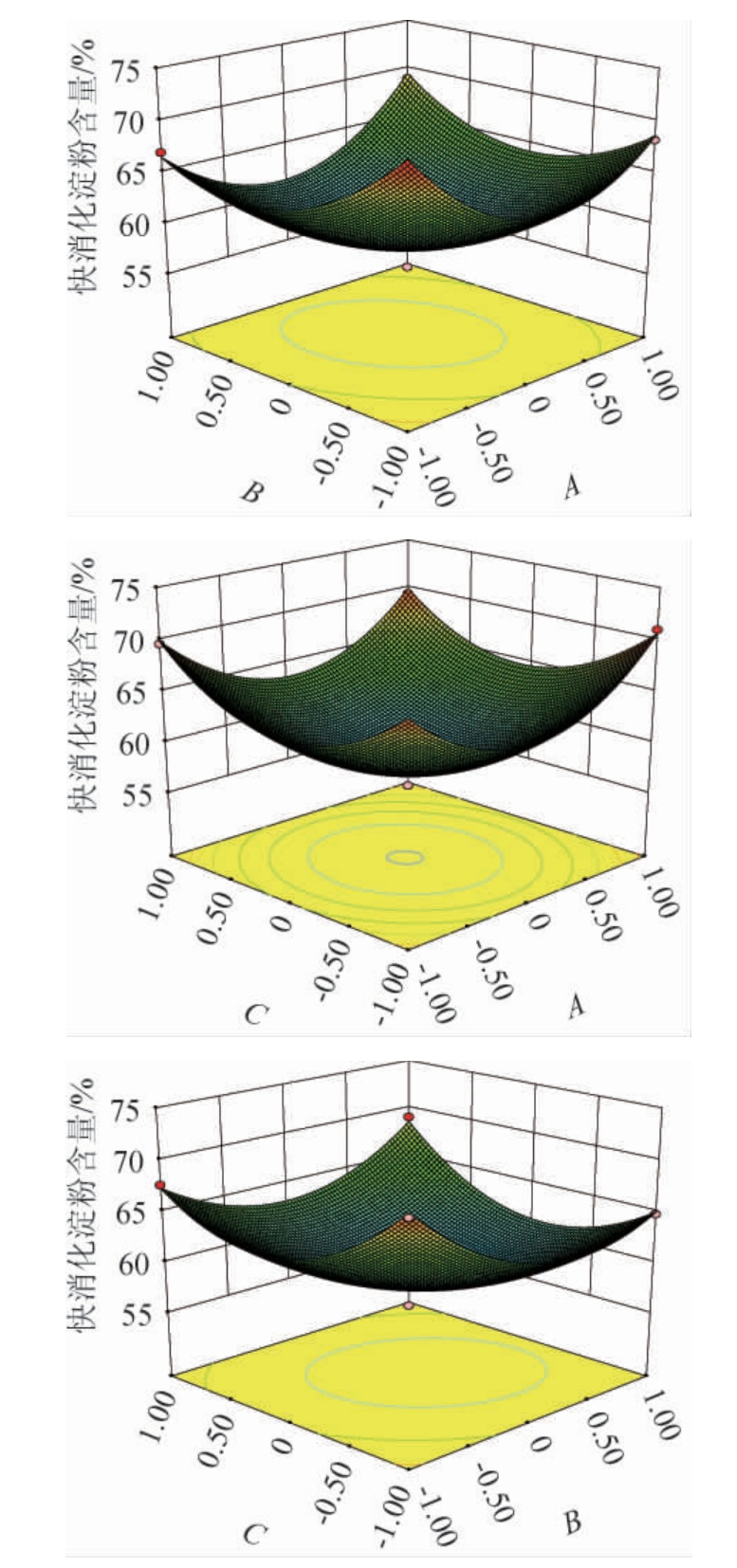
图6 各因素间交互作用对青稞快消化淀粉含量影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between various factors on rapid digestible starch contents of highland barley
2.4.3 验证试验
由Design-Expert 8.0.6软件分析后,得到最优酶解工艺条件为:α-葡萄糖苷酶添加量80.3 U/g、料液比为1∶15(g∶mL)、酶解时间为2.9 h。在此优化条件下,青稞快消化淀粉含量预测值为57.85%。为了便于实际操作,将最优酶解工艺条件修正为:α-葡萄糖苷酶添加量80 U/g、料液比1∶15(g∶mL)、酶解时间3.0 h。在此优化条件下进行3次平行验证试验,青稞快消化淀粉含量实际值为54.95%,与预测值差别不大。
2.5 改性青稞粉体外降血糖活性测定结果
淀粉等先在人体内被α-淀粉酶水解为麦芽糖等双糖,再被α-葡萄糖苷酶水解成葡萄糖、果糖等单糖,之后被小肠吸收,因此抑制α-淀粉酶和α-葡萄糖苷酶的活性可以降低餐后血糖。由图7可知,改性青稞粉的α-淀粉酶和α-葡萄糖苷酶的抑制率分别为90.94%和91.89%,比原粉分别增加了68.1%和50.4%,说明经过普鲁兰酶和α-葡萄糖苷酶双酶酶解后,青稞淀粉的体外降血糖活性得到了明显提高,可以为后期低血糖生成指数(glycemic index,GI)食品的研发提供理论基础。
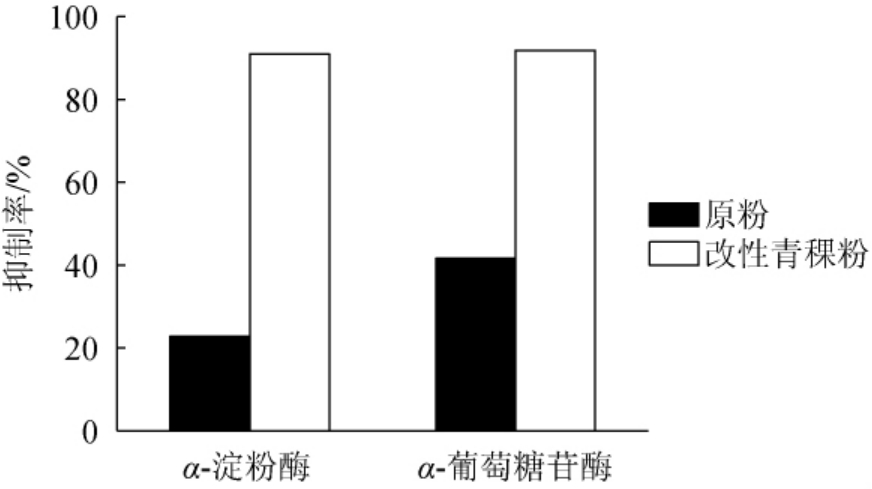
图7 α-淀粉酶和α-葡萄糖苷酶的抑制率
Fig.7 Inhibitory rate of α-amylase and α-glucosidase
3 结论
本试验研究普鲁兰酶协同α-葡萄糖苷酶降低青稞快消化淀粉含量的酶解工艺条件,在单因素试验的基础上,设计响应面试验分析优化α-葡萄糖苷酶添加量、料液比、酶解时间对快消化淀粉含量的影响。结果表明,普鲁兰酶协同α-葡萄糖苷酶降低青稞快消化淀粉含量的最佳酶解工艺条件为:普鲁兰酶添加量200 U/g、α-葡萄糖苷酶添加量80 U/g、料液比1∶15(g∶mL)、酶解时间3 h、酶解温度55 ℃。在此优化条件下,改性青稞粉快消化淀粉含量为54.95%,比未处理过的青稞粉中快消化淀粉含量(75.17%)降低了20.22%。体外降血糖活性测定结果表明,改性青稞粉的α-淀粉酶和α-葡萄糖苷酶的抑制率分别为90.94%和91.89%,比原粉分别增加了68.1%和50.4%,说明经过双酶协同酶解后,青稞淀粉的体外降血糖活性得到了明显提高,为后期研发低GI青稞产品提供了一定的理论依据。
[1]郑学玲,张玉玉,张杰.青稞淀粉和小麦淀粉的理化性质比较研究[J].中国粮油学报,2021,25(10):52-56.
[2]ZENG X Q,GUO Y,XU Q J,et al.Origin and evolution of Qingke barley in Tibet[J].Nat Commun,2018,9(1):1-11.
[3]阚建全,洪晴悦.青稞生物活性成分及其生理功能研究进展[J].食品科学技术学报,2020,38(6):11-20.
[4]GONG L X,JIN C,WU X Q,et al.Determination of arabinoxylans in Tibetan hull-less barley bran[J].Proced Eng,2012,37:218-222.
[5]GONG L X,JIN C,WU L J,et al.Tibetan hull-less barley(Hordeum vulgare L.)as a potential source of antioxidants[J].Cereal Chem,2012,89(6):290-295.
[6]ZHU F M,DU B,XU B J.Superfine grinding improves functional properties and antioxidant capacities of bran dietary fibre from Qingke (hullless barley)grown in Qinghai-Tibet Plateau,China[J].J Cereal Sci,2015,65:43-47.
[7]ENGLYST H N,HUDSON G J.The classification and measurement of dietary carbohydrates[J].Food Chem,1996,57(1):15-21.
[8]王润,党斌,杨希娟,等.低血糖生成指数食品的研究现状与展望[J].青海农林科技,2018(3):68-71.
[9]夏雪娟.青稞全谷粉对高脂膳食大鼠胆固醇肝肠代谢的影响机制研究[D].重庆:西南大学,2018.
[10]林炎,王培鑫,吕芳澜,等.抗性淀粉结构特性和肠道菌群调节功能的研究进展[J].食品科学,2020,41(11):222-232.
[11]张倩倩.青稞慢性消化淀粉制备条件的优化及研究[D].上海:上海海洋大学,2015.
[12]曹承嘉.青稞抗性淀粉的制备及其对酒精性胃损伤的保护作用研究[D].上海:华东理工大学,2020.
[13]于轩.不同来源淀粉的分子结构对其酶解性能影响的研究[D].无锡:江南大学,2013.
[14]冷志富.玉米抗性淀粉的制备及其理化性质研究[D].杨凌:西北农林科技大学,2014.
[15]安攀宇.青稞慢性消化淀粉制备条件的优化研究[J].现代食品,2016(13):111-114.
[16]GURAYA H S,JAMES C,CHAMPAGNE E T.Effect of cooling,and freezing on the digestibility of debranched rice starch and physical properties of the resulting material[J].Starch,2001,53(2):64-74.
[17]王晓燕,岳丹伟,孙培利,等.利用淀粉酶制备低糖青稞粉的研究[J].中国粮油学报,2020,35(7):36-41.
[18]缪铭,张涛,江波.慢消化淀粉体外测定方法的探讨[J].食品与发酵工业,2008,34(12):143-146.
[19]梁宗瑶,魏园园,任维维,等.橡子仁萃取物成分分析及对α-淀粉酶、α-葡萄糖苷酶的抑制作用[J].食品工业科技,2021,42(17):47-55.
[20]赖晓桦,邓甜,胡经飞,等.米糠发酵产物抑制α-葡萄糖苷酶的工艺优化[J].食品工业科技,2021,42(4):128-134.
[21]KIM J S,HYUN T K,KIM M J.The inhibitory effects of ethanol extracts from sorghum,foxtail millet and prosomillet on α-glucosidase and α-amylase activities[J].Food Chem,2011,124(4):1647-1651.
[22]赵凯,陈威,宫玉晶,等.酶脱支处理对颗粒态缓慢消化淀粉形成的影响[J].食品科学技术学报,2019,37(2):42-47.
[23]LU Z H,BELANGER N,DONNER E,et al.Debranching of pea starch using pullulanase and ultrasonication synergistically to enhance slowly digestible and resistant starch[J].Food Chem,2018,268:533-541.
[24]LOCKYER S,NUGENT A P.Health effects of resistant starch[J].Nutr Bull,2017,42(1):10-41.
[25]岳振峰,陈小霞,彭志英.α-葡萄糖苷酶研究现状及进展[J].食品与发酵工业,2000,26(3):63-67,98.
[26]李林林,张梦柯,金征宇,等.双酶法催化玉米淀粉制备γ-CD[J].食品与生物技术学报,2017,36(4):357-363.
[27]欧阳梦云,王燕,林亲录.超声辅助双酶法制备RS-3型籼米抗性淀粉工艺参数优化[J].食品工业科技,2016,37(23):176-182.
[28]刘程玲,胡煜莹,王力翾,等.普鲁兰酶酶解处理红薯淀粉及其性质研究[J].中国粮油学报,2018,33(2):6-11.
[29]朱晨晨.复合酶法改性红薯淀粉制备工艺的优化及其物化特性研究[D].合肥:安徽农业大学,2018.