细菌纤维素(bacterial cellulose,BC)是由醋酸菌属(Acetobacter)、根瘤菌属(Rhizobium)、土壤杆菌属(Agrobacterium)和八叠球菌属(Sarcina)等微生物在不同条件下合成的纤维素统称[1]。细菌纤维素不含木质素、果胶和半纤维素等伴生产物,具有高结晶度和高聚合度,拥有纳米级的超精细网状结构(因此又称为细菌纳米纤维素),具备良好的弹性、聚合性、延展性、可降解性[2-3]。目前,细菌纤维素广泛应用于食品、化妆品、医用敷料、人工角膜和复合材料等领域[4-8],被誉为21世纪最具发展前景的生物材料[9-10]。
目前,国内外对细菌纳米纤维素相关方面的研究开展了大量工作,如高产菌株选育、发酵工艺条件优化、操作方式和代谢机理等[11-13]。但是,制约细菌纤维素产业发展的主要原因是生产成本过高,其关键之处在于发酵效率较低和生产原料成本过高。因此,利用废弃物如酒糟浸出液、黄水等生产细菌纤维素一方面可以降低生产成本,另一方面实现了废弃物的资源化利用[14-16]。GAYATHRI G等[17]利用筛选获得的Komagataeibacter saccharivorans发酵废弃酒糟,细菌纤维素产量为1.24 g/L;张沙沙等[18]利用木薯水解液为发酵培养基,将细菌纤维素的产量提高到5.75 g/L,但是单位体积产量仍然不能满足工业化生产需要。王英男等[19]以乳清液为发酵基质生产细菌纤维素,实现了产量的显著提升,但是原料成本过高,且资源局限。另一方面,我国酿酒工业发达,废弃酒糟产量巨大,酒糟中残留的淀粉、蛋白质和氨基酸丰富,具有开发为细菌纤维素生产原料的潜力。贺富强等[20]用白酒糟酶解液作为促进剂添加到细菌纤维素的基础培养基中,研究表明,酒糟中含有促进细菌纤维素产量提升的活性因子,细菌纤维素产量为4.84 g/L,较对照提升了135.3%。马霞等[21]采用响应面试验设计优化了细菌纤维素的发酵条件,并添加黄酒酒糟浸出液,在发酵温度30 ℃的条件下,培养7 d后的细菌纤维素产量为14.44 g/L,较优化前提高了1.5倍。
在研究文献和前期工作的基础上,认为利用自有的高性能细菌纤维素生产菌株,可以将黄酒酒糟酶解液作为基础培养基,并充分发挥酒糟中活性因子的促进作用,只需添加部分营养物,实现细菌纤维素的高产,降低原料成本。因此,本研究将通过对黄酒酒糟酶解液发酵生产细菌纤维素的工艺条件进行系统优化,以期为细菌纤维素的低成本高产发酵开辟一条新的途径。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
新鲜黄酒酒糟:浙江嘉善黄酒股份有限公司;红茶(金骏眉900):福建南平市一杯香茶叶有限公司;木葡糖酸醋杆菌(Gluconacetobacter xylinus)BC19-2:本实验室驯化,菌体浓度为108个/mL,4 ℃保存备用。
1.1.2 试剂
蔗糖:云南滇鹏糖业有限公司;葡萄糖、柠檬酸、氢氧化钠:国药集团化学试剂有限公司;酵母膏:北京奥博星生物技术有限责任公司;蛋白胨:杭州微生物试剂有限公司;无水乙醇、乙酸:江苏强盛功能化学股份有限公司;葡糖淀粉酶(酶活260 000 U/mL):沧州夏盛酶生物技术有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
细菌纤维素发酵初始培养基:蔗糖10 g,红茶2 g,水100 mL,pH 5.0。煮沸后采用三层纱布过滤后取上清液,冷却至室温。
1.2 仪器与设备
BSA224S电子天平:赛多利斯科学仪器(北京)有限公司;THZ-92B台式恒温培养箱:上海跃进医疗器械有限公司;WB-6数显恒温水浴锅:常州迈诺仪器有限公司;LGJ-10真空冷冻干燥机:北京松源华兴科技发展有限公司。
1.3 方法
1.3.1 酒糟酶解液的制备
将新鲜的黄酒酒糟用搅拌器打碎,按照酒糟干质量加入3倍质量的水,然后加入总体积0.5%的葡糖淀粉酶(酶活260 000 U/mL),充分搅拌均匀,在酶解温度60 ℃条件下酶解3 h后用纱布过滤制得酒糟酶解液,备用。
1.3.2 细菌纤维素的发酵制备
于配制好的细菌纤维素发酵初始培养基中接种6%实验室保存的木葡糖酸醋杆菌BC19-2,25 ℃恒温静置培养5 d,待培养液表面长出细菌纤维素膜,定期称量并计算细菌纤维素的产量。
1.3.3 细菌纤维素的制备条件优化单因素试验
分别考察不同培养基组成的碳源(2%、4%、6%、8%、10%的蔗糖、葡萄糖、新鲜黄酒酒糟酶解液),氮源(0.2%、0.4%、0.6%、0.8%、1.0%的复合氮源(酵母膏∶蛋白胨=1∶1)、硝酸铵及1 g/100 mL、1.5 g/100 mL、2 g/100 mL、2.5 g/100 mL、3 g/100 mL的红茶);初始pH(3、4、5、6、7)、培养温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、接种量(2%、4%、6%、8%、10%);黄酒酒糟酶解液酶解时间(0.5 h、1 h、2 h、3 h、4 h、5 h)、酶解液体积分数(10%、30%、50%、70%、90%)对细菌纤维素产量的影响。
1.3.4 测定方法
采用称质量法(湿质量)测定细菌纤维素产量:取出纤维素膜,冲洗干净;而用酒糟酶解液发酵而成的细菌纤维素膜背面会残留一层酒糟渣颗粒,需用手轻轻搓洗干净,之后置于纱布上方沥干20 min后称质量[22]。
1.3.5 细菌纤维素膜的表征
参考张雯等[23]的方法并做适当的修改:将发酵完成后所得到的细菌纤维素膜清洗干净之后,浸泡于0.1 mol/L的NaOH中,置于烧杯内在水浴锅中90 ℃水浴加热。反复换碱液若干次直至纤维素膜呈半透明状。将膜取出用蒸馏水洗净,放入冰箱-18 ℃预冻至定型,进行真空冷冻干燥,制得冻干的细菌纤维素膜。参照文献[22]进行电镜检测。
2 结果与分析
2.1 培养基组成对细菌纤维素产量的影响
2.1.1 碳源对细菌纤维素产量的影响
由图1可知,随着碳源添加量的增加,细菌纤维素的产量也均有所增加,但在添加量达到6%之后,细菌纤维素的产量趋于平稳。由此可以看出,在碳源浓度较低时,随着碳源添加量的增加,木葡糖酸醋杆菌生长更快,细菌纤维素产量越高;另一方面,3种碳源中以酒糟酶解液为碳源时细菌纤维素产量最大(24.8 g/L),以蔗糖为碳源时产量最小。基于对细菌纤维素发酵初始培养基的比较,进一步考察了3种碳源添加量均为10%时细菌纤维素的发酵能力,酒糟酶解液产细菌纤维素能力最强(24.6 g/L),葡萄糖次之(23.2 g/L),蔗糖最低(20.8 g/L),因此,最佳碳源为酒糟酶解液,最佳添加量为6%。
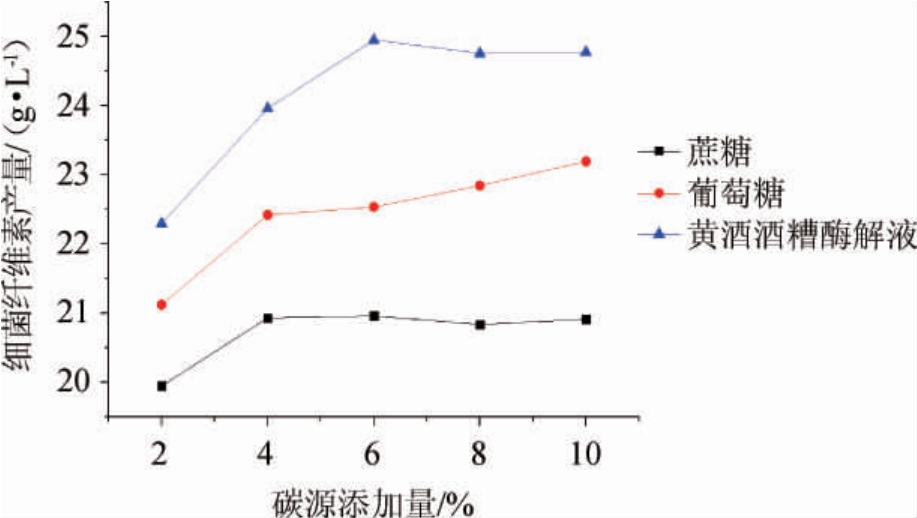
图1 不同碳源添加量对细菌纤维素产量的影响
Fig.1 Effect of different carbon source addition on bacterial cellulose yield
2.1.2 氮源对细菌纤维素产量的影响
由图2可知,随着氮源添加量的增加,细菌纤维素的产量呈先增加后下降的趋势;在复合氮源、硫酸铵添加量为0.60%,红茶添加量为2 g/100 mL时,细菌纤维素产量均达到最大值,分别为21.7 g/L、20.5 g/L、22.4 g/L;当复合氮源、硫酸铵添加量>0.60%,红茶添加量>2 g/100 mL时,细菌纤维素产量逐渐下降。因此,选择最佳氮源为红茶,添加量为2 g/100 mL。
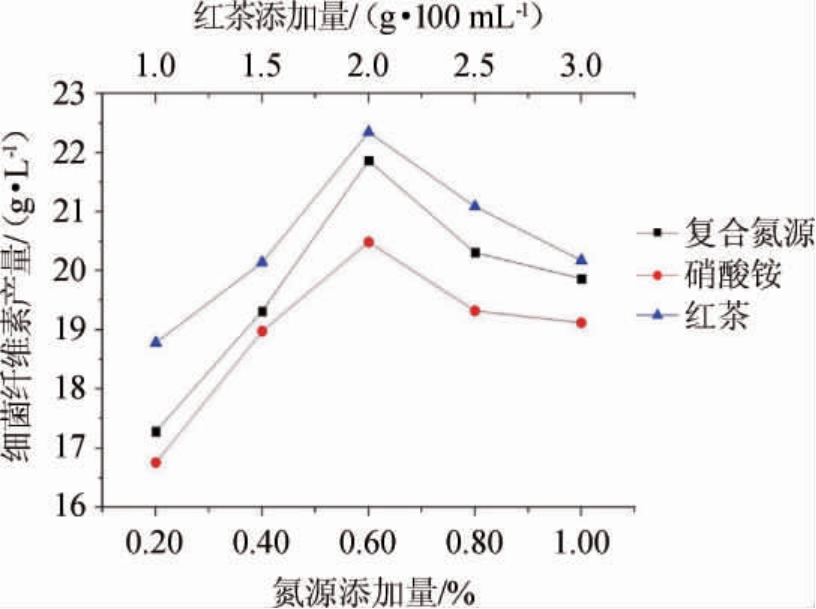
图2 不同氮源添加量对细菌纤维素产量的影响
Fig.2 Effect of different nitrogen source addition on bacterial cellulose yield
2.2 培养条件对细菌纤维素产量的影响
2.2.1 初始pH值对细菌纤维素产量的影响
由图3可知,细菌纤维素产量在培养基初始pH值为6时达到最高。木葡糖酸醋杆菌是醋酸菌属,喜好偏弱酸性的环境,太高或太低的pH值都会对菌种的生长与产细菌纤维素能力产生负面影响[24]。因此,最佳初始pH值为6。
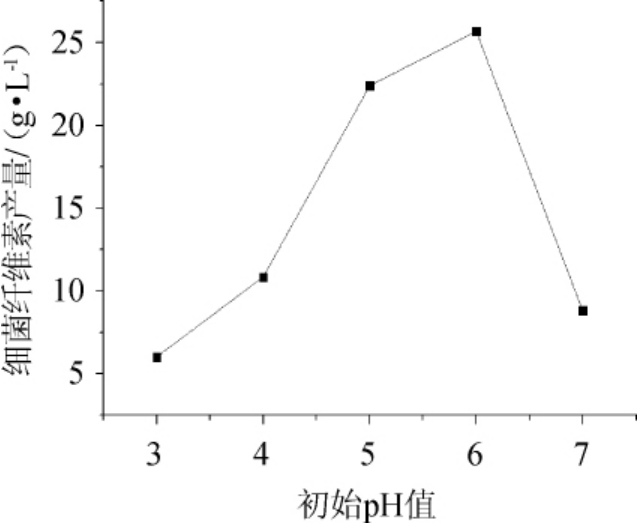
图3 初始pH值对细菌纤维素产量的影响
Fig.3 Effect of initial pH value on bacterial cellulose yield
2.2.2 培养温度对细菌纤维素产量的影响
由图4可知,随着培养温度的升高,细菌纤维素的产量增高,在30 ℃时达到峰值;温度继续升高时,细菌纤维素产量则会减少;培养温度达到40 ℃时,木葡糖酸醋杆菌便不再产细菌纤维素。由此可见,低温时木葡糖酸醋杆菌生长缓慢,细菌纤维素形成耗时长,而温度过高则会导致木葡糖酸醋杆菌休眠或死亡,无法产生细菌纤维素[25]。因此,最佳培养温度为30 ℃。
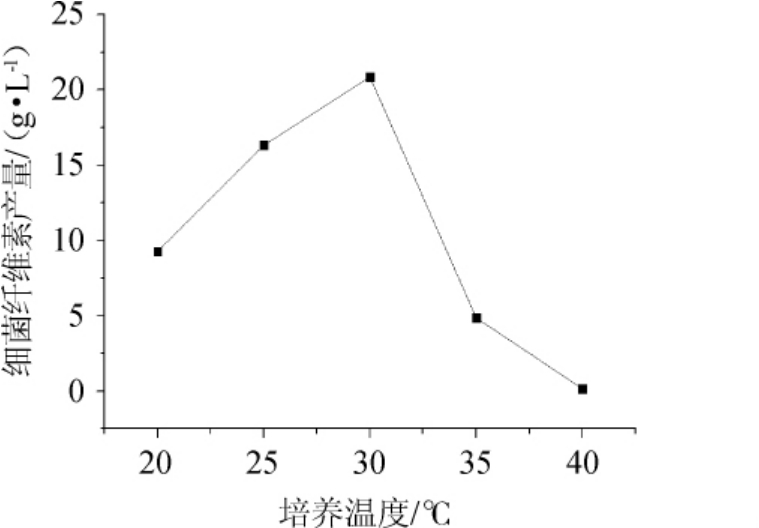
图4 培养温度对细菌纤维素产量的影响
Fig.4 Effect of culture temperature on bacterial cellulose yield
2.2.3 接种量对细菌纤维素产量的影响
由图5可知,随着菌液接种量增加,细菌纤维素产量也随之增加,当接种量达6%后,细菌纤维素产量达到峰值;继续增加接种量,细菌纤维素产量随之减少。接种量过大将不利于细菌生长,还易引起发酵过程中溶氧不足的问题,影响产物细菌纤维素合成;接种量过小时木葡糖酸醋杆菌生长缓慢,培养时间过长,产物细菌纤维素生产效率低。因此,最佳接种量为6%。
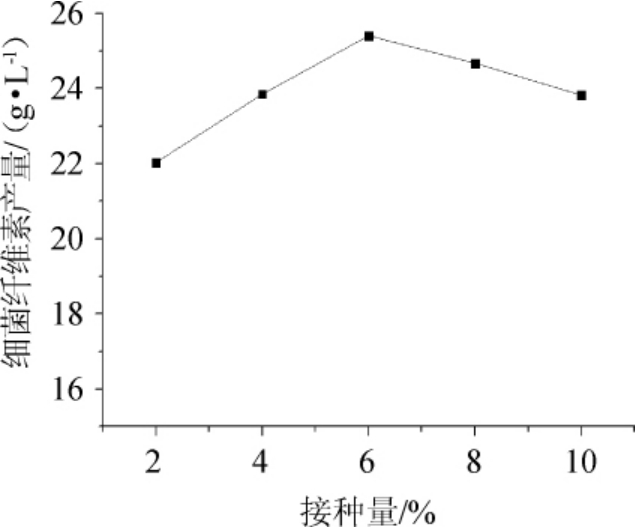
图5 接种量对细菌纤维素产量的影响
Fig.5 Effect of inoculum on bacterial cellulose yield
2.3 酒糟酶解条件对细菌纤维素产量的影响
2.3.1 酶解时间对细菌纤维素产量的影响
由图6可知,在酒糟酶解过程中,随酶解时间增加,细菌纤维素产量增加,在酶解3 h时达到峰值;酶解时间超过3 h之后,细菌纤维素的产量稍有减小。因此,黄酒糟酶解处理的最佳酶解时间为3 h。
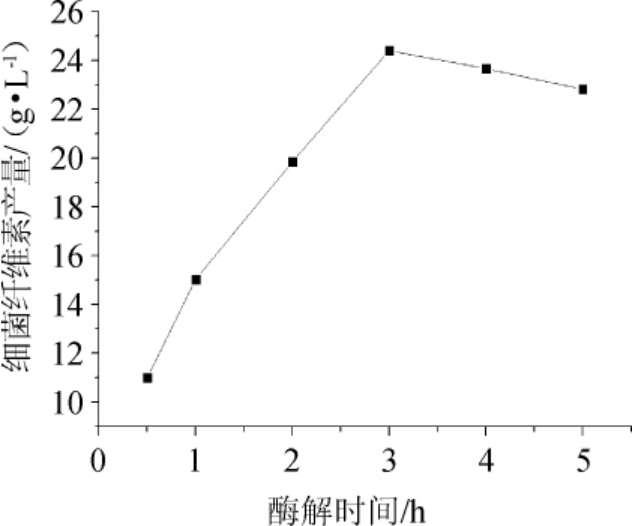
图6 酶解时间对细菌纤维素产量的影响
Fig.6 Effect of enzymatic hydrolysis time on bacterial cellulose yield
2.3.2 酒糟酶解液体积分数对细菌纤维素产量的影响
由图7可知,当酒糟酶解液体积分数为10%时,细菌纤维素产量极低;酒糟酶解液体积分数30%后有明显提高,酒糟酶解液体积分数为90%时,细菌纤维素产量最高,达到26.5 g/L。酒糟酶解液中含有丰富的木葡糖酸醋杆菌产细菌纤维素所需的营养物质,浓度越高越利于菌群生长。由此可见,酒糟酶解液直接用作培养基进行细菌纤维素发酵是可行的,酒糟酶解液最佳体积分数为90%。
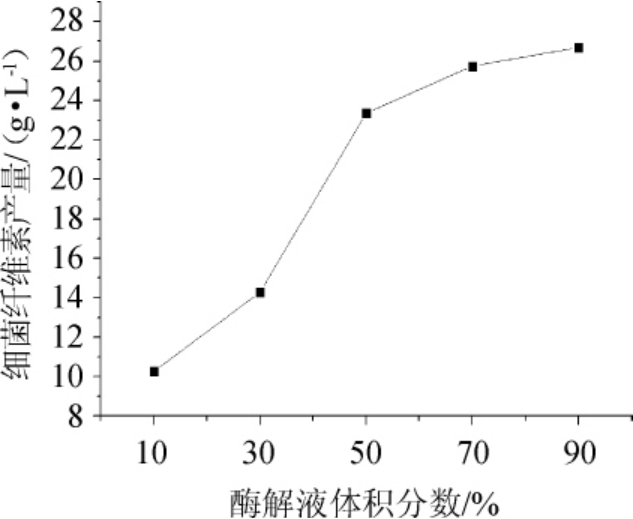
图7 酶解液体积分数对细菌纤维素产量的影响
Fig.7 Effect of enzymatic liquid volume fraction on bacterial cellulose yield
2.4 细菌纤维素膜的含水量
通过测定发现,未碱洗的细菌纤维素膜含水量为92.8%;碱洗后的细菌纤维素膜含水量为99.0%。由此可知,细菌纤维素膜具有极好的持水性,碱洗后的细菌纤维素膜相较于未碱洗的细菌纤维素膜,持水性更好。
2.5 细菌纤维素膜的显微观察
由图8可知,得到的细菌纤维素膜均为由纤细状纤维丝组成的三维立体纳米级网状结构,多孔且结构紧密。而碱洗后再干燥的细菌纤维素膜(图8b)相较于未碱洗直接干燥的细菌纤维素膜(图8a),其纤维丝上附着的残余营养物质被洗去,纤维丝之间的粘连程度更低,结构更致密,更有利于其后期作为材料的应用。
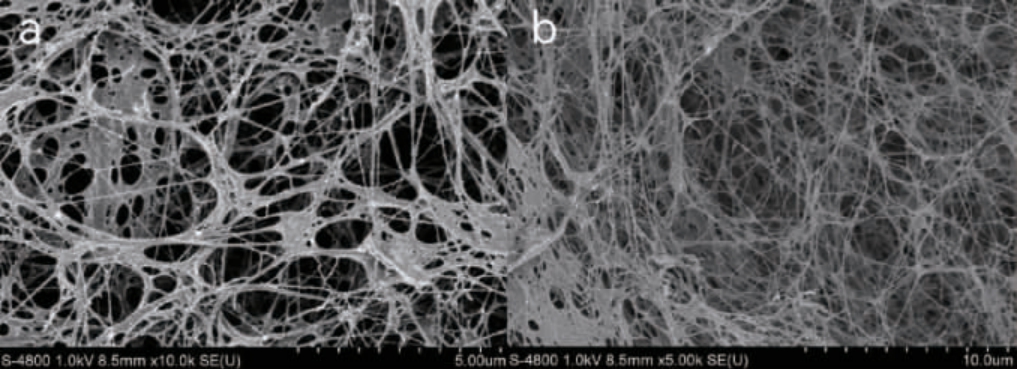
图8 细菌纤维素膜冷冻干燥后的扫描电镜图
Fig.8 Scanning electron microscopy of bacterial cellulose membrane after freeze drying
3 结论
木葡糖酸醋杆菌BC19-2发酵培养生产细菌纤维素的优化条件:培养基组成为黄酒糟酶解液6%、红茶2 g/100 mL;培养条件为初始pH 6.0、培养温度30 ℃、接种量6%;黄酒糟酶解条件为酶解时间3 h,黄酒糟酶解液体积分数90%。在此条件下细菌纤维素产量最高为26.5 g/L,解决了培养基中残留的红茶渣对纤维素膜品质影响问题。碱洗后的细菌纤维素膜含水量为99%,极好的持水能力展现了在医药等领域的良好应用前景。
[1]LI G H,WANG L,DENG Y,et al.Research progress of the biosynthetic strains and pathways of bacterial cellulose[J].J Ind Microbiol Biot,2022,49(1):1-12.
[2]孙勇慧,刘鹏涛,刘忠.细菌纤维素的应用进展[J].材料导报,2015,29(5):62-67.
[3]CHEN C T,DING W X,ZHANG H,et al.Bacterial cellulose-based biomaterials:From fabrication to application[J].Carbohyd Polym,2022,278:118995.
[4]郭艳,吴进,李腾宇,等.细菌纤维素对鸡肉品质及蛋白性质的影响[J].西北农林科技大学学报,2019,47(3):129-137.
[5]余瞻,沙如意,赵福权,等.绿色合成细菌纤维素及其在面膜基材上的应用[J].河南师范大学学报,2021,38(5):907-913.
[6]孙振炳,李晓宝,姚曜,等.细菌纤维素抗菌复合材料的制备和应用[J].包装工程,2021,42(13):21-28.
[7]方达通,陈琳,洪枫.细菌纤维素-透明质酸-聚赖氨酸复合膜的制备及其用于功能敷料的潜力[J].纤维素科学与技术,2020,28(3):10-18.
[8]SONG S,LIU Z,ABUBAKER M A,et al.Antibacterial polyvinyl alcohol/bacterial cellulose/nano-silver hydrogels that effectively promote wound healing[J].Mat Sci Eng,2021,126:112-171.
[9]ALBUQUERQUE RODRIGO M B,MEIRA HUGO M,SILVA IVO D L,et al.Production of a bacterial cellulose/poly (3-hydroxybutyrate) blend activated with clove essential oil for food packaging[J].Polym Polym Compos,2021,29(4):259-270.
[10]郑梅霞,刘波,朱育菁,等.细菌纤维素的生物合成及在食品工业的应用[J].食品安全质量检测学报,2019,10(19):6412-6421.
[11]PHATCHAYAWAT P P,KHAMKEAW A,YODMUANG S,et al.3D bacterial cellulose-chitosan-alginate-gelatin hydrogel scaffold for cartilage tissue engineering[J].Biochem Eng J,2022,184:108476.
[12]贾士儒,欧宏宇,付强.新型生物材料——细菌纤维素二[J].食品与发酵工业,2000,27(1):54-58.
[13]唐水佳,杨雪霞,洪枫.红茶菌制备细菌纤维素的研究[J].纤维素科学与技术,2012,20(2):40-45.
[14]HAMID M,BABAEIPOUR V,IMANI M,et al.Dissolution and regeneration of the produced nano bacterial cellulose of food industries wastewaters by a cost-benefit method[J].Iran J Chen Chem Eng,2019,38(3):9-21.
[15]ANWAR B,BUNDJALI B,SUNARYA Y,et al.Properties of bacterial cellulose and its nanocrystalline obtained from pineapple peel waste juice[J].Fibers Polym,2021,22:1228-1236.
[16]ZHOU J G,GU F,YANG H J,et al.Sequential fermentation strategy improves microbial conversion of waste jasmine flower to bacterial cellulose with antibacterial properties[J].Ind Crop Prod,2022,185:115147-115159.
[17]GAYATHRI G,SRINIKETHAN G.Bacterial cellulose production by K.saccharivorans BC1 strain using crude distillery effluent as cheap and cost effective nutrient medium[J].Int J Biol Macromol,2019,138:950-957.
[18]张沙沙,蔡威,吴冬阳,等.木薯水解液为原料静置发酵制备细菌纤维素的研究[J].食品工业科技,2019,40(17):115-120.
[19]王英男,黄艳玲,刘琳,等.乳清液制备细菌纤维素条件的优化[J].中国乳品工业,2019,47(8):26-28.
[20]贺富强,杨慧敏,李周,等.酒糟酶解液及不同效应因子对发酵产细菌纤维素的影响[J].中国酿造,2019,38(1):66-70.
[21]马霞,董炎炎,于海燕.酒糟浸出液发酵产细菌纤维素工艺优化[J].农业工程学报,2015,31(8):302-307.
[22]陈一源,陆筑凤,鲁瑞刚,等.黄酒糟发酵细菌纤维素的技术研究[J].纤维素科学与技术,2021,29(1):25-31.
[23]张雯,葛万云,齐香君.利用苹果渣发酵生产细菌纤维素工艺及产物性能研究[J].食品研究与开发,2015,36(18):106-110.
[24]李昊燃.红茶菌中细菌纤维素产生的筛选、鉴定及发酵条件优化[D].郑州:河南大学,2016.
[25]周艳,谭丽丽,唐欣昀.纯菌种培养红茶菌中细菌纤维素的合成[J].食品工业科技,2012,33(4):255-257,260.