人工贵腐工艺是一种酿制甜型酒的工艺,其主要用于甜型葡萄酒的酿造[1]。成熟的葡萄浆果在自然条件下被灰霉菌(Botrytis spp.)侵染,菌丝在浆果表面生长并穿透果皮吸取果实水分,在高温环境条件下提高浆果的含糖量和含酸量,从而形成特殊的贵腐效应[2]。浆果经过贵腐作用后会形成独特的贵腐香气特征[3-5]。由于对环境条件要求苛刻,贵腐现象在自然条件下自行发生的概率极低。世界范围内适合酿造贵腐酒的地区主要分布在法国的苏玳,匈牙利的托卡伊和德国的莱茵高[1]。由于气候条件和工艺技术所限,造成我国高端贵腐酒产品相对匮乏,故而发展人工贵腐技术实为开发我国贵腐酒生产潜力的必由之路。
猕猴桃是原产于我国的多年生落叶藤本果树,在植物学分类上属于猕猴桃科(Actinidiaceae),猕猴桃属(Actinidia)[6]。猕猴桃科猕猴桃属植物种类繁多,而中华猕猴桃(Actinidia chinensis)和美味猕猴桃(Actinidia deliciosa)是种植面积最广、产量最多、经济价值最高的两个种[7-8]。其中,中华猕猴桃(Actinidia chinensis)中种植最广泛的为黄金果(Gold Fruit)(Hort16A)、红阳(Hongyang)等,而美味猕猴桃(Actinidia deliciosa)中种植最广泛的为海沃德(Hayward)[8-9]。我国作为猕猴桃生产大国,提升其产品附加值将是未来主要目标,其中酿酒是最具有潜力的方向。已有大量关于干型猕猴桃酒酿造工艺的研究报道及其工艺运用后酒体香气和品质特性的探索性研究[10-13]。然而,贵腐工艺在猕猴桃酒酿造中的应用还鲜有报道。
本研究将对海沃德、黄金果和红阳三个品种的猕猴桃进行人工贵腐工艺处理,酿造人工贵腐猕猴桃酒,并以传统干型猕猴桃酒为对照,通过香气成分和香气特征的比对分析,评估人工贵腐猕猴桃酒的香气特征及其工艺技术的可行性。
1 材料与方法
1.1 材料与试剂
美味猕猴桃(Actinidia deliciosa)的海沃德(Hayward)品种:购自陕西省周至县;中华猕猴桃(Actinidia chinensis)的黄金果(Hort16A)品种、红阳(Hongyang)品种:分别从新西兰进口,购自四川省绵竹市。所购猕猴桃进行为期1周的后熟,后熟温度25 ℃、相对湿度70%。后熟后测得含糖量(以还原糖计)分别为:海沃德120 g/L,黄金果148 g/L,红阳150 g/L;含酸量(以酒石酸计)分别为:海沃德17.2 g/L,黄金果15.9 g/L,红阳15.1 g/L。
灰霉菌(Botrytis spp.):北纳生物-河南省工业微生物菌种工程技术研究中心,分离自葡萄浆果;酿酒酵母(Saccharomyces cerevisiae)ZYMAFLORE X16:法国Laffort公司;马铃薯葡萄糖琼脂(potatodextrose agar,PDA)培养基、偏重亚硫酸钾、硫酸铵、维生素B1(均为分析纯):国药集团化学试剂有限公司;液氮:宜宾天原集团股份有限公司;33种香气成分标准品(均为色谱纯):美国Sigma公司。
1.2 仪器与设备
Le Nez du Vin 80香型标准香气酒鼻子:香港逸香公司;PC-4100顶空-固相微萃取(headspace solid-phase microex traction,HS-SPME)仪、DVB/CAR/PDMS 50/30 μm(二乙烯基苯/碳分子筛/聚二甲基硅氧烷)萃取头:美国Supelco公司;QP2010气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:日本岛津公司。
1.3 方法
1.3.1 灰霉菌菌悬液的制备
将灰霉菌菌株活化后以划线法接种于PDA固体培养基上,23 ℃、相对湿度70%条件下培养4 d。从平板上刮取已培养好的灰霉菌菌丝和孢子,加入液氮研磨成粉状。将菌体及孢子粉末溶于无菌生理盐水中,制成灰霉菌菌悬液(活菌数>106 CFU/mL)。
1.3.2 猕猴桃酒酿造方法
传统干型酒工艺酿造:取猕猴桃10 kg,体积分数75%酒精逐个短暂浸泡消毒,将果实表面快速吹干。处理后的果实破碎打浆,果浆的糖质量浓度调整至221 g/L,添加60 mg/L偏重亚硫酸钾。将处理好的果浆降温至4 ℃,保持24 h,温度自然回升至20 ℃。接种0.02%活化酵母(将酵母缓慢加入10倍质量37 ℃的无菌水中,静置20 min活化),酒精度预设为13%vol,18~20 ℃条件下发酵,当糖质量浓度降至4 g/L以下,添加120 mg/L的偏重亚硫酸钾终止发酵,4 ℃静置30 d后过滤澄清稳定,装瓶检测。
人工贵腐工艺酿造:取猕猴桃20 kg,体积分数75%酒精逐个短暂浸泡消毒,将果实表面快速吹干。杀菌处理后的果实单层放置于消毒处理的不锈钢架上,在果实表面均匀喷施灰霉菌菌悬液,在23 ℃、相对湿度70%的培养箱中培养72~96 h,再在50 ℃、风速1.5 m/s条件下干燥处理2~3 h,如此重复接种和干燥处理3~5次,直至猕猴桃果实糖含量接近300 g/L,快速破碎,添加100 mg/L硫酸铵、50 mg/L维生素B1和140 mg/L偏重亚硫酸钾。将处理好的果浆降温至4 ℃,保持24 h,温度自然回升至18 ℃。接种0.02%活化酵母(将酵母缓慢加入10倍质量37 ℃的无菌水中,静置20 min活化),酒精度预设为13%vol,发酵温度16~18 ℃,发酵结束后添加360 mg/L的偏重亚硫酸钾终止发酵,4 ℃静置30 d后过滤澄清稳定,装瓶检测。
1.3.3 猕猴桃酒香气成分分析
香气成分固相微萃取:取5 mL酒样于15 mL的顶空瓶中,加1.0 g NaCl和5 μL 3-辛醇(163 μg/L,内标),密封后在40 ℃水浴中孵育10 min,插入PDMS萃取头吸附40 min,在250 ℃的条件下解吸3 min,通过GC-MS进行香气成分的分析。每个酒样重复分析2次。
气相色谱条件:载气为氦气(He),流速1 mL/min;进样口温度250 ℃;无分流进样;升温程序为40 ℃保持3 min,5 ℃/min升温至120 ℃,再以8 ℃/min升温至230 ℃保持10 min。质谱条件:电子电离(electronic ionization,EI)源;离子源温度230 ℃;接口温度230 ℃;电子能量70 eV;发射电流34.6 A;质谱扫描范围为30~450 amu。
定性定量分析[14]:利用与标准香气成分保留时间对比进行定性;采用内标-标准曲线法进行定量,3-辛醇作内标物质,采用五点法绘图。香气物质标品溶解于无水乙醇中,配制含有香气标样的模拟酒(酒精度13%vol,酒石酸15 g/L,0.1 mol/L NaOH溶液调节pH值至2.5),用于绘制标准品浓度的标准曲线。添加香气标样的模拟酒同样采用上述方法进行香气萃取和GC-MS分析。
1.3.4 猕猴桃酒香气鉴定训练及特征分析方法
猕猴桃酒香气特征量化分析参照陶永胜等[14-15]的方法并加以改进。香气鉴定人员由20名女性和20名男性,共40人组成,年龄在21~23岁。猕猴桃酒香气特征量化分析前,香气鉴定人员需要在一个月内进行3~4次标准香气酒鼻子(Le Nez du Vin,80香型)香气的识别训练。香气特征感官分析试验分为2组,每组2轮进行,每款酒样设3次重复。要求闻香人员用标准香气里的特征词汇描述样品香气特征,同时描述标准香气以外的香气,之后斟酌是否使用该词汇,并用五点标度法对每一香气特征强度进行量化:1为很弱;2为弱;3为中等;4为强;5为很强。标准频率(modifiedfrequency,MF)值是一个香气词汇的使用频率和强度量化得分的几何平均数,即由![]() ,其中,F是特征使用频率,I是特征强度。
,其中,F是特征使用频率,I是特征强度。
1.3.5 数据处理及分析方法
猕猴桃酒香气成分和香气特征的主成分分析(principal component analysis,PCA)使用SPSS 19.0软件进行处理。
2 结果与分析
2.1 不同酒样中香气物质差异分析
分别对三个品种猕猴桃酒进行传统干型发酵和贵腐发酵,得到6个供试酒样,其香气物质含量见表1。
表1 不同猕猴桃酒样挥发性香气物质的含量
Table 1 Contents of volatile aroma compounds in different kiwifruit wine samples

注:trad为传统干型酒工艺;nr为人工贵腐工艺;海为海沃德;黄为黄金果;红为红阳。下同。
6个酒样中所检测到的高级醇含量均偏低,其总含量范围在0.3~5.3 mg/L,总含量由高到低分别为:传统干型黄金果酒>传统干型红阳酒>人工贵腐黄金果酒>人工贵腐海沃德酒>传统干型海沃德酒>人工贵腐红阳酒。传统干型酒中除了海沃德酒外,其他两个品种酒样的高级醇含量都远高于三个品种人工贵腐酒。此现象同样出现在贵腐葡萄酒中,贵腐葡萄酒高级醇总含量要远低于传统甜型葡萄酒高级醇总含量[14]。高级醇主要由酵母菌葡萄糖代谢及相应氨基酸代谢所产生[16]。酒精发酵过程中,高级醇主要是由酿酒酵母通过艾利希通路(Ehrlich pathway)合成自体所需氨基酸时产生;当菌体生存环境中缺乏氨基酸时,就会导致大量高级醇产生[17-18]。本实验中,由于果实接种了灰霉菌,其细胞通透性增大,造成细胞死亡自溶;同时灰霉菌在侵染过程中也在不断死亡分解,从而导致果实中游离氨基酸含量升高,使酵母菌所产高级醇含量下降。而传统工艺海沃德酒中高级醇含量较低的主要原因可能与果实品种特性有关。与其他品种相比海沃德中有机酸含量和酸度较高[19]。高酸环境会导致酵母生长抑制和死亡[20-21]。死亡酵母自溶时会释放一定量游离氨基酸,从而导致酒中高级醇含量下降。6种酒样中共检出5种高级醇,其中辛醇在贵腐黄金果酒中含量较高;苯乙醇在传统黄金果和红阳干酒中含量较高,此外其他高级醇含量普遍偏低。这一结果表明高级醇对各个酒样香气类型和感知程度的贡献较小。
酯类物质能赋予果酒不同类型果实和花卉香气,果酒中酯类主要为乙醇酯及一些其他酯类[22-23]。果酒中的酯类物质主要源于酵母及细菌的代谢活动和酒体的陈酿处理[22-24]。本实验中,6个酒样共检测出15种酯,其中13种乙醇酯、1种甲醇酯和1种戊醇酯。乙醇酯在传统干型酒和贵腐酒中都表现出较高浓度。这可能是由酒精发酵使发酵液中乙醇浓度升高,进而使酒中乙醇酯的浓度增加。6个酒样酯类总浓度依次为:传统干型黄金果酒>传统干型红阳酒>传统干型海沃德酒>贵腐海沃德酒>贵腐黄金果酒>贵腐红阳酒。这与TOSI E等[25]的贵腐葡萄酒香气研究结果一致,其发现贵腐条件会降低葡萄酒中酯类物质的总浓度,并将此现象归因于灰霉菌侵染提高了果汁中酯酶的含量和活性。本研究显示,传统干酒和贵腐酒中的辛酸乙酯、己酸乙酯和癸酸乙酯的浓度都相对较高,尤其是辛酸乙酯的含量最为突出,其体现出两种工艺所酿猕猴桃酒共同的温带水果和香料特征,然而传统干酒中这三种酯类的浓度要高于贵腐酒,表明贵腐工艺会降低猕猴桃酒中这些温带水果和香料特征。另一方面,有5种酯类物质(乙酸异戊酯、丁酸乙酯、棕榈酸乙酯、苯甲酸乙酯和苯乙酸乙酯)经贵腐工艺酿造后,其浓度相较于传统工艺有所提升;同时在贵腐酒中出现2种(2-甲基丁酸乙酯和戊酸乙酯)传统干酒中未检出的酯类物质,这些酯类物质共同赋予贵腐酒更多热带水果花卉和香甜特征。表明较于传统干型酒,贵腐酒更多体现出热带水果花卉和香甜特征。这一结果与MIKLÓSY É等[3]有关贵腐葡萄酒中典型香气的研究结果相吻合。
6个供试酒样中检测出3种中链脂肪酸,分别为己酸、辛酸和正癸酸。其中辛酸在传统干酒中含量较高,己酸次之,正癸酸只在传统海沃德干型酒中检出。而经贵腐工艺酿造后,3种脂肪酸的浓度相较于传统干酒都有所降低或未检出。这一结果和酯类物质的研究结果相契合,3种脂肪酸所形成的乙醇酯为酯类物质主体,辛酸乙酯含量最高,己酸乙酯次之,癸酸乙酯最低,同时传统干酒中3种脂肪酸乙酯的含量要大于贵腐酒。这可能意味着猕猴桃酒中较高的脂肪酸浓度会导致其更多酯类物质的合成。本研究中,所检测出的3种脂肪酸在贵腐酒中的浓度要低于传统干酒。这一结果与TOSI E等[25]的研究结果相符,其发现在贵腐葡萄酒中脂肪酸浓度要低于传统工艺酒,而这种贵腐葡萄酒中脂肪酸含量下降的现象可能是由于果实自身对脂肪酸的氧化作用和灰霉菌侵染引起的脂质降解活动所导致。中链脂肪酸在低浓度时表现为奶酪、奶油香气,在高浓度时会带有酸败、粗糙的气味[26-27]。本实验6个酒样中的脂肪酸浓度都保持在较低水平,故不会产生明显不良气味。
6个酒样中共检出除醇、酯和酸外的10种其他类型化合物,包含4种萜烯类、3种醛类、2种酚类和桉叶油醇。其中,萜烯类和醛类化合物主要以糖苷键结合态香气存在于猕猴桃果汁中[28]。3种贵腐酒中检出全部4种萜烯类和2种酚类化合物。在所有萜烯类化合物中,4-萜烯醇的含量最高,而3个品种间其含量并无明显差异。多数萜烯类化合物带有明显的花卉和香料香气[29],而贵腐工艺有助于提高猕猴桃酒萜烯类化合物的含量,这一结果与贵腐葡萄酒的研究结果相吻合[17]。灰霉菌能够产生糖苷酶,有利于香气物质糖苷水解[30],释放结合态香气,从而增加酒体香气复杂度。酚类化合物含量总体偏低,然而相比之下,3个贵腐酒中4-乙基-2-甲氧基苯酚的总含量要略高于4-乙烯基-2-甲氧基苯酚,这是由于贵腐红阳酒中4-乙基-2-甲氧基苯酚的含量较高所致。4-乙基-2-甲氧基苯酚和4-乙烯基-2-甲氧基苯酚都为愈创木酚,而愈创木酚在酒类中常表现为明显的香辛料、丁香和发酵香气[31]。植物体产生的愈创木酚具有抑制和杀灭植物病害的作用[32],本研究中贵腐酒愈创木酚的检出极有可能是猕猴桃在受到灰霉菌侵染后的应激反应,而愈创木酚的出现也增加了贵腐酒的香气复杂度。除贵腐红阳酒中检测出少量苯甲醛外,3种醛类化合物和桉叶油醇在3个品种贵腐酒中均没有检出。
三个品种传统干酒中只检测出少量醛类化合物,并且其种类具有一定品种特异性,传统黄金果干酒中检出苯甲醛、糠醛和桉叶油醇,而传统红阳和海沃德干酒中分别只检测出壬醛和糠醛。三个品种传统干酒中未检测出任何萜烯类和酚类化合物。醛酮类物质具有一定抑菌作用[33-34],GENOVESE A等[17]也在贵腐葡萄酒中检测出了糠醛。另外有研究发现,草莓和覆盆子果实在受到灰霉菌侵染后会应激性的产生2-壬酮来抵御伤害[35]。但是在本实验中,贵腐酒样中几乎没有醛类物质的检出。这可能是由于猕猴桃果实自身生物特性所致,同样是抵御灰霉菌的侵染,猕猴桃可能会更加偏向于合成具有抑菌效果的愈创木酚,而不是醛酮类化合物。
2.2 不同酒样香气物质主成分分析
对供试酒样香气成分数据进行主成分分析,PC1和PC2解释了总方差的70.0%,其中PC1占54.9%,PC2占15.1%,不同酒样的香气成分载荷及供试酒样分布见图1。
由图1可知,辛醇、α-松油醇、丁酸乙酯、2-甲基丁酸乙酯、戊酸乙酯、棕榈酸乙酯、苯甲酸乙酯、苯乙酸乙酯、芳樟醇和4-萜烯醇在第二象限中得分较高,黄金果和海沃德贵腐酒同样位于该区域,故酒中这些成分浓度较高。薄荷醇、乙酸乙酯、乙酸异戊酯和两种愈创木酚分布在第三象限,红阳贵腐酒位于该区域。第一象限得分较高的物质包括苯乙醇、己酸乙酯、辛酸甲酯、辛酸乙酯、癸酸乙酯、癸二酸乙酯、月桂酸乙酯、壬醛、苯甲醛和桉叶油醇,传统黄金果和红阳干酒位于该区域。第四象限得分较高的物质包括正己醇、3-甲硫基丙醇、己酸、辛酸、正癸酸和糠醛,传统海沃德干酒位于该区域。3个品种贵腐酒全部位于坐标系的第二和第三象限,而3个品种传统干型酒全部位于坐标系的第一和第四象限。贵腐酒分布于醇类、酯类、酚类和萜烯类较为集中的区域,故贵腐酒中含更多与醇类、酯类、酚类和萜烯类相关香气。而传统干型酒分布于醇类、有机酸类、酯类、醛类较为集中的区域,故传统干型酒中含更多与醇类、有机酸类、酯类、醛类相关香气。这说明不同酿造工艺对猕猴桃酒最终香气类型有着重要影响,从而产生明显的工艺间差异,同时不同品种猕猴桃经过不同工艺酿造,其酒中香气物质也会出现较为明显的品种差异。贵腐酒和传统干型酒都表现出各自典型的香气轮廓,而在不同工艺条件下不同品种又表现出不同的香气复杂度。
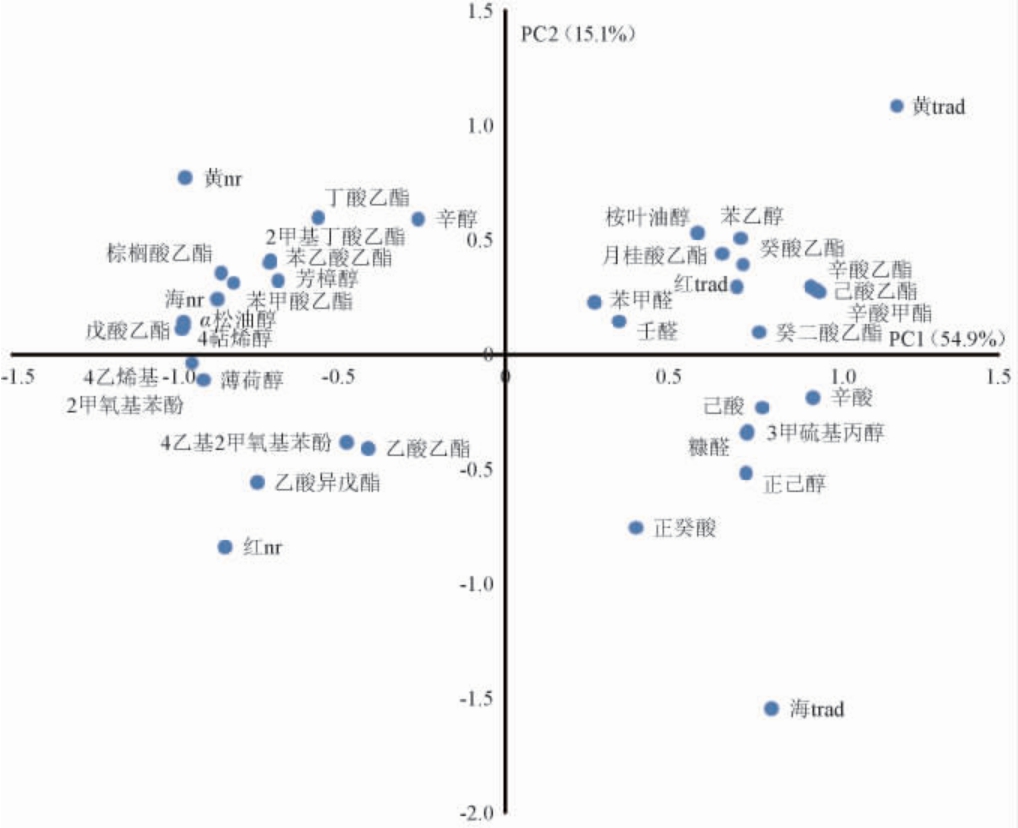
图1 六个猕猴桃酒样中香气成分的主成分分析载荷图
Fig.1 Loadings plot of principal component analysis of aroma components in six kiwifruit wine samples
2.3 不同酒样香气特征感官量化差异分析
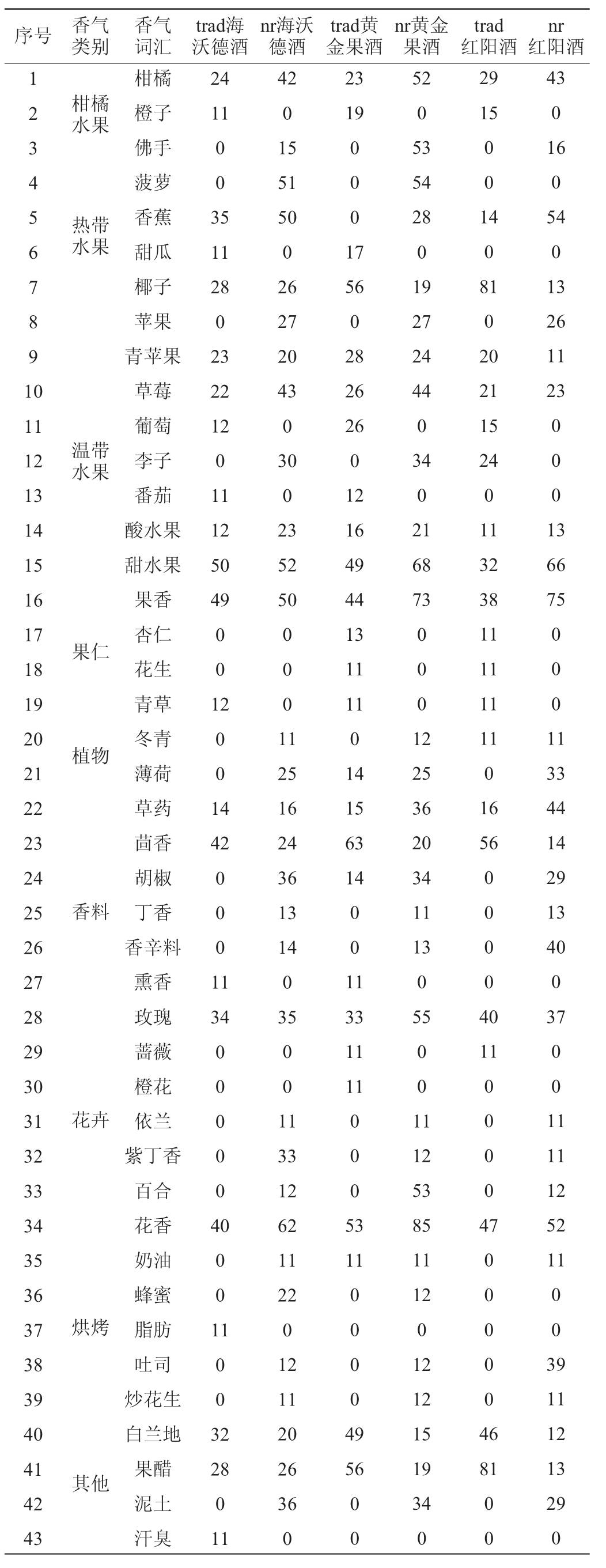
6个供试酒样香气特征感官量化结果见表2。由表2可知,供试酒样共测出9个类别43种香气特征,MF值在11%~85%之间,贵腐酒表现出较大的香气复杂性,含26种香气特征,而传统干型酒的香气复杂度略低于贵腐酒,含14个香气特征。对供试酒样的香气特征量化数据进行主成分分析,前2位主成分的方差贡献率分别60.9%和14.4%,香气特征的载荷以及酒样分布见图2。由图2可知,热带水果、花卉、香料和烘培等香气特征在坐标系第一和第四象限上得分较高,温带水果、植物和果仁等香气特征则在第二和第三象限上得分较高。其他香气特征分别分散在四个象限中。
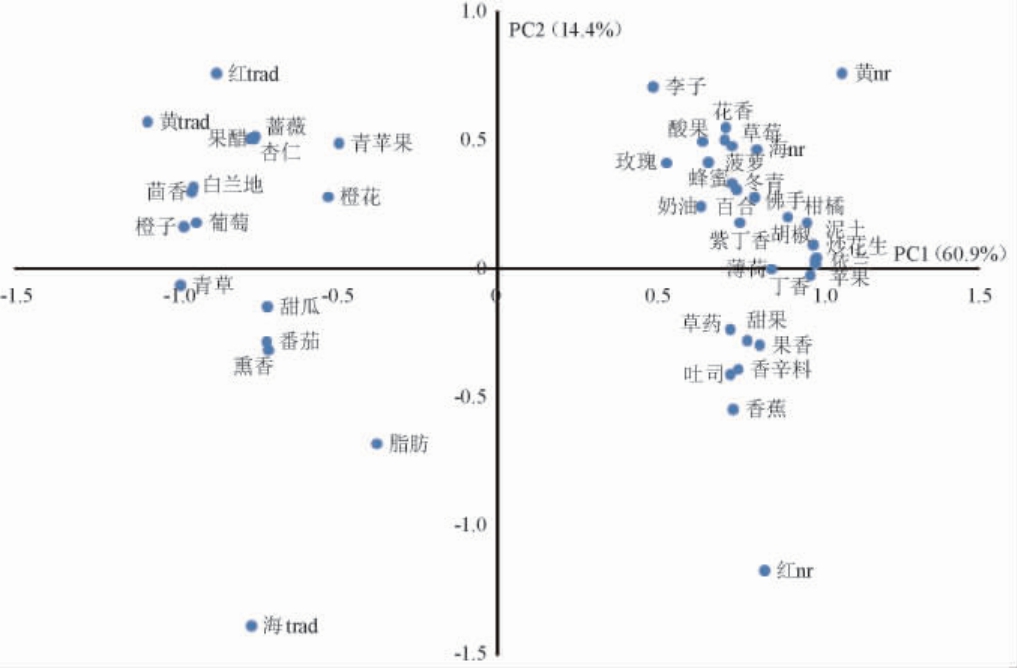
图2 六个猕猴桃酒样中香气特征的主成分分析载荷图
Fig.2 Loading plot of principal component analysis of aroma characteristics in six kiwifruit wine samples
表2 六个猕猴桃酒样香气特征量化分析结果
Table 2 Results of quantitative analysis of aroma characteristics of six kiwifruit wine samples
由图2可知,两种工艺酿造的不同品种猕猴桃酒均有其独特的香气特征。贵腐海沃德和黄金果酒位于坐标系第一象限,是香气特征最为集中和复杂的区域,其中包含柑橘、热带水果、香料、植物和烘培等香气特征;贵腐红阳酒位于第四象限,为热带水果、香料和烘培等香气特征,其复杂度远低于贵腐海沃德和黄金果酒;传统红阳和黄金果干型酒位于坐标系的第二象限,主要为温带水果、花香和果仁等香气特征;传统海沃德干型酒位于坐标系的第三象限,主要表现为温带水果和植物等香气特征。在三个品种传统干型酒中,红阳和黄金果酒表现出的香气复杂度高于海沃德酒。传统干型酒香气特征的复杂度则远低于贵腐酒。贵腐葡萄酒的香气特征主要为柑橘、芒果、百里香、桃、花香、干杏、蜂蜜、焦糖等[36],虽然酿造原料不同,但本研究中贵腐猕猴桃酒的香气特征与贵腐葡萄酒的研究结果还是存在共同之处,同时又各具特色。
3 结论
本研究通过运用人工贵腐工艺和传统干型酒工艺对3个不同品种的猕猴桃进行贵腐酒和传统干型酒的酿造,及其香气成分和特征的分析,从而了解了不同品种猕猴桃贵腐酒的特性,以及其与传统干型猕猴桃酒之间的差异。酯类物质是两种工艺猕猴桃酒最重要的香气来源,然而酯类物质的种类构成和含量差异却造就了两种工艺截然不同的香气特征,贵腐酒中的特征性酯类物质组合更多的赋予酒体热带水果花卉和香甜味特征,而传统工艺干型酒中的特征性酯类物质组合更倾向于体现温带水果和香料特征。贵腐猕猴桃酒中共检出4种萜烯类化合物和2种愈创木酚,这会更加有助于增加酒体花卉类和香料类的香气特征,而这些化合物在传统工艺干型酒中未检出。3个品种的猕猴桃对两种工艺也具有其倾向性,果实在经贵腐工艺处理后,所酿造的贵腐海沃德和黄金果酒会表现出更好的香气复杂度,而贵腐红阳酒却表现出较低的香气复杂度;果实在经传统干型酒工艺处理后,所酿造的传统红阳和黄金果干酒会表现出更好的香气复杂度,而传统海沃德干型酒会表现出较低的香气复杂度。从而推断,黄金果是一个较为良好的酿酒品种。另外,虽然本研究中使用猕猴桃作为贵腐工艺酿造原料,但是所表现出的变化现象与贵腐葡萄酒是较为相似的,这从侧面说明贵腐工艺没有过大的原料特异性,是一种较为稳定的酿造工艺,其不仅可以用于贵腐葡萄酒的酿造,同时也可以用于除葡萄外的其他种类果实贵腐酒的酿造。
[1]JACKSON R S.Wine science: principles and applications[M].3rd ed.London:Academic Press,2008:208-209.
[2]FLEET G H.Wine microbiology and biotechnology[M].2nd ed.Chur:Harwood Academic Publishers,1993:327-351.
[3]MIKLÓSY É,KALMÁR Z,KERENYI Z.Identification of some characteristic aroma compounds in noble rotted grape berries and Aszu wines from Tokaj by GC-MS[J].Acta Alimentaria,2004,33(3):215-226.
[4]MIKLÓSY É,KALMÁR Z,PÖLÖS V,et al.Study of volatile aroma components in young Tokaji Aszu wines by GC-MS[J].Chromatographia,2000,51(1):305-308.
[5]MIKLÓSY É,KEREYI Z.Comparison of the volatile aroma components in noble rotted grape berries from two different locations of the Tokaj wine district in Hungary[J].Anal Chim Acta,2004,513:177-181.
[6]谢彩云,范国华.猕猴桃开发研究进展[J].贵州农业科学,1996(6):61-63.
[7]黄宏文.猕猴桃研究进展[M].北京:科学出版社,2000:55-69.
[8]黄贞光.我国猕猴桃品种结构、区域分布及调查意见[J].果树科学,1998,15(3):193-197.
[9]GARCIA C V,STEVENSON R J,ATKINSON R G,et al.Changes in the bound aroma profiles of′Hayward′and′Hort16A′kiwifruit(Actinidia spp.)during ripening and GC-olfactometry analysis[J].Food Chem,2013,137(1-4):45-54.
[10]赵宁,魏新元,樊明涛,等.SPME-GC-MS结合电子鼻技术分析不同品种猕猴桃酒香气物质[J].食品科学,2019,40(22):249-255.
[11]陈娟,唐俊妮,王文娟.三种猕猴桃酒发酵过程中挥发性香气成分的变化[J].食品工业科技,2019(3):242-248.
[12]陈红梅,王沙沙,尹何南,等.不同工艺处理对野生猕猴桃酒品质的影响[J].食品科学,2018,39(4):234-239.
[13]黎星辰,马力,曹琳,等.不同酿酒酵母发酵猕猴桃酒香气成分研究[J].食品科技,2016,41(7):73-77.
[14]陶永胜,刘吉彬,兰圆圆,等.人工贵腐葡萄酒香气的仪器分析与感官评价[J].农业机械学报,2016,47(2):270-279.
[15]PENG C T,WEN Y,TAO Y S,et al.Modulating the formation of Meili wine aroma by prefermentative freezing process[J].J Agr Food Chem,2013,61:1542-1553.
[16]PERESTRELO R,FERNANDES A,ALBUQUERQUE F F,et al.Analytical characterization of the aroma of Tinta Negra Mole red wine:identification of the main odorants compounds[J].Anal Chimica Acta,2006,563:154-164.
[17]GENOVESE A,GAMBUTI A,PIOMBINO P,et al.Sensory properties and aroma compounds of sweet Fiano wine[J].Food Chem,2007,103:1228-1236.
[18]ZHENG N,JIANG S,HE Y,et al.Production of low-alcohol Huangjiu with improved acidity and reduced levels of higher alcohols by fermentation with scarless ALD6 overexpression yeast[J].Food Chem,2020,321:126691.
[19]王刚,王涛,潘德林,等.不同品种猕猴桃果实有机酸组分及含量分析[J].农学学报,2017,7(12):81-84.
[20]崔如生.温度酸度对大曲酒产质量的影响[J].酿酒,2007,34(6):30-31.
[21]王虎玄,胡仲秋,牛晨,等.糖度与酸度对鲁氏接合酵母生长的影响[J].农业机械学报,2015,46(10):280-284.
[22]MUOZ-GONZÁLEZ C,PÉREZ-JIMÉNEZ M,POZO-BAYÓN M N.Oral persistence of esters is affected by wine matrix composition[J].Food Res Int,2020,135(2):109286.
[23]RIOS-REINA R,SEGURA-BORREGO M P,MORALES M L,et al.Characterization of the aroma profile and key odorants of the Spanish PDO wine vinegars[J].Food Chem,2020,311:126012.
[24]MUOZ-GONZÁLEZ C,RODRÍGUEZ-BENCOMO J J,MORENO-ARRIBAS M V,et al.Beyond the characterization of wine aroma compounds:looking for analytical approaches in trying to understand aroma perception during wine consumption[J].Anal Bioanal Chem,2011,401(5): 1497-1512.
[25]TOSI E,FEDRIZZI B,AZZOLINI M,et al.Effects of noble rot on must composition and aroma profile of Amarone wine produced by the traditional grape withering protocol[J].Food Chem,2012,130:370-375.
[26]DÍAZ-MAROTO M C,SCHNEIDER R,BAUMES R.Formation pathways of ethyl esters of branched short-chain fatty acids during wine aging[J].J Agr Food Chem,2005,53:3053-3059.
[27]LILLY M,LAMBRECHTS M G,PRETORIUSE I S.Effect of increased yeast alcohol acetyltransferase activity on flavor profiles of wine and distillates[J].Appl Environ Microbiol,2000,66(2):744-753.
[28]刘鹏.猕猴桃果汁中糖苷键合态香气成分及果汁加工关键步骤对香气的影响[D].杨凌:西北农林科技大学,2022.
[29]孙宝国,刘玉平.食用香料手册[M].北京:中国石油出版社,2004:23-36.
[30]ALEU J,COLLADO I G.Biotransformations by Botrytis species[J].J Mol Catal B: Enzym,2001,13:77-93.
[31]李青卓,王嘉瑞,张小龙,等.风味物质4-乙烯基愈创木酚的研究进展[J].中国酿造,2021,40(4):15-18.
[32]饶家瑞,雷志伟,周玉锋.10种天然产物抗茶轮斑病的生物活性[J].贵州农业科学,2021,49(6):49-55.
[33]KISHIMOTO K,MATSUI K,OZAWA R,et al.Direct fungicidal activities of C6-aldehydes are important constituents for defense responses in Arabidopsis against Botrytis cinerea[J].Phytochemistry,2008,69:2127-2132.
[34]WASSIM CHEHAB E,KASPI R,SAVCHENKO T,et al.Distinct roles of jasmonates and aldehydes in plant-defense responses[J].Plos One,2008,3(4):e1904.
[35]VAUGHN S F,SPENCER G F,SHASHA B S.Volatile compounds from raspberry and strawberry fruit inhibit postharvest decay fungi[J].J Food Sci,1993,58:793-796.
[36]LOSCOS N,HERNÁNDEZ P,CACHO J,et al.Comparison of the suitability of different hydrolytic strategies to predict aroma potential of different grape varieties[J].J Agr Food Chem,2009,57:2468-2480.