马苏里拉奶酪属于帕斯塔菲拉塔(Pasta Filata)中的一种,其在制作时需要经历一个特殊的热烫拉伸过程,此过程会使奶酪具备纤维状的蛋白结构以及融化拉丝的功能特性[1]。热烫拉伸会使奶酪凝块具备良好的拉伸、延展能力,且能赋予其独特的口感及特点[2]。马苏里拉奶酪具有独特的纤维状结构和高营养价值,在国际市场上占有重要地位。
乳清是在奶酪、干酪素制作时出现的附带产物,其固形物含量为6.0%~6.5%,包含有牛乳中55%的营养成分,此外乳清中的乳清蛋白属于全价蛋白,含有20种氨基酸,其中硫基酸含量偏低,剩下其余类型的必需氨基酸含量均较高[3-6]。乳清中除了含有乳矿物质以及乳清蛋白等基本营养成分外,其中还残留有一部分制作奶酪时的凝乳酶,因而回收利用乳清不但能极大程度的再利用乳清中的营养成分,降低乳清直接排放带来的环境污染[7],同时可以再利用其中的凝乳酶。在全球每年生产干酪素和奶酪所产生的乳清可达到1.5×109~1.7×109 t[8-9],所以合理再利用乳清成为亟待解决的问题。
目前,关于乳清的再利用主要是制备乳清蛋白产品,如乳清浓缩蛋白、乳清粉、乳清分离蛋白[10-11],将乳清浓缩后制作乳清发酵乳[12]或将乳清蛋白添加在牛乳中制作奶酪。GAMLATH C J等[13]将加热后的乳清蛋白聚合物加入低脂牛奶中制成低脂奶酪,发现加热处理后的乳清蛋白可以改善低脂奶酪原本坚硬的质地,且奶酪的微观结构更加紧密;CAGNO R D等[14]采用微粒乳清蛋白浓缩物(microparticulated whey protein concentrate,MWPC)制作Caciotta奶酪,研究发现,加入MWPC的奶酪风味及口感更佳;迟涛等[15]将乳清蛋白作为脂肪替代物加入奶酪中可以提高奶酪的水解程度,且能改善奶酪的风味;闫文杰等[16]直接将大豆蛋白加入乳清中,再添加柠檬酸使其酸化制成乳清干酪;但还未见有乳清在奶酪制作中的再利用研究。
本研究以不添加乳清制备的奶酪为对照组,研究乳清添加对奶酪成熟过程中乳酸菌活菌数、油脂析出性、氨基酸及风味物质种类及含量的影响,旨在提高乳清中乳清蛋白等营养物质、凝乳酶的回收利用率,为乳清再利用开辟新的方向。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
发酵剂(保加利亚乳杆菌德氏亚种(Lactobacillus delbrueckil subsp.bulgaricus)∶唾液链球菌嗜热亚种(Streptococcus salivariussubsp.thermophilus)=1∶1):山西农业大学食品科学与工程学院乳品实验室;凝乳酶(活力150 000 U/g):丹尼斯克(中国)有限公司;食盐(食品级):晋中市太谷区家家利超市;鲜牛乳(抗生素检测均为阴性):山西农业大学牧场;乳清:本实验室自制奶酪后排出的副产物。
1.1.2 试剂
硫酸锰、硫酸镁、氢氧化钠、P-磷酸甘油二钠、磷酸氢二钾、抗坏血酸、柠檬酸铵、聚山梨酯-80、硫酸铁铵、氯化钠、乙醇(均为分析纯):天津市申泰化学试剂有限公司;葡萄糖(分析纯):天津市凯通化学试剂有限公司;大豆粉木瓜酶消化物、酪蛋白胰酶消化物、肉胃酶消化物、MRS培养基、M17培养基、LBS培养基:北京奥博星生物技术有限责任公司。其他试剂均为国产分析纯。
1.2 仪器与设备
VORTEX-5漩涡混合器:其林贝尔仪器制造有限公司;5804R高速离心机:德国Eppendorf公司;BVPJ-500TS真空包装机:嘉兴艾博实业股份有限公司;SW-CJ-2FD双人单面超净工作台:苏州净化设备有限公司;HPP-9272电热恒温培养箱:北京东联哈尔仪器制造有限公司;BS224S电子分析天平:北京赛多利斯仪器有限公司;HH-S8电热恒温水浴锅:北京科伟永兴仪器有限公司;日本日立L-8900氨基酸分析仪:柜谷科技发展(上海)有限公司;LS-75HD蒸汽压力灭菌锅:滨江医疗设备有限公司;ISQ气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:美国Thermo公司。
1.3 方法
1.3.1 马苏里拉奶酪的制作工艺
操作要点:
将鲜牛乳倒入奶酪槽中,于水浴锅中63 ℃巴氏杀菌30 min,将灭菌后鲜牛乳牛奶快速冷却至42 ℃,加入0.5%(V/V)的发酵剂,于42 ℃恒温发酵30 min。在发酵完成的牛乳中加入3‰(V/V)的凝乳酶溶液(1%的食盐水配制),搅拌均匀后在42 ℃条件下静置30 min凝乳。待牛奶凝集成块状且不粘壁即可切割,将每组奶酪切成1.5 cm3的凝块,静置10 min后排出乳清。42 ℃条件下静置堆酿30 min。乳清充分排出后,加入1.5%的食盐,然后在92 ℃、75%的食盐水中热烫拉伸,将其压成长方体,冷却至常温后真空包装。贴标并在4 ℃冰箱中成熟90 d得到马苏里拉奶酪成品。
乳清奶酪的制作方法除了在加凝乳酶之前加入25%的乳清,并将凝乳酶的添加量降低为2.25‰外,其他工艺与对照奶酪的制作工艺相同。分别在0 d、30 d、60 d、90 d取样,将对照奶酪编号为CK-0 d、CK-30 d、CK-60 d、CK-90 d,将乳清奶酪编号为RQ-0 d、RQ-30 d、RQ-60 d、RQ-90 d对照,测定各项指标。
1.3.2 活菌数的测定
取25 g奶酪于225 mL灭菌后的生理盐水中,在匀浆机中以10 000 r/min的转速匀浆1 min,然后用生理盐水进行10倍梯度稀释,取稀释液进行平板计数。乳酸球菌和乳酸杆菌分别用M17和LBS培养基在37 ℃培养48 h,取菌落数在30~300个/平板的平板计数,结果以lg(CFU/g)表示。
1.3.3 油脂析出性的测定
参照李红娟等[17]的方法进行测定。将奶酪样品切成高度为7 mm、直径为15 mm的圆柱形,将切好的圆柱形奶酪样品放在预先铺好滤纸的培养皿中,将其放于110 ℃的烘箱中加热1 h后取出,恢复室温后,测量滤纸上形成的油圈的直径。
1.3.4 挥发性风味物质的测定
参考赵赟等[18]的GC-MS法测定。前处理条件:取奶酪样品5 g,将其切成芝麻粒大小,加入25 mL萃取瓶中,再将萃取瓶盖迅速盖紧,将其加热到60 ℃水浴平衡30 min,再将老化完成的固相微萃取(solid-phase micro-extraction,SPME)萃取头(65 μm DVB/PDMS)插入萃取瓶中萃取30 min。
GC条件:进样口温度为250 ℃,载气为氦气(He),流速为1.0 mL/min;升温程序为初始柱温40 ℃,维持3 min,以6 ℃/min升至200 ℃,维持2 min,再以10 ℃/min升至230 ℃,维持10 min。
MS条件:离子源温度230 ℃,电子电离(electron ionization,EI)源,电子能量70 eV,检测器的电压1 000 V,质谱扫描范围35~400 m/z。
1.3.5 游离氨基酸含量的测定
参照GB 5009.124—2016《食品中氨基酸的测定》中的方法测定奶酪中的游离氨基酸含量。
1.3.6 数据处理
所有实验均有3个生物学重复,结果用“平均值±标准差”表示。采用Microsoft Excel 2007整理数据,采用SPSS 19.0软件进行方差分析,采用SIMCA 14.0软件进行主成分分析(principal component analysis,PCA)。氨基酸组成热图及相关性热图用Hiplot进行绘制,其余图形用Origin 8.0软件进行绘制。
2 结果与分析
2.1 不同奶酪成熟期内活菌数的变化
对照奶酪和乳清奶酪在成熟期间(0~90 d)活菌数的变化见表1。由表1可知,乳清奶酪与对照奶酪在成熟过程中乳酸菌活菌数均呈先上升后下降的趋势,且在同一个成熟期内,乳清奶酪的活菌数显著高于对照奶酪中活菌数(P<0.05)。在成熟期30 d时,乳清奶酪和对照奶酪中的乳酸菌活菌数均达到最大值,其中对照奶酪中保加利亚乳杆菌活菌数增加9%,嗜热链球菌活菌数增加10%。乳清奶酪中保加利亚乳杆菌活菌数增加10%,嗜热链球菌活菌数增加11%[19]。
表1 不同奶酪成熟期期间活菌数的变化
Table 1 Changes of viable bacterial count of different cheeses during the ripening period
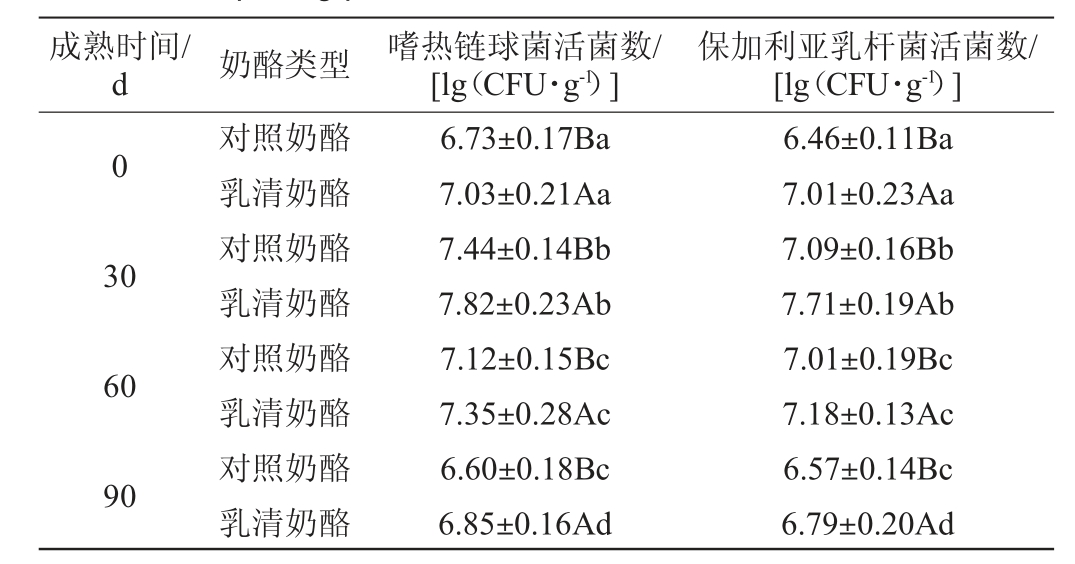
注:同列数据大写字母不同表示两种奶酪差异显著(P<0.05);同列数据小写字母不同表示不同成熟期差异显著(P<0.05)。
奶酪在成熟初期活菌数呈增长趋势,增长的主要原因可能是奶酪中含有的大量营养物质适合微生物生长繁殖;在奶酪成熟中后期,随着奶酪成熟时间的增长,其水分含量下降,从而导致奶酪中盐浓度增大,在此阶段,奶酪中可供微生物生长繁殖的营养物质含量也在下降,从而抑制了微生物的生长,所以在奶酪成熟后期,活菌数量减少[20]。在成熟期,乳清奶酪的乳酸菌活菌数>对照奶酪,分析主要原因可能是乳清中含有一部分乳糖,乳糖为乳酸菌提供了大量底物,可以促进乳酸菌的增长繁殖[21]。
2.2 不同奶酪成熟期内油脂析出性的变化
奶酪加热温度达到40 ℃以上时,其融化性、拉伸性、流动性、油脂析出性等性质会随加热温度的上升而显现出来,奶酪的油脂析出性既反映出了奶酪加热后的流动分散能力,还能体现出奶酪内部的胶束结构的完整性[20]。对照奶酪和乳清奶酪在成熟期间(0~90 d)油脂析出性的变化见图1。
由图1可知,在奶酪成熟期间,油脂析出性一直呈上升趋势,而且在同一成熟期间,对照奶酪的油脂析出性<乳清奶酪。在0~90 d的成熟期内,乳清奶酪的油脂析出性增加62.0%,对照奶酪的油脂析出性增加58.8%。乳清奶酪的油脂析出性高于对照奶酪,分析原因可能是添加乳清后,乳清中含有的乳清蛋白使酪蛋白的结构顺序发生了改变;奶酪油脂析出性的变化与蛋白质降解及蛋白质结构有很大的关系,酪蛋白基质的结构受到奶酪液相状态和酪蛋白钙的影响,与此同时酪蛋白基质的结构可控制脂肪的包裹从而可以影响到酪蛋白网络结构的拉伸特性[22]。在奶酪成熟期内由于蛋白质的降解,减弱了蛋白之间的相互作用,使蛋白胶束间的结构也变弱,从而导致了蛋白胶束结构之间的乳浆中存在脂肪,这些脂肪逐渐聚团会形成较大的脂肪颗粒,在较高的温度情况下,大脂肪颗粒很容易被释放出来,因此会增加奶酪的油脂析出性。
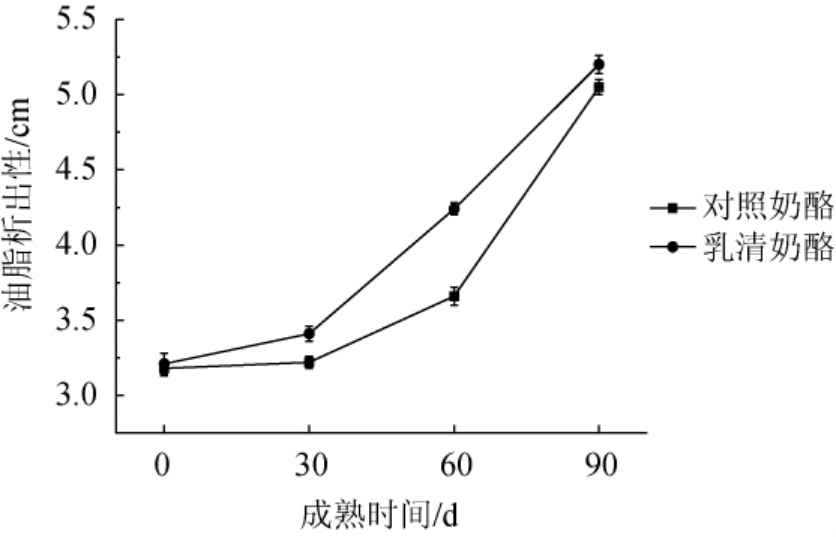
图1 不同奶酪在成熟期间油脂析出性的变化
Fig.1 Changes of oil release properties of different cheeses during the ripening period
2.3 不同奶酪成熟期内挥发性风味物质的变化
2.3.1 挥发性风味物质检测结果
对照奶酪和乳清奶酪在成熟期间(0~90 d)挥发性风味物质GC-MS检测结果见表2。由表2可知,从两种奶酪中共检测到61种挥发性风味物质,包括酸类22种、醇类9种、醛类7种、酯类16种、酮类7种。其中对照奶酪中共检出43种,包括酸类14种、醇类8种、醛类4种、酯类13种、酮类4种;其中乳清奶酪中共检出55种,包括酸类22种、醇类7种、醛类7种、酯类13种、酮类6种。在刚制备好奶酪(0 d)时,乳清奶酪相较于对照奶酪而言,酯类、酸类、酮类相对含量更多。当成熟到30 d时,两种奶酪中的醛、酸、酯、酮类物质相对含量及种类均增加,除醇类物质外,对照奶酪中的风味物质种类及含量均少于乳清奶酪。当成熟到60 d时,奶酪中的醇、酸、酯类物质相对含量及种类相较于30 d时呈增加的趋势;醛和酮类物质呈下降趋势,因为醛和酮类物质均为羰基类化合物,在奶酪中不稳定,停留时间较短,会很快转换为相应的酯和酸[23]。当成熟到90 d时,奶酪中的酮、醛类物质相对含量呈下降趋势,酯类物质相对含量呈上升趋势,原因可能是在奶酪成熟后期酸类物质分解为酯类物质[24],酯类物质可赋予奶酪香气,所以酯类物质含量的增加可以直接影响奶酪的香味[25]。在奶酪成熟后期酸类物质含量下降,表明酸类物质在脂肪降解和蛋白水解的作用下可以分解生成酯类物质,可提升奶酪的风味[24,26]。乳清奶酪中风味物质含量高于同期对照奶酪,可以说明在成熟期间,乳清奶酪的风味强于同时期的对照奶酪。
表2 不同奶酪成熟期间主要挥发性风味物质的变化
Table 2 Changes of main volatile flavor substances of different cheeses during the ripening period

续表

注:不同大写字母代表同一组奶酪在不同成熟时间存在显著差异(P<0.05),不同小写字母代表不同组奶酪在同一成熟时间存在显著差异(P<0.05)。
酸类物质对奶酪的风味物质有重要影响,在检测出的酸类物质中,乙酸、丁酸、辛酸、癸酸的挥发性较强,且这些酸在马苏里拉奶酪中均可以被检测出,乙酸带有醋味[27],是由奶酪中微生物所代谢的乳糖所产生的;丁酸以及辛酸带有强烈的奶油气味[27-29];己酸带有奶香气味并略带油脂气[27];癸酸带有蜡脂香[30]。酸类物质主要可以降低奶酪的pH值抑制腐败菌的生长,是其他物质的前体物质,在奶酪成熟中后期酸类物质可被降解氧化生成其他风味物质。两种奶酪的酯类物质种类及含量均较多,酯类物质可为奶酪提供花香味及果香味,丁酸乙酯带有苹果味[30]、正己酸乙酯带有果香[31]、丁位十一内酯带有果香味[32],酯类物质对奶酪整体香味影响较大[33-34]。酮类及醛类物质的阈值较低,在奶酪中的存留时间很短,但是影响奶酪风味的重要因素且酮类物质大多是由不饱和脂肪酸氧化而形成的,是产生牛奶香味的重要来源[35],己醛带青草香味[36]、壬醛带有油脂香气[37]、2-十一酮带有牛奶香味[35]、3-辛酮带有甜橙香气[38]。本实验在马苏里拉奶酪中共检测出7种醛类物质,且这些醛类物质大多是在成熟前中期检测到的,因为此类物质会很快被还原为相应的醇和酸。醇类物质在0 d时很少被检测出来,在奶酪成熟过程中醇类物质主要由乳糖代谢、酮类物质还原、氨基酸的代谢以及脂肪酸降解产生[39]。
结果表明,在奶酪成熟过程中(0~90 d),越到成熟后期,奶酪的风味物质更多,酸类物质明显减少,分解为酯类和醇类物质,且所有挥发性物质中乳清奶酪所占比例更大,说明乳清奶酪中的挥发性风味物质优于对照奶酪。
2.3.2 挥发性风味物质的主成分分析
基于挥发性风味物质进一步对乳清奶酪与对照奶酪成熟期样品进行主成分分析,结果见图2。
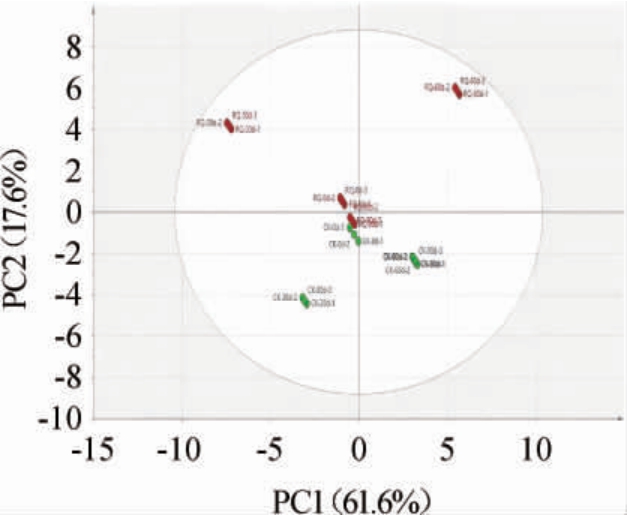
图2 不同奶酪成熟期挥发性风味物质主成分分析结果
Fig.2 Principal component analysis results of volatile flavor components of different cheeses during the ripening period
由图2可知,PC1的方差贡献率为61.6%,PC2的方差贡献率为17.6%,累计方差贡献率为79.2%,说明此模型预测能力可靠,可以说明整体的样本信息。乳清奶酪与对照奶酪分布在不同区域,乳清奶酪集中在第一、二象限,对照奶酪则集中在第三、四象限;结果表明,乳清奶酪与对照奶酪中的挥发性风味物质有明显区别。
2.4 不同奶酪成熟期内氨基酸含量的变化
对照奶酪和乳清奶酪在成熟期间(0~90 d)氨基酸含量的变化见图3。
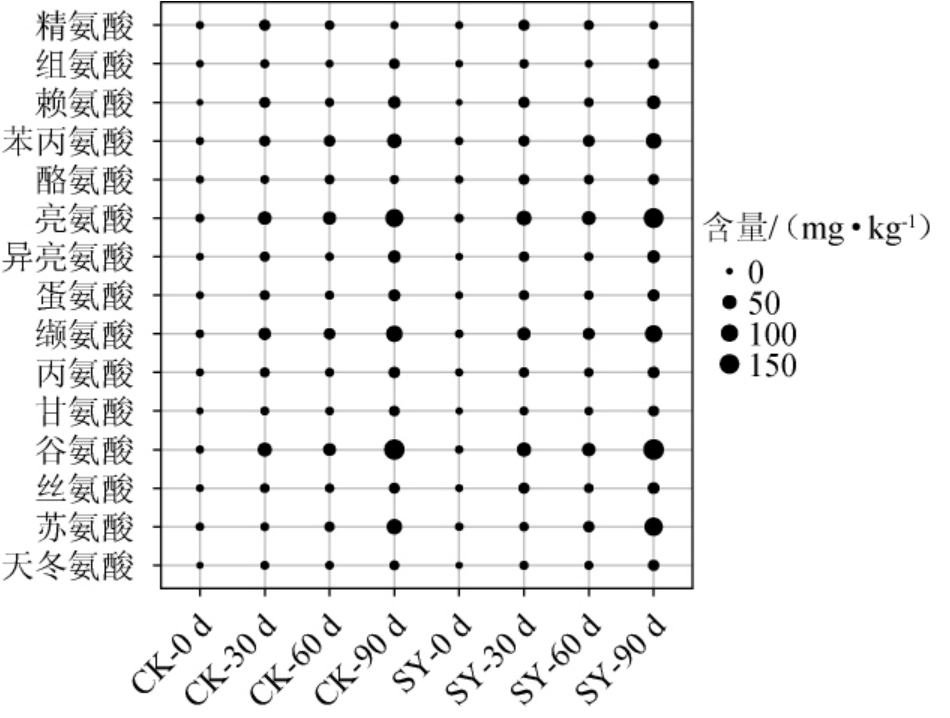
图3 不同奶酪成熟期间氨基酸含量的变化
Fig.3 Changes of amino acid contents of different cheese during the ripening period
由图3可知,从乳清奶酪和对照奶酪成熟期间均分别检测到15种游离氨基酸,两种奶酪的氨基酸含量存在差异,乳清奶酪中氨基酸含量明显高于对照奶酪。两种奶酪在成熟0~30 d期间氨基酸含量均呈现上升趋势;在成熟期30~90 d内,伴随成熟时间的增长,并不是所有类型氨基酸的含量都可随着奶酪成熟期的增长而变高。除苯丙氨酸、苏氨酸的含量随着成熟时间的延长而增大之外,在成熟期30~60 d之间其余氨基酸含量均呈现出下降的趋势,探究其原因可能是奶酪中仍残留有部分凝乳酶及奶酪中微生物代谢所产生的部分酶将奶酪中氨基酸转化为其他风味物质如醛、酸、酮、醇、酯类物质[24],除苯丙氨酸、苏氨酸外的其他氨基酸在成熟期60~90 d期间含量呈上升趋势,主要是因为随着成熟时间的增加,蛋白质的水解程度不断增加,奶酪中微生物的活性降低,从而导致成熟后期奶酪中氨基酸的含量再次呈上升的趋势[40]。
2.5 不同奶酪成熟期内挥发性风味物质与氨基酸的相关性分析
为了研究氨基酸与奶酪风味之间的关系,对不同奶酪成熟期内挥发性风味物质与氨基酸进行相关性分析,结果见图4。由图4可知,精氨酸、异亮氨酸、酪氨酸、苯丙氨酸在奶酪成熟期间对奶酪的风味物质起重要作用,精氨酸和酪氨酸与苦味有关,丙氨酸和苏氨酸属于甜味氨基酸[41];苯丙氨酸在奶酪成熟期间会分解为有奶香味的醇类物质[42]。除精氨酸、丝氨酸、酪氨酸、天冬氨酸外,其余氨基酸对亚油酸、肉豆蔻酸、十三烷酸、月桂酸、己酸、乙酸、十一烷酸、癸酸、2-癸醇、1,3-丁二醇、2,3-丁二醇、2-十四烷醇、2-辛醇、2-辛炔酸乙酯、油酸甲酯、丁位十一内酯、甘油单油酸酯、亚油酸乙酯、辛酸-1-甲基乙醇酯及顺-11-十六碳醛具有积极的作用。
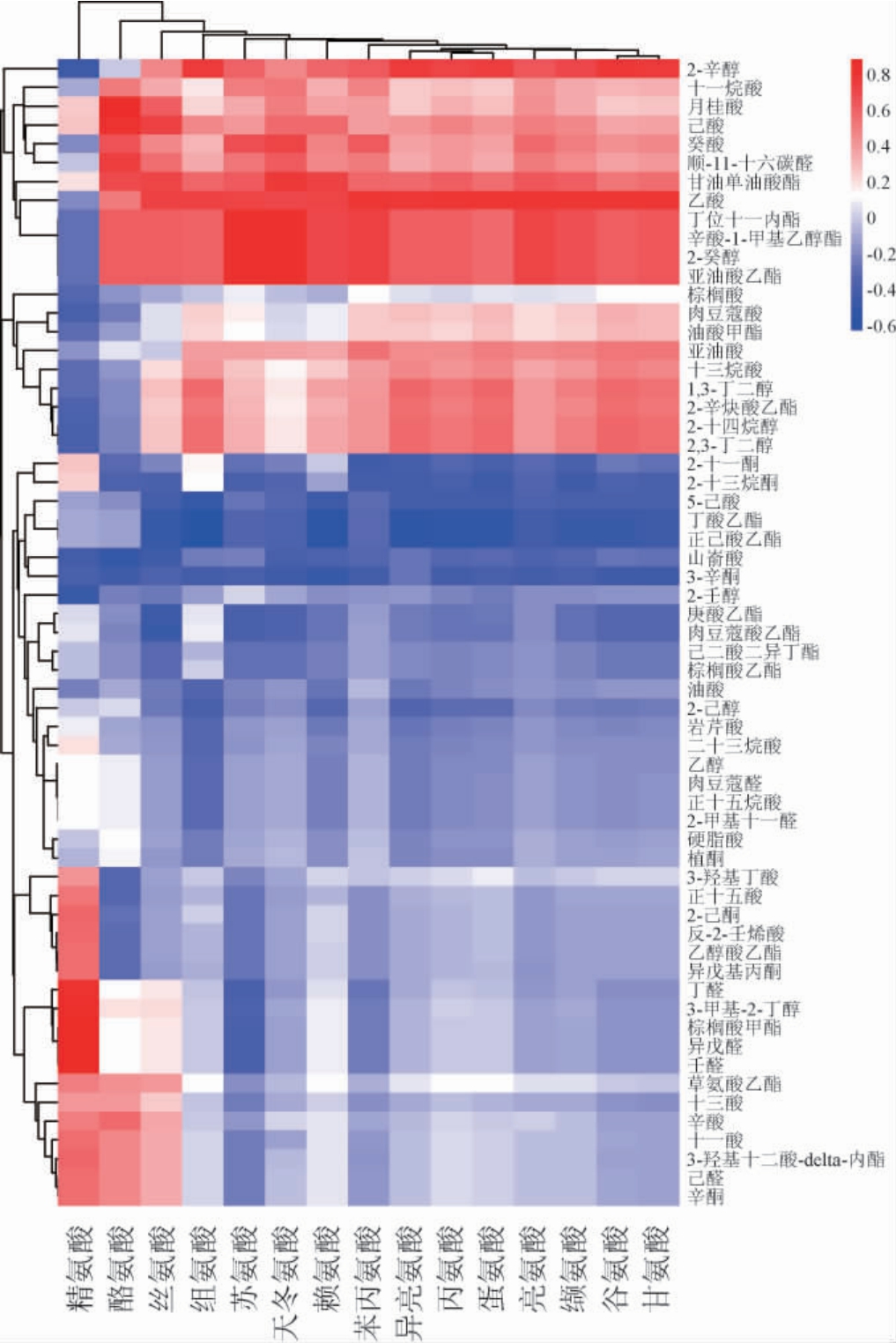
图4 不同奶酪氨基酸及挥发性风味物质相关性分析热图
Fig.4 Correlation analysis heat map of amino acid and volatile flavor substances of different cheese
红色代表正相关,蓝色代表负相关。
3 结论
本研究考察乳清添加对Mozzarella奶酪成熟期(0 d、30 d、60 d、90 d)乳酸菌活菌数、油脂析出性、挥发性风味物质及氨基酸含量变化的影响,结果表明,在成熟期0~90 d,两种Mozzarella奶酪中乳酸菌活菌均先增加后减小,油脂析出性增大;两种奶酪中共检测到61种挥发性风味物质,对照奶酪中共检出43种,乳清奶酪中共检出55种,醛、酸、酮类物质的含量均呈现先上升后下降的趋势,醇类物质的含量呈现先下降后上升的趋势,酯类含量有不同程度的增加;总氨基酸含量呈现先上升,再小幅度下降,最后又上升的波动式变化。在成熟期间,与未添加乳清的对照奶酪相比,乳清奶酪的乳酸菌活菌数及油脂析出性均高于对照奶酪;两种奶酪成熟期间均分别检测出15种游离氨基酸,成熟期90 d时,乳清奶酪的氨基酸总含量(848.92 mg/kg)高于对照奶酪(663.44 mg/kg)。通过挥发性风味物质与氨基酸间的相关性分析发现,除精氨酸、丝氨酸、酪氨酸、天冬氨酸外,其余氨基酸对20种挥发性风味物质具有积极作用。综上说明添加乳清对提升马苏里拉奶酪的风味具有重大意义,结果为乳清的再利用提供了理论依据。
[1]罗洁,任发政,王紫薇,等.干酪质构与风味控制技术研究进展[J].农业机械学报,2016,47(1):190-201,208.
[2]杜长江.响应面法优化再制Mozzarella干酪工艺的研究[J].中国乳品工业,2015,43(9):48-50.
[3]洪启通,钟俊桢,俞宏达,等.DHPM协同胃蛋白酶对β-乳球蛋白构象的影响[J].中国食品学报,2017,17(10):51-56.
[4]房天琪.液态浓缩乳清蛋白的制备与功能特性修饰及应用研究[D].长春:吉林大学,2019.
[5]TORRES I C,AMIGO J M,KNUDSEN J C,et al.Rheology and microstructure of low-fat yoghurt produced with whey protein microparticles as fat replacer[J].Int Dairy J,2018,81:62-71.
[6]庞肖飞,汪超.牛乳乳清蛋白的主要组成及其营养特点[J].畜牧与饲料科学,2016,37(3):52-54.
[7]PRAZERES A R,CARVALHO F,RIVAS J.Cheese whey management:A review[J].J Environ Manage,2012,110:48-68.
[8]刘季善,张健,高建勇,等.大豆分离蛋白生产乳清废水提取回收清蛋白的方法:CN101497645B[P].2014-06-11.
[9]王胭.干酪副产物乳清的综合利用[D].济南:齐鲁工业大学,2014.
[10]孙敏.乳清蛋白抗氧化肽的制备、分离纯化及体外抗氧化活性研究[D].雅安:四川农业大学,2019.
[11]刘培玲,张晴晴,高增丽,等.乳清蛋白改性研究进展[J].食品科学,2021,42(23):333-348.
[12]杜慧敏.浓缩乳清蛋白发酵乳制品的制备研究[D].长沙:中南林业科技大学,2021.
[13]GAMLATH C J,LEONG T S H,ASHOKKUMAR M,et al.Incorporating whey protein aggregates produced with heat and ultrasound treatment into rennet gels and model non-fat cheese systems[J].Food Hydrocolloid,2020,109:106103.
[14]CAGNO R D,PASQUALE I D,ANGELIS M D,et al.Use of microparticulated whey protein concentrate,exopolysaccharide-producing Streptococcus thermophilus,and adjunct cultures for making low-fat Italian Caciotta-type cheese[J].J Dairy Sci,2014,97(1):72-84.
[15]迟涛,王欢,姜楠,等.聚合乳清蛋白对低脂切达干酪理化性质的影响[J].乳业科学与技术,2020,43(2):1-7.
[16]闫文杰,崔建云,任发政.乳清干酪的研制[J].中国酿造,2010,29(9):173-174.
[17]李红娟,王祎,刘燕,等.热烫拉伸融化过程对Mozzarella干酪品质、分子间作用力及微观结构的影响[J].食品科学,2020,41(3):30-36.
[18]赵赟,夏亚男,刘皓,等.基于GC-MS及PCA对比15种奶酪的有机酸成分[J].食品研究与开发,2021,42(15):163-171.
[19]郝欣悦,李晓东,刘璐,等.瑞士乳杆菌对契达干酪成熟期间所产ACE抑制肽的影响及其消化稳定性[J].食品科学,2021,42(18):143-149.
[20]豆佳毓,梁琪,张炎.脱脂牦牛乳硬质干酪成熟期间水溶性多肽的抗氧化活性[J].食品与发酵工业,2020,46(10):80-86.
[21]吕建敏,刘月环.乳清粉对断奶实验兔肠道微生物区系和益生菌的影响[J].中国比较医学杂志,2015,25(8):12-17.
[22]李开鑫,纪晓宇,王芳,等.天然Mozzarella干酪和再制Mozzarella干酪理化特性和功能特性的比较[J].食品科学,2018,39(13):55-60.
[23]王蒙,侯莉,曹长春,等.清炖猪肉汤香气物质的分析鉴定[J].食品科学,2015,36(24):105-111.
[24]郑晓吉.新疆哈萨克族奶酪微生物菌群结构及特征风味解析[D].无锡:江南大学,2018.
[25]陈欢.新疆哈萨克族传统奶酪中乳酸菌发酵剂的筛选及对奶酪风味影响的研究[D].石河子:石河子大学,2019.
[26]OZTURKOGLU-BUDAK S,WIEBENGA A,BRON P A,et al.Protease and lipase activities of fungal and bacterial strains derived from an artisanal raw ewe′s milk cheese[J].Int J Food Microbiol,2016,237:17-27.
[27]曾椿淋.内蒙古手工奶酪微生物多样性和功能性研究[D].镇江:江苏大学,2020.
[28]葛武鹏.山羊乳营养特性及对嗜酸乳杆菌增菌发酵效能的研究[D].杨凌:西北农林科技大学,2008.
[29]PETERSON D G,REINECCIUS G A.Characterization of the volatile compounds that constitute fresh sweet cream butter aroma[J].Flavour Frag J,2003,18:215-220.
[30]VAN GEMERT L J.Compilations of odour threshold values in air,water and other media[M].Second enlarged and revised edition.Netherlands:Oliemans Punter&Partners BV,2011.
[31]XIAO Z B,XIANG P,ZHU J C,et al.Evaluation of the perceptual interaction among sulfur compounds in mango by Feller′s additive model,odor activity value,and vector model[J].J Agr Food Chem,2019,67(32):8926-8937.
[32]王爱华,马红叶,李荣飞,等.凤梨草莓与黄毛草莓种间杂种果实香气成分的代谢谱分析[J].中国农业科学,2021,54(5):1043-1054.
[33]ORDIALES E,MARTIN A,BENITO M J,et al.Role of the microbial population on the flavor of the soft-bodied cheese Torta del Casar[J].J Dairy Sci,2013,96(9):5477-5486.
[34]YILDIZ G,RABABAH T M,FENG H.Ultrasound-assisted cutting of cheddar,mozzarella and swiss cheeses-effects on quality attributes during storage[J].Innov Food Sci Emerg,2016,37(PA):1-9.
[35]秦晓.养殖暗纹东方鲀风味物质鉴定分析[D].上海:上海海洋大学,2015.
[36]赵泽伟,丁筑红,顾苑婷,等.基于SPME-GC-MS和电子鼻分析薏苡仁油加速氧化过程挥发性成分变化[J].食品科学,2019,40(16):220-226.
[37]LIU H,WANG Z Y,ZHANG D Q,et al.Characterization of key aroma compounds in Beijing roasted duck by gas chromatography-olfactometry-mass spectrometry,odoractivity values,and aroma-recombination experiments[J].J Agric Food Chem,2019,67(20):5847-5856.
[38]王德峰.食用香味料制备与应用手册[M].北京:中国轻工业出版社,2000:31.
[39]COLLINS Y F,MCSWEENEY P L H,WILKINSON M G.Lipolysis and free fatty acid catabolism in cheese: a review of current knowledge[J].Int Dairy J,2003,13(11):841-866.
[40]梅迩蓝.外源添加乳酸菌对传统奶酪品质的影响[D].呼和浩特:内蒙古农业大学,2021.
[41]魏沙沙,彭静,陈志丹,等.尤溪苦茶苦味相关物质检测及与苦味的关联分析[J].茶叶科学,2021,41(3):337-349.
[42]杨宇.基于发酵特性的乳酸乳球菌乳酸亚种基因组分析及应用[D].无锡:江南大学,2021.