窖泥的理化指标(水分含量、pH值、有机酸等)决定着窖泥品质,直接影响窖泥微生物群落组装构成[1]。如水分含量直接影响窖泥pH及微生物区系组成[2];适当的pH能促进酒精发酵,还能促进香气前体物质的合成,提高酒质[3]。有研究证实,窖泥的pH值和总酸是影响窖泥优势菌群空间分布的主要理化因子[4]。窖泥中细菌总量与pH值、水分含量和有效磷等呈正相关[5]。此外,窖泥pH值、铵态氮、乙酸等与老窖泥菌群呈强正相关,乳酸、乙醇和丙酸等与新窖泥菌群呈强正相关[6]。因此,目前研究热点在于揭示窖泥微生物多样性与其理化因子之间的关系,但考虑某一单独的理化因子影响窖泥微生物群落结构变化,是值得探讨的。
乳酸是浓香型白酒的四大有机酸之一,对窖泥pH值影响最大,具有一定的抑菌功能,维持窖池的酸性环境利于淀粉糖化和乙醇发酵的进行[7-8];同时对白酒的香气具有矫正和稳定作用,能减轻苦涩味和糙辣感,使酒质浓厚并带有回甜味[9]。与窖泥微生物方面,乳酸与Caproiciproducens和Hydrogenispora等优势菌属呈较强相关性[10]。同时,乳酸是窖泥、糟醅和黄水中主要有机酸,根据不完全文献统计[10-12],乳酸含量约为10~80 g/L,因此,研究乳酸对窖泥菌群的影响是必要的。
本实验研究不同pH值条件下浓香型白酒窖泥微生物群落结构演替和主要风味物质进行分析和比较,通过在一定pH值的环境下揭示三者之间的联系,以期为阐明窖泥微生物的功能及其影响代谢因素提供理论依据。
1 材料与方法
1.1 材料与试剂
窖泥样品:采集自五粮液股份有限公司酿造车间,窖池窖龄约20年。窖泥均采集为下层窖泥,采集3个平行样品,分别取100 g,混合均匀,于-20 ℃条件下保存备用。
乳酸(分析纯):美国Sigma公司;发酵培养基(经糊化五粮粉培养基):参照文献[13]进行制备,五粮质量配比为高粱∶大米∶糯米∶小麦∶玉米=18∶11∶9∶8∶4,五粮粉∶水为1∶10的比例煮沸糊化。
1.2 仪器与设备
NextSeq 500高通量测序仪:美国Illumina公司;MP Biomedicals Fast脱氧核糖核酸(deoxyribonucleic acid,DNA)土壤样品提取试剂盒:美国MP Biomedicals生物医学公司;ABI 7200聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;C7~C30直链正构烷烃(气相色谱级色谱纯):美国Sigma-Aldrich公司;顶空固相微萃取(headspace solid-phase micro-extraction,HS-SPME)手柄、50/30 μm CAR/DVB/PDMS Stableflex纤维萃取头:美国Supelco公司;PALRTC2-7890B-5977BMSD带有全自动样品前处理平台的气质联用仪(gas chromatography-mass spectrometry,GC-MS)、TG-WAXMS石英毛细管色谱柱(30.0 m×0.25 mm×0.5 μm):美国Agilent公司。
1.3 方法
1.3.1 窖泥洗脱液的制备
按窖泥∶无菌水=1∶10(g∶mL)的比例进行涡旋混匀5 min,先800 r/min低速分离,收集上清液;后10 000 r/min高速收集,去掉上清液,再按窖泥∶无菌水=1∶10(g∶mL)比例加入无菌水,重复以上步骤5~6次,尽量洗脱窖泥溶解于水中的风味物质,得到窖泥洗脱液。
1.3.2 不同pH胁迫窖泥微生物发酵
按10%比例接种窖泥洗脱液接种至已灭菌的发酵培养基中,采用乳酸分别调节pH至3.0、4.0、5.0,对照组为pH6.8,34 ℃培养箱中培养15 d,分别在发酵第0天、第3天、第5天、第7天、第15天取样。
1.3.3 基因组DNA提取及PCR扩增
采用土壤DNA提取试剂盒提取发酵液的DNA,具体操作步骤见试剂盒使用手册。高通量测序区域为细菌16SrDNA基因V4区域。引物为515F(5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGGTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGGACTACHVGGGTTCTAAT-3′)。PCR扩增体系:DNA模板为2.5 L,引物515F为5 L、806R为5 L和2×Taq PCR Master mix为12.5 L,PCR扩增程序:94 ℃预变性3 min;94 ℃变性20 s,53 ℃退火25 s,72 ℃延伸45 s,共25个循环;72 ℃延伸5 min。利用磁珠法纯化PCR扩增产物,再进行测序文库构建[14]。
1.3.4 风味物质的检测
样品前处理:发酵液经高速离心后,采用0.22 μm滤膜过滤于-20 ℃冰箱保存,待测。
HS-SPME条件:准确吸取1 mL发酵液样品于20 mL顶空样品瓶中,加入定量内标(4-辛醇,5.5 mg),置于50 ℃金属浴中平衡15 min,插入萃取头吸附45 min,随后插入GC进样口热解吸3 min,每个样品2个平行测试。
GC条件:进样口温度250 ℃,载气为氦气(He),流速1.0 mL/min,分流模式进样,分流比为15∶1,分流流量为15 mL/min。升温程序:起始温度40 ℃,保持5 min,以4 ℃/min升至230 ℃,保持5 min。MS条件:电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度230 ℃,四级杆温度150 ℃,质量数扫描范围m/z为35~350。
1.3.5 数据处理
对测序原始数据参照文献[14]进行处理;采用Origin 2021绘制柱状图;采用R软件绘制热图;采用Canoco5软件绘制冗余分析(redundancy analysis,RDA)图。
2 结果与分析
2.1 基于门水平下不同pH胁迫窖泥微生物菌群变化
基于操作分类单元(operational taxonomic unit,OTU)注释,共得到10个门,其中细菌门9个,古菌门1个。其中4个优势菌门(相对丰度含量>1%的门)占每个样品总含量的98%以上。
由图1可知,各优势门的相对丰度,培养前以厚壁菌门(Fimicutes)(62.42%)、广古菌门(Euryarchaeota)(27.58%)和拟杆菌门(Bacteroidetes)(7.35%)为优势菌门,培养后以厚壁菌门(Fimicutes)和变形菌门(Proteobacteria)为优势菌群。与对照组相比,在pH3.0和pH4.0胁迫发酵下,优势菌群主要为厚壁菌门(Fimicutes)(90%以上),而在pH5.0胁迫发酵下,优势菌群主要为厚壁菌门(Fimicutes)和变形菌门(Proteobacteria),前者随发酵时间增加呈逐渐增加的趋势,后者随发酵时间增加呈逐渐减少的趋势。说明在发酵环境pH≤4.0时,窖泥微生物群落结构演替在门水平下具有显著性差异。
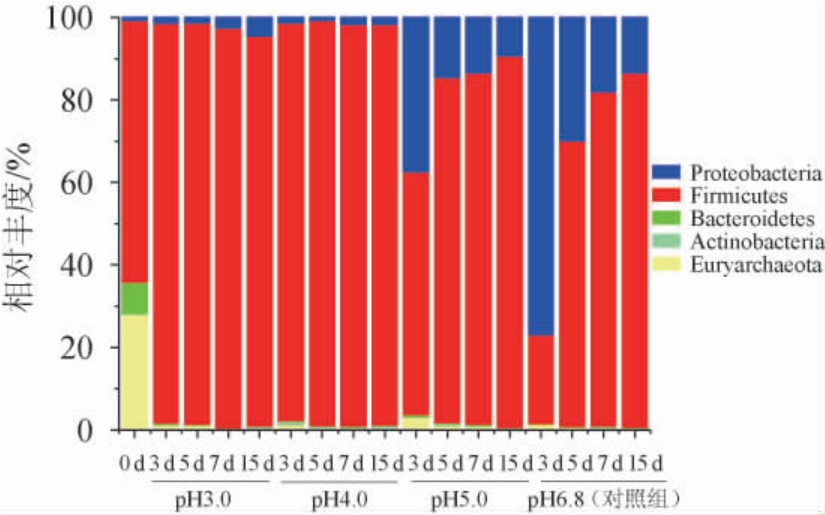
图1 基于门水平优势窖泥微生物菌群组成
Fig.1 Dominant microbial communities in pit mud based on phylum level
2.2 基于属水平下不同pH胁迫窖泥微生物菌群变化
将平均相对丰度>1%的微生物定义为优势微生物[15]。本研究基于OTU注释,共得到116个属,其中相对丰度>1%的优势菌属共21个,各优势菌属的相对丰度见图2。
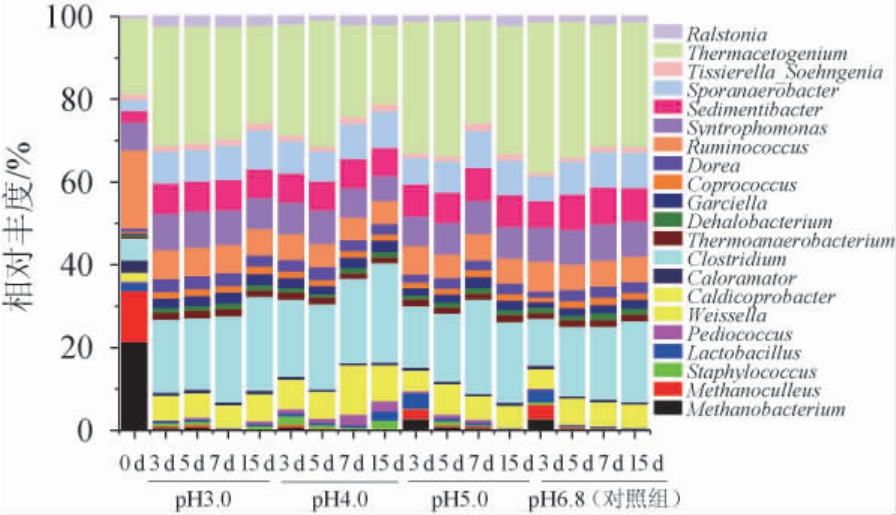
图2 基于属水平优势窖泥微生物菌群组成
Fig.2 Dominant microbial communities in pit mud based on genus level
由图2可知,与培养前相比,发酵后的甲烷细菌属(Methanobacterium)和甲烷囊菌属(Methanoculleus)呈显著性减少,这是因为甲烷菌属于极端厌氧环境下生长的不产芽孢的革兰氏阴性菌,能利用氢、甲酸、甲醇、乙酸类物质生成甲烷[16-17]。发酵后的优势菌群主要为Thermacetogenium和Clostridium,随发酵时间增加呈逐渐增加的趋势。在pH 3.0胁迫发酵下,Thermacetogenium和Clostridium的相对含量分别为19.66%~23.65%、15.14%~18.95%;在pH 4.0胁迫发酵下,Thermacetogenium和Clostridium的相对含量分别为15.89%~26.66%、15.67%~20.03%;在pH5.0胁迫发酵下,Thermacetogenium和Clostridium的相对含量分别为1.80%~9.94%、0.85%~6.23%;对照组中,Thermacetogenium和Clostridium的相对含量分别为2.84%~6.55%、1.46%~4.28%。Thermacetogenium以乙醇、糖类化合物、氨基酸为底物,能将乙酸转化为甲烷[18],Clostridium是窖泥中重要功能菌之一,在厌氧或兼性厌氧下能代谢产生有机酸(己酸、丁酸等)和醇[19-20],均属于梭状芽胞杆菌纲(Clostridia),是维持窖泥菌群网络结构稳定、微生态平衡及代谢白酒中重要呈香物质及其前体物质(如己酸、丁酸等)的主要微生物[21-22]。值得注意的是,优质窖泥中含量最多的属瘤胃球菌属(Ruminococcus)(相对含量5%以上),随发酵时间增加呈逐渐减少的趋势。
同时,在pH3.0和pH4.0胁迫发酵下,Clostridium、Thermacetogenium、Caldicoprobacter、瘤胃球菌属(Ruminococcus)、Garciella、Coprococcus、Tissierella_Soehngenia、互营单胞菌属(Syntrophomonas)、沉积菌属(Sedimentibacter)、Sporanaerobacter和Thermoanaerobacterium等优势菌属的相对丰度含量均在2%以上,且均大于在pH5.0胁迫发酵下和对照组(相对丰度含量为1%左右)。这与赵东等[14]确定窖泥中的优势菌属为Lactobacillus、Caldicoprobacter、Caloramater、Clostridium、Caloribacterium、Garciella、Syntrophomonas、Sedimentbacter、Sporanaerobacter、Tissierella_Soehngenia 等基本保持一致。这些优势菌属对浓香型白酒重要风味物质形成和维持窖泥微生态平衡具有重要作用。如Caldico-probacter能利用葡萄糖、乳糖等产生乙酸、CO2和H2[23];Sedimentibacter具有降解氨基酸的功能,其分解产物铵态氮可以作为窖泥中微生物生长所需氮源[24];Coprococcus能进行丙酸发酵[25]。故对窖泥微生物生长所需的特定环境进行适当的调整,为定向富集窖泥中某种或某些优势菌属提供一种方向。
2.3 不同pH胁迫发酵下发酵液中风味物质变化
利用HS-SPME/GC-MS对发酵液风味成分进行了分析,结果见图3。由图3可知,共鉴定出30种风味物质,定量分析了11种差别较大的风味成分,包括4种醇类、5种酯类和2种芳香族类。其中苯乙醇含量(20~70 mg/kg)最高,后依次为异戊醇(20~37 mg/kg)、异丁醇(2~9 mg/kg)、乙酸乙酯(0.3~1.7 mg/kg)。苯乙醇、异戊醇、乙酸乙酯、异丁醇在发酵过程中呈现先增高后降低的趋势,均在第7天达到最高。
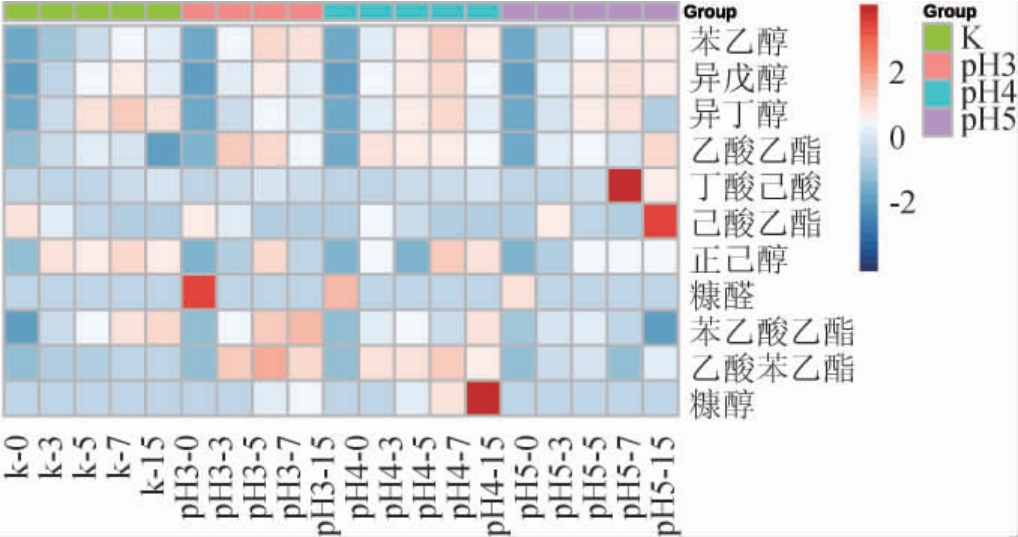
图3 不同pH胁迫发酵下风味物质的变化
Fig.3 Changes of flavor compounds under different pH stress
2.4 发酵液中优势菌属与主要风味物质的冗余分析
采用冗余分析法解读发酵液中的优势菌属的相对含量与主要风味物质之间的相关性,结果见图4。
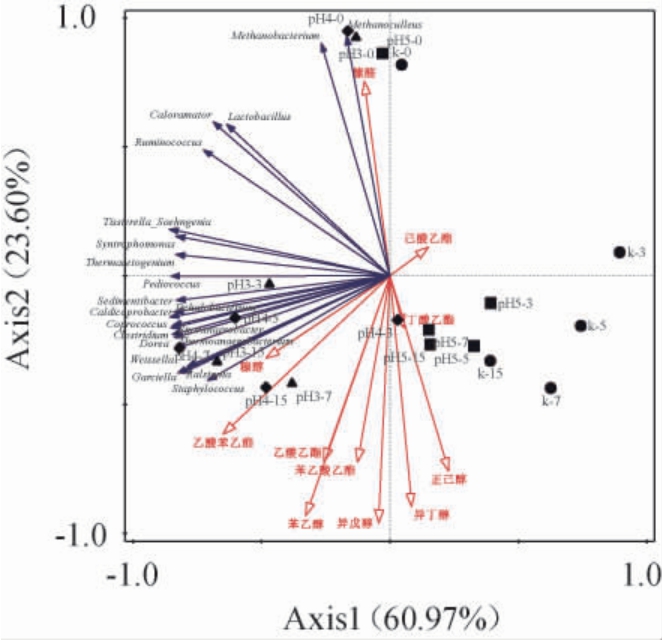
图4 发酵液中优势菌属与主要风味物质的冗余分析
Fig.4 Redundancy analysis of dominant genus and main flavor substances in fermentation broth
由图4可知,两个主成分总解释度84.57%。相同pH下发酵前和发酵后能在Axis2轴上能很好地区分开;对比不同pH胁迫发酵下,pH3.0、pH4.0与pH5.0、K-对照组(pH6.8)的主要区别主要集中在Axis1(60.97%)上,其中对照组和pH5.0组主要分布在第四象限,pH3.0和pH4.0组主要分布在第三象限,与其显著相关的为Caldicoprobacter、Clostridium、Thermoanaerobacterium、Garciella、Coprococcus、Sedimentibacter和Sporanaerobacter等。
近年来,关于环境条件决定微生物群落组成的研究越来越多[26]。李小龙等[27]研究芝麻香型白酒微生物群落与环境因子的相关性,表明酸度和乙醇分别是发酵前期和后期微生物群落演替的关键环境推动力。王鹏等[28]通过探究浓香型白酒核心微生物群演替的环境推动力,揭示了化学因素改变是群落演替的关键推动力。SONG Z W等[29]通过探究酱香型白酒核心微生物群与环境因子的相关性,揭示了在发酵前期和后期与核心微生物群显著相关的环境因子分别为乙醇、水分和乳酸、pH。因此,揭示单个环境因子对于微生物群落演替的影响是值得研究的。
3 结论
本研究利用高通量测序技术对不同pH值浓香型白酒窖泥微生物群落结构变化规律。结果表明,在门水平下,在发酵环境pH值≤4.0时,窖泥微生物群落结构变化具有显著性差异,在pH≤4.0胁迫发酵下,优势菌群主要为厚壁菌门(Fimicutes,90%以上),而在pH>4.0胁迫发酵下,优势菌群主要为Fimicutes和变形菌门(Proteobacteria)。在属水平下,共检出21个优势菌属,优势菌群主要为Thermacetogenium和Clostridium,随发酵时间增加呈逐渐增加的趋势。
采用HS-SPME/GC-MS对发酵液风味成分进行分析表明,苯乙醇含量(20~70 mg/kg)最高,其次依次为异戊醇(20~37 mg/kg)、异丁醇(2~9 mg/kg)、乙酸乙酯(0.3~1.7 mg/kg),苯乙醇、异戊醇、乙酸乙酯、异丁醇在发酵过程中呈现先增高后降低的趋势,均在第7天达到最高。本研究初步探究了单一理化因子(pH)影响窖泥微生物群落结构及风味物质,揭示了不同pH值胁迫下浓香型白酒窖泥的优势菌属组成变化,为阐明窖泥微生物的功能及其影响代谢因素提供理论依据。
[1]吴浪涛,丁文骏,谢专,等.不同时期窖泥理化因子、风味物质和细菌组成的相关性[J].微生物学通报,2022,49(3):1030-1047.
[2]向祖祥,刘明,陈明学,等.浓香型白酒窖泥与土壤几种理化指标的对比分析[J].酿酒科技,2009(5):81-83.
[3]廖昶,吴生文,黄小晖,等.特香型酒功能窖泥和普通窖泥理化指标对比分析[J].酿酒科技,2010(2):86-90.
[4]胡晓龙,余苗,王康丽,等.浓香型白酒窖泥微生物群落多样性及理化因素对其影响[J].食品研究与开发,2021,42(2):178-185,204.
[5]王艳丽,孟雅静,何宏魁,等.不同品质浓香型窖泥理化因子与细菌总量的相关性[J].食品与发酵工业,2019,45(3):89-94.
[6]张会敏,王艳丽,孟雅静,等.浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J].食品科学,2020,41(6):207-214.
[7]孙超,刘勇.白酒生产中乳酸菌的分布及主要代谢产物[J].中国酿造,2012,31(5):1-4.
[8]栗连会.泸型酒酒醅中乳酸菌和乳酸降解菌的多样性和代谢特性[D].无锡:江南大学,2016.
[9]张方,张宿义,苏占元,等.有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J].酿酒科技,2016(1):94-97,102.
[10]孟雅静,王艳丽,丁峰,等.浓香型白酒新、老窖池分层池底窖泥菌群总氢代谢与乳酸含量之间的关系[J].食品科学,2021,42(18):171-177.
[11]张会敏,王艳丽,孟雅静,等.浓香型白酒新、老窖池池壁泥与池底泥原核菌群结构分析[J].食品科学,2020,41(18):180-187.
[12]张会敏,孟雅静,王艳丽,等.浓香型白酒窖池分层分位点池底窖泥pH值、主要有机酸与钙、镁离子之间的相关性分析[J].食品科学,2020,41(19):90-97.
[13]张霞,雷学俊,杨康卓,等.五株酵母菌的分离鉴定及产丁二酸能力分析[J].酿酒科技,2021(6):39-43.
[14]赵东,郑佳,彭志云,等.高通量测序技术解析五粮液窖泥原核微生物群落结构[J].食品与发酵工业,2017,43(9):1-8.
[15]WOLFE B E,BUTTON J E,SANTARELLI M,et al.Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J].Cell,2014,158(2):422-433.
[16]杜礼泉,罗惠波,黄治国,等.不同质量窖泥古菌群落的研究[J].酿酒科技,2015(2):58-61.
[17]何翠容,吴冬梅,郑佳,等.浓香型白酒窖池细菌与古菌随窖龄变化的特征[J].酿酒科技,2013(1):27-30,38.
[18]卢振,孟镇,钟其顶,等.应用PCR-DGGE技术分析不同性状窖泥的细菌群落结构[J].中国酿造,2018,37(3):28-32.
[19]唐贤华.高通量测序技术初步解析浓香型白酒窖泥细菌群落结构[J].中国酿造,2020,39(1):160-164.
[20]HU X L,DU H,XU Y.Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].Int J Food Microbiol,2015,214:116-122.
[21]胡晓龙,王康丽,余苗,等.基于高通量测序的浓香型窖泥原核微生物群落的窖池空间分布[J].中国酿造,2020,39(6):167-172.
[22]张会敏.古井贡酒微生物群落结构及其与主要风味物质的关联研究[D].哈尔滨:哈尔滨工业大学,2017.
[23]BOUANANE-DARENFED A,HANIA W B,HACENE H,et al.Caldicoprobacter guelmensis sp.nov.a thermophilic,anaerobic,xylanolytic bacterium isolated from a hot spring[J].Int J Syst Evol Micr,2013,63:2049-2053.
[24]IMACHI H,SAKAI S,KUBOTA T,et al.Sedimentibacter acidaminivorans sp.nov.an anaerobic,amino-acid-utilizing bacterium isolated from marine subsurface sediment[J].Int J Syst Evol Micr,2016,66(3):1293-1300.
[25]REICHARDT N,DUNCAN S H,YOUNG P,et al.Erratum: Phylogenetic distribution of three pathways for propionate production within the human gut microbiota[J].ISME J,2014,8:1323-1335.
[26]LI P,LIN W F,LIU X,et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Front Microbiol,2016,7:1237.
[27]李小龙,吴群,徐岩.乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J].微生物学通报,2019,46(1):1-10.
[28]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[29]SONG Z W,DU H,ZHANG Y,et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Front Microbiol,2017,8:1294.