α-半乳糖苷酶(α-galactosidase,EC.3.2.1.22)属于外切糖苷酶类,具有较强的水解能力,可以催化水解糖蛋白、糖脂、半乳甘露聚糖和半乳糖脂的末端α-半乳糖基[1],也可以切割棉子糖、水苏糖和毛蕊花糖等棉子糖家族寡糖(raffinose family oligosaccharides,RFOs)在半乳糖和葡萄糖之间的α-1,6糖苷键。此外α-半乳糖苷酶广泛存在于自然界中,其作为生物催化工具[2],在食品、饲料、益生元、生物炼制、纸浆加工、制糖工业以及生物医药学等不同行业中都能发挥作用。该酶的水解特性可以降解豆类植物中的α-低聚半乳糖(α-galactooligosaccharides,GOS),消除饲料中的抗营养因子(α-半乳糖苷类物质),避免人或动物在摄食后胃肠胀气的发生[3];也可以作为外源酶添加到饲料中,消除棉子糖家族寡糖,提高饲料的利用率[4];此外该酶在治疗法布里病时也起着重要作用[5-6],使用酶替代疗法(enzyme replacement therapy,ERT)弥补患者本身缺乏的溶酶体α-半乳糖苷酶,现已研究出一款治疗法布里病的药物Fabrazyme 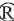 agalsidase-β,并于2003年上市,该药也是美国食品药品监督管理局(food and drug administration,FDA)批准的唯一一种治疗法布里病的药物。
agalsidase-β,并于2003年上市,该药也是美国食品药品监督管理局(food and drug administration,FDA)批准的唯一一种治疗法布里病的药物。
目前微生物源的α-半乳糖苷酶因其在生产过程中较好的耐受能力和在廉价底物上能快速生长使其在经济上更适合于工业开发[7],但由于天然的α-半乳糖苷酶经发酵后活性依旧较低,需要依靠某些诱变等方法来提高酶活活性,这不仅增加了该酶的生产成本且使对α-半乳糖苷酶的研究局限于实验室小试。而随着技术的不断发展,国内外研究者正着力于探索新的α-半乳糖苷酶基因并克隆和表达到合适的宿主中,以提高酶的催化效率、产量和耐受性,从而达到产业化生产这一终极目标,同时对于该酶的高效分离纯化方法也有待进一步的研究。因此,本文综述了近年来α-半乳糖苷酶的发酵生产工艺、异源表达和分离纯化等研究内容,并展望了其今后的发展,对α-半乳糖苷酶商业化和产业化的研究也具有一定意义。
1 α-半乳糖苷酶催化机制
糖苷水解酶(glycoside hydrolases,GH)是由一个能够催化糖苷键分解的大家族酶组成,根据氨基酸序列相似性,在CAZy数据库中将报道的α-半乳糖苷酶分为糖苷水解酶家族GH-4、GH-27、GH-31、GH-36、GH-57、GH-97和GH-110,现有研究发现,大部分的α-半乳糖苷酶属于GH-27和GH-36家族,而在GH-4和GH-36家族中主要由原核起源的酶组成,GH-27家族包含原核和真核起源的酶[8]。若根据酶活性的最佳pH来说,又有酸性酶、碱性酶之分,大多数酸性α-半乳糖苷酶属于糖苷水解酶GH-27家族,而在GH-36家族中既有酸性酶,又有碱性酶和中性酶。
在催化糖苷键分解时,根据糖苷水解酶催化底物分子异头碳构型是否发生转变,可分为两种不同的催化水解反应机制:保持机制和反转机制。GH-4、GH-27、GH-36和GH-57家族的α-半乳糖苷酶遵循保留机制;GH-110家族的α-半乳糖苷酶遵循反转机制;而GH-97家族的α-半乳糖苷酶是一个值得注意的例外,同时拥有保留和反转机制。这两种催化机制中,遵循反转机制的水解反应通常是由一步法实现,涉及类似碳鎓离子的过渡态,该催化反应由两个氨基酸侧链的广义酸/碱催化剂协助发生,通常是谷氨酸和天冬氨酸,由糖苷键上的氧攻击酸催化剂上的氢;同时在碱催化剂的作用下水分子攻击底物的异头碳,使糖基解离出来,这种催化方式使水解产物的构型发生了转变。保留机制的水解反应是一个两步反应,其中每步反应也都涉及类似碳鎓离子的过渡态,由两个氨基酸侧链的广义酸和广义碱协助发生通常是谷氨酸和天冬氨酸,该反应采用双置换机制,经过糖基化和去糖基化这两步使水解产物的构型保持不变,即在第一步糖基化反应中,一个残基作为亲核试剂,对底物的异头碳进行亲核攻击,促进糖-酶中间体的合成,与此同时,另一个残基起酸催化的作用,在糖苷键断裂时使其质子化,第二步是去糖基化反应,在水分子水解糖-酶中间体时,另一个残基起碱催化的作用,在水分子攻击时使其去质子。而GH-4家族的α-半乳糖苷酶的水解反应在遵循保留机制时,区别于其他家族的是需依赖还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)辅助因子催化,通过阴离子过渡态进行消除和氧化还原。保持机制和反转机制见图1、图2。
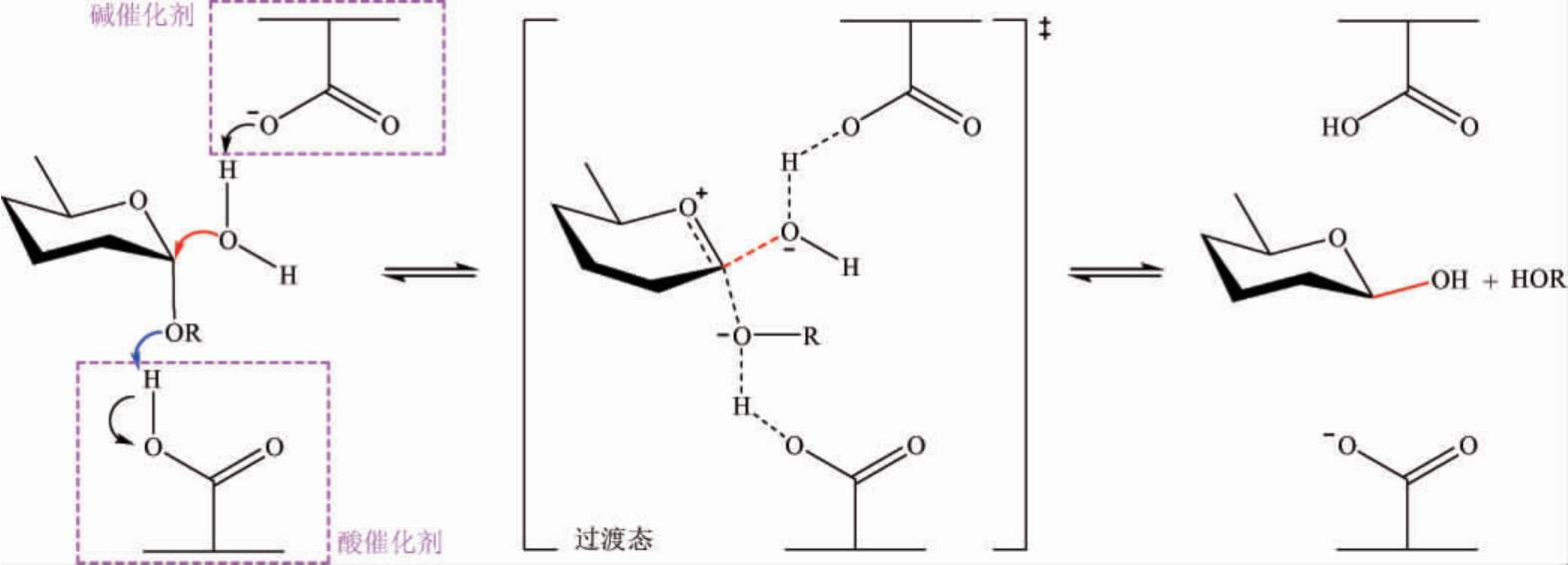
图1 糖苷水解酶家族反转机制(GH-4、GH-27、GH-31、GH-36、GH-57和GH-97)
Fig.1 Inversion mechanism of glycoside hydrolase family (GH-4、GH-27、GH-31、GH-36、GH-57 and GH-97)
图2 糖苷水解酶家族保持机制(GH-97和GH-110)
Fig.2 Retention mechanism of glycoside hydrolase family (GH-97 and GH-110)
2 微生物源的α-半乳糖苷酶
α-半乳糖苷酶广泛存在于大自然中,早期COURTOIS J E等[9]在咖啡豆中发现了该酶,之后在多种植物以及哺乳动物中均发现了该酶,而在微生物中更是表现出了α-半乳糖苷酶的巨大生产潜力,尤其是微生物易于培养,胞外分泌,不仅能在廉价的农业副产物上生长,而且对于不同的温度和酸碱度范围内有较强的稳定性,这些特性使得α-半乳糖苷酶在食品及饲料加工上有显著作用。已有研究发现,嗜热微生物是嗜热和耐热酶的主要微生物来源,JANG J M等[10]从Irpexlacteus克隆出一种具有高催化效率、热稳定性和pH稳定性的α-半乳糖苷酶,属GH-27家族,该酶在70 ℃和pH4.8时活性最大,在pH3~11内保持活性稳定,且在50 ℃和60 ℃培养10 h后依旧保留了90%以上的活性,表现出独特的耐热性和pH稳定性,同时也发现其对RFOs具有非常高的催化效率。XIE J等[11]从总状横梗霉(Lichtheimia ramosa)中发现并成功表达了一个属GH-36家族的新的α-半乳糖苷酶基因,该重组酶在65 ℃和pH6时活性最大,在pH4.5~6.5内仍能保留大部分活性,在60 ℃或更低温度条件下均能保持稳定,该酶与GH-36家族的其他α-半乳糖苷酶不同的是,除了能消除RFOs外还对半乳甘露聚糖有水解作用。这些具有热稳定性质的酶将有助于食品和饲料的加工。
目前也有更多不同地方微生物来源的α-半乳糖苷酶被发现和鉴别出来,据报道产α-半乳糖苷酶的微生物主要包括细菌、真菌、放线菌等,ZHOU J等[12-13]从云南的磷酸盐堆放地的矿渣和盐渍土中发现了一株新的菌株中生根瘤菌(Mesorhizobium sp.)JB07,并从中分离出了两种属于GH-36的α-半乳糖苷酶AgaAJB07和AgaAHJG4,之后又在该地的盐矿中发现了产自菌株海洋杆菌属(Pontibacter sp.)HJ8中一种新型的属于GH-27家族的α-半乳糖苷酶。此外真菌来源的该酶多被曲霉属、青霉属等广泛研究,WANG H等[14]从来自某锡矿酸性废水中分离出一种新型的嗜热真菌费希新萨托菌(Neosartorya fischeri)P1,能分泌出高活性的胞外α-半乳糖苷酶;刘德海等[15]首次从紫花苜蓿草种植土壤中分离出一株产α-半乳糖苷酶的黑曲霉菌株A1-19。而在益生菌[16]的研究中也能发现α-半乳糖苷酶,如双歧杆菌、乳酸菌(lactic acid bacteria,LAB)以及乳酸杆菌,其抗菌活性、在刺激的肠胃环境中的存活率、储存期间的存活率较高而言,因此是理想的候选来源。对于从不同环境中分离鉴别出的α-半乳糖苷酶在经研究后发现了该酶具有更多不同的优良特性,这也使得它们在功能上存在差异性,近年来国内外关于微生物源的α-半乳糖苷酶的研究概况见表1。
表1 微生物源的α-半乳糖苷酶的研究概况
Table 1 Overview of α-galactosidase from microorganisms

3 产α-半乳糖苷酶菌株的发酵工艺研究
3.1 固态发酵
固态发酵(solid state fermentation,SSF)可以定义为在没有或几乎不存在游离液体的情况下,微生物在潮湿、水不溶性的固体基质上生长的技术[24]。固体基质是一种复杂的大分子混合物,通常是在农业和工业活动时产生的残留物,视为农工副产品[7],如麦麸、米糠、甘蔗渣、水果和蔬菜加工废料等。因此有必要找到并采用一种适当的无害环境、低成本和经济上可行的方法来处理这些农工副产品,所以利用农工业残留物作为生产α-半乳糖苷酶的固体基质不仅增加了它们自身的价值,而且为处理日益构成威胁的农工废物提供了一种独特的解决办法。
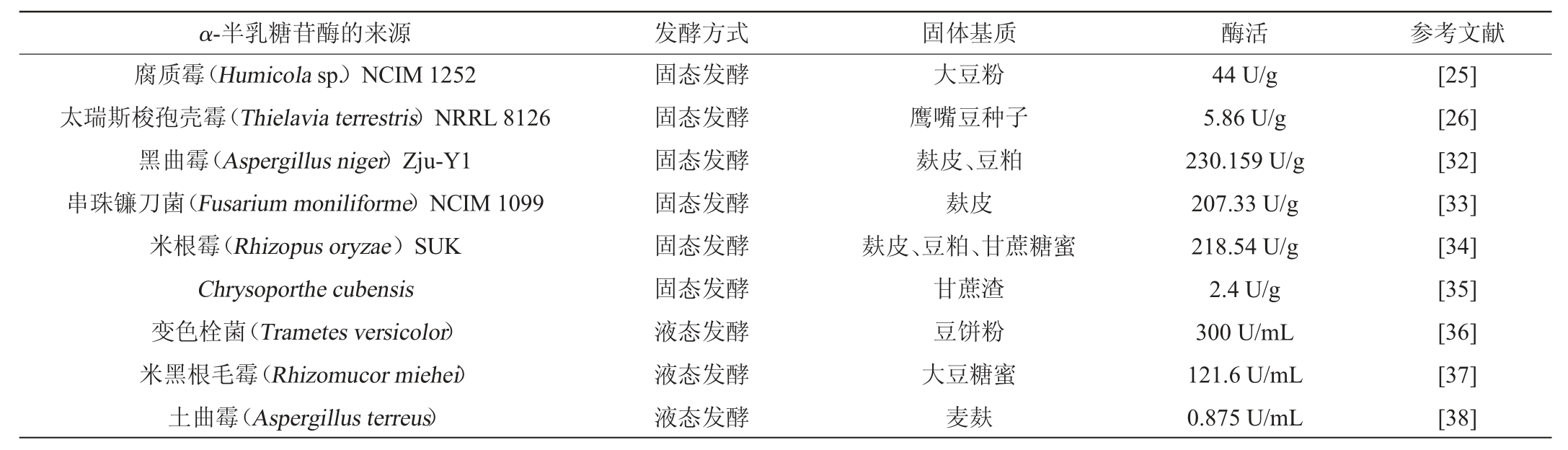
KOTWAL S M等[25]研究发现了一种嗜热真菌腐质霉,能在固态发酵中利用各种农业残留物生产胞外α-半乳糖苷酶,当用大豆粉作为碳源时,其酶活性最大。此外通过扫描电镜(scanning electron microscope,SEM)研究发现,该真菌菌丝体缠绕在固体基质上,具有很高的生长密度,致使真菌分泌出大量的α-半乳糖苷酶。SAAD R R等[26]研究发现了一株耐高温真菌能利用不同豆科植物的种子和外壳作为固体基质发酵产酶,研究表明,鹰嘴豆种子是该酶最佳的固体发酵基质。SHANKAR S K等[27]利用红豆植物废料和麦麸为复合固体基质对真菌米曲霉进行固态发酵,将麦麸与红豆植物废料以1∶2(g∶mL)混合,在最适条件下发酵所产α-半乳糖苷酶的酶活性最高。综上,可以利用农副产品作为固体基质进行固态发酵,且在发酵时呈现的蓬松状态有利于真菌菌丝附着在其表面生长从而更便于产生大量的酶。
此外,由于农业副产物容易获得且价格低廉,在大规模产酶时发挥了极大的成本优势。如ANISHA G S等[28]利用大豆粉为固体基质对灰链霉菌产胞外α-半乳糖苷酶的研究,使用填充床生物反应器在SSF中生产丝状菌的α-半乳糖苷酶,发现此时该酶的产量比在锥形瓶中发酵提高了约100%。而VIDAY C H等[29]首先筛选出了15株真菌,检测发现泡盛曲霉(Aspergillus awamori)MTCC 548中的α-半乳糖苷酶和β-半乳糖苷酶的活性最高,之后在该菌株发酵时用脱脂大豆粉代替了麦麸,并将小试工艺放大,在不锈钢托盘对该产酶菌株进行大规模的固态发酵。由此可见,在固态发酵时可利用农工副产品作固体基质发酵产α-半乳糖苷酶,不仅具有成本效益,也为指导α-半乳糖苷酶的大规模生产展示了巨大潜力。
3.2 液态发酵
液态发酵(submerged fermentation,SMF)是一种将微生物作为悬浮培养物进行培养,并将其产物释放到发酵液中的发酵生产方式。SANADA C T N等[30]利用大豆蜜糖酒精发酵的残渣大豆酒槽为底物进行液态深层发酵产α-半乳糖苷酶,通过筛选发现敏捷乳杆菌(Lactobacillus agilis)LPB 56的酶活性较高,该菌株在发酵144 h后,酶活性达到最高,为11.07 U/mL。ALVAREZ-CAO M E等[31]利用廉价的农副产品蜜糖作为生产α-半乳糖苷酶的底物,降低了酶的生产成本有助于循环经济。与固态发酵相类似,液态发酵也能以廉价的农作物为底物,且获得的发酵液能直接作为酶混合物应用到某些工业中去,这些都为利用农业残渣创造更高价值的工业发展显示了广阔前景。此外,在发酵工艺中不同固体基质对α-半乳糖苷酶的活性也有不同的影响,对近年来微生物发酵所产α-半乳糖苷酶活性的研究概况见表2。
表2 α-半乳糖苷酶的发酵工艺
Table 2 Fermentation technology of α-galactosidase
3.3 发酵工艺的优化
在固态或液态发酵产α-半乳糖苷酶时,筛选合适的固体基质、碳源、氮源等因素,以及确定合适的发酵条件都对酶的活性和产量有一定的影响,因此需要采用单因素、正交试验以及响应面法等方法进行工艺优化,以发掘产α-半乳糖苷酶菌株的最大潜力。
在微生物发酵时,碳源和氮源是为生物合成、产物形成和代谢提供能量的基本营养物质。GURKOK S等[39]通过响应面优化法研究发现,在烟曲霉发酵时,采用甘蔗糖蜜和NH4NO3分别为碳源、氮源,使α-半乳糖苷酶的产量增加了4倍。GAJDHANE S B等[34]通过Plackett Burman试验设计关键的培养基成分,在以麸皮为底物的前提下,确定了补充碳源和氮源分别为甘蔗糖蜜和豆粕,然后采用响应面优化法确定其最佳浓度,使α-半乳糖苷酶的活性提高至218.54 U/g。DONG M等[40]在研究α-半乳糖苷酶的最适条件时,发现当以蔗糖为碳源,(NH4)2SO4/尿素按2∶1比例为复合氮源时,可以提高酶的活性,通过对发酵罐继续补料研究对其活性影响时发现,在不断添加半乳糖时,其既能作为诱导物也能作为底物补充损失掉的营养,从而可以使α-半乳糖苷酶的活性达到最高。
此外,除基本的碳源氮源等营养因素,某些金属离子如Fe2+、Ca2+、Mg2+、Mn2+、Zn2+等也是微生物在发酵过程中不可或缺的微量元素,其中部分金属离子对酶的活性起促进作用,相反也会抑制酶的活性。DELGADO-FERNANDEZ P等[16]在研究金属离子对植物乳杆菌产α-半乳糖苷酶活性的影响时发现,在培养基中添加Mn2+和Fe2+时能使α-半乳糖苷酶的活性提高145%和139%,相比之下添加Hg2+和Cu2+时都分别抑制了α-半乳糖苷酶的产生。YE F等[41]研究发现,金属离子浓度的不同对α-半乳糖苷酶的活性也有不同的影响,在浓度相同的情况下,K+、Ba2+、Pb2+、Hg+、Al3+和Cr3+相比于Ca2+、Mg2+、Cd2+对α-半乳糖苷酶有明显的抑制作用,而当这些金属离子的浓度降低时,Ba2+、Pb2+、Al3+和Cr3+又能使α-半乳糖苷酶的活性增加,此外Cu2+和Fe2+对该酶活性具有双向的影响,当这两种金属离子的浓度增加时,其对α-半乳糖苷酶的活性也增加,反之则会抑制其活性的增加。研究表明,金属离子可以通过影响酶的结构从而改变对酶活性的影响,不同的金属离子对酶活性的影响也不同。
当微生物进行发酵时,控制微生物的发酵条件(尤其是温度和pH)也对α-半乳糖苷酶的活性有着至关重要的影响,其活性将在最适的生长环境下达到最大,而稍微偏离最佳条件便会改变微生物的生长和酶的产生。LI Q等[42]研究发现,黑曲霉生产α-半乳糖苷酶会受pH和温度的影响,当温度为25 ℃,pH6~7时酶产量较高,是原始的2.2~2.3倍。VIDAY C H等[29]研究了高产α-半乳糖苷酶的曲霉泡盛曲霉(Aspergillus awamori)MTCC 548的小试工艺试验,并对其发酵条件进行优化,确定了最佳反应条件为温度28 ℃,pH5.0和发酵120 h,之后将其扩大到容量约3 kg的不锈钢托盘中进行大规模发酵,最终检测发现α-半乳糖苷酶活性可达109.27 U/g,这为工业生产α-半乳糖苷酶提供了方向。
4 α-半乳糖苷酶的异源表达
目前,从自然界中筛选得到产α-半乳糖苷酶的菌株很多,但原始菌株在发酵后的酶产量相对较低,有的需要依靠物理或化学诱变等方法来提高酶产量,这也会使大规模生产α-半乳糖苷酶的成本增高,所以获得高表达、活性高的α-半乳糖苷酶基因并成功表达的方法受到了研究者们的青睐。国内外研究者对分泌表达α-半乳糖苷酶的工程微生物菌株作了一定的研究,从而提高酶的产量,以期望满足α-半乳糖苷酶的工业化生产。对于不同来源的α-半乳糖苷酶基因编码的蛋白质也具有不同的酶学性质,经研究发现已经有数个α-半乳糖苷酶基因被克隆并在不同的表达系统中成功表达。基因工程表达系统主要有大肠杆菌,酵母,枯草芽孢杆菌和昆虫等,其中α-半乳糖苷酶基因主要的表达系统是大肠杆菌和酵母表达系统。
4.1 大肠杆菌表达系统
在各种表达系统中,最早被采用进行研究的是大肠杆菌表达系统,是原核蛋白表达系统的最佳代表。HUANG Y等[43]从巨大芽孢杆菌(Bacillus megaterium)中克隆了α-半乳糖苷酶基因(AgaB),并在大肠杆菌(Escherichia coli)BL21(DE3)中成功表达,该重组酶在最适条件下比活性高达362.6 U/mg。其天然结构被研究确定为一种同源三聚体,同时它也被发现具有良好的蛋白酶抗性和半乳糖耐受性,且对棉子糖和水苏糖具有良好的降解活性,利用这些优良性质该重组酶将在食品和饲料行业中去除棉子糖家族寡糖(RFOs)的方面上发挥很大的潜力。FEI Y等[18]在解淀粉乳杆菌(Lactobacillus amylolyticus)L6基因组中发现了α-半乳糖苷酶的编码基因(AglB),对其与乳酸杆菌的其他α-半乳糖苷酶进行氨基酸序列比对,发现其属于GH36家族,具有保留水解机制。根据L6的脱氧核糖核酸(deoxyribonucleic acid,DNA)序列设计引物,通过聚合酶链式反应(polymerase chain reaction,PCR)扩增得到AglB基因,在大肠杆菌BL21(DE3)中成功表达并探究了AglB的最适反应条件。经后续研究发现,该重组酶具有转糖基化活性可用于低聚半乳糖(GOS)的生产,在最佳反应条件下,以300 mmol/L的蜜二糖为底物可使GOS的最大产量达31.56%。LEE C M等[44]通过构建宏基因组fosmid文库,在羧甲基纤维素板上对文库进行功能性筛选,经序列分析发现了一个新的α-半乳糖苷酶基因(Agas2),并在大肠杆菌中成功表达。该重组酶具有良好的pH稳定性,在40 ℃和pH 7.0时表现出最大酶活性高达128.37U/mg。此外,有研究发现在真核生物中克隆出编码基因表达到大肠杆菌中后,对重组酶菌株进行发酵后所制备得到的粗酶液的活性和比活性都相对较低,如CAO Y等[45]从赤霉素(Gibberella sp.)F75中克隆了α-半乳糖苷酶的基因(aga-F75)并在大肠杆菌中成功表达,研究发现其属于GH36家族,具有良好的水解能力和热稳定性,但该酶的活性相对较低,粗酶活性仅为1.42 U/mL。这是由于大肠杆菌缺乏对真核蛋白质的修饰加工系统,细胞周质含有多种内毒素等缺点不利于进行真核生物源蛋白的表达。
4.2 酵母表达系统
酵母表达系统作为一种后起的外源蛋白表达系统,由于兼具原核以及真核表达系统的优点,其生产的酶活性、产量均比较高以及易诱导使其在基因工程领域中倍受青睐。真菌来源的α-半乳糖苷酶具有良好的稳定性且含有信号肽能进行胞外分泌,使酵母表达系统成为该酶研究的热点,因此产生α-半乳糖苷酶的真菌也受到越来越广泛的关注,目前利用毕赤酵母来生产α-半乳糖苷酶的研究较多。MI S等[46]在青霉菌(Penicillium sp.)F63 CGMCC 1669中发现了一种胞外α-半乳糖苷酶,命名为Agl1,根据纯化蛋白的部分氨基酸序列,克隆并测序了编码α-半乳糖苷酶Agl1的基因,成功在毕赤酵母(Pichia pastoris)细胞外表达,并在发酵罐中达到111 U/mL的高产量。该重组的α-半乳糖苷酶的最适pH和温度分别为5.0和40 ℃,这与单胃动物肠道的物理化学条件基本一致,从饲料添加剂的实际应用来看,该重组α-半乳糖苷酶在饲料中的应用是非常有利的。CHEN Z等[47]克隆了来自太瑞斯梭孢壳霉(Thielavia terrestris)中一种新的α-半乳糖苷酶基因(TtGal27A)并在毕赤酵母中成功表达,研究发现TtGal27A属于GH27家族,在5 L发酵罐中进行高密度发酵后其酶活性高达4 402 U/mL。此外该酶可以水解棉子糖家族寡糖以及不同的半乳甘露聚糖且表现出良好的蛋白酶抗性,这使得它有潜力应用到食品和饲料工业中去。WANG C等[21]从莱色篮状菌(Talaromyces leycettanus)JCM12802中发现了一种新型的α-半乳糖苷酶基因,属于GH27家族,并成功在毕赤酵母GS115中表达。研究发现该重组酶具有良好的嗜热性,能在70 ℃时表现出最大活性,具有稳定的水解能力以及对半乳糖有良好的耐受性。
类似地,除大肠杆菌和毕赤酵母表达系统以外,也能在其他生物源系统中表达。GÜRKÖK S等[48]编码烟曲霉IMI 385708中的α-半乳糖苷酶基因(AglB),克隆到pAN52-4真菌表达载体上,并在3-磷酸甘油醛脱氢酶启动子的控制下在大豆曲霉ATCC11906中成功表达,且不需要添加诱导物,可在重组大豆曲霉菌株中得到2.45U/mL的α-半乳糖苷酶产量,约为初始烟曲霉(0.85 U/mL)的3倍。近年来,研究发现利用基因工程技术可提高α-半乳糖苷酶的水解能力、耐受性和产量,该方法已经成为设计全新分子或修饰天然分子的重要工具,许多α-半乳糖苷酶产生菌株已经成功地通过修饰其氨基酸序列而被改造以增强表达和水解功能,以期望能在工业中发挥它们的最大潜力。
5 α-半乳糖苷酶的分离纯化
酶的分离纯化是指以熟练、经济的方式获得一定纯度的酶。胞内酶可通过细胞破碎方法得到粗酶液,胞外酶可经过发酵,通过离心或浸提等方法获得。在微生物发酵后尤其是固态发酵后粗酶液中的成分复杂,掺杂着其他代谢物或酶类,对此需采取高效的分离纯化方法以得到高纯度的α-半乳糖苷酶。一般可采用硫酸铵分级沉淀、离子交换色谱、凝胶过滤色谱等不同层析技术对该酶进行分离纯化,而聚丙烯酰胺凝胶电泳法可用于蛋白质分子质量的测定和纯度水平的估量。目前α-半乳糖苷酶已从许多来源进行分离纯化。MUTRA R等[49]从发芽的绿豆种子中发现了α-半乳糖苷酶,并通过离子交换、凝胶过滤和亲和层析柱纯化出了低分子量的α-半乳糖苷酶,该酶的纯化倍数达522倍,其比活性为146.3 U/mg。SAKHARAYAPATNA RANGANATHA K等[50]从番荔枝种子中发现了一种低分子质量的酸性α-半乳糖苷酶,通过硫酸铵分级沉淀,收集活性高(20%~40%和40%~60%)的部分再采用疏水层析和凝胶过滤层析从种子粗提物中纯化α-半乳糖苷酶。纯化后的α-半乳糖苷酶在非变性聚丙烯凝胶电泳中显示分子质量约67 kDa的单一条带。YE F等[41]在食用菌猴头菇中发现了一种分子质量为57 kDa的α-半乳糖苷酶,命名为HEG,该酶属于GH27家族。研究人员分别使用三种离子交换色谱弱阴离子交换层析(DEAE-Sepharose)、弱阳离子交换层析(CM-Sepharose)、强阴离子交换层析(Q-Sepharose)和凝胶过滤层析对猴头菇粗酶液进行纯化直至均一,纯化倍数高于大多数α-半乳糖苷酶,高达1 251.64倍,纯化后的HEG比活性为46.74 U/mg。VIDYA C H等[29]在泡盛曲霉(Aspergillus awamori)MTCC 548中发现了α-半乳糖苷酶,通过硫酸铵(饱和度50%~80%)沉淀、离子交换和疏水层析使粗提取物中的酶纯化至均一,并在十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)中观察到一条单一条带,该纯酶的表观分子质量约为(118±2)kDa。WANG J等[51]对从米曲霉中克隆的α-半乳糖苷酶(galC)纯化,采用镍离子金属鳌合亲和层析,用咪唑缓冲液洗脱目标蛋白,收集活性高的洗脱液,在SDS-PAGE中观察到单一条带分子质量为100 kDa,该重组酶的纯化倍数为1.96,比活性为150.9 U/mg,其活性高于一般α-半乳糖苷酶,具有良好的大规模纯化潜力。目前已有研究者们发现了更多不同来源的α-半乳糖苷酶,并通过各种层析柱分离纯化出来,现对近年来研究的α-半乳糖苷酶的分离纯化进行了总结概括见表3。
表3 α-半乳糖苷酶的分离纯化
Table 3 Isolation and purification of α-galactosidase

6 展望
α-半乳糖苷酶在大自然中无处不在,它的一些优良特性如热稳定性、pH稳定性、对蛋白酶的抗性等也被研究出来并在各个领域发挥着重要的作用,因此它的市场需求也在不断的增长,在目前的研究中发现该酶的活性和产量较低不能满足工业的大规模应用,因此获得高活性、高产量、低成本的α-半乳糖苷酶是目前研究亟待解决的问题。为了经济高效地生产α-半乳糖苷酶,可以从以下几个方面考虑。
①目前对各个家族成员的研究仍有未知存在,对这些酶的催化机制和底物特异性的全面研究将为进一步促进工业应用的研究提供理论基础。
②虽然生产的成本问题可以通过利用廉价的农业副产物来降低,但对使用固态发酵以提高其产量仍需进一步研究,可以通过对固态发酵和液态发酵中培养的产α-半乳糖苷酶微生物的代谢差异进行研究,以指导该酶的大规模生产。
③随着基因组测序和宏基因组学的出现,有可能在不局限于可培养物种的情况下探索出不同环境中潜在微生物的基因组库,以开发更多有特异性的新型工程菌,从而将该酶的某些优良性能应用到各个领域。
④深入研究α-半乳糖苷酶的分离纯化工艺,以提高该酶的纯度和产量,促进其工业化大规模应用。
[1]KATROLIA P,RAIASHEKHARA E,YAN Q,et al.Biotechnological potential of microbial α-galactosidases[J].Crit Rev Biotechnol,2014,34(4):307-317.
[2]ANISHA G S.Microbial alpha-galactosidases: Efficient biocatalysts for bioprocess technology[J].Bioresour Technol,2022,344(Pt B):126293.
[3]ZHAI Y,SHU G,ZHU X,et al.Identification of an intestine-specific promoter and inducible expression of bacterial α-galactosidase in mammalian cells by a lac operon system[J].J Anim Sci Biotechnol,2012,3(1):32.
[4]张民.酶制剂在畜禽养殖中的应用研究进展[J].生物产业技术,2019(3):91-98.
[5]BIFERI M G,COHEN-TANNOUDJI M,GARCÍA-SILVA A,et al.Systemic treatment of fabry disease using a novel AAV9 vector expressing α-galactosidase A[J].Mol Ther Method Clin Dev,2021,20:1-17.
[6]LEE H J,PARK H H,SOHN Y,et al.α-Galactosidase delivery using 30Kc19-human serum albumin nanoparticles for effective treatment of fabry disease[J].Appl Microbiol Biot,2016,100(24):10395-10402.
[7]YAFETTO L.Application of solid-state fermentation by microbial biotechnology for bioprocessing of agro-industrial wastes from 1970 to 2020:A review and bibliometric analysis[J].Heliyon,2022,8(3):e09173.
[8]BHATIA S,SINGH A,BATRA N,et al.Microbial production and biotechnological applications of α-galactosidase[J].Int J Biol Macromol,2020,150:1294-1313.
[9]COURTOIS J E,PETEK F.[97]α-Galactosidase from coffee beans[J].Method Enzymol,1966,8:565-571.
[10]JANG J M,YANG Y,WANG R,et al.Characterization of a high performance alpha-galactosidase from Irpex lacteus and its usage in removal of raffinose family oligosaccharides from soymilk[J].Int J Biol Macromol,2019,131:1138-1146.
[11]XIE J,WANG B,He Z,et al.A thermophilic fungal GH36 alpha-galactosidase from Lichtheimia ramosa and its synergistic hydrolysis of locust bean gum[J].Carbohydr Res,2020,491:107911.
[12]ZHOU J,LU Q,ZHANG R,et al.Characterization of two glycoside hydrolase family 36 alpha-galactosidases:novel transglycosylation activity,lead-zinc tolerance,alkaline and multiple pH optima,and low-temperature activity[J].Food Chem,2016,194:156-166.
[13]ZHOU J,LIU Y,LU Q,et al.Characterization of a glycoside hydrolase family 27 alpha-galactosidase from Pontibacter reveals its novel salt-protease tolerance and transglycosylation activity[J].J Agr Food Chem,2016,64(11):2315-2324.
[14]WANG H,SHI P,LUO H,et al.A thermophilic alpha-galactosidase from Neosartorya fischeri P1 with high specific activity,broad substrate specificity and significant hydrolysis ability of soymilk[J].Bioresour Technol,2014,153:361-364.
[15]刘德海,权淑静,扬文玲,等.高产α-半乳糖苷酶菌株的筛选鉴定及发酵培养基的优化[J].中国酿造,2019,38(12):80-86.
[16]DELGADO-FERNANDEZ P,PLAZA-VINUESA L,Hernandez-Hernandez O,et al.Unravelling the carbohydrate specificity of MelA from Lactobacillus plantarum WCFS1:An alpha-galactosidase displaying regioselective transgalactosylation[J].Int J Biol Macromol,2020,153:1070-1079.
[17]PANWAR D,SHUBHASHINI A,CHAUDHARI S R,et al.GH36 alphagalactosidase from Lactobacillus plantarum WCFS1 synthesize Gal-alpha-1,6 linked prebiotic alpha-galactooligosaccharide by transglycosylation[J].Int J Biol Macromol,2020,144:334-342.
[18]FEI Y,JIAO W,WANG Y,et al.Cloning and expression of a novel alphagalactosidase from Lactobacillus amylolyticus L6 with hydrolytic and transgalactosyl properties[J].PLoS One,2020,15(7):e0235687.
[19]LEE A,CHOI K H,YOON D,et al.Characterization of a thermostable glycoside hydrolase family 36 alpha-galactosidase from Caldicellulosiruptor bescii[J].J Biosci Bioeng,2017,124(3):289-295.
[20]ZHAO R,ZHAO R,TU Y,et al.A novel alpha-galactosidase from the thermophilic probiotic Bacillus coagulans with remarkable protease-resistance and high hydrolytic activity[J].PLoS One,2018,13(5):e0197067.
[21]WANG C,WANG H,MA R,et al.Biochemical characterization of a novel thermophilic alpha-galactosidase from Talaromyces leycettanus JCM12802 with significant transglycosylation activity[J].J Biosci Bioeng,2016,121(1):7-12.
[22]SHIN Y J,WOO S H,JEONG H M,et al.Characterization of novel alpha-galactosidase in glycohydrolase family 97 from Bacteroides thetaiotaomicron and its immobilization for industrial application[J].Int J Biol Macromol,2020,152:727-734.
[23]MCGUIRE B E,HETTLE A G,VICKERS C,et al.The structure of a family 110 glycoside hydrolase provides insight into the hydrolysis of alpha-1,3-galactosidic linkages in lambda-carrageenan and blood group antigens[J].J Biol Chem,2020,295(52):18426-18435.
[24]CHILAKAMARRY C R,MIMI SAKINAH A M,ZULARISAM A W,et al.Advances in solid-state fermentation for bioconversion of agricultural wastes to value-added products: Opportunities and challenges[J].Bioresour Technol,2022,343:126065.
[25]KOTWAL S M,GOTE M M,SAINKAR S R,et al.Production of α-galactosidase by thermophilic fungus Humicola sp.in solid-state fermentation and its application in soyamilk hydrolysis[J].Process Biochem,1998,33(3):337-343.
[26]SAAD R R,FAWZI E M.Purification and characterization of a thermostable alpha-galactosidase from Thielavia terrestris NRRL 8126 in solid state fermentation[J].Acta Biol Hung,2012,63(1):138-150.
[27]SHANKAR S K,MULIMANI V H.Alpha-galactosidase production by Aspergillus oryzae in solid-state fermentation[J].Bioresour Technol,2007,98(4):958-961.
[28]ANISHA G S,JOHN R P,PREMA P,et al.Investigation on alphagalactosidase production by Streptomyces griseoloalbus in a forcefully aerated packed-bed bioreactor operating in solid-state fermentation condition[J].Appl Biochem Biotechnol,2010,160(2):421-427.
[29]VIDAY C H,GNANESH KUMAR B S,CHINMAYEE C V,et al.Purification,characterization and specificity of a new GH family 35 galactosidase from Aspergillus awamori[J].Int J Biol Macromol,2020,156:885-895.
[30]SANADA C T N,KARP S G,SPIER M R,et al.Utilization of soybean vinasse for α-galactosidase production[J].Food Res Int,2009,42(4):476-483.
[31]ALVAREZ-CAO M E,CERDAN M E,GONZALEZ-SISO M I,et al.Bioconversion of beet molasses to alpha-galactosidase and ethanol[J].Front Microbiol,2019,10:405.
[32]GU F Y,GAO J,RUAN H,et al.Solid-state fermentation production of α-galactosidase by Aspergillus niger zju-Y1[J].Adv Mater Res,2012,550-553:662-666.
[33]GAJDHANE S B,BHAGWAT P K,DANDGE P B.Response surface methodology-based optimization of production media and purification of alpha-galactosidase in solid-state fermentation by Fusarium moniliforme NCIM 1099[J].3 Biotech,2016,6(2):260.
[34]GAJDHANE S B,BHAGWAT P K,DANDGE P B.Statistical media optimization for enhanced production of α-galactosidase by a novel Rhizopus oryzae strain SUK[J].Biocatal Agr Biotechnol,2016,8:301-309.
[35]DUTRA T R,GUIMARAES V M,VARELA E M,et al.A Chrysoporthe cubensis enzyme cocktail produced from a low-cost carbon source with high biomass hydrolysis efficiency[J].Sci Rep,2017,7(1):3893.
[36]LIU Q,DU F,KONG W,et al.Fermentation production,purification and characterization of a fungal α-galactosidase from Trametes versicolor and its synergistic degradation of guar gum with mannanase[J].Food Sci Technol Res,2020,26(2):265-280.
[37]WANG Z P,ZHANG L L,LIU S,et al.Whole conversion of soybean molasses into isomaltulose and ethanol by combining enzymatic hydrolysis and successive selective fermentations[J].Biomolecules,2019,9(8):353.
[38]FERREIRA J G,REIS A P,GUIMARAES V M,et al.Purification and characterization of Aspergillus terreus alpha-galactosidases and their use for hydrolysis of soymilk oligosaccharides[J].Appl Biochem Biotechnol,2011,164(7):1111-1125.
[39]GURKOK S,CEKMECELIOGLU D,OGEL Z B.Optimization of culture conditions for Aspergillus sojae expressing an Aspergillus fumigatus alpha-galactosidase[J].Bioresour Technol,2011,102(7):4925-4929.
[40]DONG M,GONG Y,GUO J,et al.Optimization of production conditions of rice alpha-galactosidase II displayed on yeast cell surface[J].Protein Expr Purif,2020,171:105611.
[41]YE F,GENG X R,XU L J,et al.Purification and characterization of a novel protease-resistant GH27 alpha-galactosidase from Hericium erinaceus[J].Int J Biol Macromol,2018,120(Pt B):2165-2174.
[42]LI Q,RAY C S,CALLOW N V,et al. Aspergillus niger production of pectinase and alpha-galactosidase for enzymatic soy processing[J].Enzyme Microb Technol,2020,134:109476.
[43]HUANG Y,ZHANG H,BEN P,et al.Characterization of a novel GH36 alpha-galactosidase from Bacillus megaterium and its application in degradation of raffinose family oligosaccharides[J].Int J Biol Macromol,2018,108:98-104.
[44]LEE C M,KIM S Y,SONG J,et al.Isolation and characterization of ahalotolerant and protease-resistant alpha-galactosidase from the gut metagenome of Hermetia illucens[J].J Biotechnol,2018,279:47-54.
[45]CAO Y,WANG Y,MENG K,et al.A novel protease-resistant alphagalactosidase with high hydrolytic activity from Gibberella sp.F75:gene cloning,expression,and enzymatic characterization[J].Appl Microbiol Biotechnol,2009,83(5):875-884.
[46]MI S,MENG K,WANG Y,et al.Molecular cloning and characterization of a novel α-galactosidase gene from Penicillium sp.F63 CGMCC 1669 and expression in Pichia pastoris[J].Enzyme Microb Tech,2007,40(5):1373-1380.
[47]CHEN Z,YAN Q,JIANG Z,et al.High-level expression of a novel α-galactosidase gene from Rhizomucor miehei in Pichia pastoris and characterization of the recombinant enyzme[J].Protein Expres Purif,2015,110:107-114.
[48]GÜRKÖK S,SÖYLER B,BIELY P,et al.Cloning and heterologous expression of the extracellular alpha-galactosidase from Aspergillus fumigatus in Aspergillus sojae under the control of gpdA promoter[J].J Mol Catal B-Enzym,2010,64(3-4):146-149.
[49]MUTRA R,JOSEPH J E,PANWAR D,et al.Low molecular weight alpha-galactosidase from black gram (Vigna mungo): Purification and insights towards biochemical and biophysical properties[J].Int J Biol Macromol,2018,119:770-778.
[50]SAKHARAYAPATNA RANGANATHA K,VENUGOPAL A,CHINTHAPALLI D K,et al.Purification,biochemical and biophysical characterization of an acidic α-galactosidase from the seeds of Annona squamosa(custard apple)[J].Int J Biol Macromol,2021,175:558-571.
[51]WANG J,YANG X,YANG Y,et al.Characterization of a protease-resistant alpha-galactosidase from Aspergillus oryzae YZ1 and its application in hydrolysis of raffinose family oligosaccharides from soymilk[J].Int J Biol Macromol,2020,158:708-720.
[52]HU Y,TIAN G,GENG X,et al.A protease-resistant α-galactosidase from Pleurotus citrinopileatus with broad substrate specificity and good hydrolytic activity on raffinose family oligosaccharides[J].Process Biochem,2016,51(4):491-499.
[53]DU F,ZHU M,WANG H,et al.Purification and characterization of an alpha-galactosidase from Phaseolus coccineus seeds showing degrading capability on raffinose family oligosaccharides[J].Plant Physiol Biochem,2013,69:49-53.
[54]SHIVAM K,MISHRA S K.Purification and characterization of a thermostable α-galactosidase with transglycosylation activity from Aspergillus parasiticus MTCC-2796[J].Process Biochem,2010,45(7):1088-1093.
[55]STRATILOVA B,KLAUDINY J,REHULKA P,et al.Characterization of a long-chain alpha-galactosidase from Papiliotrema flavescens[J].World J Microbiol Biotechnol,2018,34(2):19.
[56]CARRERA-SILVA E A,SILVESTRONI A,LEBLANC J G,et al.A thermostable alpha-galactosidase from Lactobacillus fermentum CRL722:genetic characterization and main properties[J].Curr Microbiol,2006,53(5):374-378.