保健酒是将我国酒文化和中药文化有机结合的产物,是我国特有的现象。保健酒是以白酒为基酒,以单味或多味中药材为原料,精制而成的一种具有某些功能性的酒。随着我国经济社会的发展,人们生活水平的提高,消费者越来越注重健康的生活方式,保健酒愈发受到消费的青睐。因此,保健酒成为众多研究者和学者的研究对象。谢洪等[1-2]以青钱柳为原料,探究了青钱柳保健酒的生产工艺,确认最佳的工艺条件。许明君等[3]以肉苁蓉、枸杞子、红参、菟丝子等4味药材为原料,研究出了具有增强免疫力的复方中药保健酒。与此同时,那广宁等[4]以苦瓜汁与苹果菠萝混合果汁为原料研究出了一种发酵型苦瓜保健酒,研究结果表明,该保健酒具有一定的抗氧化活性。
复方保健酒是以多种中药材为原料,以中药材的配伍合理性为基础而研究的保健酒[5-7]。本文研究的复方保健酒是以人参、西红花、葛仙米3味药材为原料,经过数字化提取精制而成的具有提高免疫力的保健酒。现代医学研究结果表明人参在抗炎[8-9]、增强免疫力[10-11]、降血脂[12]、护肝[13-14]、保护肾脏[15-16]、提高心脏功能[17]等方面具有显著效果。西红花苷是西红花的主要成分,在保护心脏、肾脏、肝脏[18-21]等方面有显著作用。目前,对人参皂苷及西红花苷的含量检测研究较多[22-25],但关于复方保健酒中人参皂苷及西红花苷的检测研究甚少。该研究将人参皂苷和西红花苷作为复方保健酒的标志性成分,采用高效液相色谱法(high performance liquid chromatography,HPLC)对复方保健酒中的标志性成分人参皂苷、西红花苷进行检测,为后期生产过程中的质量监控及评价提供参考依据。
1 材料与方法
1.1 材料与试剂
人参皂苷Rg1(批号:110703-201933,含量:93.4%)、人参皂苷Rb1(批号:110704-202028,含量:93.1%)、人参皂苷Rb2(批号:111715-201203,含量:93.8%)、西红花苷I(批号:111588-201704,含量:88.4%)、西红花苷II:(批号:111589-201705,含量:92.2%):中国食品药品检定研究院;人参皂苷Rc(批号:CFS201901,含量:98%):ChemFaces公司。
乙腈(HPLC级):美国Fisher公司;水为超纯水。
3批复方保健酒由劲牌有限公司提供。
1.2 仪器与设备
UltiMate 3000高效液相色谱仪:美国赛默飞公司;SQP电子分析天平:德国赛多利斯公司;SK1200H 数控超声波清洗仪:上海科导超声仪器有限公司;RE-2002旋转蒸发仪:郑州科达机械仪器设备有限公司。
1.3 方法
1.3.1 对照品溶液制备
精密称取人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、西红花苷I、西红花苷II对照品适量,加50%甲醇溶解,制成1 mL中含有人参皂苷Rg1 0.39 mg、人参皂苷Rb1 0.42 mg、人参皂苷Rb2 0.42 mg、人参皂苷Rc 0.41 mg、西红花苷I 0.22 mg、西红花苷II 0.24 mg的混合对照品溶液。
1.3.2 供试品溶液制备
精密量取人参保健酒样品50 mL,置于茄形瓶中,于55 ℃条件下旋转蒸发至近干,用体积分数为50%甲醇溶解样品,定容至5 mL容量瓶中,摇匀,即得。
1.3.3 色谱条件
(1)人参皂苷含量检测色谱条件
色谱柱:Agilent Sb-Aq(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱见表1;流速1.0 mL/min;柱温30 ℃;检测波长203 nm;进样量10 μL。
表1 人参皂苷含量检测梯度洗脱程序
Table 1 Gradient elution program for ginsenoside content detection

(2)西红花苷含量检测色谱条件
色谱柱:Agilent Sb-Aq(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱见表2;流速1.0 mL/min;柱温30 ℃;检测波长440 nm;进样量10 μL。
表2 西红花苷含量检测梯度洗脱程序
Table 2 Gradient elution program for crocin content detection

1.3.4 人参皂苷及西红花苷含量的测定
根据人参皂苷及西红花苷对照品在色谱图上的保留时间对复方保健酒的人参皂苷及西红花苷进行定性分析,同时以对照品浓度与样品峰面积的比值,依据标准曲线得到各物质的含量。计算公式如下:
式中:cx为样品质量浓度,mg/L;cr为对照品质量浓度,mg/L;Ax为样品峰面积,mAU·s;Ar为对照品峰面积,mAU·s。
1.3.5 数据分析
利用仪器自带的软件Chromeleon7用于查看色谱图、绘制标准曲线,利用Excel 2019软件处理数据。
2 结果与分析
2.1 方法学考察
2.1.1 线性关系试验考察
将“1.3.1”项下对照品溶液稀释成5个不同浓度水平的对照品混合溶液,按照“1.3.3”项色谱条件下进样测定,以物质质量浓度(X)为横坐标,相对应的色谱峰面积(Y)为纵坐标建立标准曲线,得出线性关系及范围,结果见表3。由表3可知,各成分在各自范围内线性关系良好,相关系数R均>0.999。
表3 各成分的标准曲线回归方程及线性关系
Table 3 Standard curve regression equation and linear relationships of various constituents
2.1.2 人参皂苷和西红花苷成分HPLC色谱图
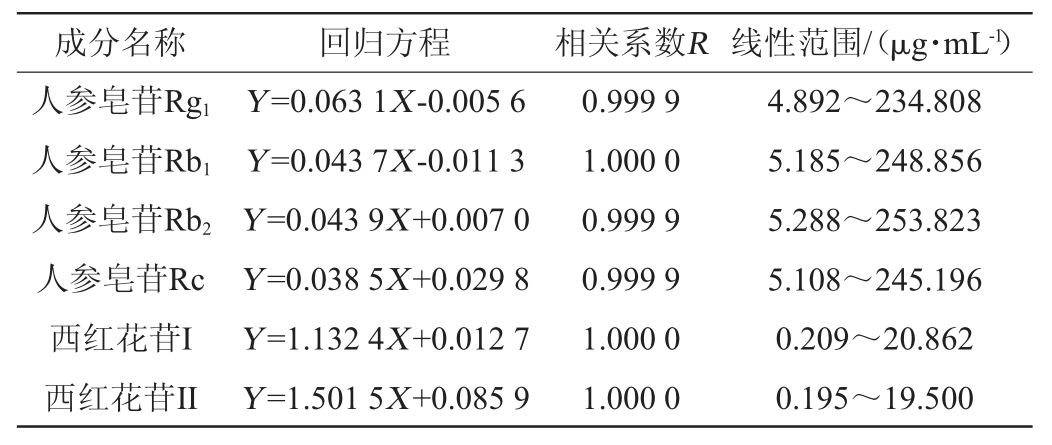
在“1.3.3”项色谱条件下将对照品及样品进行进样测定,色谱图见图1及图2。结果显示,对照品及样品在相同时间下均有色谱峰出现,表明复方保健酒中含有人参皂苷及西红花苷。
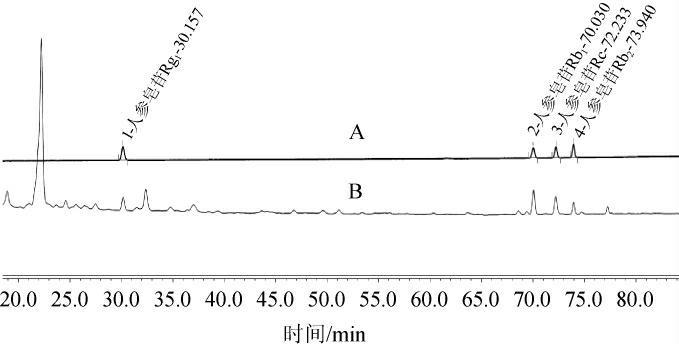
图1 人参皂苷成分HPLC色谱图
Fig.1 HPLC chromatogram of ginsenoside components
1.人参皂苷Rg1,2.人参皂苷Rb1,3.人参皂苷Rc,4.人参皂苷Rb2。
A对照品溶液,B供试品溶液。
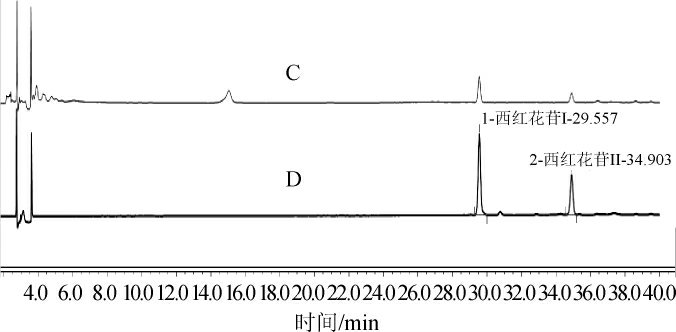
图2 西红花苷成分HPLC图
Fig.2 HPLC chromatogram of crocin composition
1.西红花苷I,2.西红花苷II。
C供试品溶液,D对照品溶液。
将样品于190~500 nm波长范围内进行扫描,扫描结果见图3。由图3可知,西红花苷I、西红花苷II在波长440 nm处有较大的的吸收峰,因此将440 nm作为西红花苷成分的检测波长;而人参皂苷在波长190~210 nm区间范围内有较大的响应,但随着波长的增大,响应值逐渐减小,因此对人参皂苷成分进行不同波长下(190 nm、230 nm)进样检测,结果见图4。
图3 不同波长条件下西红花苷及人参皂苷扫描图谱
Fig.3 Scanning profile of crocin and ginsenoside under different wavelength conditions
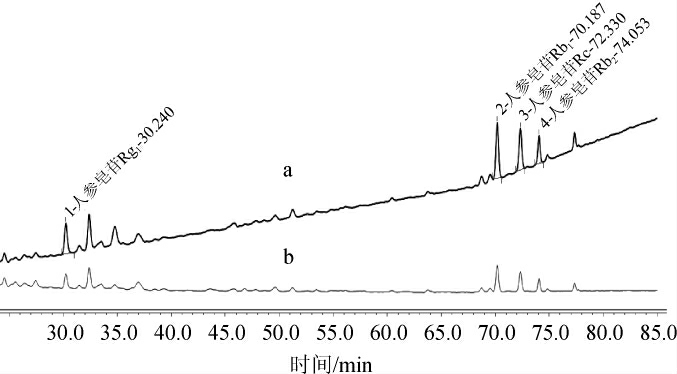
图4 不同波长下人参皂苷色谱图
Fig.4 Chromatograms of ginsenosides at different wavelengths
a 190 nm,b 230 nm。
由图4可知,当检测波长为190 nm时色谱峰的基线不平,当检测波长为203 nm时,基线平稳,故选择203 nm作为人参皂苷的检测波长。
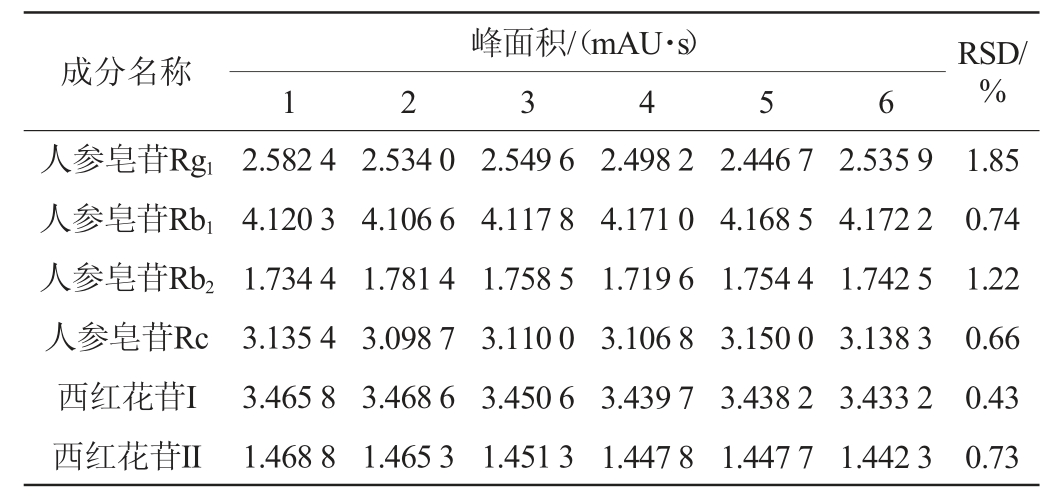
2.1.3 精密度试验
取同一酒样,按照1.3.2供试品溶液制备方法制备供试品,人参皂苷按1.3.3项下人参皂苷含量检测色谱条件进行连续进样6次,记录峰面积;西红花苷按“1.3.3”项下西红花苷含量检测色谱条件进行连续进样6次,检测结果见表4。由表4可知,测得人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、西红花苷I、西红花苷II峰面积的相对标准偏差(relative standard deviation,RSD)分别为1.85%、0.74%、1.22%、0.66%、0.43%、0.73%,均<5%,表明该仪器精密度良好。
表4 各成分含量的精密度试验测定结果
Table 4 Precision test results of each component
2.1.4 稳定性试验
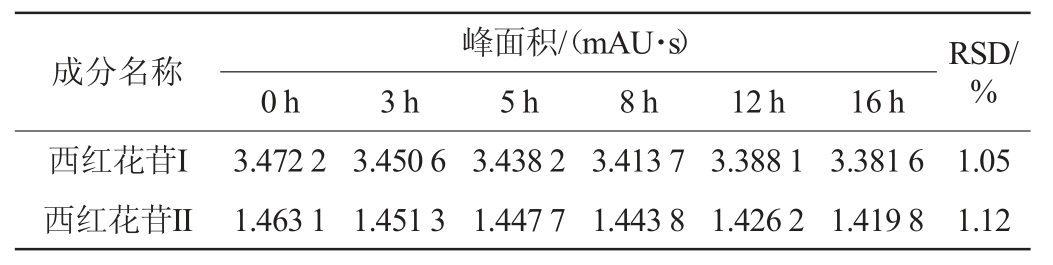
取同一酒样,人参皂苷检测按“1.3.3”项下人参皂苷含量检测色谱条件分别于0 h、4 h、8 h、12 h、16 h、18 h进样,记录峰面积,检测结果见表5;西红花苷检测按“1.3.3”项下西红花苷含量检测色谱条件分别于0 h、3 h、5 h、8 h、12 h、16 h进样,记录峰面积,检测结果见表6。由表5表6可知,测得人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、西红花苷I、西红花苷II峰面积测定结果的RSD值分别为0.86%、1.11%、1.47%、1.26%、1.05%、1.12%,表明供试品溶液中人参皂苷在室温放置18 h内稳定性良好,西红花苷在室温条件下16 h内稳定性良好。
表5 人参皂苷各成分的稳定性试验结果
Table 5 Stability test results of each component of ginsenoside
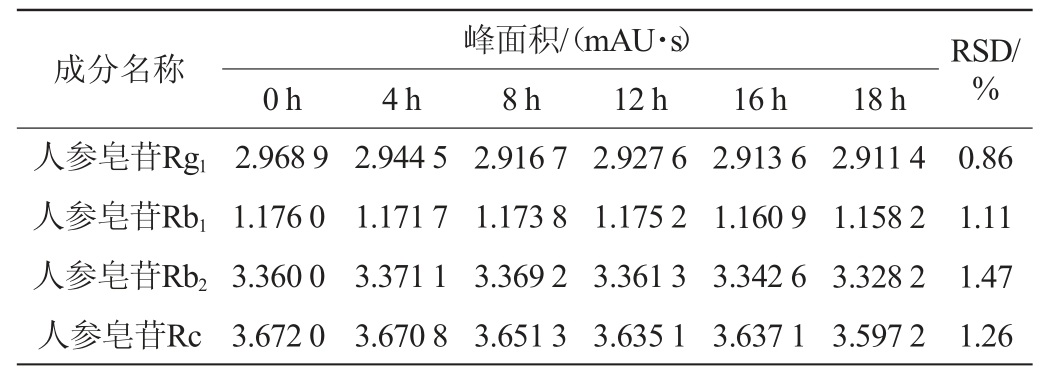
表6 西红花苷各成分的稳定性试验结果
Table 6 Stability test results of each component of crocin
2.1.5 重复性试验
取同一酒样,按照“1.3.2”项下供试品溶液制备方法制备供试品6份,分别按“1.3.3”项下色谱条件进行进样,记录含量,检测结果见表7。结果表明,测得人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、西红花苷I、西红花苷II峰面积测定结果的RSD值分别为1.73%、0.75%、1.12%、0.67%、0.36%、0.23%,均<5%,表明该方法重复性良好。
表7 各成分重复性试验数据
Table 7 Repeatability test results of each component
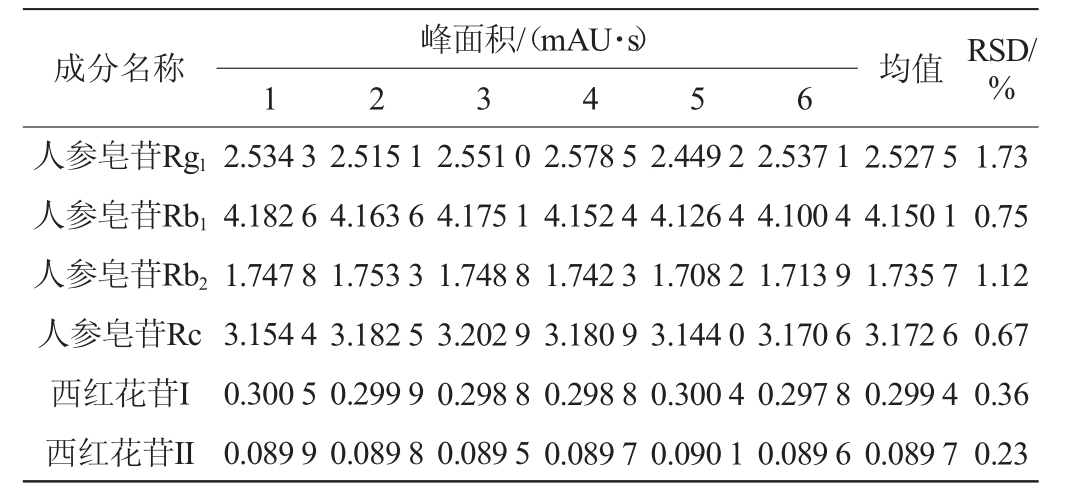
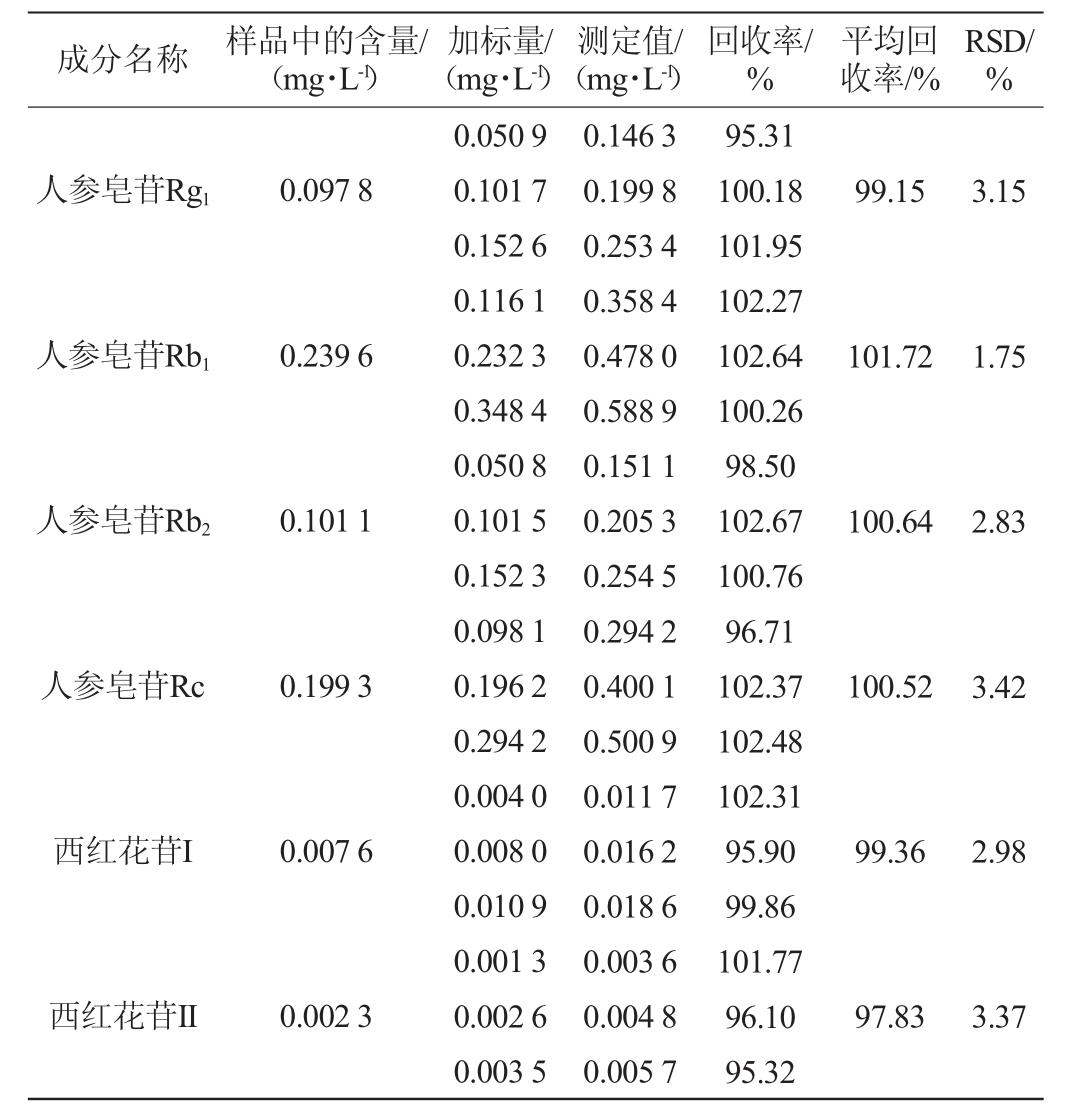
2.1.6 加标回收率试验
精密量取已知含量的同一酒样25 mL至茄形瓶中,共9份,分别按照酒样中各成分含量的低、中、高三个水平加入对照品适量,分别按“1.3.3”项下色谱条件进行测定,计算各成分加标回收率,结果见表8。由表8可知,各成分平均加标回收率分别为人参皂苷Rg1 99.15%、人参皂苷Rb1 101.72%、人参皂苷Rb2 100.64%、人参皂苷Rc 100.52%、西红花苷I 99.36%、西红花苷II 97.83%。加标回收率的RSD值分别为3.15%、1.75%、2.83%、3.42%、2.98%、3.37%,均<5%,表明该方法准确度高。
表8 样品中各成分的加标回收率试验结果
Table 8 Recovery rates tests results of each component in the samples
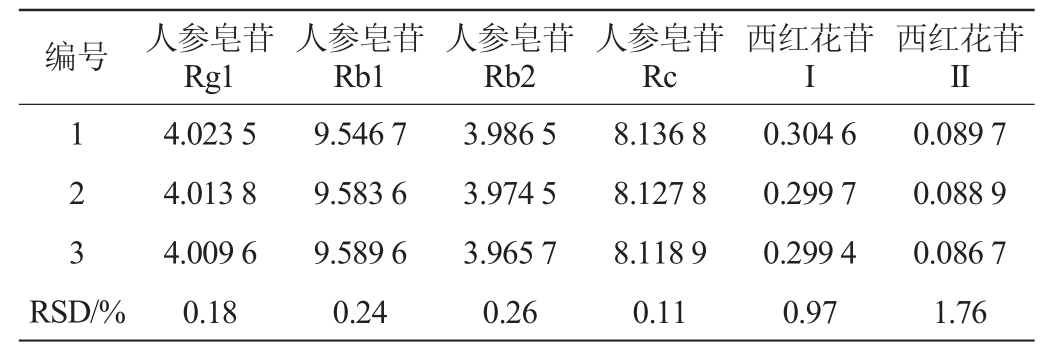
2.2 样品含量测定
取3批次复方保健酒样品,按照“1.3.2”项下供试品溶液制备方法制备供试品,分别按“1.3.3”项下色谱条件进行进样,计算各批次复方保健酒样品中各成分的含量,含量测定结果见表9。由表9可知,3批次的复方保健酒中人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、西红花苷I、西红花苷II含量的RSD值均<2%,表明复方保健酒的生产工艺较稳定。
表9 样品中人参皂苷和西红花苷含量的测定结果
Table 9 Determination results of ginsenoside and crocin contents of samples
3 结论
本研究建立了HPLC法测定复方保健酒中人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、西红花苷I、西红花苷II的含量的方法,该方法操作简便,重复性好,准确度高,可为后期复方保健酒生产过程中的质量监控及评价提供参考依据。
[1]谢洪,陆步诗,伍强,等.响应面法生产青钱柳老叶保健酒的工艺优化[J].酿酒科技,2021(3):85-91,99.
[2]龙晓鹏,张苇莉,武纪天,等.利用青钱柳生产保健酒的研究[J].酿酒科技,2021(1):45-49.
[3]许明君,高如意,邓辰辰,等.HPLC法同时测定复方中药保健酒中松果菊苷和毛蕊花糖苷的含量[J].食品与发酵科技,2020,56(1):100-105.
[4]那广宁,徐铭悦,郑诗绮,等.混合型苦瓜保健酒的发酵工艺优化及其抗氧化活性研究[J].中国酿造,2019,38(11):199-204.
[5]牛曼思,童钰琴,李姝,等.复方金钗石斛保健酒缓解小鼠体力疲劳的研究[J].中国酿造,2020,39(12):198-202.
[6]宋红卫,张惠喜,朱山,等.可调节机体免疫力复方人参保健酒工艺研究[J].酿酒科技,2019(7):82-85,93.
[7]李薪宇,牛曼思,杨阳,等.正交试验法优选复方金钗石斛保健酒渗漉工艺[J].中国酿造,2019,38(9):182-184.
[8]YI Y S.New mechanisms of ginseng saponin-mediated anti-inflammatory action via targeting canonical inflammasome signaling pathways[J]. J Ethnopharmacol,2021,278(3):114292.
[9]庞会婷,罗朵生,郭姣.三七化学成分分析及其抗炎机制的网络药理学探讨[J].中草药,2020,51(21):5538-5547.
[10]王超楠,赵大庆,王隶书,等.人参及复方人参制剂免疫双向调节机制及应用研究进展[J].时珍国医国药,2021,32(1):177-180.
[11]初百吉,贺阳,张铭健,等.红参-红景天功能饮品加工工艺优化及其提高免疫力功能评价[J].食品工业科技,2019,40(19):200-204,265.
[12]孙伟,许桂凤,唐小杭,等.人参总皂苷对高脂模型小鼠的降血脂作用[J].中成药,2020,42(7):1726-1731.
[13]赵永军,李刚刚,孙治安.人参皂苷Rg3对肝细胞癌上皮间质转化的抑制作用机制研究[J].中国临床药理学杂志,2020,36(14):2066-2069.
[14]王轲,胡慧灵,许英,等.人参皂苷Rb2对小鼠非酒精性脂肪肝病的治疗作用及其机制研究[J].热带医学杂志,2021,21(2):125-129,143,120.
[15]邓锟红,刘亚男,谭鸿毅,等.人参皂苷Rg1对肾疾病的保护作用及机制研究现状[J].中国临床药理学杂志,2021,37(7):910-913.
[16]冀凯,杜世豪,李新,等.人参皂苷Rg3抑制高糖诱导的人肾小球系膜细胞过度增殖、炎症反应和PTX3的表达[J].烟台大学学报(自然科学与工程版),2020,33(1):55-62.
[17]陈延勋,李松森,张辉锋.人参皂苷Rg1对冠状动脉粥样硬化性心脏病模型大鼠心功能及血管舒缩功能的影响[J].中医学报,2020,35(7):1491-1496.
[18]黄建成,郭世超,刘璞娟,等.西红花苷对大鼠缺血缺氧心肌损伤的保护作用及其机制[J].吉林大学学报(医学版),2021,47(1):102-109.
[19] LAI L L.Protective effects of quercetin and crocin in the kidneys and liver of obese Sprague-Dawley rats with type 2 diabetes:Effects of quercetin and crocin on T2DM rats[J]. Human Exp Toxicol,2021,40(4):661-672.
[20] LIU Y,YAO C Y,WANG Y,et al.Protective effect of crocin on liver function and survival in rats with traumatic hemorrhagic shock[J].J Surg Res,2021,261:301-309.
[21]侯莉,于颖,丁力.西红花苷通过C/EBP-β/PGC-1α/UCP3途径对缺血缺氧损伤心肌的保护作用[J].中国动脉硬化杂志,2019,27(6):481-488.
[22]于现花,刘军玲,金传山,等.西洋参破壁饮片中8种人参皂苷类成分双标多测法的建立[J].中国药房,2021,32(11):1345-1350.
[23]徐文武,谢涛,吕东峰,等.一测多评法同时测定红参中11种人参皂苷的含量[J].中草药,2021,52(7):2099-2105.
[24]田园,夏梅玲,吴佳,等.UPLC波长切换法同时测定西红花中西红花苷-Ⅰ、西红花苷-Ⅱ和苦番红花素含量[J].亚太传统医药,2019,15(3):33-36.
[25]高丽,王旭,张景景,等.HPLC法测定不同产地西红花中西红花苷-Ⅰ和西红苷-Ⅱ的含量[J].中华中医药学刊,2017,35(9):2274-2276.