生物活性肽,也称活性蛋白肽,是指具有生理功能的肽类物质。其主要的生理功能由氨基酸组成顺序决定,是当前最被学术界热衷于研究的生物功能因子之一,极具发展前景[1]。微生物发酵法是获得生物活性肽的常用方法,它是利用微生物在生长过程中所产生的蛋白酶将蛋白质转化成具备生物活性的小分子肽的方法,由于微生物自身产生的蛋白酶种类丰富,因此,可获得更多种类的活性肽[2]。血管紧张素转化酶(angiotensin convening enzyme,ACE)是存在于人体组织、血浆及肺部中的一种糖蛋白,对血压起调节作用。ACE过多会引起人体血压升高。ACE抑制肽是一类能够抑制ACE活性,控制和降低血压的短肽[3-6]。
金针菇(Flammulina velutipes)又名绒毛柄金钱菌,不仅营养丰富,还具有抗菌、抗氧化、抗肿瘤、提高身体免疫力等作用[7-10],是广为人知的药食两用菌[11-12]。金针菇蛋白质含量高,是活性肽开发和生产的极好原料[13]。但目前学术界尚未见有关于利用发酵法制备金针菇ACE抑制肽的报道,因此,本研究选择利用益生菌发酵法制备金针菇ACE抑制肽。试验以ACE抑制率作为评价指标,对枯草芽孢杆菌(Bacillus subtilis)、酿酒酵母(Saccharomyces cerevisiae)和黑曲霉(Aspergillus niger)三种益生菌进行了筛选[14-15],并优选出沉淀分离活性肽的最适pH,然后采用单因素和响应面设计对发酵条件进行了优化,最后采用超滤法对ACE抑制肽进行了分级分离和活性比较,以期为金针菇ACE抑制肽的研发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
金针菇:购自黑龙江省绥化市北林区农贸市场。
枯草芽孢杆菌(Bacillus subtilis)、酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger):由绥化学院微生物实验室提供。
血管紧张素转换酶(ACE)和N-马尿酰-L-组氨酰-L-亮氨酸水合物(N-Hippuryl-L-Histidyl-L-Leucine,HHL)(均为优级纯):美国Sigma公司;牛肉膏和蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;硼酸、硼砂、硝酸钠、磷酸氢二钾、乙酸乙酯等(均为分析纯):天津市致远化学试剂有限公司。
菌种活化用的牛肉膏蛋白胨培养基、马铃薯葡萄糖培养基及查氏培养基配方参见文献[16]。
1.2 仪器与设备
LX-100型立式压力蒸汽灭菌器:深圳良谊实验室仪器有限公司;752型紫外可见分光光度计:上海菁华科技仪器有限公司;JR-750A型万能粉碎机:浙江金华永康市云达机械设备厂;GZX-9030 MBE型数显鼓风干燥箱:上海博迅实业有限公司;TGL-20bR型高速冷冻离心机:上海安亭科学仪器厂;SHA-B型水浴恒温振荡器:上海新乘仪器设备有限公司;pHS-3C型酸度计:上海雷磁仪器有限公司;超滤离心管(截留分子质量分别为3 kDa和10 kDa):美国Millipore公司。
1.3 试验方法
1.3.1 血管紧张素转化酶(ACE)抑制率的测定
将6μL金针菇活性肽与2μL0.1U/mL的ACE(用0.1mol/L含0.3 mol/L NaCl的硼酸盐缓冲液(pH8.3)溶解而成)混合,37 ℃预温育5 min后混合10 μL的5 mol/L马尿酰-组氨酰-亮氨酸溶液(用0.1 mol/L含0.3 mol/L NaCl的硼酸盐缓冲液(pH8.3)溶解而成),混合物于37 ℃温育30 min,80 ℃加热10 min终止反应。再加入0.24 mL乙酸乙酯并振荡15 s,3 000 r/min离心10 min,吸取0.2 mL上层反应液,在95 ℃热蒸发10 min。
将含有马尿酸的残余物溶解在2.5 mL去离子水中,利用紫外可见分光光度计在波长228 nm处测量溶液的吸光度值A1[17-19]。以0.1 mol/L含0.3 mol/L NaCl的硼酸盐缓冲液代替金针菇活性肽,其余组分的添加量不变,所测吸光度值为A0。以0.1 mol/L含0.3 mol/L NaCl的硼酸盐缓冲液代替ACE,其余组分的添加量不变,测金针菇活性肽的本底吸光度值A2。每组测3次,取平均值。ACE抑制率计算公式如下:
1.3.2 沉淀分离发酵液中的活性肽
采用酸度计在pH3、4、5、6、7、8、9进行测试(利用1 mol/L NaOH和1 mol/L HCl调pH值),分别测定在各pH所获得的金针菇活性肽沉淀物的ACE 抑制率,筛选出最适合沉淀ACE抑制肽的pH值。
1.3.3 益生菌的筛选
利用枯草芽孢杆菌、酿酒酵母、黑曲霉菌进行筛选,选出能在金针菇发酵过程中高效降解金针菇蛋白质产生ACE抑制肽的菌株。
菌种活化:将装有牛肉膏蛋白胨培养液的锥形瓶灭菌后接入枯草芽孢杆菌,然后放置在水浴恒温振荡器中,于37 ℃以120 r/min培养约20 h,取菌悬液于波长600 nm处测定,当OD值为0.1时停止培养,此时菌体浓度约为1×106~1×107 CFU/mL。酿酒酵母用马铃薯葡萄糖培养基于28 ℃、120 r/min振摇培养30 h;黑曲霉用查氏培养基在恒温培养箱中28 ℃培养3 d,至孢子成熟后用无菌水制成孢子悬液。适当稀释使酿酒酵母菌体浓度和黑曲霉孢子浓度约为1×108 CFU/mL(采用血球计数板直接计数法)[20]。
准确称取金针菇干粉(由洗净的金针菇子实体于50 ℃烘干后用万能粉碎机粉碎并过80目筛制得)40 g和蔗糖3 g,加入500 mL锥形瓶中,同时加入150 mL蒸馏水,充分混匀后,121 ℃灭菌20 min。将活化好的三种菌的菌悬液或孢子悬液2 mL接种至金针菇固体培养基中,均匀混合后放置在32 ℃恒温培养箱中发酵72 h。之后转移至45 ℃干燥箱中干燥24 h,加入蒸馏水,充分混合,离心,取上清液,利用上述的沉淀法获取金针菇ACE抑制肽,将沉淀用蒸馏水复溶后测定肽溶液的ACE抑制率,筛选出所产肽ACE抑制性最强的菌株[21-23]。
1.3.4 金针菇ACE抑制肽制备工艺优化的单因素试验
利用筛选出的菌株按照上述方法制备金针菇ACE抑制肽,同时考察不同的发酵条件对其ACE抑制率的影响。
(1)液料比对发酵金针菇产ACE抑制肽的影响
取5份每份为40 g的金针菇干粉,各加蔗糖3 g,按照液料比(蒸馏水体积:金针菇粉质量)分别为3.25∶1、3.75∶1、4.25∶1、4.75∶1、5.25∶1(mL∶g)加入蒸馏水。将配制好的固态发酵培养基装入500 mL三角瓶中,32 ℃发酵48 h。之后的处理方法同上,依次测定肽的ACE抑制率。
(2)发酵时间对发酵金针菇产ACE抑制肽的影响
取5份40 g金针菇干粉于500 mL三角瓶中,各加蔗糖3 g,当液料比取值为3.75∶1(mL∶g),发酵温度为32 ℃时,分别将物料发酵12 h、24 h、36 h、48 h、72 h。依次测定肽的ACE抑制率。
(3)发酵温度对发酵金针菇产ACE抑制肽的影响
取5份40 g金针菇干粉于500 mL三角瓶中,各加蔗糖3 g,当液料比取值为3.75∶1(mL∶g),发酵时间为48 h时,将物料分别置于23 ℃、28 ℃、32 ℃、37 ℃、40 ℃条件下培养。依次测定肽的ACE抑制率。
(4)金针菇粉用量对发酵金针菇产ACE抑制肽的影响
当液料比取值为3.75∶1(mL∶g),发酵温度为32 ℃,发酵时间为48 h时,金针菇粉用量分别设定为10 g、20 g、40 g、60 g、80 g于500 mL三角瓶中。依次测定肽的ACE抑制率。
1.3.5 金针菇ACE抑制肽制备工艺优化的响应面试验设计
以单因素试验结果为依据,挑选出对ACE抑制率影响较大的因素,通过Design-Expert 8.0.6软件的Box-Behnken试验设计,进行响应面分析,以确定益生菌发酵法制备金针菇ACE抑制肽的最佳条件[24-27],响应面试验因素与水平见表1。
表1 血管紧张素转化酶抑制肽制备条件优化响应面试验设计因素与水平
Table 1 Factors and levels of response surface experiments for angiotensin converting enzyme inhibitory peptide preparation conditions optimization

1.3.6 ACE抑制肽的分级分离
将在最适发酵条件下获得的金针菇ACE抑制肽用沉淀法分离,然后用蒸馏水复溶后先经0.22 μm微孔滤膜过滤,再用截留3 kDa和10 kDa两种分子质量的超滤离心管进行离心,从而把金针菇ACE抑制肽分离成3个分子质量区间,即<3 kDa,3~10 kDa,>10 kDa。研究不同分子质量肽的ACE抑制率。
1.3.7 数据分析
每组试验均重复3次,所得数据采用Excel 2010进行分析处理并制图。
2 结果与分析
2.1 益生菌筛选结果
分别利用三株菌进行发酵,发酵结束后,在金针菇固体培养基中并未见到酿酒酵母的菌落生长,可见金针菇固体培养基不适合酿酒酵母的生长,因此将其排除。枯草芽孢杆菌和黑曲霉发酵液在不同pH条件下对ACE抑制率影响的结果见表2。
表2 枯草芽孢杆菌和黑曲霉发酵液的血管紧张素转化酶抑制率
Table 2 Angiotensin converting enzyme inhibitory rates of fermentation liquid of Bacillus subtilis and Aspergillus niger%

由表2可知,黑曲霉发酵液的ACE抑制率较低,枯草芽孢杆菌为制备金针菇ACE抑制肽的最佳菌种;最适合沉淀金针菇ACE抑制肽的pH为6。
2.2 单因素试验结果
2.2.1 液料比对金针菇肽ACE抑制率的影响
液料比对金针菇肽ACE抑制率的影响见图1。由图1可知,金针菇肽ACE抑制率随液料比的变化呈现出先升高后降低的趋势,在液料比4.75∶1(mL∶g)处达到最大值,可能是由于固态发酵时,物料中水分含量的高低对微生物生长和发酵影响很大。每一种微生物对其生长的物料环境中的水分含量都有一定的要求。如果环境中的水分含量过高,细胞就会吸水膨胀,甚至引起细胞破裂。反之,如果环境中水分含量过低,则会使细胞内的水分外渗,造成质壁分离,使细胞代谢活动受到抑制甚至引起死亡[28]。而微生物的生长状态直接影响到蛋白酶的分泌,从而影响到ACE抑制肽的产生。所以选择4.75∶1(mL∶g)为最佳液料比。
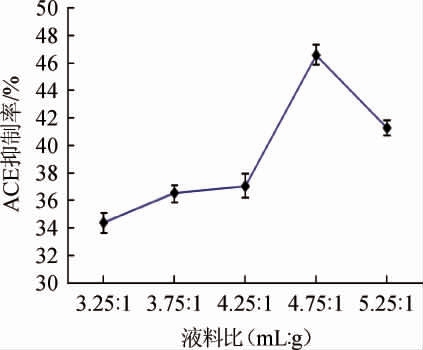
图1 液料比对金针菇肽血管紧张素转化酶抑制率的影响
Fig.1 Effect of liquid-material ratio on angiotensin converting enzyme inhibition rate of Flammulina velutipes peptides
2.2.2 发酵时间对金针菇肽ACE抑制率的影响
发酵时间对金针菇肽ACE抑制率的影响见图2。由图2可知,当发酵时间从12 h延长至24 h,ACE抑制率增加,并在发酵24 h时到达最大值,超过24 h后呈下降趋势,原因可能是枯草芽孢杆菌在发酵时间12~24 h内为生长旺盛期,蛋白酶大量分泌,从而促进了ACE抑制肽的积累。而随着发酵时间继续延长,菌体细胞大量繁殖,培养基中营养物质不断耗尽,微生物生长逐渐进入衰亡期,造成蛋白酶分泌量减少,从而影响到ACE抑制肽的产生[28]。所以选择24 h为最佳发酵时间。
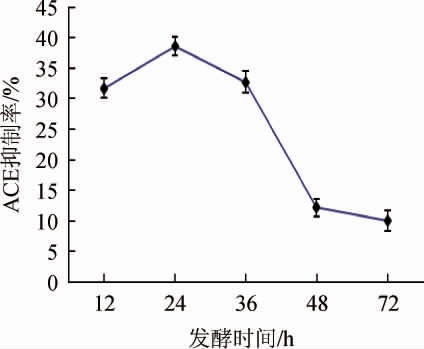
图2 发酵时间对金针菇肽血管紧张素转化酶抑制率的影响
Fig.2 Effect of fermentation time on angiotensin converting enzyme inhibition rate of Flammulina velutipes peptides
2.2.3 发酵温度对金针菇肽ACE抑制率的影响
发酵温度对金针菇肽ACE抑制率的影响见图3。由图3可知,温度过低或者过高都不利于枯草芽孢杆菌的固态发酵。在温度逐渐升高至37 ℃的过程中,ACE抑制率显著升高。当温度到达37 ℃时,ACE抑制率达到最大值,但当温度再增高时,ACE抑制率开始下降。原因可能是过低过高的温度都会影响蛋白酶的活性,从而影响到ACE抑制肽的形成。因此选择37 ℃为最佳发酵温度。
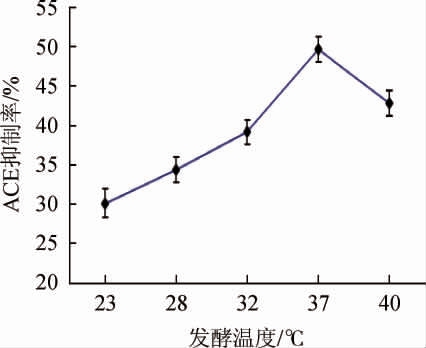
图3 发酵温度对金针菇肽血管紧张素转化酶抑制率的影响
Fig.3 Effect of fermentation temperature on angiotensin converting enzyme inhibition rate of Flammulina velutipes peptides
2.2.4 金针菇粉用量对金针菇肽ACE抑制率的影响
金针菇粉用量对金针菇肽ACE抑制率的影响见图4。由图4可知,金针菇ACE抑制率随金针菇粉用量增加呈现出先升高后降低的趋势,金针菇粉用量为20 g/500 mL时,ACE抑制率达到峰值,原因可能是金针菇粉用量适当加大,可增加培养基中营养物的供给以满足菌体生长过程中对营养的需求,但在培养瓶容积和液料比一定的前提下,金针菇粉用量过多,势必引起瓶装量过大,导致瓶中供氧量不足,从而影响到菌体的生长和蛋白酶的分泌以及ACE抑制肽的产生。因此选择最佳金针菇粉用量为20 g/500 mL。
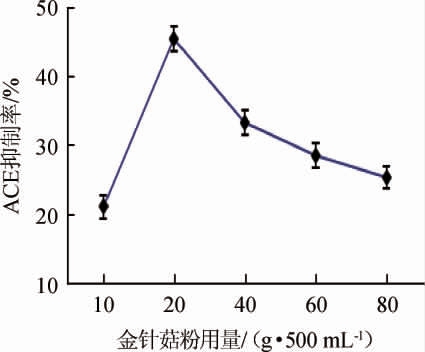
图4 金针菇粉用量对金针菇肽血管紧张素转化酶抑制率的影响
Fig.4 Effect of Flammulina velutipes powder addition on angiotensin converting enzyme inhibition rate of Flammulina velutipes peptides
2.3 响应面试验设计结果
根据单因素试验结果,以A(液料比)、B(发酵时间)、C(发酵温度)、D(金针菇粉用量)为自变量,以ACE抑制率(Y)为响应值,进行四因素三水平的Box-Behnken设计,响应面试验结果与分析见表3,方差分析见表4。
表3 血管紧张素转化酶抑制肽制备条件优化响应面试验结果与分析
Table 3 Results and analysis of response surface experiments for angiotensin converting enzyme inhibitory peptide preparation conditions optimization
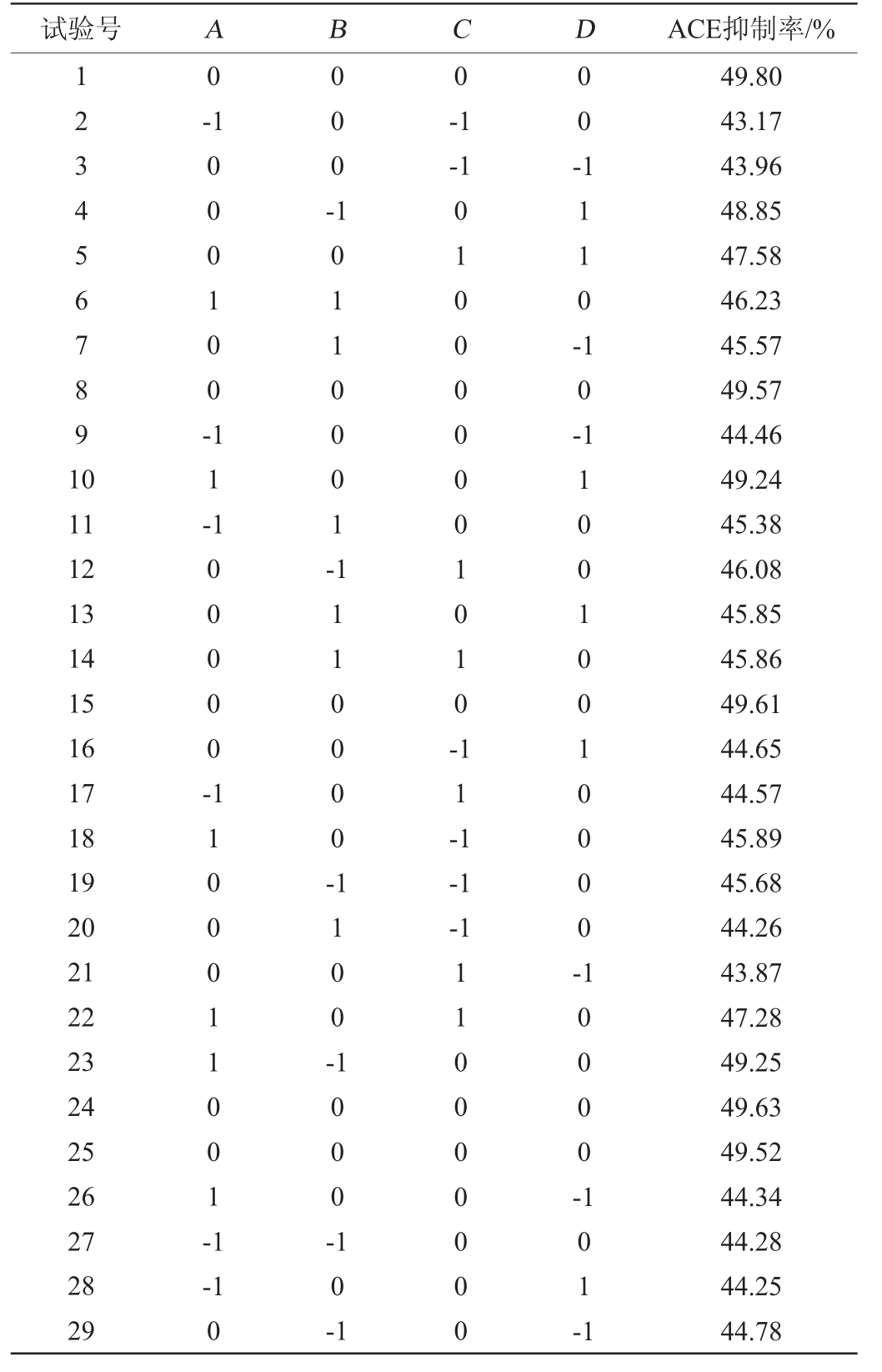
表4 响应面试验结果方差分析
Table 4 Variance analysis of response surface tests results
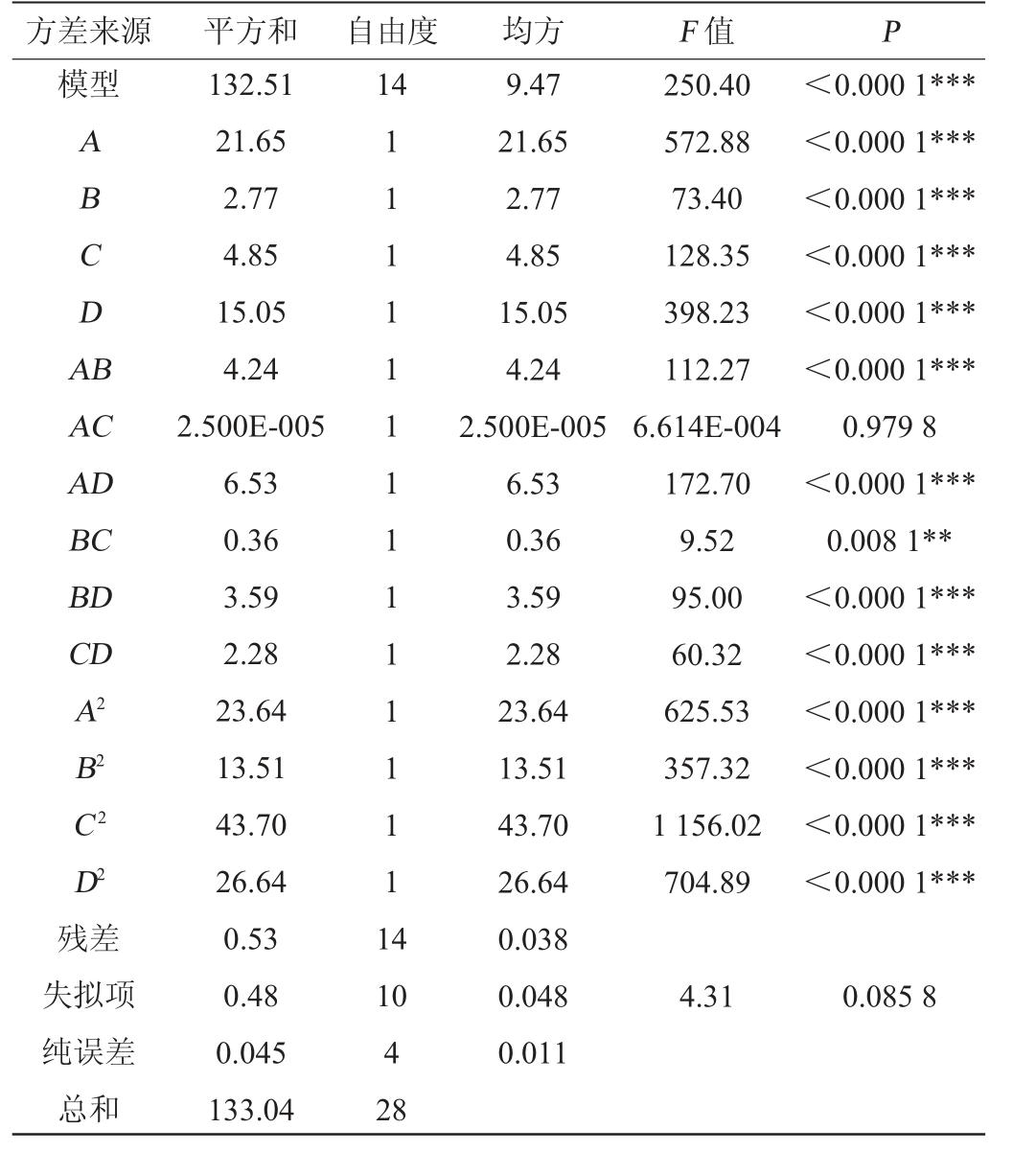
注:“**”表示对结果影响显著,P<0.01;“***”表示对结果影响极显著,P<0.001。
利用软件Design-Expert 8.0.6 进行数据分析和二次多元回归拟合,得到二次多元回归方程为:

由表4可知,模型的P<0.000 1,表明该回归方程模型极显著,且模型失拟项P值=0.085 8>0.05不显著,决定系数R2=0.996 0,调整决定系数R2adj=0.992 0说明模型拟合程度较好,可以用此模型来分析和预测枯草芽孢杆菌发酵制备金针菇ACE抑制肽的工艺条件。从表4还可以看出A、B、C、D、AB、AD、BD、CD、A2、B2、C2、D2对金针菇肽ACE抑制率的影响极显著(P<0.001),BC的影响显著(P<0.01)。反映各因素对响应值影响的曲面图见图5。

图5 各因素间交互作用对金针菇肽血管紧张素转化酶抑制率的响应面和等高线
Fig.5 Response surface plots and contour lines of effects of interaction between each factor on the angiotensin converting enzyme inhibition rate of Flammulina velutipes peptides
从以上6个曲面图中可以看出,4个影响因素的曲面都非常陡,除A、C交互作用影响的曲面图中等高线近于圆形,从而说明A、C两个因素交互作用影响不显著外,另5个曲面图中的等高线均为椭圆形,说明图中两个因素交互作用影响显著,又由于等高线通常向影响相对大的因素轴向聚集,所以综合来看,4个因素的影响程度排序为A>D>C>B。
由Design Expert 8.0.6软件预测此工艺的最优条件为液料比为5.13∶1(mL∶g)、发酵时间为16.19 h、发酵温度为36.75 ℃,金针菇用量为35.55 g。在此条件下预测金针菇肽的ACE抑制率预测值为50.75%。为了实际操作可行性,将条件修正为液料比为5∶1(mL∶g),发酵时间为16 h,发酵温度为37 ℃,金针菇粉用量为35 g/500 mL。为检验该预测条件的可靠性,进行3次验证试验,得到金针菇肽的ACE抑制率实测值为(51.25±1.02)%。实测值与预测值偏差(0.85±0.52)%,表明所建模型与实际情况高度拟合,此响应面法优化的枯草芽孢杆菌发酵制备金针菇ACE抑制肽的工艺可靠。
2.4 ACE抑制肽分级分离的结果
不同分子质量区间肽的ACE抑制率见表5。由表5可知,肽分子质量越小,ACE抑制率越高。截留分子质量<3 kDa的肽ACE抑制活性最强。
表5 三个分子质量区间内肽的血管紧张素转化酶抑制率
Table 5 Angiotensin converting enzyme inhibition rates of peptides in three molecular mass ranges
3 结论
该研究对益生菌发酵金针菇基质制备ACE抑制肽的条件进行了优化,还对金针菇ACE抑制肽进行了分级分离和活性比较。试验结果表明,枯草芽孢杆菌为最适发酵菌种;沉淀法分离ACE抑制肽的最适pH为6;最佳发酵条件为液料比5∶1(mL∶g),发酵时间16 h,发酵温度37 ℃,金针菇用量35 g/500 mL,在此条件下得到金针菇ACE抑制肽的ACE抑制率为(51.25±1.02)%。截留分子质量<3 kDa的肽ACE抑制活性最强。此研究成果将为金针菇的进一步开发利用,尤其是在ACE抑制肽领域的研发提供一定的理论依据。在下一步的工作中,本课题组将扩大益生菌的筛选范围,并对沉淀法分离ACE抑制肽的pH筛选范围进一步细化,还将重点对截留分子质量<3 kDa的金针菇ACE抑制肽的相对分子质量及结构做进一步的分析鉴定。
[1]曹慧英,柴媛,肖志刚,等.玉米活性肽的研究进展[J].食品安全质量检测学报,2019,10(19):6587-6591.
[2]李晓杰,李富强,朱丽萍,等.生物活性肽的制备与鉴定进展[J].齐鲁工业大学学报,2021,35(1):23-28.
[3]马菲菲.银杏种仁ACE抑制肽的分离纯化、鉴定及抑制机理的研究[D].合肥:合肥工业大学,2019.
[4]王琳琳,陈立,李建科.食源血管紧张素转化酶抑制肽研究进展[J].中国果菜,2020,40(6):71-76.
[5]赵越,张孚嘉,吴楠,等.ACE抑制肽的研究进展[J].中国酿造,2020,39(1):6-11.
[6]贾聪,孟醒,游静,等.低苦味芝麻ACE抑制肽的制备及氨基酸组成和结构分析[J].食品与发酵工业,2021,47(17):172-178.
[7]刘兰庆,汪鋆植,倪炎.金针菇黄酮类化合物的体外抗氧化活性研究[J].生物化工,2018,4(6):62-65.
[8]刘宗奇,武晨剑,袁学文,等.白色和黄色金针菇子实体营养成分与挥发性物质比较[J].食用菌学报,2021,28(3):102-111.
[9]陆欢,王瑞娟,刘建雨,等.不同品种金针菇的营养成分分析与评价[J].食品与机械,2021,37(6):69-75.
[10]王慧,郭东方,王鑫.金针菇的营养保健功能及开发利用现状[J].中国食用菌,2021,40(11):11-14.
[11]王桂林,杨宇,李国辉,等.金针菇多糖生物活性研究进展[J].中国食用菌,2021,40(12):10-13,18.
[12]刘学成,王文亮,弓志青,等.金针菇膳食纤维改性、理化性质及抗氧化、降血脂活性[J].食品科学,2021,42(23):90-98.
[13]党仪安,王文亮,弓志青,等.食用菌生物活性肽制备及功能活性研究进展[J].食品工业,2019,40(8):228-231.
[14]戴旭平.复合益生菌发酵黄芪的制备及应用[D].大连:大连海洋大学,2022.
[15]叶泽,季彬,杜津昊,等.益生菌饲料添加剂对初级饲料的改良[J].饲料研究,2021(11):142-145.
[16]蔡信之,黄君红.微生物学实验(第四版)[M].北京:科学出版社,2019:276-277.
[17]颜泽.牡蛎(Ostrea tailienwhanensis)ACE 抑制肽的制备技术的研究[D].大连:大连海洋大学,2018.
[18]伍强.灵芝菌丝ACE抑制肽的鉴定、抑制机理及其降血压分子机制研究[D].长沙:中南林业科技大学,2020.
[19]张孟凡,敬思群,郑力,等.葵花籽粕ACE 抑制肽分离纯化及其性质研究[J].粮食与油脂,2020,33(4):44-48.
[20]刘潇,郭丽娜,马海乐,等.枯草芽孢杆菌和黑曲霉固态发酵制备核桃多肽的工艺条件优化[J].现代食品科技,2018,34(8):130-137.
[21]刘建成.棉粕寡肽发酵制备及其生物活性和营养特性研究[D].石河子:石河子大学,2018.
[22]佡思涵.纳米蛹虫草基质发酵制备活性肽及其降血糖活性研究[D].沈阳:沈阳农业大学,2018.
[23]冒鑫哲,彭政,周冠宇,等.枯草芽孢杆菌高产角蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(17):138-144.
[24]杨晓婷,徐力,田永强.响应面优化黑曲霉和酿酒酵母发酵豆粕的条件[J].草原与草坪,2020,40(5):102-107.
[25]于莹,宿小杰,周德庆,等.响应面法优化紫贻贝免疫活性肽的制备工艺[J].中国海洋药物,2021,40(6):21-29.
[26]王睿文,黄旭萍,时梦,等.响应面法优化余甘子果实总黄酮提取工艺[J].食品安全质量检测学报,2021,12(24):9521-9529.
[27]闫舒雅,郭素萍.响应面法优化桦褐孔菌发酵产多糖工艺[J].食品与发酵科技,2021,57(6):49-53.
[28]许赣荣,胡鹏刚.发酵工程[M].北京:科学出版社,2013:27-30.