红曲霉(Monascus)作为一种药食用丝状真菌,其次级代谢产物包括天然红曲色素、γ-氨基丁酸、莫纳可林(Monacolin)K、桔霉素等[1-2]。红曲色素作为一种聚酮类代谢产物,现已有110多种被发现[3],根据其溶解性可分为醇溶性和水溶性2种[4]。红曲色素具有食品着色剂的生物安全性和适用性[5],已被用于研制具有功能特性的调味品[6]、酒类[7]、肉制品[8]和面制品[9]等。除此之外,红曲色素具有羟基、醚键、羰基等官能团和共轭结构,具有抗突变[10]、抗癌[11]、抗肥胖[12-13]、抗氧化[14]、降血压[15]和抗阿尔兹海默症[4]等多种生物活性,使得红曲色素在功能性食品、制药等方面有更广的应用前景。
氮源作为重要的能源物质,对真菌生长发育过程中大分子物质有调控作用,已有关于构巢曲霉(Aspergillus nidulans)、粗糙脉胞菌(Neurosporacrassa)中氮代谢调控机制的研究[16-17]。岳倩倩等[18]考察不同的无机氮源对红曲霉菌丝生长和产色素的调控情况发现,铵态氮对红曲霉生长和产色素有促进作用,亚硝态氮则有抑制作用,但其氮代谢调控机制尚不清楚。
随着第二代测序技术的出现,组学技术应运而生。到目前为止,主要的组学方法包括基因组学、转录组学、蛋白质组学、代谢组学等[19-20]。其中,转录组学因其具有灵敏度高、费用低、针对性强、对其筛出的遗传标记可直接进行应用等优点而率先取得进步[21]。因其可以用于深度挖掘新基因、确定代谢途径及进化分析[22-23],已被广泛应用于生物学、医学、农学等领域。如稻曲病菌有性生殖中光诱导基因的转录组分析[24]、大青转录组测序及生物信息学分析[25]等。为深入研究氮源对红曲霉生长和产色素的调控机制,本研究分别以铵态氮、亚硝态氮为氮源培养安卡红曲霉(Monascus anka)菌株GZUM-25,采用Illumina二代测序平台对红曲霉GZUM-25进行转录组测序分析,分析不同氮源条件下调控红曲霉菌丝生长和产色素的差异表达基因,并对基因进行GO功能富集及KEGG通路富集分析,以期为后续红曲霉基因的深度挖掘提供信息资源和理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
安卡红曲霉(Monascus anka)GZUM-25:本实验室分离保藏。
1.1.2 培养基
沙氏琼脂改良培养基[25]:麦芽糖5 g/L,蛋白胨10 g/L,酵母膏5 g/L,琼脂20 g/L,葡萄糖20 g/L,pH自然,121 ℃高压灭菌25 min。液体培养基中不添加琼脂。
察氏培养基[25]:NaNO33g/L,K2HPO41g/L,MgSO·47H2O 0.5 g/L,KCl 0.5 g/L,FeSO4 0.01 g/L,蔗糖30 g/L,琼脂20 g/L,121 ℃高压灭菌25 min。
调控培养基:向察氏培养基中分别添加1%的NaNO2、(NH4)2SO4两种不同的无机氮源,用于红曲霉菌株培养。
1.1.3 化学试剂
麦芽糖、葡萄糖、酵母膏、蛋白胨(均为生化试剂):奥博星生物技术有限公司;NaNO2、K2HPO4、MgSO4·7H2O、KCl、FeSO4(均为分析纯):重庆北碚精细化工厂;(NH4)2SO4(分析纯):重庆川江化工有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LDZX-50KBS立式高压蒸汽灭锅:上海申安医疗器械厂;SW-CJ-1F超净工作台:苏州净化设备有限公司;DH-360A电热恒温培养箱:北京科伟永兴仪器有限公司;THZ-82A数显气浴恒温振荡器:金坛市晶玻实验仪器厂;Trizol总核糖核酸(ribonucleic acid,RNA)抽提试剂盒、TruseqTM RNA sample prep试剂盒、Dynal M280磁珠:美国Invitrogen公司;NanoDrop2000:美国Thermo Scientific公司。
1.3 试验方法
1.3.1 红曲霉样品制备
将安卡红曲霉菌株GZMU-25接种到沙氏琼脂改良培养基上,30 ℃恒温培养10 d。将已活化的安卡红曲霉菌株GZMU-25用10 mL无菌水洗下后,将孢子悬液分别转移到含1%NaNO2和1%(NH4)2SO4的调控培养基中,分别编号为MP1、MP2,30 ℃、230 r/min条件下振荡培养7 d。培养结束后,将菌丝用无菌镊子挑出,用液氮速冻保存于-80 ℃冰箱。
1.3.2 总RNA的提取
采用总RNA提取试剂盒提取经液氮冷冻保藏的菌丝球总RNA,通过NanoDrop2000对所提RNA的浓度和纯度进行检测,采用琼脂糖凝胶电泳检测RNA完整性,Agilent 2100测定RNA完整值(RNA integrity number,RIN),挑选满足测序要求的RNA样本进行转录组测序。
1.3.3 文库的构建和Illummina Hiseq测序
利用带有Oligo(dT)的磁珠与poly A进行腺嘌呤(adenine,A)-胸腺嘧啶(thymine,T)配对,从样本MP1、MP2总RNA中分离出信使核糖核酸(messenger ribonucleic acid,mRNA),加入fragmentation buffer,将mRNA随机断裂成碱基长度为200 bp左右的小片段。在逆转录酶的作用下,加入六碱基随机引物,以mRNA为模板反转录合成第一链互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),随后进行第二链合成,形成稳定的双链结构。对双链cDNA进行末端修饰、片段大小选择,最后选择富集合格的文库进行Illummina Hiseq测序。
1.3.4 序列分析和功能注释
通过Illummina Hiseq测序得到包含测序接头序列、低质量读段、N(无法确定碱基信息)率较高序列及长度过短序列的原始测序数据,采用软件SeqPrep、Sickle对原始数据进行阅读框(reads)中接头序列的去除、3'端低质量碱基的修剪及含N比率>10%reads的去除。利用bowtie将修剪后的测序数据比对到基因组上,检测外显子之间的可变剪切信息,并将最终得到的序列与Nr、GO、KEGG数据库进行对比,并对其功能进行注释。
2 结果与分析
2.1 红曲霉转录组测序与转录分析
对原始数据进行统计分析,结果见表1。由表1可知,从样品MP1中得到的阅读框(reads)总数和碱基总数分别为62 127 568条和9 381 262 768 bp;从样品MP2中得到的reads总数和碱基总数分别为52 725 002条和7 961 475 302 bp。对原始数据进行质量修剪后,样品MP1得到的Clean reads和Clean碱基总数分别为61 233 790条和9 145 916 108 bp;样品MP2得到的Clean reads 和Clean 碱基总数分别为51 890 476条和7 746 137 365 bp。样品MP1和MP2的鸟嘌呤(guanine,G)胞嘧啶(cytosine,C)含量分别为53.29%、53.10%,Q20碱基比例分别为98.59%、98.53%,Q30碱基比例分别为95.78%、95.64%。通过与参考基因组对比后,样品MP1和MP2得到的Uniquely mapped总数分别为45 194 295、35 139 204,占比分别为73.81%、67.72%。结果表明,该转录组样本测序质量较高,可进行下一步样品中差异基因的分析。
表1 转录组测序结果统计
Table 1 Statistics of transcriptome sequencing analysis results

注:Q20为质量值≥20的碱基所占比列;Q30为质量值≥30的碱基所占比列。
2.2 红曲霉样本间差异基因的分析
使用edgeR软件,根据gene read count数据进行差异表达计算,按照错误发现率(false discoveryrate,FDR)<0.05且差异倍数(fold change,FC)对数值的绝对值(|log2FC|)≥1为标准,对样品差异基因进行筛选,结果见图1。
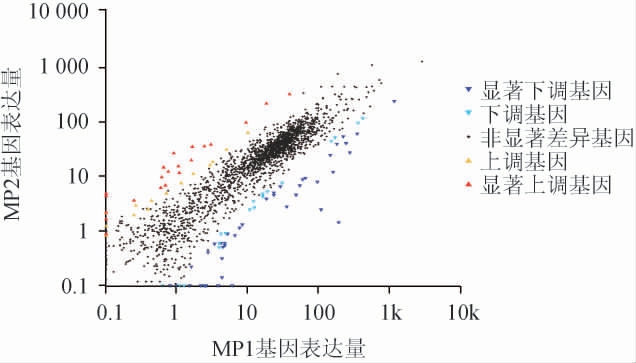
图1 红曲霉样本间差异表达基因散点图
Fig.1 Scatter plot of differentially expressed genes between Monascus samples
越接近0的点,说明表达量越低;偏离对角线程度越大的点表明该基因在两个样本间表达差异越大。
由图1可知,样本MP1与MP2中共存在2 117个基因,其中存在显著差异基因有95个,37个基因属于显著上调,58个基因属于显著下调。
2.3 红曲霉样本间差异表达基因的GO功能富集分析
使用Goatools软件对红曲霉样品间差异表达的基因进行GO功能显著性富集,利用GO数据库,以P≤0.05为筛选标准,按照基因参与的生物学过程(biological process,BP)、构成细胞组分(cellular component,CC)、实现的分子功能(molecular function,MF)等将MP1、MP2样品存在的差异表达基因进行比对分析,结果见图2。由图2可知,在样本MP1和MP2中,差异基因参与了生物学过程、细胞组分和分子功能。将95个差异基因分别映射到46个代谢通路中,在分子功能中,主要富集通路为铁离子连接(iron ion binding)和单氧化酶活性(monooxygenase activity),均有5个差异基因参与,均占差异表达基因总数的5.26%。其次是氧化还原酶活性(oxidoreductase activity)、血红素结合(heme binding)等。在细胞组分中,主要富集通路为葡萄糖苷酶II复合物(glucosidase II complex)、细胞表面(cell surface),参与的差异表达基因数均为1个,均占总差异表达基因总数的1%。在生物学过程中,主要富集通路为葡萄糖代谢过程(sucrose metabolic process)、淀粉代谢过程(starch metabolic process)、细胞碳水化合物代谢过程(cellular carbohydrate metabolic process),参与差异表达的基因数分别有3个、3个、4个,占总差异表达基因总数的3.16%、3.16%、4.21%。
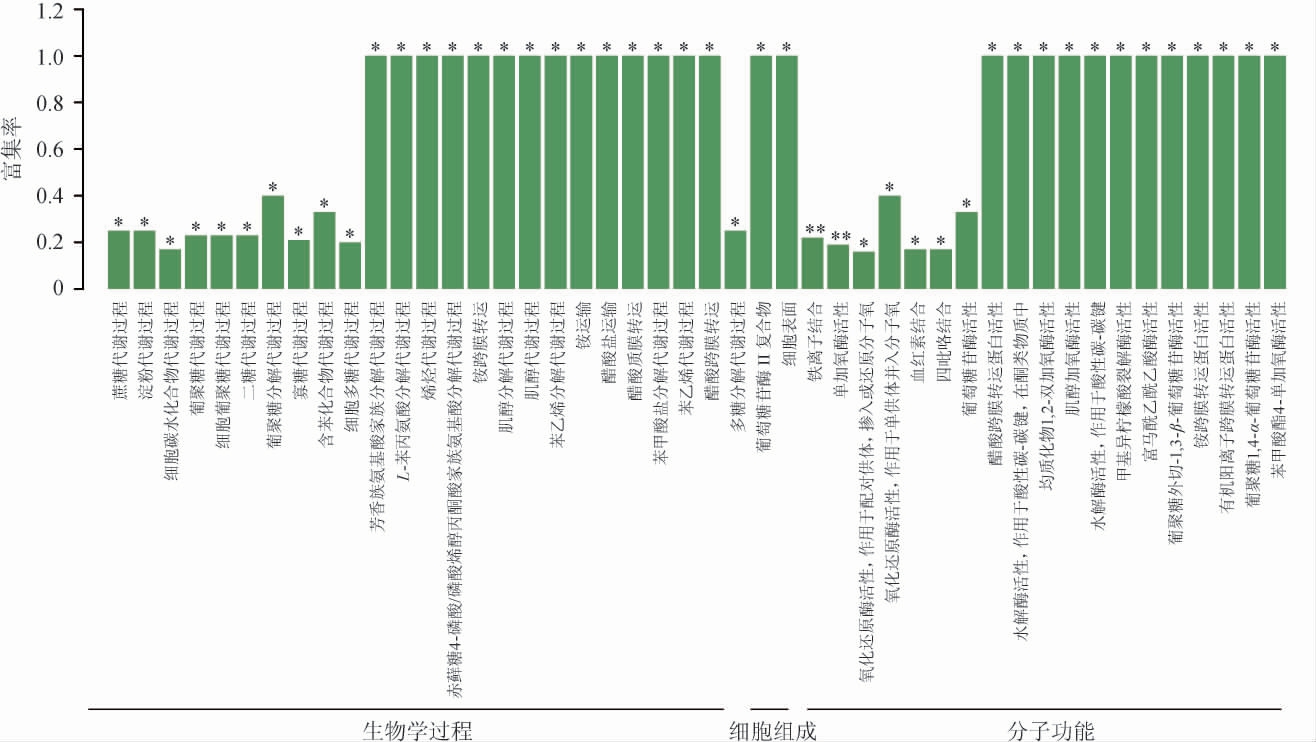
图2 红曲霉样本间差异表达基因的GO功能富集结果
Fig.2 GO functional enrichment results of differentially expressed genes between Monascus samples
“**”表示极显著富集(P<0.01),“*”表示显著富集(P<0.05)。
2.4 红曲霉样本间差异表达基因的KEGG通路富集分析
以P≤0.05作为筛选差异基因在KEGG通路显著富集的标准,使用软件KOBAS对红曲霉样本间差异基因进行KEGG通路富集分析,结果见图3。由图3可知,在样品MP1和MP2中,95个差异基因中有11个基因注释到KEGG 17条通路中。包括磷酸肌醇代谢(inositol phosphate metabolism)、氨基苯基酸酯降解(aminobenzoate degradation)、淀粉和蔗糖代谢(starch and sucrose metabolism)、氯代环己烷和氯苯降解(chlorocyclohexane and chlorobenzene degradation)、紧密连接(tight junction)、缬氨酸、亮氨酸和异亮氨酸生物合成(valine,leucine and isoleucine biosynthesis)、酪氨酸代谢(tyrosine metabolism)等。在以上差异表达基因富集通路中,磷酸肌醇代谢(inositol phosphate metabolism)、淀粉和蔗糖代谢(starch and sucrose metabolism)、苯乙烯降解(styrenedegradation)以及氨基苯基酸酯降解(aminobenzoate degradation)差异基因参与数目最多,均为2个,可推测以上4条通路在红曲霉菌丝生长和色素产生方面存在重要作用。
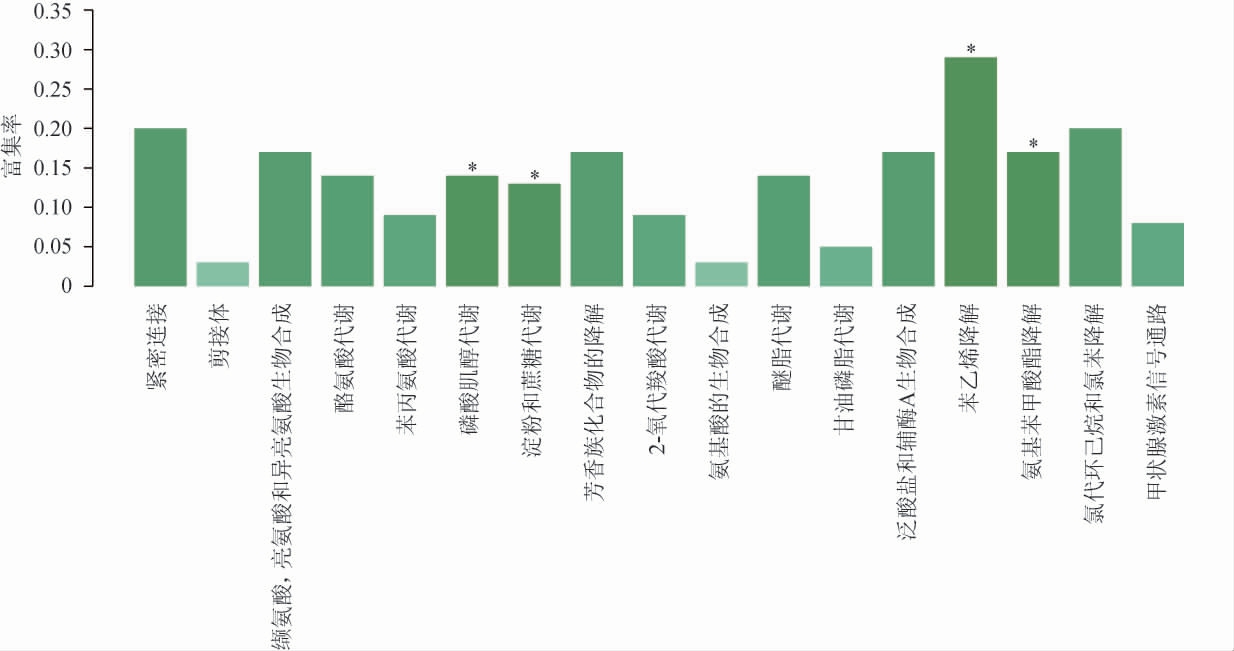
图3 红曲霉样本间差异表达基因的KEGG通路富集分析结果
Fig.3 KEGG pathway enrichment analysis results of differentially expressed genes between Monascus samples
颜色的深浅代表通路富集程度;“*”表示差异基因在该通路显著富集(P<0.05)。
3 结论
以铵态氮、亚硝态氮为氮源培养安卡红曲霉(Monascus anka)菌株GZUM-25,采用Illumina二代测序平台对红曲霉GZUM-25进行转录组测序分析发现,铵态氮和亚硝态氮培养下的安卡红曲霉GZUM-25基因组中有95个差异表达基因,其中,上调基因有37个,下调基因有58个。通过GO功能富集及KEGG通路富集分析发现,差异基因主要富集的功能为生物学过程、细胞组分和分子功能,富集的通路为磷酸肌醇代谢、淀粉和蔗糖代谢、苯乙烯降解、氨基苯基酸酯降解。本研究为红曲霉相关功能基因的挖掘提供了理论支持。
[1]许赣荣.红曲霉菌的研究进展[J].中国酿造,2002,21(s1):7-11.
[2] JIRASATID S,NOPHARATANA M,KITSUBUN P,et al.Statistical optimization for Monacolin K and yellow pigment production and citrinin reduction by Monascus purpureus in solid-state fermentation[J].J Microbiol Biotechnol,2013,23(3):364-374.
[3]CHEN W P,FENG Y L,MOLNÁR I,et al.Nature and nurture:confluence of pathway determinism with metabolic and chemical serendipity diversifies Monascus azaphilone pigments[J].Nat Prod Rep,2019,36(4):561-572.
[4]玛合沙提·努尔江,包天雨,张添琪,等.红曲色素的生物活性及其作用机制研究进展[J/OL].食品与发酵工业:1-12[2022-08-31].DOI:10.13995/j.cnki.11-1802/ts.031410.
[5]DARWESH O M,MATTER I A,ALMOALLIM H S,et al.Isolation and optimization of Monascus ruber OMNRC45 for red pigment production and evaluation of the pigment as a food colorant[J].Appl Sci,2020,10(24):8867.
[6] SONG J,ZHANG J J,SU Y,et al. Monascus vinegar-mediated alternation of gut microbiota and its correlation with lipid metabolism and inflammation in hyperlipidemic rats[J].J Funct Foods,2020,74:104152.
[7]吴玉峰.高产洛伐他汀红曲菌的选育及其在黄酒中的应用研究[D].无锡:江南大学,2021.
[8]金二庆.红曲菌发酵对广式腊肠感官、风味及保藏特性的影响[D].广州:暨南大学,2017.
[9]付丽芳,林家莲.新型功能食品——红曲面包的研制[J].粮油加工与食品机械,2002(1):45-46.
[10]FENG Y L,SHAO Y C,CHEN F S. Monascus pigment[J].Appl Microbiol Biotechnol,2012,96(6):1421-1440.
[11] ZHENG Y Q,XIN Y W,SHI X N,et al.Anti-cancer effect of rubropunctatin against human gastric carcinoma cells BGC-S23[J].Appl Microbiol Biotechnol,2010,88(5):1169-1177.
[12]CHOE D,LEE J,WOO S,et al.Evaluation of the amine derivatives of Monascus pigment with anti-obesity activities[J]. Food Chem,2012,134(1):315-323.
[13]KIM J H,KIM Y O,JEUN J,et al.L-Trp and L-Leu-OEt derivatives of the Monascus pigment exert high anti-obesity effects on mice[J].Biosci Biotechnol Biochem,2010,74(2):304-308.
[14]YULIANA A,SINGGIH M,JULIANTI E,et al.Derivates of azaphilone Monascus pigments[J]. Biocatal Agric Biotechnol,2017,9:183-194.
[15]WU H C,CHENG M J,WU M D,et al.Secondary metabolites from the fermented rice of the fungus Monascus purpureus and their bioactivities[J].Nat Prod Res,2019,33(24):3541-355.
[16]刘敏,黄炜忠,何孟璐,等.大青转录组测序及生物信息学分析[J].广州中医药大学学报,2022,39(1):177-183.
[17]MOROZOV I Y,GALBIS-MARTINED M,JONES M G,et al.Charac-terization of nitrogen metabolite signaling in Aspergillus via the regulated degradation of areA mRNA[J].MOL Microbiol,2001,42(1):269-277.
[18]岳倩倩,倪爱欣,周礼红.无机氮源对红曲霉调控初探[J].中国酿造,2016,35(12):48-52.
[19]QIN X M,XIA Y T,HU C X,et al.Ionomics analysis provides new insights into the co-enrichment of cadmium and zinc in wheat grains[J].Ecotoxicol Environ Saf,2021,223:112623.
[20] SHAH T,XU J S,ZOU X L,et al.Omics approaches for engineering wheat production under abiotic stresses[J].Int J Mol Sci,2018,19(8):2390.
[21]龚诗琦,王志勇,肖世俊,等.黄姑鱼转录组SSR的开发与验证[J].集美大学学报(自然科学版),2016,21(4):241-246.
[22]王楚彪,卢万鸿,林彦,等.转录组测序的发展和应用[J].桉树科技,2018,35(4):20-26.
[23]朱晨,张舒婷,周承哲,等.萎凋处理对乌龙茶风味品质形成的转录组分析[J].生物工程学报,2022,38(1):303-327.
[24]孙钰超,邓平川,邓启得,等.稻曲病菌有性生殖中光诱导基因的转录组分析[J/OL].植物病理学报:1-22[2022-08-31].DOI:10.13926/j.cnki.apps.000612.
[25]鲍龙飞,秦玉琪,曲音波.FluG-BrlA途径参与构巢曲霉无性发育机制的研究进展[J].微生物学通报,2014,41(1):104-110.