淫羊藿(Epimedium brevicornu Maxim.)具有补肾阳、强筋骨、祛风湿的作用,常用于肾阳虚衰、阳痿遗精、筋骨萎软、风湿麻痹、麻木拘挛等病症,其主要活性成分为具异戊烯基取代的黄酮类化合物[1],淫羊藿中的黄酮类化合物主要以多糖苷、双糖苷、单糖苷的形式存在,淫羊藿多糖苷黄酮渗透性差,吸收利用率低,单糖苷和苷元的的生物活性是多糖苷的数十倍[2]。但淫羊藿中多糖苷黄酮数量多、含量高,低糖苷尤其是单糖苷和苷元含量低,采用绿色安全的方法将淫羊藿中大量的多糖苷类成分转化为更具活性的低糖苷或苷元成为现在的研究热点问题之一[3]。
淫羊藿经传统油炙炮制后可以提高淫羊藿苷、淫羊藿次苷的含量[4-5],该方法需高温,不同温度油炙后成分差异巨大。蒋艳荣等[6-7]分别利用β-葡萄糖苷酶、蜗牛酶将淫羊藿苷转化为苷元和宝藿苷I,酶解法环境友好,常温常压下即可完成,但酶的成本高昂。谷春秀等[8]用黑曲霉固态发酵淫羊藿后,淫羊藿苷含量得到大幅提高,显示出生物发酵法在淫羊藿活性成分转化方面的巨大潜力。植物乳杆菌(Lactobacillus plantarum)能产生蛋白酶,葡萄糖苷酶等丰富的酶系,能有效破除植物类中药细胞壁和果胶类物质形成的物理屏障,使有效活性成分溶出,且具有打断β糖苷键,将多糖苷转化为单糖苷和苷元的潜力[9-10]。超高效液相色谱-串联四极杆飞行时间质谱(ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)已被广泛应用于食品、药品、化妆品等化学成分的快速鉴定,可通过将液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)扫描的碎片离子信息和化合物裂解规律与对照品或文献比对来快速、准确地分析化合物中所含化学成分。淫羊藿中不同母核结构的化学成分在电喷雾电离质谱(electrospray ionization-mass spectrometry,ESI-MS)法中有不同的特征碎片,可根据碎片离子特征和裂解规律鉴定其所含的化学成分[11]。目前,中药的生物转化大多将中药中的某一特定有效成分提取出来,经生物转化后,寻找新的化合物[3],并通过药理筛选来确定对新化合物的转化是否有益。而中药往往含有多种成分或组分,这种研究思路不适于一些靠复合成分起作用的中药,也不利于将中药中的一些无活性的前体转化后形成活性成分,对中药多成分或某一类组分的生物转化研究能更真实反映中药的作用机制[12]。
本研究以淫羊藿为研究对象,以植物乳杆菌为发酵菌株,考察淫羊藿发酵过程中1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和羟基自由基清除能力及多酚、黄酮、多糖含量的变化,采用UPLC-Q-TOF-MS法研究淫羊藿灭菌前后及发酵过程中主要活性成分的变化,以期在更深层次上阐明生物转化在中药发挥药效过程中的作用,为制定合理的生物转化工艺和质量标准提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
植物乳杆菌(Lactobacillus plantarum)GIM1.191:广东省微生物菌种保藏中心;淫羊藿(Epimedium brevicornu Maxim.)(批号:20211024):洛阳医药城。
1.1.2 试剂
1,1-二苯基-2-三硝基苯肼(DPPH):上海思域化工科技有限公司;芦丁、朝藿定A1、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ、去水淫羊藿素、8-异戊烯基山柰酚标准品(纯度均>98%):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
X500R液质联用仪(配有sciex os数据处理软件和质谱自动校准调谐系统(calibrant delivery system,CDS)):美国AB sciex公司;PE Victor Nivo多功能酶标仪:帕金埃尔默企业管理有限公司;3-18KS高速冷冻离心机:德国Sigma公司;TDZ5-WS大容量离心机:湖南湘仪实验室仪器开发有限公司;JP300G超声波提取、萃取机组:武汉嘉鹏电子有限公司;FMS超低温超微粒粉碎机:台湾弘荃机械企业有限公司;SPX-250BSH-Ⅱ生化培养箱:上海新苗医疗器械制造有限公司;ALX-2000W 离心过滤器:北京金鼐科技发展有限公司;F-7000荧光分光光度计:日立科学仪器(北京)有限公司。
1.3 方法
1.3.1 发酵培养基的制备
将淫羊藿于60 ℃干燥箱中烘干至恒质量,用实验室小型粉碎机粉碎过120目筛,按照料液比1∶8(g∶mL)添加体积分数70%的乙醇,置于超声波提取装置中超声(超声功率400 W,超声频率20 kHz,温度40 ℃,转速20 r/min)提取40 min后放入离心过滤器中过滤,离心(4 500 r/min、5 min),提取2次,合并2次滤液,将过滤后的滤液放入40 ℃恒温水浴锅中,蒸发至无醇味,按照1∶30(g∶mL)的比例添加蒸馏水稀释作为发酵培养基,pH值自然,于121 ℃高压灭菌15 min。
1.3.2 植物乳杆菌种子液的制备
将植物乳杆菌接入MRS固体培养基中,在34 ℃培养箱培养24 h,挑取单菌落在固体培养基上划线,连续活化2次后,挑取单菌落接种于MRS液体培养基,置于34 ℃培养箱培养18 h,使最终植物乳杆菌浓度为1×106 CFU/mL,即为植物乳杆菌三代种子液。
1.3.3 淫羊藿发酵液的制备
以10%的比例接种植物乳杆菌种子液至灭菌后的发酵培养基,装液量为200 mL/250 mL,在34 ℃培养箱静置培养61 h,分别在灭菌前、灭菌后以及不同发酵时间点(7 h、13 h、24 h、37 h、47 h、61 h)进行取样,取样后将发酵液离心(5 000 r/min、5 min)取上清液。
1.3.4 分析方法
(1)理化指标的测定
总黄酮含量测定:参照吕亭亭等[13]的方法,在波长510 nm处用酶标仪分别测定不同浓度芦丁标准品的吸光度值,以芦丁质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,绘制芦丁标准工作曲线,获得芦丁标准曲线回归方程为Y=0.131 6X+0.002 4(相关系数R2=0.999),根据标准曲线回归方程计算总黄酮含量。
总多酚含量的测定:参照王海坤等[14]的方法,于波长770 nm处测定没食子酸吸光度值,以没食子酸质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,绘制没食子酸标准工作曲线,获得没食子酸标准曲线回归方程为Y=0.130 9X+0.075 4(相关系数R2=0.998 9),根据标准曲线回归方程计算多酚含量。
多糖含量的测定:参照牛晓方等[15]的方法,在波长490nm处测定葡萄糖吸光度值,以葡萄糖质量浓度(X)为横坐标,以吸光度值(Y)为纵坐标,绘制葡萄糖标准工作曲线,获得葡萄糖标准曲线回归方程为Y=8.161X+0.024(相关系数R2=0.977),根据标准曲线回归方程计算多糖含量。
(2)抗氧化性能的测定
DPPH自由基清除率参照张岩松等[16]的方法进行测定,其计算公式如下:
式中:A0为空白组吸光度值;A为样品组吸光度值。
羟基自由基清除率参照白建华等[17]的方法进行测定,其计算公式如下:
式中:A0为空白组(缓冲液替代样品)吸光度值;Ax为样品组吸光度值;Ax0为样品对照组(缓冲液替代H2O2溶液)吸光度值。
1.3.5 淫羊藿活性成分的质谱条件
淫羊藿活性成分的检测采用超高效液相色谱-串联四极杆飞行时间质谱法进行分析鉴定。
超高效液相色谱条件:Agilent eclipse plus C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相为0.01%甲酸水溶液(A)-0.01%甲酸乙腈(B),梯度洗脱(0~3 min,5%B;3~63 min,5%~95%B;63~68 min,95%B;68~69 min,95%~5%B;69~73 min,5%B);流速0.3 mL/min;柱温30 ℃;进样量3 μL。
质谱条件:化合物扫描范围m/z 50~1 500 Da;离子化温度(temperature,TEM):500 ℃;雾化气(GS1):50 psi;辅助加热气(GS2):50 psi;气帘气(curtain gas,CUR):30 psi;去簇电压(declustering potential,DP):80 V;碰撞能量(collision energy,CE):7 eV;正、负离子模式下喷雾电压(ion spray voltage floating,ISVF)分别为5 500 V和-4 500 V。采用信息关联采集;子离子扫描模式的参数设置如下:分子质量扫描范围50~1 000 m/z,碰撞能量(CE):(35±15)eV;其他主要参数同TOF-MS扫描模式,采用CDS对分子质量准确度进行自动校准。
1.3.6 淫羊藿化学成分的鉴定
查阅国内外淫羊藿及其同科属植物化学成分研究相关文献[18-22],收集整理了淫羊藿中化学成分信息,建立包括化合物中文名、英文名称、结构式、分子式、精确相对分子质量以及特征碎片的淫羊藿化学成分文献信息。通过分析化学成分的质谱信息,利用SCIEX公司的Sciex os分析软件,采用质量亏损过滤、中性丢失、产物离子过滤方法[23-25]提取色谱峰和对应的1级和2级质谱图,与部分对照品和整理的化学成分文献信息比对,根据准分子离子峰精确质量数,同位素峰,确定化合物分子式,然后结合软件自带谱库、二级质谱碎片与对照品裂解规律进行比对或参照文献,鉴定和推测出淫羊藿化学成分,利用Sciex os软件对淫羊藿中化合物的峰面积进行积分,以色谱峰面积的大小来表示各化合物的相对含量。
1.3.7 数据处理
试验重复3次,结果以“平均值±标准差”表示。采用SPSS26.0软件进行显著性分析,显著水平为P<0.05。
2 结果与分析
2.1 淫羊藿发酵过程中抗氧化活性的变化
自由基是生物生命活动中的重要物质,生物氧化代谢产生的氧自由基中以羟基自由基的氧化作用最强,它可通过电子转移、夺取氢原子和羟基化反应攻击脂质、蛋白质和核酸等生物分子造成机体损伤,活性成分对DPPH自由基和羟基自由基清除能力的强弱,能直观反映其抗氧化活性的能力[26]。淫羊藿发酵过程中对DPPH自由基和羟基自由基清除率的变化见图1。
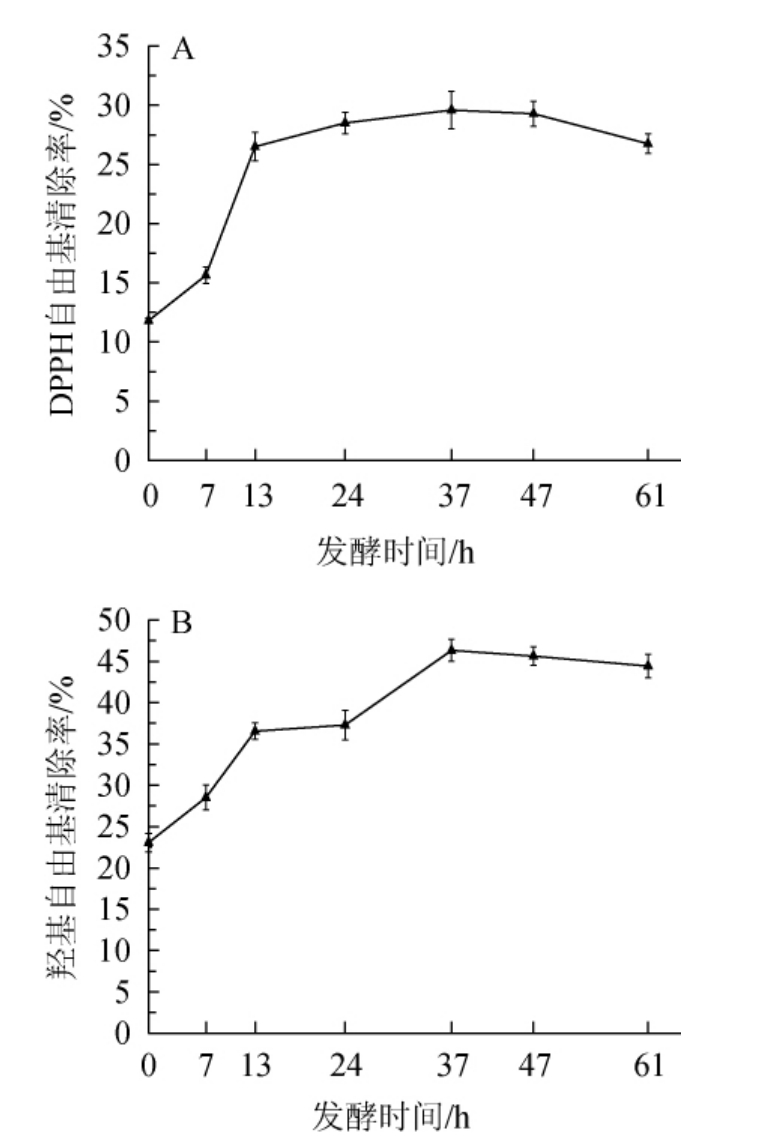
图1 淫羊藿发酵过程中DPPH自由基(A)和羟基自由基(B)清除率的变化
Fig.1 Changes of DPPH radical (A) and hydroxyl radical (B)scavenging rates during Epimedium fermentation process
由图1A和图1B可知,随着发酵的进行,在0~37 h内,DPPH自由基清除率和羟基自由基清除率均呈现增加的趋势;当发酵时间为37 h时,DPPH自由基清除率、羟基自由基清除率均达到最大值,分别为29.59%、46.33%;发酵进行37 h后,两者均呈缓慢下降的趋势。
2.2 淫羊藿发酵过程中总黄酮、多酚、多糖含量的变化
淫羊藿发酵过程中对总黄酮、多酚、多糖含量的变化见图2。
由图2A可知,在发酵0~13 h,总黄酮含量呈快速增加的趋势;当发酵时间>13 h时,总黄酮含量整体呈现下降后增加的趋势;当发酵时间为37 h时,总黄酮含量达到最大值,为11.90 mg/L;发酵时间>37 h后,总黄酮含量变化趋于平缓。由图2B可知,在发酵0~13 h,多酚含量呈快速增加的趋势;当发酵时间>13 h时,多酚含量整体呈先增加后下降的趋势,当发酵时间为24 h时,多酚含量达到最大值,为1.56 mg/L;发酵时间>24 h后,多酚含量变化趋于平缓。由图2C可知,在发酵0~13 h,多糖含量呈快速增加的趋势;当发酵时间>13 h时,多糖含量整体呈先增加后下降的趋势,当发酵时间为24 h时,多糖含量达到最大值,为0.18 g/L;当发酵时间>37 h时,多糖含量逐渐下降。结合发酵过程中DPPH自由基和羟自由基清除率的变化(图1)可知,植物乳杆菌对淫羊藿的发酵时间控制为37 h为宜,此时DPPH自由基清除率、羟自由基清除率、总黄酮、多酚、多糖含量分别为29.59%、46.33%、11.90 mg/L、1.51 mg/L、0.18 g/L。发酵过程中,多糖、多酚、黄酮含量和自由基清除率的变化具有明显相关性,这和杨娟等[27]的实验结果类似,植物乳杆菌利用淫羊藿作为发酵的药性基质,植物乳杆菌能产生淀粉酶,葡萄糖苷酶等丰富的酶系,能有效破除植物类中药细胞壁和果胶类物质形成的物理屏障,使有效活性成分溶出,且可以打断β糖苷键,将淫羊藿中含有的大量多糖苷转化为相应的低糖苷或苷元,将酚酸转化为小分子物质[9],从而引起总黄酮和总多酚含量的升高,多糖含量的升高可能更多的来源于植物乳杆菌对淫羊藿糖苷类物质的分解,转化为胞外多糖或自身多糖贮存[10]。在发酵后期,多糖、多酚、黄酮等物质的含量下降,其原因可能是,其营养物质消耗殆尽,植物乳杆菌更将多糖、多酚、黄酮作为能源物质消耗[28]。
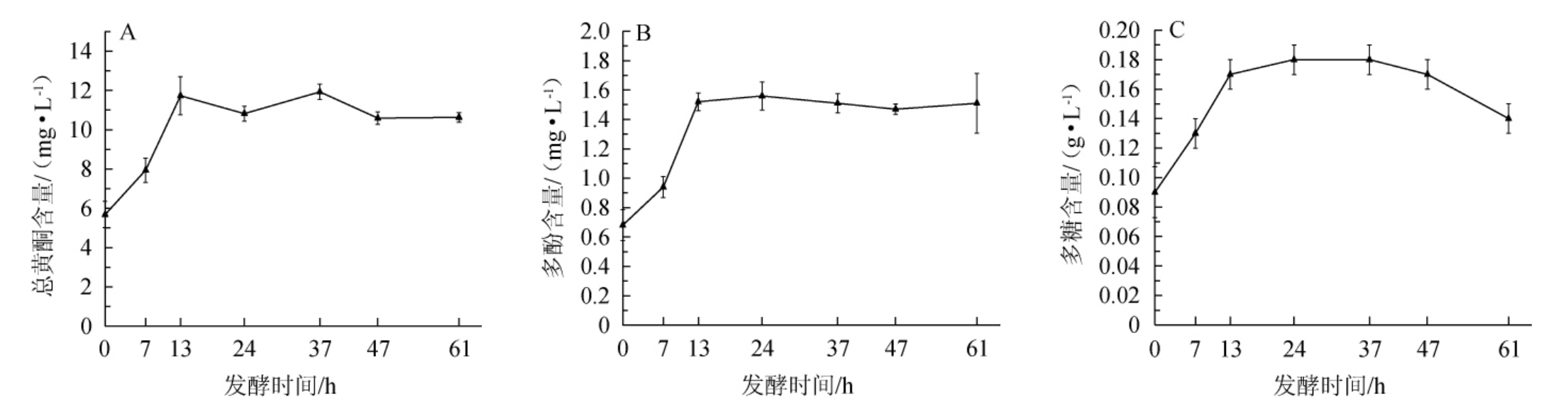
图2 淫羊藿发酵过程中总黄酮(A)、多酚(B)、多糖(C)含量的影响
Fig.2 Changes of total flavonoids(A),polyphenols(B) and polysaccharides(C) during Epimedium fermentation process
2.3 淫羊藿活性成分的UPLC/Q-TOF/MS分析结果
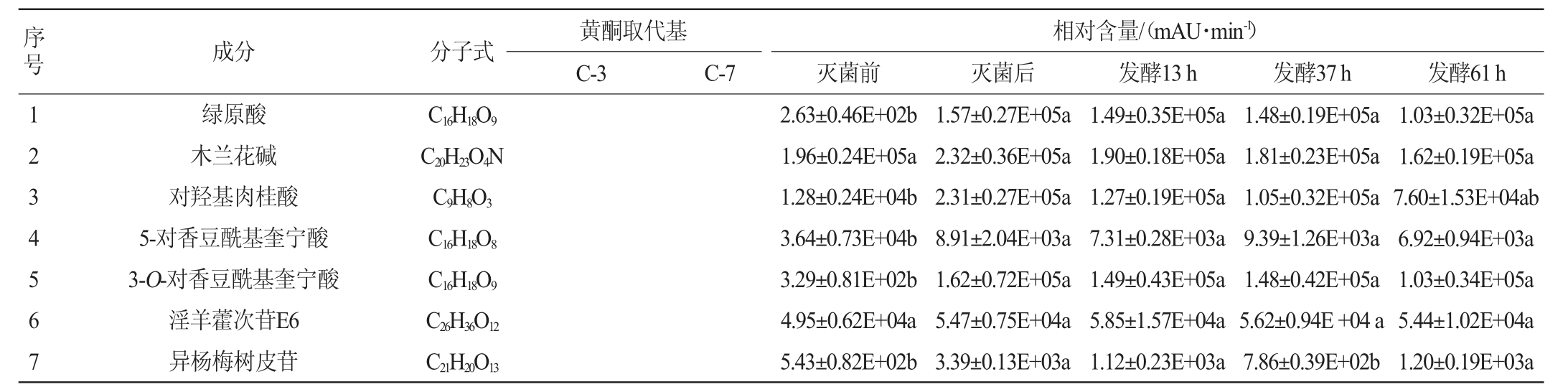
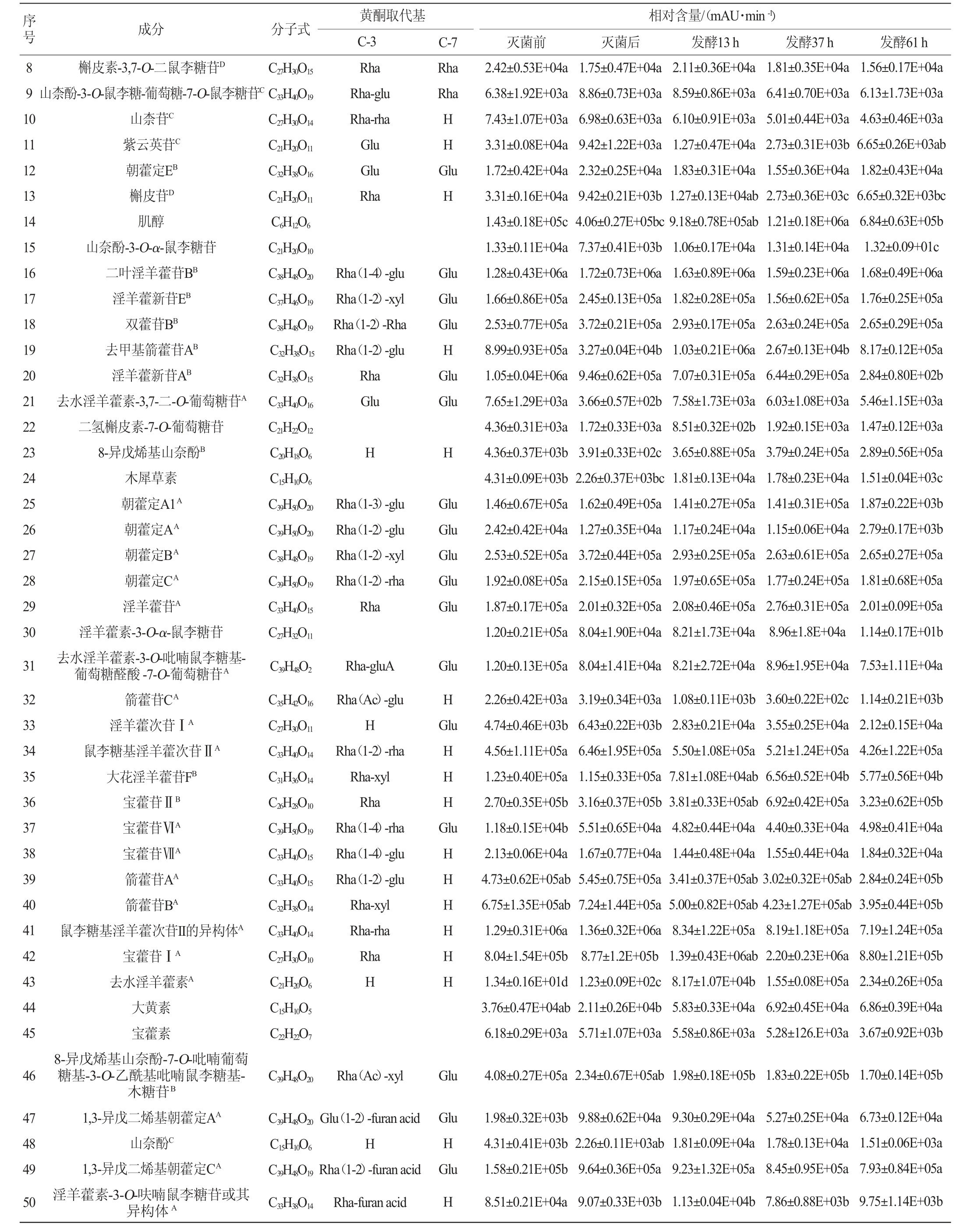
淫羊藿化合物的UPLC/Q-TOF/MS分析结果见表1。由表1可知,利用UPLC-Q-TOF-MS共鉴定灭菌前、灭菌后及发酵13 h、37 h、61 h淫羊藿发酵液中含有57种化合物,其中,黄酮类成分51种,酚酸类成分4种,其他成分2种。黄酮类物质主要以黄酮苷的形式存在,其中,以去水淫羊藿素(以A表示)为苷元的成分有26种,以8-异戊烯基山奈酚(以B表示)为苷元的成分有10种,其他黄酮类成分15种,主要特征活性成分为以去水淫羊藿素(别名anhydroicaritin或8-异戊烯基山奈素)、8-异戊烯基山奈酚为苷元的具异戊烯基取代的黄酮,4种苷元结构如下所示。糖基取代发生在C-3位或C-7位,以多糖苷、二糖苷、单糖苷以及部分醛酸的形式存在[20-23]。
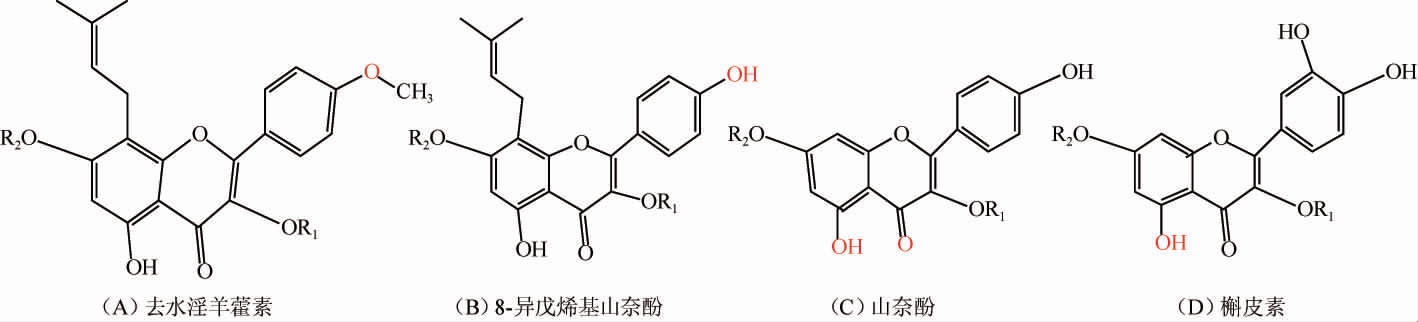
表1 淫羊藿黄酮苷类化合物的UPLC-Q-TOF-MS分析结果
Table 1 Results of Epimedium flavonoid glycosides compound analyzed by UPLC-Q-TOF-MS
续表
续表
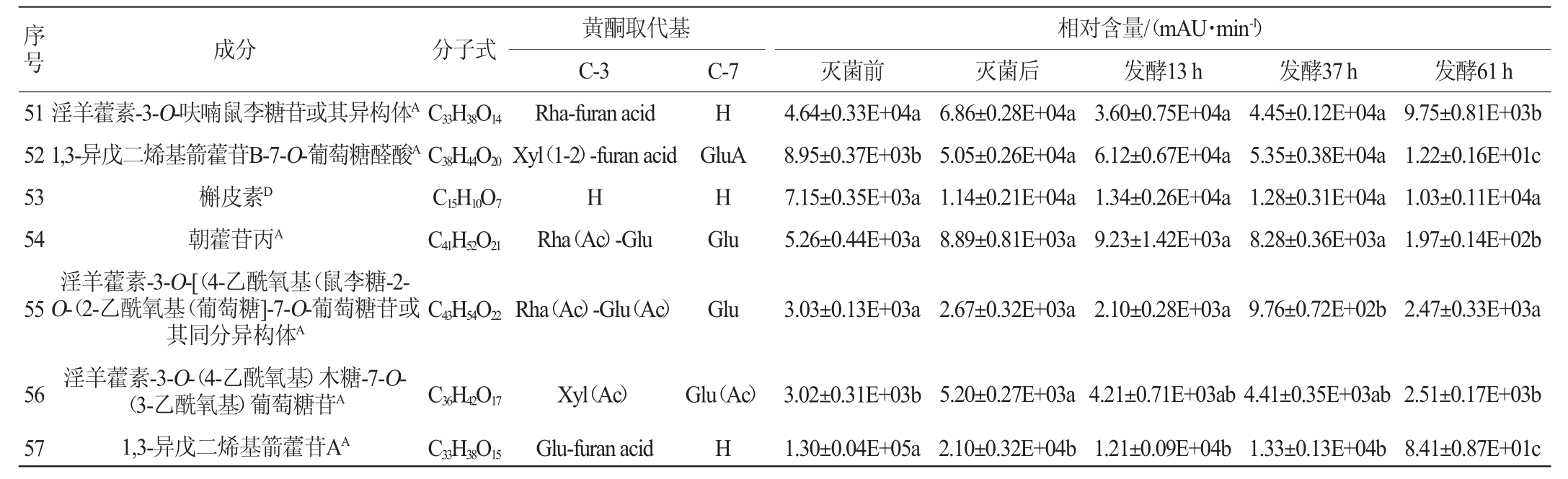
注:非上标大写字母代表不同化合物的名称,上标大写字母表示不同苷元;A表示苷元为脱水淫羊藿素,B表示苷元为8-异戊烯基山奈酚,C表示苷元为山奈酚,D表示苷元为槲皮素;小写字母不同表示差异显著(P<0.05)。
2.3.1 淫羊藿发酵过程中黄酮成分的变化
由表1可知,与灭菌后相比,植物乳杆菌发酵淫羊藿后,多糖苷中山柰酚-3-O-鼠李糖-葡萄糖-7-O-鼠李糖苷、淫羊藿新苷E、diphylloside B、朝藿定A1、朝藿定A、朝藿定B、朝藿定C、去水淫羊藿素-3-O-吡喃鼠李糖基-葡萄糖醛酸-7-O-葡萄糖苷、宝藿苷Ⅵ、8-异戊烯基山奈酚-7-O-吡喃葡萄糖基-3-O-乙酰基吡喃鼠李糖基-木糖苷、1,3-异戊二烯基朝藿定A、1,3-异戊二烯基朝藿定C、1,3-异戊二烯基箭藿苷B-7-O-葡萄糖醛酸、朝藿苷丙、淫羊藿素-3-O-[(4-乙酰氧基)鼠李糖-2-O-(2-乙酰氧基)葡萄糖]-7-O-葡萄糖苷或其同分异构体发酵61 h后相对含量降低,其中朝藿定A1、朝藿定A、1,3-异戊二烯基箭藿苷B-7-O-葡萄糖醛酸、朝藿苷丙发酵后相对含量显著降低(P<0.05)。二叶淫羊藿苷B发酵61 h后无明显变化。
与灭菌后相比,双糖苷中,槲皮素-3,7-O-二鼠李糖苷、山柰苷、朝藿定E、淫羊藿新苷A、箭藿苷C、鼠李糖基淫羊藿次苷Ⅱ、大花淫羊藿苷F、箭藿苷A、箭藿苷B、鼠李糖基淫羊藿次苷II的异构体、淫羊藿素-3-O-呋喃鼠李糖苷及其异构体、淫羊藿素-3-O-(4-乙酰氧基)木糖-7-O-(3-乙酰氧基)葡萄糖苷、1,3-异戊二烯基箭藿苷A发酵61 h后相对含量降低,其中淫羊藿新苷A、箭藿苷C、大花淫羊藿苷F、箭藿苷A、箭藿苷B、淫羊藿素-3-O-呋喃鼠李糖苷及其异构体、淫羊藿素-3-O-(4-乙酰氧基)木糖-7-O-(3-乙酰氧基)葡萄糖苷、1,3-异戊二烯基箭藿苷A相对含量显著降低(P<0.05);宝藿苷VII先降低再升高,去水淫羊藿素-3-O-吡喃鼠李糖基-呋喃酸或其异构体先升高再降低,但未达到显著水平(P>0.05);去甲基箭藿苷A、去水淫羊藿素-3,7-二-O-葡萄糖苷发酵后相对含量显著升高(P<0.05),淫羊藿苷无明显变化。
单糖苷中,淫羊藿次苷Ⅰ、宝藿苷Ⅱ发酵后先增加后减少,其最大值出现在发酵37 h,且最大值和灭菌后相对含量相比均具有显著性差异(P<0.05);紫云英苷、槲皮苷发酵后含量先增加后降低,且最低值和灭菌前相比有显著差异(P<0.05)。在淫羊藿黄酮苷元中,去水淫羊藿素随发酵时间增加而增加,8-异戊烯基山奈酚、大黄素、槲皮素、山奈酚、木犀草素发酵过程中先增加后减少,8-异戊烯基山奈酚、大黄素最大值出现在发酵37 h,槲皮素、山奈酚、木犀草素最大值出现在发酵后13 h,木犀草素最大值和发酵前相对含量相比有显著差异(P<0.05)。
总体上来看,植物乳酸菌对淫羊藿的发酵呈现多糖苷、双糖苷向单糖苷和苷元转化的规律。低糖苷和苷元从化学结构上增加了活性的OH级,减少了空间位阻,具有更大的抗氧化活性,这和国内外多位学者的研究是相符的[29],本次研究DPPH自由基、羟基自由基清除率的增加以及总黄酮含量的提高也再一次印证了这个结果。
2.3.2 高温灭菌对淫羊藿黄酮成分的影响
由表1可知,灭菌后,次糖苷淫羊藿苷和宝藿苷I相对含量升高;多糖苷中,朝藿定A、淫羊藿素-3-O-[(4-乙酰氧基)鼠李糖-2-O-(2-乙酰氧基)葡萄糖]-7-O-葡萄糖苷等多糖苷的相对含量降低,但是大部分多糖苷,如朝藿定A1、朝藿定B、朝藿定C、宝藿苷Ⅵ、1,3-异戊二烯基朝藿定等的相对含量不仅没有降低而且较高温灭菌前均有所升高。孙娥等[30]的研究表明,将淫羊藿油炙(油炙温度160~170 ℃,受热时间5~7 min)可以使淫羊藿黄酮脱去糖基,由多糖苷转化为次糖苷(多糖苷朝藿定A、B、C含量降低,淫羊藿苷、宝藿苷I的含量增高),这可能和实验中采用的溶剂、温度、湿度、压力等条件不同所致。
另外,淫羊藿3种酚酸中,绿原酸、对羟基肉桂酸、3-O-对香豆酰基奎宁酸高温灭菌后含量也显著升高。灭菌的高温高压条件下淫羊藿糖苷类成分可能同时发生两种变化,一种是高温、高压条件下的化学变化,多糖苷和低糖苷水解,分别转化为低糖苷或苷元,另外一种是灭菌的高温高压的物理作用和酶的“破壁作用”,破坏了植物类中药细胞壁和果胶类物质形成的物理屏障,使得活性成分溶出增加所致[31],这从灭菌后多糖、黄酮、多酚含量和羟基自由基、DPPH自由基清除率增加的实验结果中也得到了验证。
3 结论
淫羊藿经乳酸菌发酵后,DPPH自由基清除率、羟基自由基清除率、总黄酮、多酚、多糖含量均显著提高,发酵后的淫羊藿具有更高的抗氧化功效,最适的发酵时间为厌氧发酵37 h。从淫羊藿经植物乳杆菌发酵前后组分共鉴定出57种,其中,黄酮类51种,酚酸类4种、其他类2种。植物乳杆菌以淫羊藿作为药性基质进行生物转化总体上显著提高了酚酸类、黄酮单糖苷和黄酮苷元的含量,降低了淫羊藿黄酮多级糖苷和二级糖苷的含量。单糖苷和苷元含量的提高可能来自于黄酮多糖苷和二糖苷的生物转化,植物乳酸菌利用淫羊藿中的营养成分和转化糖苷后的糖类作为自身生长的物质基础,多糖含量有了明显提高,多糖和酚酸含量的提高可能分别来自于植物乳杆菌的合成代谢和对植物细胞的破壁作用。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020:340-345.
[2]ZHANG D W,ZHANG J C,FONG C C,et al.Herba epimedii flavonoids suppress osteoclastic differentiation and bone resorption by inducing G2M arrest and apoptosis[J].Biochimie,2012,94(12):2514-2522.
[3]富盈昕,刘春莹,郭美娟,等.酶转化在淫羊藿苷提取中的应用[J].食品工业科技,2017,38(8):167-171.
[4]孙欣光,周茗,马百平,等.淫羊藿和巫山淫羊藿药材经加热处理淫羊藿苷含量变化研究[J].中国中药杂志,2019,44(9):1857-1861.
[5]金晓勇,贾晓斌,孙娥,等.炙淫羊藿炮制过程中5种黄酮类成分变化规律研究[J].中国中药杂志,2009,34(21):2738-2742.
[6]蒋艳荣,张振海,孙娥,等.酶解淫羊藿总黄酮制备宝藿苷I[J].中国医院药学杂志,2013,33(4):260-263.
[7]贾东升.淫羊藿苷元的酶法制各及其脂质体研究[D].镇江:江苏大学,2010.
[8]谷春秀,于燕,王璐,等.黑曲霉固态发酵对淫羊藿苷含量的影响及检测[J].生命科学仪器,2012,10(2):29-32.
[9]MARTA M,MÉDICI M,VALDEZ G F,et al.Soybean-based functional food with vitamin B12-producing lactic acid bacteria[J]. J Funct Foods,2012,4(4):831-836.
[10] POLOMSKA X,WOJTATOWICZ M,ZAROWSKA B,et al.Freezedrying preservation of yeast adjunct cultures for cheese production[J].Pol J Food Nutr Sci,2012,62(3):143-150.
[11]王媛,袁磊,李遇伯,等.基于UPLC-Q-TOF-MS的淫羊藿化学成分分析[J].中草药,2017,48(13):2625-2631.
[12]吴雪韦.朝鲜淫羊藿的化学成分及生物活性研究[D].济南:山东大学,2018.
[13]吕亭亭,杨志华,陶娟,等.泡桐花总黄酮的提取工艺优化及抗氧化活性[J].中国酿造,2021,40(1):197-202.
[14]王海坤,张存劳,陈程.Folin-Ciocalteu比色法测定牡丹籽饼、牡丹叶、牡丹籽种壳中总多酚的含量[J].应用化工,2018,47(8):1794-1796,1802.
[15]牛晓方,高一军,怀宝刚,等.硫酸-苯酚法测定六种牡丹叶中总多糖的含量[J].山东农业工程学院学报,2021,38(4):33-35.
[16]张岩松,刘向慧,牛江秀,等.护肤功效原料牡丹花和牡丹叶提取物的提取工艺和性能研究[J].精细与专用化学品,2020,28(12):27-34.
[17]白建华,程琳,武宇芳,等.苯甲酸-Fenton体系荧光法测定中草药抗氧化活性[J].分析科学学报,2011,27(5):675-677.
[18]ZHAO H Y,SUN J H,FAN M X,et al.Analysis of phenolic compounds in Epimedium plants using liquid chromatography coupled with electrospray ionization mass spectrometry[J].J Chromatogr A,2008,1190(12):157-161.
[19]于雪娥,秦建平,李家春,等.基于UPLC/Q-TOF-MS/MS技术快速分析淫羊藿总黄酮胶囊中的化学成分[J].中国中药杂志,2016,41(24):4587-4597.
[20]李明雨,孙娥,徐凤娟,等.基于UPLC-Q/TOF-MS分析淫羊藿炮制前后黄酮组分的变化规律[J].中草药,2020,51(11):2900-2907.
[21]马文娟,姚广哲,贾琪,等.UPLC-Q-TOF-MS/MS法定性分析淫羊藿中的化学成分[J].中药材,2019,42(7):1554-1559
[22]周茗.基于UHPLC-Q-TOF/MS技术的淫羊藿和山楂叶质量研究[D].太原:山西医科大学,2020.
[23]WANG Y Q,GUO Z M,JIN Y,et al.Identification of prenyl flavonoid glycosides and phenolic acids in Epimedium koreanum Nakai by Q-TOFMS combined with selective enrichment on"click oligo(ethylene glycol)"column[J].J Pharm Biomed Anal,2010,51(3):606-616.
[24]杨宗林,赵静.UPLC-Q-TOF-MS定性定量分析淫羊藿中淫羊藿苷类似物[J].质谱学报,2017,38(1):19-29.
[25]刘丽萍,徐晓芳,孙东东,等.淫羊藿水提部位化学成分的HPLC-ESI-Q-TOF-MS分析[J].中国实验方剂学杂志,2014,20(19):112-116.
[26]李化,于艳秋,杨滨.黄酮化合物与Ⅱ络合反应的动力学研究[J].中国实验方剂学杂志,2010,16(17):99-102.
[27]杨娟,张华峰,牛丽丽,等.不同地区商品淫羊藿中朝藿定、淫羊藿苷、总黄酮含量变异及抗氧化活性分析[J].食品工业科技,2014,35(16):96-100.
[28]吴领风,韦双,陈莹,等.低聚果糖对植物乳杆菌A33发酵酸角汁的影响[J].食品科学,2021,42(4):122-129.
[29]李明静,庆伟霞,杨玉霞,等.七种天然黄酮类化合物对超氧阴离子自由基的清除活性[J].化学研究,2006,17(4):73-75.
[30]孙娥,陈彦,贾晓斌,等.基于活性成分转化-肠吸收屏障网络耦联作用的中药炙淫羊藿炮制机理研究[C]//2010中药炮制技术、学术交流暨产业发展高峰论坛论文集.成都:中华中医药学会,2010:186-194.
[31]王凯,任向楠,董捷,等.多指标评价果胶酶对油菜蜂花粉的破壁作用[J].食品与机械,2015,31(6):164-168.