刺梨(Rosa roxbunghii)为一种蔷薇科多年生落叶灌木缫丝花的果实[1],是滋补健身的营养珍果,富含多种氨基酸和维生素C[2],因其含有抗衰老和抗癌物质超氧化歧化酶(superoxide dismutase,SOD),被称为“长寿防癌”的绿色珍果[3]。我国贵州地区刺梨资源尤为丰富,产量全国领先[4-6]。近年来,刺梨特色产业迎来了前所未有的历史发展机遇[6-7]。目前,刺梨产品主要为原汁、饮料、果干、果糕和浸泡酒等,这些产品大多存在附加值偏低的缺点[8]。刺梨果酒历史悠久,早在清道光十三年便有记录[9],目前刺梨果酒多以高度白酒浸泡[10-11]、商用酵母直接酿造[12-13]或用经驯化后的商用酵母酿造[14],但受限于浸泡果酒口感粗糙不够柔和、缺乏刺梨果酒酿造专用酵母,在刺梨果酒酿造过程中未能很好的体现贵州产地刺梨果酒的特色和风格。
酵母是发酵酿制果酒中决定果酒品质优劣的核心要素,优良的刺梨果酒酵母菌应具有发酵速度快、产乙醇率高、耐受性好(耐糖、耐乙醇、耐SO2、耐酸等)、凝聚性好,发酵结束后能使酒快速澄清的特点[15]。目前,针对刺梨果酒酿造专用的产酒精酵母报道较少,基于此,本研究拟从贵州遵义、荔波、六盘水、都匀刺梨种植基地采集刺梨鲜果样品,采用孟加拉红培养基分离纯化、2,3,5-三苯基氯化四氮唑(2,3,5-triphenyte-trazoliumchloride,TTC)培养基初筛产酒精能力强的酵母菌株,结合杜氏小管产气实验和耐受性实验复筛发酵性能优良的酵母菌株,然后采用复筛菌株酿造刺梨果酒,测定果酒理化指标,最后基于26S rDNA基因序列对复筛菌株进行分子生物学鉴定。筛选出适合贵州地区刺梨果酒酿造的产酒精酵母,对改善刺梨果酒特色风味和品质具有重要意义。同时可提升刺梨的附加值,解决刺梨季节性过剩的问题,亦可丰富果酒市场,具有良好的社会效益和经济效益前景。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
成熟新鲜刺梨:采自贵州遵义、荔波、六盘水、都匀刺梨种植基地。
1.1.2 菌株
商业酿酒酵母(Saccharomyces cerevisiae)D524:上海康禧食品饮业有限公司。
1.1.3 培养基
孟加拉红培养基:杭州百思生物技术有限公司;TTC培养基:环凯微生物科技有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:蛋白胨20 g/L、酵母浸粉10 g/L,葡萄糖20 g/L,121 ℃高压蒸汽灭菌15 min。YPD固体培养基中添加琼脂粉20 g/L。
1.1.4 试剂
乙醇(分析纯):南昌华鑫医药化工有限公司;盐酸(分析纯):上海沪试实验室器材股份有限公司;氢氧化钠、酚酞、偏重亚硫酸钾(均为分析纯):北京沃凯生物科技有限公司;无水葡萄糖、琼脂粉(均为生化试剂):常德比克曼生物科技有限公司;酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
RE5RAA高压蒸汽灭菌锅:上海申安医疗器械厂;CV-5200PC分光光度计:上海元析仪器有限公司;BGG-9140A干燥箱:上海一恒科学仪器有限公司;HZQ-C卧式恒温摇床:常州洛基仪器有限公司;DL-CJ-2NDI超净工作台:北京东联哈尔仪器制造有限公司;SHP-250生化培养箱:上海博讯实业有限公司医疗设备厂;DKB24电热恒温水浴锅:上海森信实验仪器有限公司;FA2004W电子天平:上海菁海仪器有限公司。
1.3 方法
1.3.1 刺梨果酒产酒精酵母的富集
将采摘好的刺梨进行榨汁、过滤,所得的刺梨汁与刺梨渣各分装两份进行发酵,一份隔绝空气、一份不隔绝空气。相同条件下自然发酵7 d[16]。
吸取上述样品各5 mL分别放入100 mL YPD液体培养基中,并在28 ℃、220 r/min摇床中富集培养12 h。
1.3.2 刺梨果酒产酒精酵母的分离
在无菌操作条件下,使用梯度稀释法将富集培养好的菌液进行梯度稀释,各取0.1 mL稀释液涂布在孟加拉红琼脂培养基上,在28 ℃的培养箱中倒置培养48 h。观察菌落在孟加拉红琼脂培养基上的颜色形态以及隆起情况,选取明显是酵母菌的菌株,将其进行分离纯化,直到看到单个菌落[17]。
1.3.3 刺梨果酒产酒精酵母的形态观察及产酒精能力筛选
将筛选出的单个酵母菌菌落接种在YPD固体培养基上,于28 ℃培养箱中倒置培养48 h。通过观察酵母菌的形态特征,挑选出典型的酵母菌菌落(表面光滑、湿润、黏稠,质地柔软,容易挑起,大多为乳白或奶油色,并且具有愉悦香气等特征[18])。随后以商业酿酒酵母D254为对照,将其接种于TTC固体培养基,于28 ℃培养箱中静置培养48 h后观察酵母菌的颜色。因为TTC本身是一种显色剂,它能与酵母中的脱氢酶发生呈色反应,通过颜色深浅可以判断酵母中呼吸酶活力的大小,进而判断出酵母菌产酒精能力的高低,产酒精能力强的酵母会显深红色,次之显红色、微红色或不显色[19],所以筛选颜色较深的酵母菌作为初筛菌株,并分别接种到YPD斜面培养基上,在28 ℃培养箱中培养48 h后放入冰箱(4 ℃)保存,用于后续酵母菌的筛选鉴定。
1.3.4 刺梨果酒产酒精酵母发酵性能的测试
(1)杜氏小管发酵测试
将初筛菌株接种于YPD液体培养基中,28 ℃、220 r/min培养12 h活化,制成菌悬液。按照1%(V/V)的接种量接种于含10 mL YPD液体培养基和杜氏小管的试管中[20],于28 ℃培养箱中静置培养,平行实验3次,期间记录各菌株的产气起始时间、凝聚性能、杜氏管内充满气体时间,如有大量白色沉淀形成,表明生长旺盛[21]。将产气时间较快,有絮凝沉淀物,且气泡为杜氏小管2/3的菌株在冰箱中(4 ℃)保藏,作为一级筛选的菌株进行耐受性试验。
(2)耐受性测试
参照文献[22]的方法并做了部分调整,将一级筛选得到的菌株制成菌悬液,按照1%(V/V)的接种量分别接种到不同葡萄糖含量(10%、20%、30%、40%、50%)、乙醇含量(10%vol、12%vol、14%vol、16%vol、18%vol)、SO2含量(100 mg/L、150 mg/L、200 mg/L和300 mg/L)以及酸度(pH=2.0)的YPD液体培养基试管中,于28 ℃培养箱静置培养24 h,记录酵母菌在24 h内产气情况,每个试验平行重复3次,总结分析菌株的耐受性,筛选出耐高糖含量、低pH值、高乙醇含量、高SO2含量的产酒精酵母菌株作为二级筛选菌株进行酿酒试验。
1.3.5 刺梨果酒产酒精酵母的酿酒实验
在无菌条件下,将二级筛选得出的酵母菌菌株接种于100 mL YPD液体培养基内,在28 ℃、220 r/min的摇床中培养12 h。将过滤后的1 L刺梨汁倒入大烧杯中,使用白砂糖调节刺梨原汁的糖度至20.3°Bx,加入偏重亚硫酸钾0.1 g,随后摇匀分装入容量为200mL的锥形瓶中,并将酵母菌菌液按照5%(V/V)的接种量加入至各锥形瓶中,贴好标签,用橡胶塞塞住瓶口并插上单向排气阀,置于28 ℃培养箱中发酵8 d。
1.3.6 刺梨果酒理化指标测试及感官评价
发酵结束后,取样测定发酵过程中发酵醪的白利糖度、总酸及挥发酸和最终发酵液的酒精度、澄清度,然后对刺梨果酒进行感官评价。根据其理化指标与感官评价,筛选出优良的刺梨产酒酵母菌作为三级筛选菌株。理化指标中总酸度、挥发酸、酒精度测试参考GB/T15038—2006《葡萄酒、果酒通用分析方法》[23];感官评价参考文献[24]并做适当调整,具体评分标准见表1。
表1 刺梨果酒的感官评分标准
Table 1 Sensory evaluation standards of Rosa roxbunghii wine

1.3.7 刺梨果酒产酒酵母的分子生物学鉴定
参照文献[25]对筛选出的优良产酒酵母菌进行26SrDNA序列鉴定,将三级筛选酵母菌株送至北京擎科生物技术有限公司重庆分公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性搜索比对,选取同源性较高的模式菌株的26S rDNA基因序列,采用MEGA6软件中的邻接(neighbor-joining,NJ)法构建菌株系统发育树。
1.3.8 数据处理及分析
采用Excel 2013、SPSS 20.0统计软件处理数据,结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 刺梨果酒产酒精酵母的分离、形态鉴定及产酒精能力筛选结果
刺梨发酵液经孟加拉红培养基梯度稀释分离纯化,然后结合YPD固体培养基观察酵母菌的外观特征以及产酒精酵母特有的香味,共分离筛选出35株疑似酵母菌,菌株编号及TTC显色结果见表2。由表2可知,菌株GL13、GL14、GL141、GL15、GP21、GP23、GP24、GP25、GD33、GD331、GZ431与商业酿酒酵母D254在TTC培养基上的颜色较深,将其作为初级筛选菌株。
表2 2,3,5-三苯基氯化四氮唑培养基筛选产酒酵母结果
Table 2 Screening results of wine-producing yeasts by 2,3,5-triphenyltetrazolium chloride medium
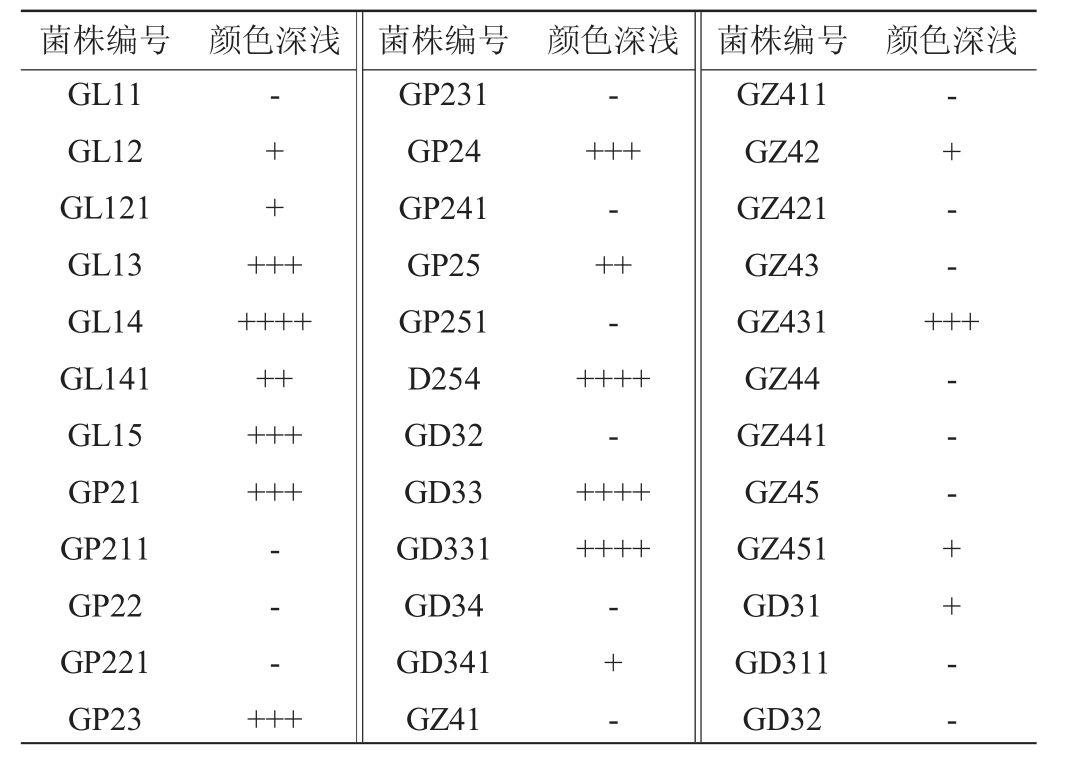
注:“-”代表白色,“+”代表浅红色,“++”代表红色,“+++”代表深红色,“++++”代表暗红色。
2.2 刺梨果酒产酒精酵母发酵性能的测定结果
2.2.1 杜氏小管实验结果
将初级筛选菌株经杜氏管产气试验后,观察各菌株的产气起始时间、杜氏管内充满气时间和菌体凝集性,筛选出起酵快和凝聚性良好菌株,结果见表3。由表3可知,菌株GL13、GL14、GP21、GP23、GP24、GD331、GD33、GZ431与D254都具有较好的凝聚性能,在10 h内凝聚且快速在试管底形成大量白色沉淀,将其作为一级筛选菌株。
表3 杜氏小管产气实验结果
Table 3 Results of Duchenne tube gas production tests

续表
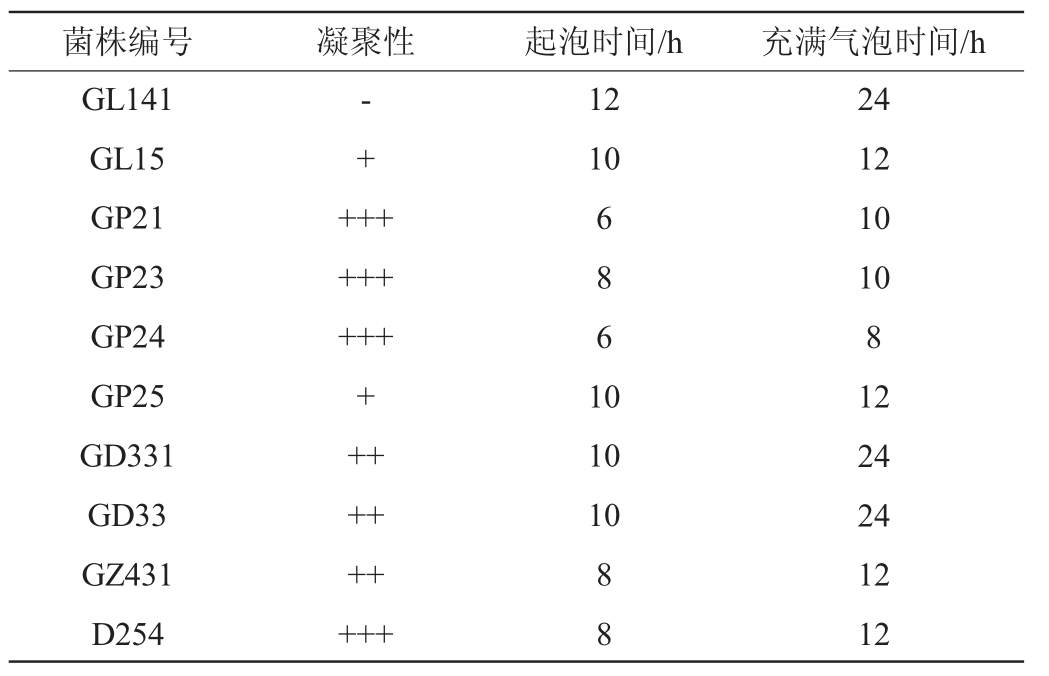
注:“+”表示凝聚性较差;“++”表示凝聚性一般;“+++”表示凝聚性较好;“-”表示还没有开始凝集。
2.2.2 耐受性实验结果
(1)糖耐受性实验结果
一级筛选菌株的糖耐受性试验结果见表4。由表4可知,在高糖含量下,只有菌株GL14、GP21、GP24产气受到的抑制最小,能够发酵产气充满杜氏小管。商业酿酒酵母D254在葡萄糖含量为40%时产气受到抑制,其余菌株在不同葡萄糖含量下会产气,但受到不同程度的抑制。
表4 糖耐受性实验结果
Table 4 Results of glucose resistance tests
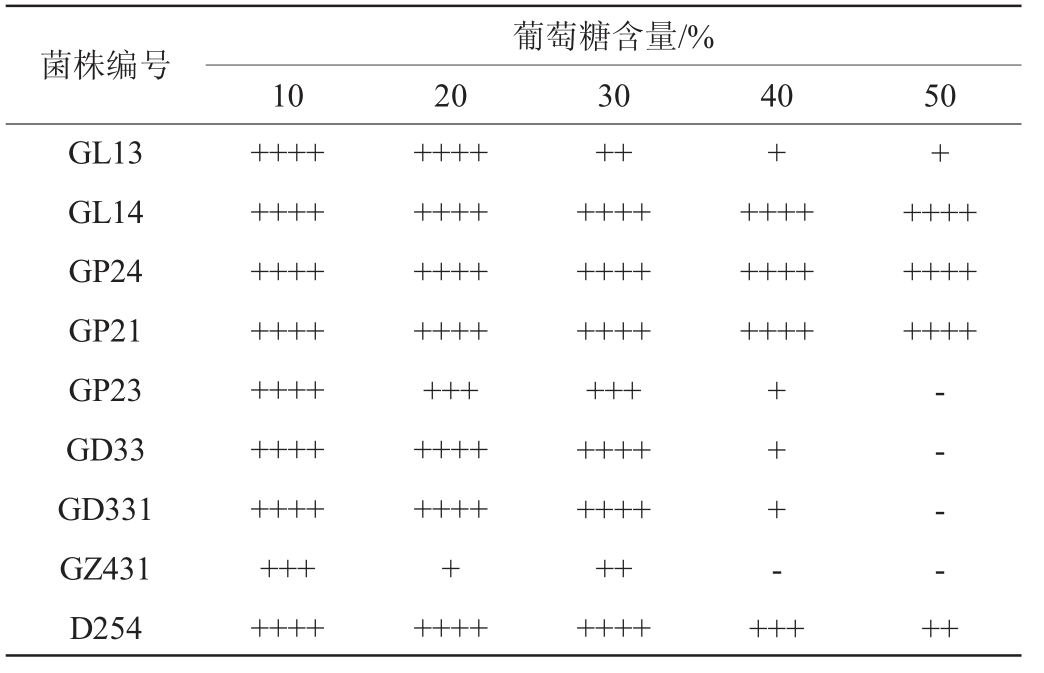
注:“++++”指菌体产气充满杜氏小管;“+++”指菌体产气达到3/4杜氏小管;“++”指菌体产气达到1/2杜氏小管;“+”指菌体达到1/4杜氏小管;“-”指菌体停止产气。下同。
(2)乙醇耐受性实验结果
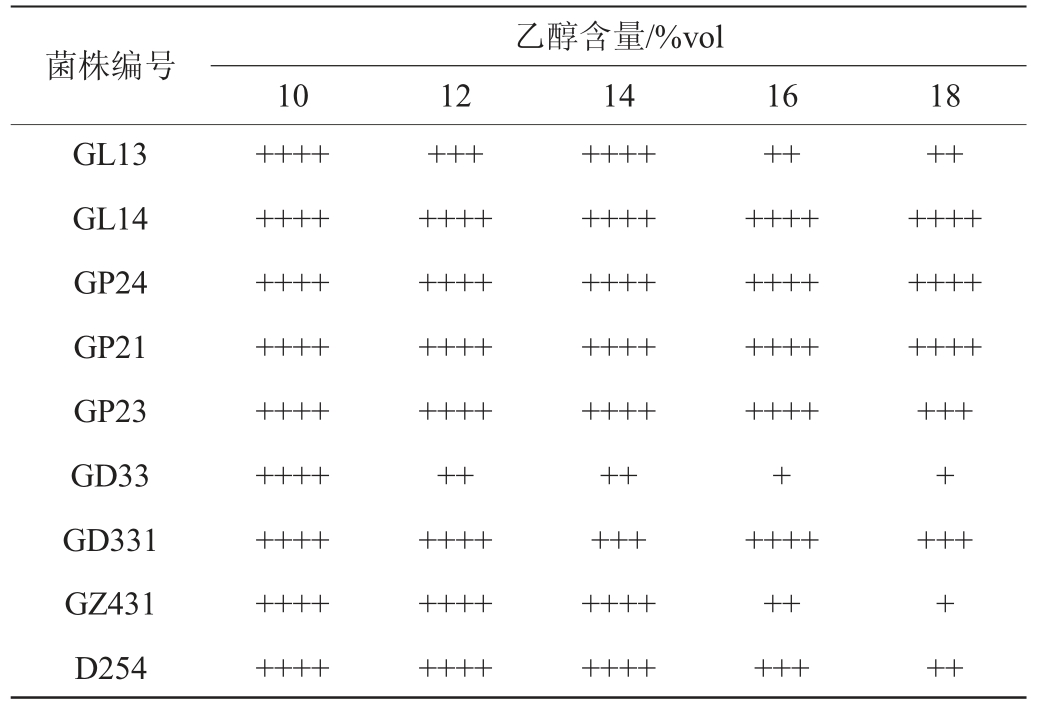
一级筛选菌株的乙醇耐受性试验结果见表5。由表5可知,所有菌株在乙醇含量为10%vol的YPD液体培养基中都能够正常发酵,产气充满杜氏小管。当乙醇含量上升到12%vol时,菌株GL13和GD33发酵产气速度受到抑制;而商业酿酒酵母菌D254在乙醇含量为16%vol时产气才受到抑制;当乙醇含量上升到18%vol时,只有菌株GL14、GP24、GP21的产气没有受到抑制,其余菌株都有着不同程度的抑制。
表5 乙醇耐受性实验结果
Table 5 Results of ethanol resistance tests
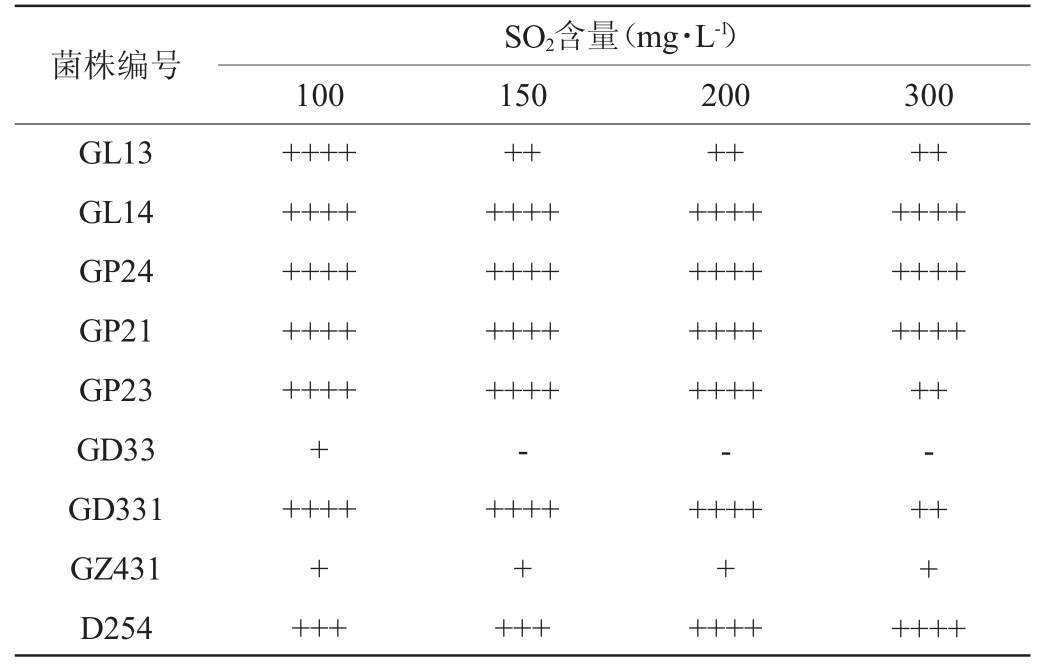
(3)SO2耐受性实验结果
一级筛选菌株的SO2耐受性试验结果见表6。由表6可知,当SO2含量为100 mg/L时,菌株GD33、GZ431的产气受到明显抑制;当SO2含量为150 mg/L时,菌株GD33已经停止产气;当SO2含量为300 mg/L时,菌株GL13、GP23、GD331、GZ431的产气受到抑制,而菌株GL14、GP24、GP21、D254的耐受性较好。
表6 SO2耐受性实验结果
Table 6 Results of SO2 resistance tests
(4)酸耐受性实验结果
一级筛选菌株在pH=2的高酸环境下的耐受性试验结果见表7。由表7可知,在pH=2的高酸性条件下,菌株GD33、GZ431停止产气,菌株GP23产气受到严重的抑制,菌株GL13、GL14、GP21、GD331产气受到不同程度的抑制,而菌株GP24、D254产气受到的抑制最小。
表7 酸(pH=2)耐受性实验结果
Table 7 Results of acid (pH=2) resistance tests

根据8株一级筛选菌株的耐受性实验结果可知,菌株GL14、GP21、GP24在高糖、高乙醇、高SO2含量和高酸特性下受到的抑制影响最小,且在耐高糖、高乙醇含量方面优于商业酿酒酵母D254。因此,将这3株酵母菌作为二级筛选结果。
2.3 刺梨果酒产酒酵母的酿酒实验
2.3.1 理化指标分析
采用菌株GL14、GP21、GP24发酵刺梨汁制备刺梨果酒,检测刺梨果酒的理化指标,结果见表8。由表8可知,澄清度方面,菌株GL14和GP24发酵的刺梨果酒澄清度较高,分别为0.373和0.306;总酸和挥发酸方面,3株酵母发酵的刺梨果酒差异不显著(P>0.05);糖度方面,菌株GP21发酵的刺梨果酒糖度最高(9.3 °Bx),说明其发酵程度相对较低,与其酒精度较低(7.0%vol)相符合;酒精度方面,菌株GL14和GP24发酵的刺梨果酒较高,均为8.0%vol。
表8 不同酵母菌发酵刺梨果酒的理化指标
Table 8 Physical and chemical indicators of Rosa roxbunghii wine fermented by different yeasts
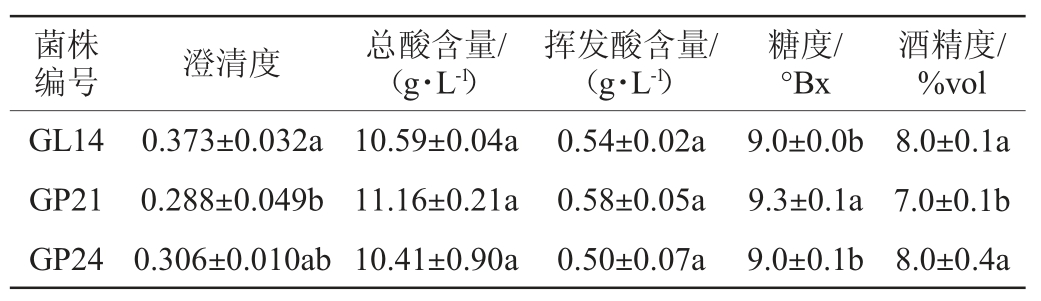
注:同一列不同字母表示差异显著(P<0.05)。下同。
2.3.2 感官评价
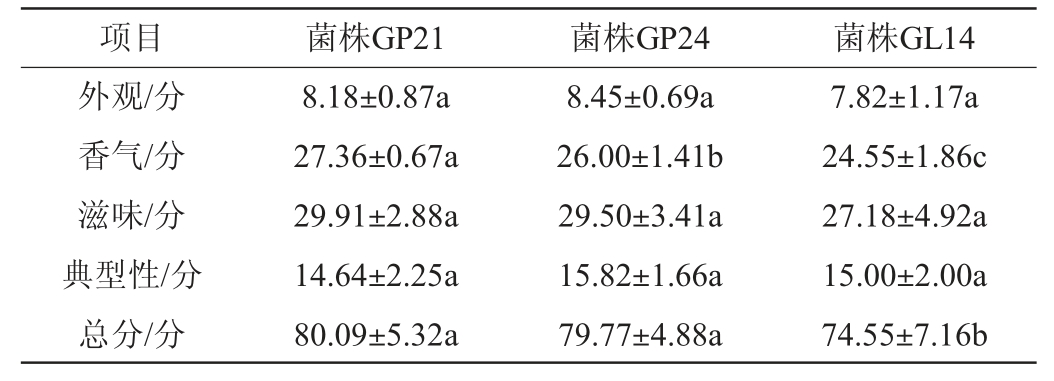
菌株GL14、GP21、GP24发酵刺梨果酒的感官评分见表9。由表9可知,菌株GL14、GP21、GP24发酵刺梨果酒的感官评分分别为74.55分、80.09分、79.77分。就香气而言,菌株GP21发酵刺梨果酒的分数最高,为27.36分;而在外观、滋味和典型性方面,3株菌株发酵刺梨果酒无显著差异(P>0.05);3株酵母菌株发酵刺梨果酒的各项感官指标均未出现明显缺陷,均具有刺梨果酒酿造潜力。
表9 不同酵母发酵刺梨果酒的感官评价结果
Table 9 Sensory evaluation results of Rosa roxbunghii wine fermented by different yeasts
根据菌株GL14、GP21、GP24发酵酿制得到的刺梨果酒的理化指标和感官评价可知,其酒精度符合NY/T 1508—2017《绿色食品 果酒》标准[26]。其中菌株GL14、GP24发酵酿制的刺梨果酒在澄清度及酒精度方面优于菌株GP21;在刺梨果酒的香气上菌株GP21更适合刺梨果酒的酿造。综上,菌株GL14、GP21、GP24具有优质刺梨果酒酿造潜力,将这3株酵母菌作为三级筛选菌株。
2.4 刺梨果酒产酒酵母的分子生物学鉴定结果
将三级筛选酵母菌进行26S rDNA分子生物学鉴定,构建其系统发育树,结果见图1。由图1可知,菌株GP24和GP21与热带假丝酵母(Candida tropicalis)聚于一支,菌株GL14与异常威克汉姆酵母(Wickerhamomyces anomalus)聚于一支,亲缘关系最近。因此,菌株GP21、GP24被鉴定为热带假丝酵母(Candida tropicalis)、菌株GL14被鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus)。
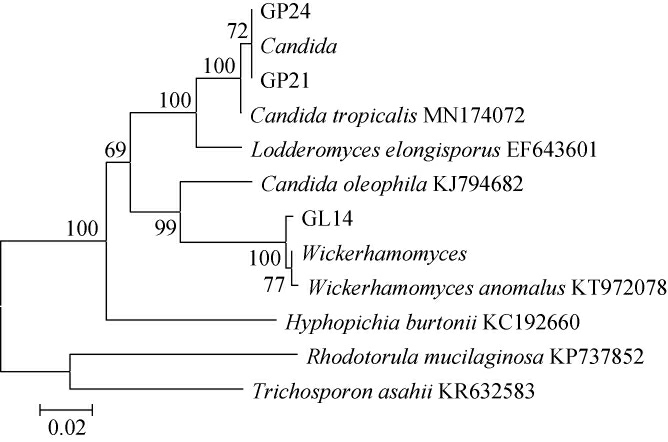
图1 基于26S rDNA基因序列3株酵母菌的系统发育树
Fig.1 Phylogenetic tree of 3 yeasts based on 26S rDNA gene sequences
3 结论
本实验选用贵州遵义、荔波、六盘水、都匀的新鲜刺梨为原料,采用孟加拉红培养基从中分离纯化得到35株酵母菌株,经TTC培养基初筛,结合杜氏管产气实验、耐受性实验复筛得到3株优良产酒精酵母,编号分别为GL14、GP21、GP24,其产气快、凝聚性强,可耐受50%葡萄糖、18%vol乙醇、300 mg/L SO2、pH=2环境。利用这3株菌株发酵酿造刺梨果酒,结果表明,菌株GL14、GP24发酵的刺梨果酒在澄清度及酒精度方面优于菌株GP21,而在刺梨果酒的香气上,菌株GP21发酵的刺梨果酒更优。经分子生物学鉴定,菌株GL14被鉴定为异常威克汉姆酵母(Wickerhamomycesanomalus),菌株GP24和GP21均被鉴定为热带假丝酵母(Candida tropicalis)。本研究为今后选育适合刺梨果酒酿造的酵母菌奠定基础,对未来酿造具有独特风格的刺梨果酒、促进贵州地区的刺梨资源开发利用和产业化生产有十分重要的意义。
[1]CHEN G J,KAN J Q.Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J].Int J Biol Macromol,2018,107(Pt A):166-174.
[2]李东,张小勤,蒋思峡,等.刺梨功能成分及其功能性食品研究进展[J].食品安全质量检测学报,2022,13(17):5730-5738.
[3]史官清,涂兴蜓,李慧君.贵州省刺梨产业优化发展的问题与对策研究[J].中国果树,2021(11):103-108.
[4]杨方红,杨邦祝,魏怡冰,等.贵州刺梨产业发展概述[J].中国食品,2022(14):130-132.
[5]任启鑫.为刺梨产业高质量发展注入动力[N].贵州日报,2019-10-24(006).
[6]陈毓钊.广州王老吉助力贵州刺梨成为“全国的刺梨”[N].贵州日报,2022-03-28(004).
[7]刘明,何欢.我国刺梨产业发展存在的问题及对策[J].乡村科技,2018(33):29-30.
[8]张莉萍,李嗣婷.贵州盘州刺梨产业发展对策浅析[J].广东蚕业,2022,56(4):139-141.
[9]白丽霞.贵州省刺梨产业发展问题与对策研究[J].经济研究导刊,2022(8):34-36.
[10]姚敏.刺梨果酒技术研究[D].贵阳:贵州大学,2015.
[11]宋永民,刘代成.刺梨果酒制作工艺的优化研究[J].山东农业科学,2008(3):109-112.
[12]蔡金腾,郭文升.活性干酵母在不同刺梨原汁发酵液中的产酒度[J].贵州大学学报(农业与生物科学版),2002,21(1):39-43.
[13]谭书明,申世轩,丁筑红.刺梨干型全汁果酒加工技术研究[J].酿酒科技,2006(8):21-23.
[14]王续强.刺梨果酒发酵技术研究[J].中国新技术新产品,2010(8):126.
[15]吴启凤,李红梅,杨胜涵,等.水晶葡萄酿酒酵母菌的分离筛选及酿酒性能研究[J].中国酿造,2019,38(7):65-69.
[16]刘慧.现代食品微生物学[M].北京:中国轻工业出版社,2011:278-288.
[17]张莉,张兰,张玉,等.酿酒酵母菌株的筛选与发酵特性分析[J].河南农业科学,2018,47(6):144-148.
[18]薛军侠.酿酒酵母的筛选鉴定及耐受性初步研究[D].杨凌:西北农林科技大学,2007.
[19]胡晓冰,王振伟.TTC法在筛选西瓜果酒酵母中的应用[J].酿酒科技,2011(2):69-70,73.
[20]王轩,周健,明红梅,等.樱桃果酒酿酒酵母的筛选及香气成分分析[J].食品与发酵工业,2020,46(3):124-130.
[21]李杨,李雷.桑椹果酒酿造酵母的诱变选育研究[J].酿酒,2015,42(4):60-64.
[22]张丽珠,邢亚阁,许青莲,等.川藏高原威代尔冰葡萄中酵母菌的分离、筛选及其耐受性研究[J].中国酿造,2013,32(10):94-97.
[23]中华人民共和国国家质量监督检验检疫总局.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2015.
[24]韦唯,江帆,袁振辉,等.不同发酵方式对刺梨果酒品质的影响[J].食品科技,2020,45(3):105-113.
[25] KORSAK N,TAMINIAU B,LECLERCQ M,et al.Short communication: Evaluation of the microbiota of kefir samples using metagenetic analysis targeting the 16S and 26S ribosomal DNA fragments[J].J Dairy Sci,2015,98(6):3684-3689.
[26]中华人民共和国农业部.NY/T 1508—2017 绿色食品果酒[S].北京:中国农业出版社,2017.