啤酒糟是啤酒酿造过程中最主要的副产物,俗称麦糟,是麦芽和大米、淀粉等辅料经过糊化、糖化、过滤糖化醪后,分离的不溶性残渣物,其主要成分为非淀粉多糖(纤维素、半纤维素,30%~50%)和蛋白质(19%~30%)[1],除此之外,还含有大量的酚类化合物、维生素和矿物质等[2-4]。对于啤酒糟,传统处理方式是堆肥和用于动物饲料[5],既可作为廉价氮源[6],又能为动物提供所必需的含氮营养物质[7],由于湿啤酒糟具有较高含水量益于消化,多用作反刍动物的蛋白饲料[8],但其易酸败变质而产生大量有机酸、杂醇油及毒素等[9],并且含有较多的抗营养因子,直接饲喂将会影响到动物的消化吸收[10],限制了啤酒糟直接作为饲料的可行性。与此同时,饲料市场需求也十分有限,故大多数啤酒糟常作为固体废物直接排放[11],产生巨大的资源浪费,并且啤酒糟营养丰富,若不经一定的处理就排放,易造成微生物富集而污染环境。
啤酒糟具有增值化潜力,经正确处理后可转化为有价值的资源,从而大大降低生产成本,并促进其他产业经济的发展。要实现啤酒糟资源化利用,高效且低成本的降解技术是必须解决的难题,啤酒糟的降解方法主要为微生物发酵法[12]、碱法[13]以及酶法[14]等,其中微生物降解技术操作简单且不污染环境,效果好,成本低,同时还能有效降低啤酒糟粗纤维含量和提高蛋白质含量[15],故微生物发酵法在降解啤酒糟方面具有非常广阔的市场前景,为啤酒糟的降解利用提供了新思路。
现有研究对啤酒糟的降解主要利用真菌微生物,如黑曲霉(Aspergillus niger)[16]和出芽短梗霉(Aureobasidium pullulans)[17],对细菌发酵降解啤酒糟的研究较少。因此,本研究采用传统培养分离方法从啤酒糟中分离细菌微生物,通过形态观察及分子生物学技术对其进行菌种鉴定,再利用其对啤酒糟进行发酵,并与常规真菌对比,探究啤酒糟中细菌对啤酒糟的降解能力,以期为啤酒糟的进一步降解研究提供思路和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
啤酒糟:盐城工学院啤酒中试实验室;出芽短梗霉(Aureobasidium pullulans)、黑曲霉(Aspergillus niger):盐城工学院实验室保藏。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[18]:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌15~20 min。PDA液体培养基中不添加琼脂。
LB培养基[19]:胰蛋白胨10 g,酵母膏5 g,氯化钠10 g,琼脂粉20 g,去离子水1 000 mL,pH 7.0~7.2,121 ℃高压蒸汽灭菌25 min。
啤酒糟培养基[17]:将啤酒糟粉碎过60目筛,取20 g啤酒糟于锥形瓶中,加入50 mL去离子水,121 ℃高压蒸汽灭菌30 min。
1.1.3 化学试剂
酵母膏、胰蛋白胨(均为生化试剂):赛默飞世尔科技公司;琼脂、牛白蛋白(均为生化试剂)、葡萄糖、四水酒石酸钾钠、考马斯亮蓝G-250、三水醋酸钠、乙酸、木糖、木聚糖、十二烷基硫酸钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):国药集团化学试剂有限公司;氯化钠、磷酸、硫酸铵、氢氧化钠、无水亚硫酸钠、无水乙醇、四硼酸钠(均为分析纯):江苏彤晟化学试剂有限公司;硫酸卡那霉素、丙酮(均为分析纯):南京都莱生物技术有限公司;细菌基因组提取试剂盒:北京索莱宝科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
UV-2100紫外可见分光光度计:尤尼科仪器有限公司;HWS-26数显恒温水浴锅、LRH-500F低温培养箱、THZ-300C恒温培养摇床:上海一恒科学仪器有限公司;H1850R台式高速冷冻离心机:湖南湘仪实验仪器开发有限公司;SW-CJ-1D超净工作台:江苏通净净化设备有限公司;YXQ-50A立式全自动高压灭菌器:上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 啤酒糟细菌微生物的分离纯化
将啤酒糟粉碎,取10 g啤酒糟于已灭菌的锥形瓶中,加入90 mL的无菌水,28 ℃、150 r/min摇床培养30 min后,取适量发酵液进行梯度稀释,接种于LB培养基,于37 ℃条件下进行培养,分离并纯化单菌落,保存。
1.3.2 菌种鉴定
形态观察:将分离纯化得到的细菌接种于LB固体培养基,37 ℃培养12~14 h,观察菌落形态特点,保存菌落形态具有显著差异的单菌落。
分子生物学鉴定:采用相应的基因组提取试剂盒对细菌单菌落的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取,以其为模板,采用引物对27F(5'-AGAGTTTGATCCTGGCTCAG-3')/1492R(5'-TACGACTTAACCCCAATCGC-3')对细菌的16S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,PCR扩增体系:2×Taq PCR Master Mix 12.5 μL、上、下游引物各1 μL、DNA模板0.5 μL、双蒸水(ddH2O)10 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性1 min,55~58 ℃复性1 min,72 ℃延伸90 s,30个循环;最后72 ℃延伸10 min。采用1%琼脂糖凝胶电泳检测PCR扩增产物,委托通用生物(安徽)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)对比,根据相似度对菌株进行鉴定。
1.3.3 啤酒糟发酵
在PDA斜面培养基上分别接种黑曲霉和出芽短梗霉,于恒温培养箱中28 ℃培养7 d,待长满斜面后,将菌种接入PDA液态培养基中,在28 ℃、180 r/min条件下摇床培养3 d,即为真菌种子液。从LB固体培养基上挑取分离得到的细菌分别接入LB液体培养基,在37 ℃、180 r/min条件下摇床培养8 h,即为细菌种子液。按12%(V/V)的接种量取种子液到啤酒糟培养基中,28 ℃、150 r/min摇床培养4 d。通过测定发酵液中蛋白质、膳食纤维、还原糖、阿魏酰低聚糖含量和木聚糖酶、羧甲基纤维素酶酶活,比较研究啤酒糟中分离获得细菌微生物与常用啤酒糟降解真菌的发酵降解效果。
1.3.4 发酵啤酒糟理化指标的测定
蛋白质含量的测定:采用考马斯亮蓝染色法;不溶性膳食纤维含量的测定:参照金信江[20]的方法;可溶性膳食纤维含量的测定:参照邬建国等[21]的方法;还原糖含量的测定:采用DNS法测定;阿魏酰低聚糖(feruloyl oligosaccharides,FOs)含量的测定:采用双波长法测定;木聚糖酶活力的测定:参照沈诚等[22]的方法;羧甲基纤维素酶活力的测定:参照杜晓梅等[23]的方法。
1.3.5 数据处理
实验结果及制图采用Excel 2019和Origin 9.0软件进行分析处理,并运用SPSS 20.0软件进行单因素方差分析和MEGA 11.0软件构建系统发育树。
2 结果与分析
2.1 啤酒糟中细菌微生物的分离及鉴定
2.1.1 细菌微生物的分离及形态观察
通过LB培养基从啤酒糟中共分离出6株菌落形态特征完全不同的细菌,分别编号为B1~B6,其菌落形态见图1。
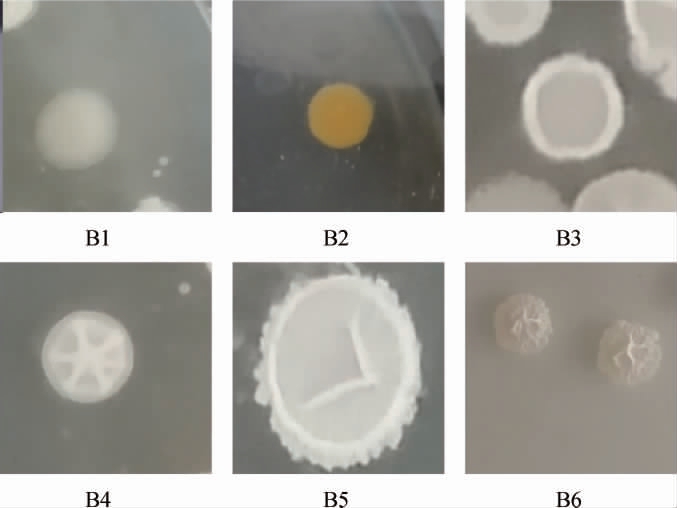
图1 分离细菌的菌落形态
Fig.1 Colony morphologies of isolated bacteria
由图1可知,6种细菌B1~B6的菌落均近似圆形,菌株B1呈哑光白色,菌株B2呈哑光黄色,菌株B3表面粗糙且存在中心圆状凹陷,呈白色不透明状,菌株B4~B6的菌落边缘不规则,内部有褶皱,呈白色。
2.1.2 分子生物学鉴定
将测序结果在NCBI上进行BLAST比对分析,结果见表1。由表1可知,6种细菌B1~B6分别与蜡样芽孢杆菌(Bacillus cereus)(LC052668.1)、梭菌属(Clostridiumsp.)(HQ183777.1)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)(KP967704.1)、贝莱斯芽孢杆菌(Bacillus velezensis)(CP051463.1)、暹罗芽孢杆菌(Bacillus siamensis)(MT176526.1)、枯草芽孢杆菌(Bacillus subtilis)(CP028213.1)相似度最高。
表1 NCBI序列比对结果
Table 1 Results of NCBI sequence alignment
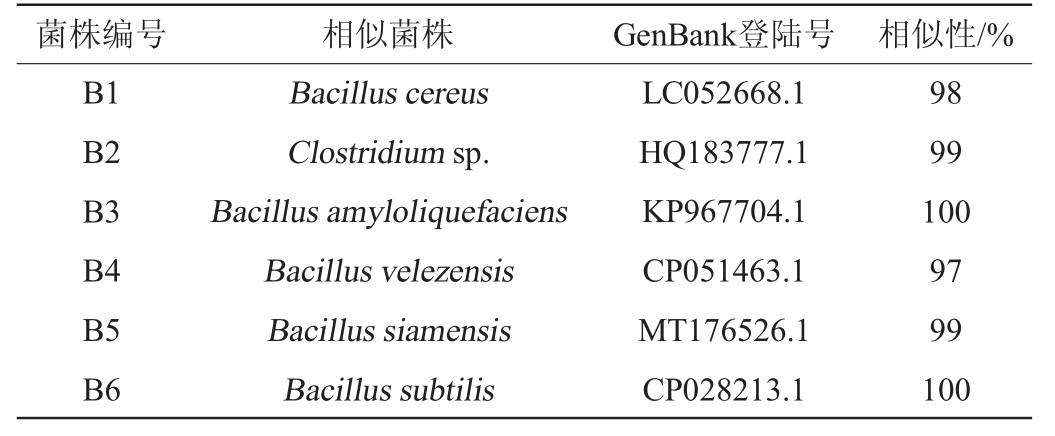
结合形态观察,将细菌B1~B6分别鉴定为蜡样芽孢杆菌(Bacillus cereus)、梭菌属(Clostridium sp.)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、贝莱斯芽孢杆菌(Bacillus velezensis)、暹罗芽孢杆菌(Bacillus siamensis)、枯草芽孢杆菌(Bacillus subtilis)。
2.2 不同微生物发酵对啤酒糟的影响
有研究表明[24],微生物发酵时可产生蛋白酶、淀粉酶、半纤维素酶等分解酶类,应用微生物发酵可以同时水解原料中的蛋白质和淀粉,以及水解其中的半纤维素以制备阿魏酰低聚糖,因此,发酵后产生的阿魏酰低聚糖含量可以作为初步探究细菌微生物对啤酒糟降解能力的指标。前期试验发现,细菌B1(蜡样芽孢杆菌)、B2(梭菌属)和B3(解淀粉芽孢杆菌)的阿魏酰低聚糖产量较高,因此将该3株细菌作为目标菌发酵啤酒糟。
2.2.1 发酵啤酒糟中蛋白质含量的分析
不同微生物发酵啤酒糟样品中蛋白质的含量测定结果见图2。
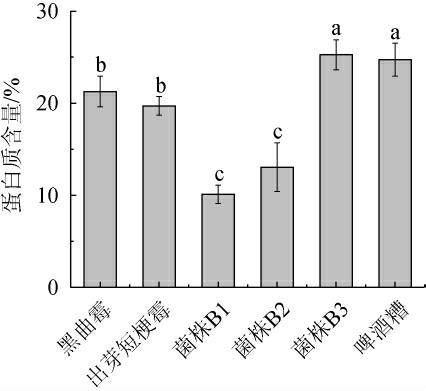
图2 不同微生物发酵啤酒糟中蛋白质含量的测定结果
Fig.2 Determination results of protein contents in brewer's spent grain fermented by different microorganisms
不同小写字母表示差异显著(P<0.05)。下同。
由图2可知,不同微生物发酵啤酒糟的蛋白质含量大小依次为:菌株B3>黑曲霉>出芽短梗霉>菌株B2>菌株B1。其中,菌株B3发酵啤酒糟所得的蛋白质含量最高,为25.26%,菌株B1发酵啤酒糟所得的蛋白质含量最低,为10.08%。王晓力等[25]对3个地区的啤酒糟中蛋白质含量进行研究发现,蛋白质含量均>20%,本研究利用解淀粉芽孢杆菌B3发酵啤酒糟中的蛋白质含量>25%。有研究表明,啤酒糟具有特殊结构,其所含蛋白被周围纤维素紧紧包埋住,从而使啤酒糟蛋白的提取率和纯度较低[14],综合来看解淀粉芽孢杆菌B3对啤酒糟纤维素具有一定降解能力,从而释放被包埋的蛋白质。此外,菌株在发酵过程中,产生相应的降解酶类,进而增加蛋白质含量。
2.2.2 发酵啤酒糟中不溶性膳食纤维含量的分析
啤酒糟中膳食纤维是可利用的主要营养成分之一,研究微生物发酵啤酒糟中膳食纤维含量,是反应啤酒糟降解利用的重要指标[26]。不同微生物发酵啤酒糟样品中不溶性膳食纤维含量的测定结果见图3。
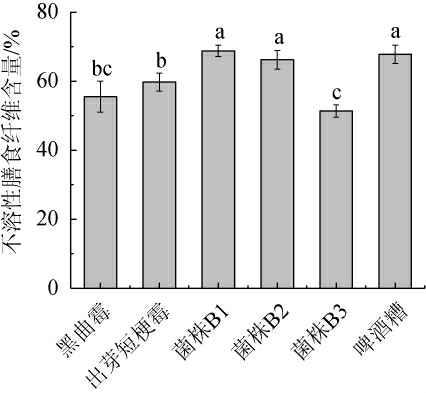
图3 不同微生物发酵啤酒糟中不溶性膳食纤维含量的测定结果
Fig.3 Determination results of insoluble dietary fiber contents in brewer's spent grain fermented by different microorganisms
由图3可知,不同微生物发酵啤酒糟所得的不溶性膳食纤维的含量大小依次为:菌株B1>菌株B2>出芽短梗霉>黑曲霉>菌株B3。其中,菌株B1发酵啤酒糟所得的不溶性膳食纤维含量最高,为68.81%,菌株B3发酵啤酒糟所得的不溶性膳食纤维含量最低,为51.39%。综合来看,菌株B3发酵啤酒糟后所剩不溶性膳食纤维含量低,可以推测解淀粉芽孢杆菌B3的纤维素酶活可能相对较高,对啤酒糟中不溶性膳食纤维的降解能力较强。
2.2.3 发酵啤酒糟中可溶性膳食纤维含量的分析
不同微生物发酵啤酒糟样品中可溶性膳食纤维含量的测定结果见图4。
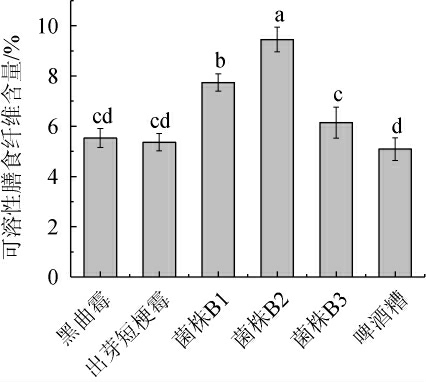
图4 不同微生物发酵啤酒糟中可溶性膳食纤维含量的测定结果
Fig.4 Determination results of soluble dietary fiber contents in brewer's spent grain fermented by different microorganisms
由图4可知,不同微生物发酵啤酒糟所得的可溶性膳食纤维的含量大小依次为:菌株B2>菌株B1>菌株B3>黑曲霉>出芽短梗霉。其中,菌株B2发酵啤酒糟所得的可溶性膳食纤维含量最高,为9.45%,出芽短梗霉发酵啤酒糟所得的可溶性膳食纤维含量最低,为5.36%。有研究表明,以大麦为原料的啤酒糟中各类膳食纤维含量(干质量)为8%[27],姜福佳等[28]利用酶法对啤酒糟中的水溶性膳食纤维进行提取,得率为5.09%。综合来看,菌株B2对啤酒糟的降解能力较好,且细菌发酵的降解能力要优于真菌。
2.2.4 发酵啤酒糟中总还原糖含量的分析
在啤酒糟降解过程中会产生多种分解酶类,而啤酒糟中含有丰富的多糖,因此,在微生物发酵啤酒糟过程中所含多糖成分会被分解,产生还原糖等小分子物质。不同微生物发酵啤酒糟样品中的总还原糖含量测定结果见图5。
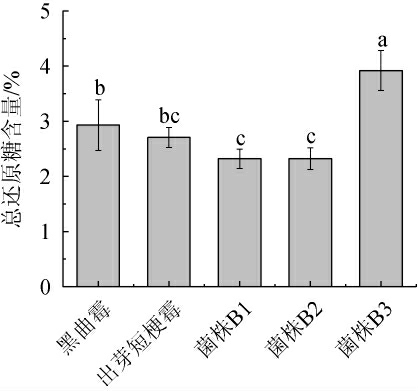
图5 不同微生物发酵啤酒糟中总还原糖含量的测定结果
Fig.5 Determination results of total reducing sugar contents in brewer's spent grain fermented by different microorganisms
由图5可知,不同微生物发酵啤酒糟的总还原糖含量大小依次为:菌株B3>出芽短梗霉>黑曲霉>菌株B2>菌株B1。其中,菌株B3发酵啤酒糟的总还原糖含量最高,为3.92%,菌株B1发酵啤酒糟中的总还原糖最低,为2.32%。综上,解淀粉芽孢杆菌B3发酵啤酒糟制备总还原糖的能力要明显好于其他4种微生物(P<0.05)。
2.2.5 发酵啤酒糟中阿魏酰低聚糖含量的分析
阿魏酰低聚糖是一种天然抗氧化剂,主要来源于谷物的皮壳或细胞壁[29],不同微生物发酵啤酒糟中阿魏酰低聚糖的含量测定结果见图6。
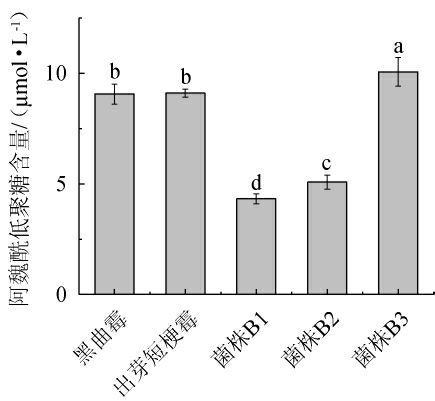
图6 不同微生物发酵啤酒糟中阿魏酰低聚糖含量的测定结果
Fig.6 Determination results of feruloyl oligosaccharides contents in brewer's spent grain fermented by different microorganisms
由图6可知,不同微生物发酵啤酒糟中阿魏酰低聚糖的含量大小依次为:菌株B3>出芽短梗霉>黑曲霉>菌株B2>菌株B1。其中,菌株B3发酵啤酒糟中的阿魏酰低聚糖含量最高,为10.01 μmol/L,菌株B1发酵啤酒糟中的阿魏酰低聚糖最低,为4.33 μmol/L,说明解淀粉芽孢杆菌B3在降解啤酒糟产生高附加值利用的低聚糖方面,具有一定潜力。
2.2.6 发酵啤酒糟中木聚糖酶酶活的分析
木聚糖是啤酒糟中的主要无氮浸出物,是诱导生产木聚糖酶较佳的基质[30],有研究利用微生物菌种发酵啤酒糟生产木聚糖酶,且所得木聚糖酶活性较高[31]。不同微生物发酵啤酒糟的木聚糖酶酶活测定结果见图7。
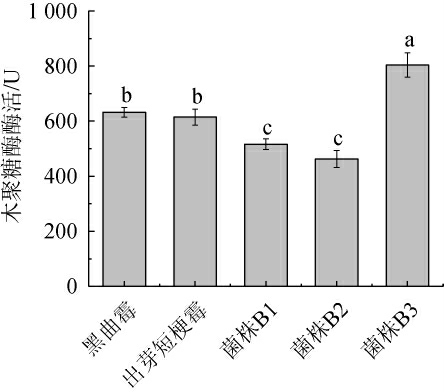
图7 不同微生物发酵啤酒糟木聚糖酶酶活的测定结果
Fig.7 Determination results of xylanase activities of brewer's spent grain fermented by different microorganisms
由图7可知,不同微生物发酵啤酒糟的木聚糖酶酶活大小依次为:菌株B3>黑曲霉>出芽短梗霉>菌株B1>菌株B2。其中,菌株B3发酵啤酒糟的木聚糖酶酶活最高,为803.59 U,菌株B2发酵啤酒糟的木聚糖酶活最低,为462.39 U。鲜啤酒糟中含有11.5%的无氮浸出物(主要为木聚糖),并且目前木聚糖酶的生产成本较高[32],综上可知,利用解淀粉芽孢杆菌B3发酵啤酒糟不仅起到较好的降解效果,而且进一步提高了啤酒糟的经济效益。
2.2.7 发酵啤酒糟中羧甲基纤维素酶酶活的分析
羧甲基纤维素酶是一种内切葡聚糖酶,是降解纤维素过程中的主要酶[33],不同微生物发酵啤酒糟的羧甲基纤维素酶酶活测定结果见图8。
由图8可知,不同微生物发酵啤酒糟所得的羧甲基纤维素酶酶活大小依次为:菌株B3>黑曲霉>出芽短梗霉>菌株B2>菌株B1。其中,菌株B3发酵啤酒糟的羧甲基纤维素酶酶活最高,为38.16 U,菌株B1发酵啤酒糟的羧甲基纤维素酶酶活最低,为10.74 U。宾冬梅等[34]利用黑曲霉、康氏木酶(Rrichoderma koningi)、曲霉(Aspergillus)和青霉(Penicillium)对啤酒糟进行发酵,结果发现,单菌使用黑曲霉进行发酵所得纤维素酶活力较好。本研究表明,解淀粉芽孢杆菌B3发酵啤酒糟的羧甲基纤维素酶酶活高于黑曲霉。综上可知,解淀粉芽孢杆菌B3对啤酒糟的降解效果较好。
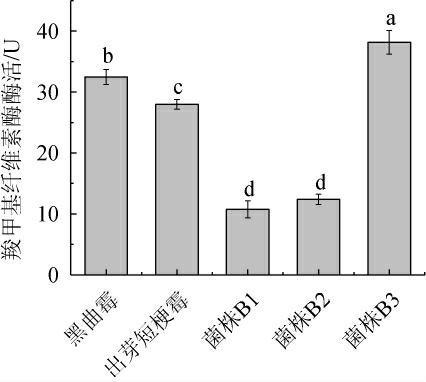
图8 不同微生物发酵啤酒糟羧甲基纤维素酶酶活的测定结果
Fig.8 Determination results of carboxymethyl cellulase activities of brewer's spent grain fermented by different microorganisms
3 结论
本研究通过传统培养分离方法从啤酒糟中共分离得到6种细菌,编号为B1~B6经形态观察及分子生物学技术,B1~B6分别为蜡样芽孢杆菌(Bacillus cereus)、梭状菌属(Clostridium sp.)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、贝莱斯芽孢杆菌(Bacillus velezensis)、暹罗芽孢杆菌(Bacillus siamensis)、枯草芽孢杆菌(Bacillus subtilis)。以黑曲霉和出芽短梗霉为对照,利用蜡样芽孢杆菌B1、梭状芽孢杆菌B2、解淀粉芽孢杆菌B3分别发酵啤酒糟,结果发现,解淀粉芽孢杆菌B3对啤酒糟的降解效果优于真菌,为最优发酵菌株,其发酵啤酒糟的蛋白质、总还原糖、阿魏酰低聚糖、木聚糖酶酶活及羧甲基纤维素酶酶活均达到最高,分别为25.26%、3.92%、10.01 μmol/L、803.59 U、38.16 U。本研究筛选出具有较好降解能力的菌种B3,为啤酒糟的进一步发酵降解利用以及后续寻找性能更加优越的降解菌株提供了研究思路与理论依据。
[1]MUSSATTO S I.Brewer's spent grain:a valuable feedstock for industrial applications[J].J Sci Food Agr,2014,94(7):1264-1275.
[2] IKRAM S,HUANG L Y,ZHANG H J,et al.Composition and nutrient value proposition of brewers spent grain[J]. J Food Sci,2017,82(10):2232-2242.
[3] MOREIRINHA C,VILELA C,SILVA N H C S,et al.Antioxidant and antimicrobial films based on brewers spent grain arabinoxylans,nanocellulose and feruloylated compounds for active packaging[J].Food Hydrocolloid,2020,108:105836.
[4]姜福佳,翟思羽,孙香盟,等.啤酒糟多糖提取工艺及其抗肿瘤活性[J].食品工业科技,2017,38(10):303-306.
[5]张德勇,郑志航,许晓路.国外利用生物技术对麦糟进行高值化开发利用的新进展[J].中国粮油学报,2022,37(1):1-12.
[6]FACCENDA A,ZAMBOM M A,CASTAGNARA D D,et al.Use of dried brewers'grains instead of soybean meal to feed lactating cows[J]. R Bras Zootec,2017,46(1):39-46.
[7]马骏,王家林,石晓丹.啤酒糟综合利用研究进展[J].酿酒科技,2021(3):100-104.
[8]郭萌萌,赵建德,杜金华,等.啤酒糟在国内外食品加工中的利用现状[J].中国酿造,2013,32(9):24-27.
[9]张磊,徐杨,潘孝青,等.啤酒糟发酵饲料研究进展[J].饲料研究,2022,45(3):154-156.
[10]王明瑞,焦婵.啤酒糟发酵制备蛋白饲料营养价值的研究[J].饲料研究,2020,43(7):142-146.
[11]成堃,高星,王小霞,等.麦糟的综合利用研究[J].中国酿造,2020,39(12):24-29.
[12]寇慧,文晓霞,叶思廷,等.微生物发酵生产饲用菌体蛋白的研究进展[J].饲料工业,2021,42(21):26-33.
[13]许祯毅,李力,姜咸彪,等.响应面法优化碱法提取啤酒糟中可溶性膳食纤维的工艺研究[J].食品研究与开发,2021,42(17):75-80.
[14]曲亮璠,郑雅元,曹琳琳,等.纤维素酶酶解啤酒糟的工艺研究[J].食品研究与开发,2020,41(8):90-93,148.
[15]陈曦,赵建国.混株发酵混合酒糟生产含酶蛋白饲料的研究[J].中国酿造,2006,25(5):30-33.
[16]黄河清涛,宾冬梅,易诚,等.啤酒糟单菌发酵与混菌发酵降解纤维素效果比较[J].粮食与饲料工业,2016,45(1):46-50.
[17]卜雯丽.出芽短梗霉发酵啤酒糟制备阿魏酰低聚糖和膳食纤维的研究[D].镇江:江苏大学,2019.
[18]冯志勇,王志强,郭力刚,等.秀珍菇生物学特性研究[J].食用菌学报,2003,10(3):11-16.
[19]马召稳.青贮苜蓿中主要微生物的筛选、鉴定与应用[D].洛阳:河南科技大学,2019.
[20]金信江.固态发酵法制取麦麸膳食纤维技术研究[D].南京:南京农业大学,2009.
[21]邬建国,周帅,张晓昱,等.采用药用真菌液态发酵甘薯渣获得膳食纤维的发酵工艺研究[J].食品与发酵工业,2005,31(7):42-44.
[22]沈诚,李戎,胡婷莉,等.木聚糖酶活力的二硝基水杨酸(DNS)测定法[J].印染,2011,37(2):35-39.
[23]杜晓梅,付国家,郭庆杰,等.黑曲霉3.316固态发酵啤酒糟生产纤维素酶[J].青岛科技大学学报(自然科学版),2012,33(3):263-268.
[24]潘海晓,刘海顺,王静,等.玉米麸皮中阿魏酰低聚糖的制备[J].食品科学技术学报,2011,29(3):33-37.
[25]王晓力,孙尚琛,匡彦蓓,等.不同地区啤酒糟基本成分测定及其分析[J].安徽农业科学,2015,43(13):276-278.
[26]叶春苗.啤酒糟再利用研究进展[J].农业科技与装备,2016,38(1):57-58.
[27]孙智媛,常凌,范志勇.啤酒糟的营养特性及其在畜禽饲料中的应用[J].畜牧与饲料科学,2020,41(5):33-36.
[28]姜福佳,张雪,杜佳欣,等.酶法提取啤酒糟中水溶性膳食纤维的研究[J].安徽农业科学,2017,45(2):114-117.
[29]王文文,王园,尹娜,等.阿魏酰低聚糖的生理功能及其在动物生产中的应用前景[J].动物营养学报,2021,33(1):77-84.
[30]邹正,陈力力,王雅君,等.啤酒糟发酵应用[J].中国酿造,2011,30(10):20-23.
[31]曾莹,杨明.发酵啤酒糟产饲用木聚糖酶的基质条件及其酶学性质研究[J].中国酿造,2006,25(9):12-15.
[32]王家林,王煜.啤酒糟的综合应用[J].酿酒科技,2009(7):99-102.
[33]苑广伟,周洁嫦,王欣宇,等.一株来源于土壤的横梗霉菌及其产羧甲基纤维素酶性质[J].工业微生物,2021,51(1):23-29.
[34]宾冬梅,黄河清涛,易诚,等.啤酒糟一次发酵菌种配伍选择[J].黑龙江畜牧兽医,2017(18):187-189.