腐霉利(procymidone,PCD)是一种低毒的杀菌剂,又名杀霉利、二甲菌核利、速克灵等,通过抑制菌丝顶端细胞壁合成杀死霉菌,被广泛用于蔬菜及果树的灰霉病防治[1-3]。研究表明,腐霉利可以在植物上蓄积,少量摄入体内对人的身体没有影响,但长期超标食用,会影响人体健康,轻则刺激眼部和皮肤,重则可能在人体内定量沉积,对人体的神经、血液系统等造成危害[4-6]。国家卫健委、农业农村部及市场监管总局联合发布的GB 2763—2021《食品安全国家标准食品中农药最大残留限量》中明确规定了腐霉利在蔬菜水果中的使用范围和最大残留限量。但近年来,腐霉利在果蔬上的广泛使用,仍使其成为农药残留检出率和超标率较高的农药品种之一。2019年以来,在国家市场监管总局和各省市抽检通报中[7],多次出现果蔬中腐霉利超标的问题,因此,蔬菜水果中腐霉利的监控检测尤为重要。
腐霉利常用的检测方法主要为仪器检测法和免疫分析法。仪器检测法主要包括气相色谱法[8-9]、气相色谱-质谱联用法[10-11]和高效液相色谱法[12]等。现行国标方法中腐霉利的检测方法为气相色谱和气相色谱-质谱联用法。免疫分析法主要包括胶体金免疫层析法[13]和酶联免疫法[14]等。仪器检测法灵敏度高、重现性好,也是现阶段我国监控食品安全的常用方法,但前处理复杂,耗时、耗力,专业性强,检测成本高[15]。免疫分析法是基于抗原抗体之间特异性结合的原理来测定农药残留的方法,具有简便、快速、成本低的优点,适合大量样品的初步筛选和现场检测[16],其中又以胶体金免疫层析法应用最为广泛[17-20]。
将仪器检测法和免疫分析法结合,先用胶体金免疫层析法对大批量样品进行快速筛检,然后用仪器检测法对阳性样本进行确证,可大大缩短检验时间,减少人力、物力投入,提高检验效率[21-23]。目前市场上已有约上百家腐霉利快速检测试纸条生产企业,但是由于不同品牌结果判读、仪器性能差异、匹配的试剂来源不一、结果的判定存在差异等原因,腐霉利农药残留快速检测技术在实际应用过程中出现了很多问题[24-25]。本研究通过优化主流腐霉利快检产品的前处理步骤,确定检测方法的性能指标,考察每种胶体金快检产品在果蔬基质样品检测中的灵敏度、特异性、假阳性率、假阴性率和交叉反应,建立一种蔬菜水果中腐霉利的胶体金免疫层析快速检测方法。旨在为基层监管部门快速筛查和农贸市场、餐饮单位、超市等把关蔬菜水果的进货提供快捷有效的方式。
1 材料与方法
1.1 材料与试剂
蔬菜、水果样品:购自济南某大型超市,且经参比方法GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》(定量限为0.01 mg/kg)检测均不含腐霉利;阳性样品韭菜(样品A)、黄瓜(样品B)和葡萄(样品C)经GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》测定的腐霉利含量分别为0.67 mg/kg、3.20 mg/kg、5.61 mg/kg。
乙腈(纯度≥99%):霍尼韦尔贸易(上海)有限公司;丙酮、甲醇、Tris(纯度均≥99%):国药集团化学试剂有限公司;腐霉利、百菌清、福美双、多菌灵、啶酰菌胺、乙烯菌核利、异菌脲、五氯硝基苯、三唑酮、三氯杀螨醇、丙溴磷农药标准品(纯度均≥99%):曼哈格(上海)生物科技有限公司。
1.2 仪器与设备
MS204TS/02电子天平:梅特勒-托利多仪器(上海)有限公司;MS 3漩涡混合器:德国IKA公司;XMTD-7000电热恒温水浴锅:北京市永光明医疗仪器有限公司。
1.3 方法
本方法采用竞争抑制免疫层析原理。样品中残留的腐霉利经提取后与胶体金标记的特异性抗体结合,抑制抗体和试纸条中检测线(T线)上抗原的结合,从而导致检测线颜色深浅的变化。通过检测线与控制线(C线)颜色深浅比较,对样品中残留的腐霉利进行定性判定。
1.3.1 样品前处理
称取3 g(精确至0.01 g)捣碎后的蔬菜、水果样品于50 mL离心管中,加入9 mL提取液(Tris-盐酸-10%甲醇缓冲液,pH 9.0),涡旋振荡提取1 min,过滤后备用。
1.3.2 样品中腐霉利提取条件的优化
(1)提取液的选择
比较pH 9.0的磷酸盐缓冲液(phosphate buffer solution,PBS)、Tris-盐酸缓冲液和Tris-盐酸-10%甲醇缓冲液对不同样品进行处理后胶体金试纸条的显色效果,选择最佳提取液。
(2)提取液pH的优化
比较当提取液pH分别为7.0、8.0、9.0时,对模拟阳性样本进行测定后试纸条的显色结果,选择最佳的提取液pH。
(3)提取液中甲醇体积分数的优化
比较当提取液中甲醇体积分数分别为2%、4%、6%、8%、10%、12%时,对模拟阳性样本进行提取后的加标回收率和试纸条的显色效果,确定最佳的甲醇体积分数。
(4)样品提取液处理方式的优化
比较将不同样品提取后的样液分别经静置、离心和过滤处理后试纸条的显色效果,重复处理测定3次,选择最佳的处理方式。
1.3.3 检出限测定
由于本方法为定性检测,判断结果为阴性或阳性的依据就是样品基质的限量水平,GB 2763—2021《食品安全国家标准食品中农药最大残留限量》中规定了蔬菜水果中腐霉利的最大残留限量,其中限量水平最低的基质为韭菜即0.2 mg/kg,因此确定本方法的最低检出限为0.2 mg/kg。取不含腐霉利的韭菜空白基质样品,制成腐霉利质量浓度为0.1 mg/kg、0.2 mg/kg、0.4 mg/kg的模拟样品,将空白样品和模拟样品按照上述样品前处理方法和分析步骤进行处理,观察试纸条的显色效果。
1.3.4 试纸条测定
吸取待测液200 μL于金标微孔中,抽吸5~10次混匀,3~5 min后将试纸条插入微孔中,8~9 min后进行结果判定。
检测线(T线)颜色比控制线(C线)颜色深或颜色相当,表明样品中腐霉利残留量低于方法检出限,判定为阴性;检测线(T线)不显色或检测线(T线)颜色比控制线(C线)颜色浅,表明样品中腐霉利残留量高于方法检出限,判定为阳性;控制线(C线)不显色,表明操作不当或试纸条无效。
1.3.5 检测方法学研究
(1)性能指标的测定
称取以韭菜、黄瓜和葡萄为代表的空白基质样品,制成腐霉利质量浓度为相应限量水平的0.5倍、1.0倍和2.0倍的盲样样品各50份,共计450份样本,按照优化后的方法进行测定,鉴于GB 2763—2021《食品安全国家标准食品中农药最大残留限量》中黄瓜的腐霉利限量为2 mg/kg,葡萄的腐霉利限量为5 mg/kg,所以其样品过滤液需稀释后测定,考虑到不同品牌产品之间的差异,可参照厂家试剂盒说明书中的稀释倍数进行稀释后测定,以考察方法的灵敏度、特异性、假阳性率和假阴性率。
(2)交叉反应
在韭菜空白基质样品中分别加入百菌清、福美双、多菌灵、啶酰菌胺、乙烯菌核利、异菌脲、五氯硝基苯、三唑酮、三氯杀螨醇、丙溴磷等10种农药,每种农药质量浓度水平为最低检出限的1 000倍即200 mg/kg,按照优化后的测定方法考察交叉反应。
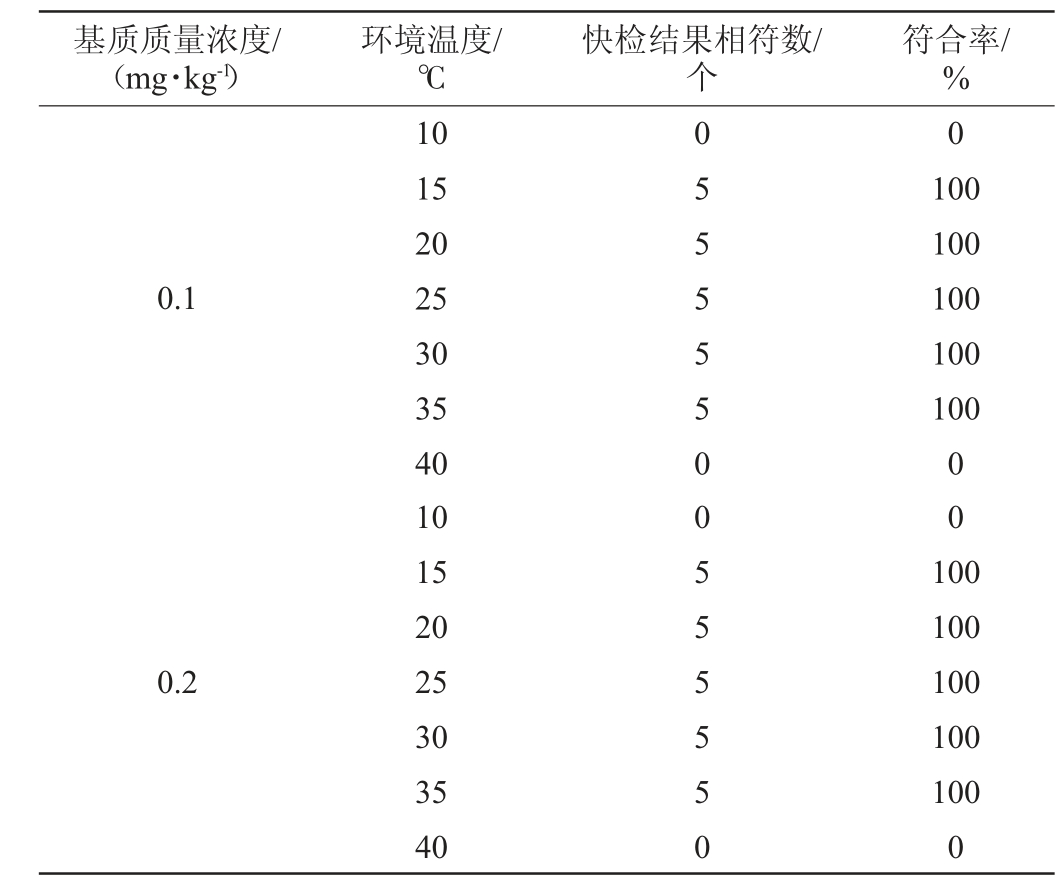
(3)环境温度的影响
利用腐霉利添加量为0.1 mg/kg、0.2 mg/kg的模拟样品在10~40 ℃范围进行环境温度适应性考察,每份浓度样品进行5次平行测试。
(4)与参比方法的一致性
称取以韭菜、黄瓜和葡萄为代表的空白基质样品,制成腐霉利添加量为相应限量水平的0.5倍、1倍和2倍的盲样样品各20份。分别用本研究建立的快速检测方法和标准参比方法GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》进行检测,对方法一致性进行考察。
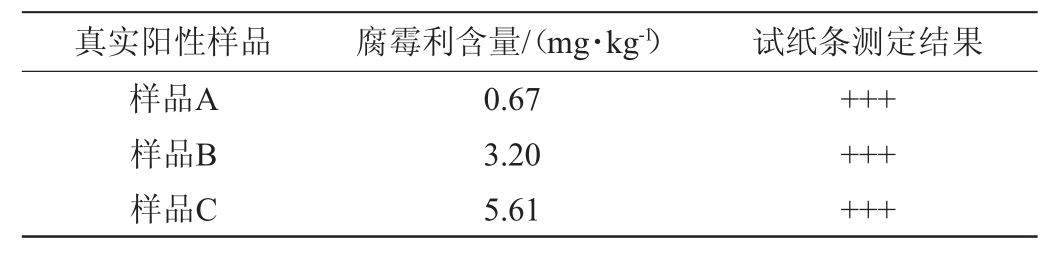
(5)真实阳性样品验证
韭菜(样品A)、黄瓜(样品B)和葡萄(样品C)腐霉利真实阳性样品,经GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》测定的腐霉利含量分别为0.67 mg/kg、3.20 mg/kg、5.61 mg/kg,按照优化后的测定方法进行验证。
2 结果与分析
2.1 提取液的选择
选取经参比方法GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》检测后的3个样品:模拟阴性样本1、模拟阴性样本2和韭菜真实阳性样本(样品A)。对比考察了3种提取液(pH 9.0的PBS缓冲液、Tris-盐酸缓冲液、Tris-盐酸-10%甲醇缓冲液)对腐霉利农药的提取效果,用胶体金试纸条平行测定3次,结果见表1。由表1可知,3种提取液对模拟阴性样本1和模拟阴性样本2的试纸条检测结果均为阴性,与参比方法一致。样品A分别经PBS缓冲液和Tris-盐酸缓冲液提取后,试纸条测定结果与参比方法结果不一致;经Tris-盐酸-10%甲醇缓冲液的提取后,试纸条测定结果与参比方法结果一致,试纸条结果重复性好。因此,选择Tris-盐酸-10%甲醇缓冲液为提取液。
表1 不同提取液对腐霉利的提取效果比较
Table 1 Comparison of extraction effects of different extracts on procymidone

注:试纸条检出限为0.2 mg/kg。ND表示未检出,“-”表示结果阴性,“+”表示结果阳性,试纸条测试结果为3次平行的结果。
2.2 提取液pH的优化
图1为模拟阳性样本的试纸条测定结果。由图1可知,试纸条C线显色正常,T线颜色随着提取液pH的增加由深变浅,当pH为9.0时,样本的检测结果为明显阳性,C、T线颜色对比明显,结果重复性好。因此,选择提取液的pH值为9.0。
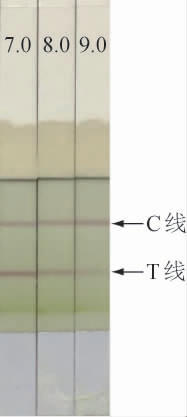
图1 不同pH的提取液下模拟阳性样本的试纸条测试结果
Fig.1 Test results of test strip of simulated positive samples under different pH extracts
2.3 提取液中甲醇体积分数的优化
利用胶体金试纸条和参比方法GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》对比考察不同甲醇体积分数的提取液对模拟阳性样品中腐霉利的提取效果,结果见表2。由表2可知,随着提取液中甲醇体积分数不断增大,回收率随之增加。当甲醇体积分数为2%、4%和6%时,模拟阳性样品的检测结果为阴性;当甲醇体积分数为8%和12%时,试纸条测试结果重复性不好;当甲醇体积分数为10%时,回收率为77.8%,试纸条测定结果为阳性,且重复性好。因此,考虑到腐霉利加标回收率、试纸条显色结果和环保低毒等要求,选择提取液中甲醇体积分数为10%。
表2 不同甲醇体积分数对腐霉利试纸条的测试结果
Table 2 Test results of different methanol volume fraction on procymidone test strip
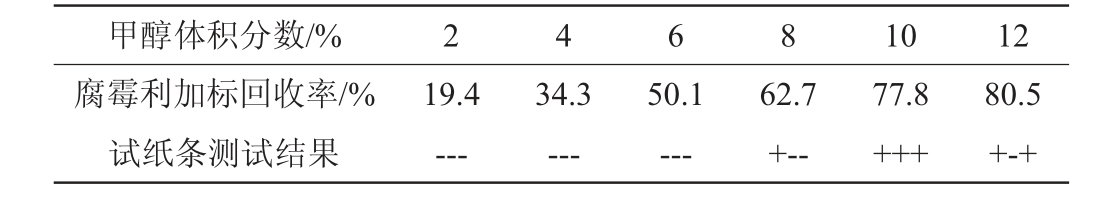
注:“-”表示结果阴性,“+”表示结果阳性,试纸条测试结果为重复3次的结果。
2.4 样品提取液处理方式的优化
选取经参比方法GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》检测后的模拟阴性样本和韭菜真实阳性样本(样品A),用试纸条进行测定。将样品提取液分别经静置、离心和过滤处理后试纸条的显色结果见表3。由表3可知,三种不同处理方式,阴性样本的测试结果与参比方法一致。样品A的提取液经静置或离心处理后,试纸条检测结果存在检出阴性的情况;经过滤处理后,试纸条检测结果与参比方法检测结果一致,重复性和稳定性好。考虑到本方法中样品制备方式为捣碎,样品比较细,为降低提取后的样品液中基质对检测结果的影响,保证检测结果的准确性,选择过滤的处理方式。
表3 不同样液处理方式对试纸条显色结果的影响
Table 3 Effect of different liquid treatment methods on color development results of test strip
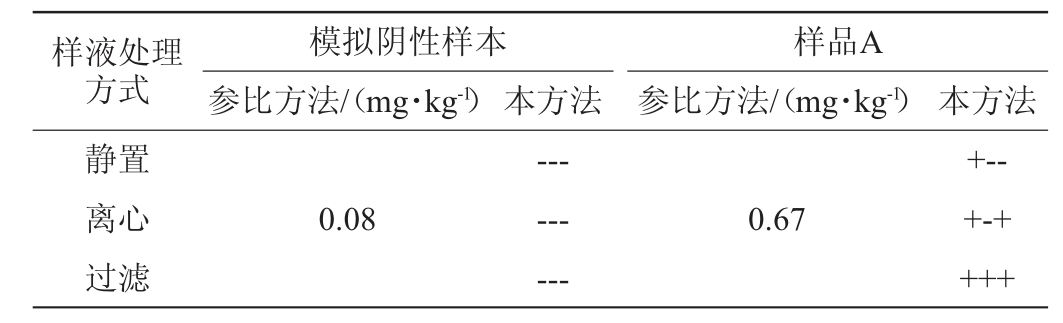
注:“-”表示结果阴性,“+”表示结果阳性,试纸条测试结果为重复3次的结果。
2.5 检出限的测定
图2为试纸条检出限的测定结果,从左到右依次为空白基质样品和腐霉利质量浓度分别为0.1 mg/kg、0.2 mg/kg、0.4 mg/kg的模拟样品的平行检测结果。由图2可知,试纸条C线均显色正常,T线颜色随着腐霉利含量上升由深变浅,当腐霉利质量浓度为0.2 mg/kg时,T线颜色明显弱于C线,为阳性结果,因此本方法的检出限为0.2 mg/kg。

图2 试纸条检出限结果
Fig.2 Detection limit results of test strip
2.6 产品方法性能指标的测定
由表4可知,韭菜、黄瓜、葡萄基质阳性样品均检出50个阳性结果,假阴性率均为0;韭菜、黄瓜、葡萄基质阴性样品均检出100个阴性结果,假阳性率均为0;优化后的检测方法测定的不同基质样品的灵敏度、特异性均为100%。上述性能指标均符合《食品快速检测方法评价技术规范》(食药监办科[2017]43号)[26]的技术要求。
表4 方法性能指标的计算结果
Table 4 Calculation results of the method performance indexes
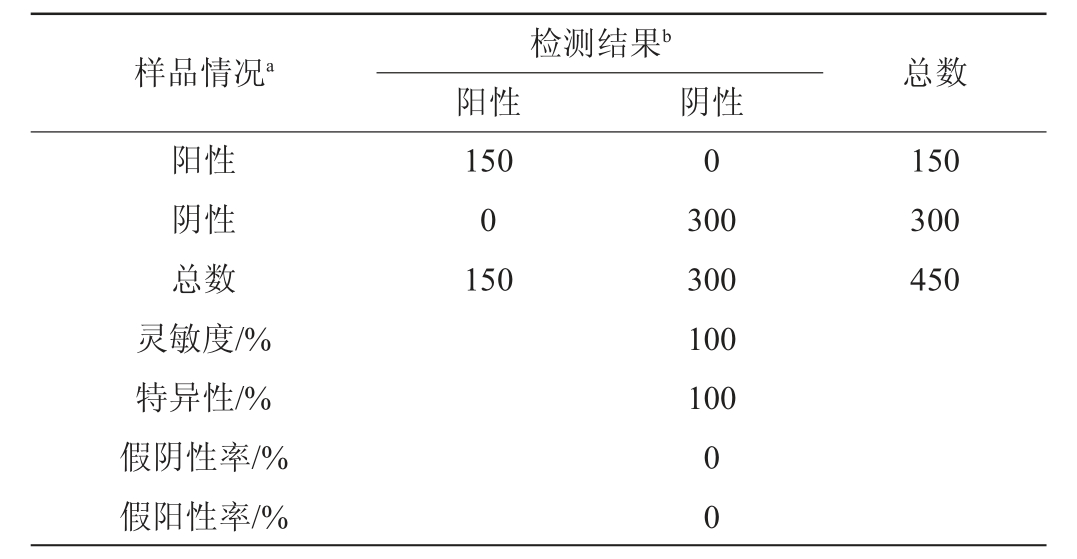
注:a为参比方法的检测结果;b为本研究方法的检测结果。
2.7 交叉反应
选取与腐霉利用途相同或复配使用或与腐霉利结构相似以及比较容易检出的10种农药:百菌清、福美双、多菌灵、啶酰菌胺、乙烯菌核利、异菌脲、五氯硝基苯、三唑酮、三氯杀螨醇、丙溴磷等,考察其与腐霉利是否会产生交叉反应,结果见图3。

图3 交叉反应试纸条显色结果
Fig.3 Color development results cross-reaction test strip
从左到右依次为百菌清、福美双、多菌灵、啶酰菌胺、乙烯菌核利、异菌脲、五氯硝基苯、三唑酮、三氯杀螨醇、丙溴磷的平行测定结果。
由图3可知,当空白韭菜基质样品中加入腐霉利浓度水平为检出限的1 000倍(即200 mg/kg)时,试纸条显色结果均为阴性。因此本方法试纸条与百菌清、福美双、多菌灵、啶酰菌胺、乙烯菌核利、异菌脲、五氯硝基苯、三唑酮、三氯杀螨醇、丙溴磷10种农药均无交叉反应。
2.8 环境温度的影响
由表5可知,当环境温度为15~35 ℃,测定5次的快检结果与国标结果均相符,符合率为100%,因此,最佳环境温度为15~35 ℃。
表5 温度耐变性实验结果
Table 5 Experimental results of temperature resistance
2.9 与参比方法一致性分析
分别用本研究建立的快速检测方法与参比方法GB 23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》测定3种不同基质的果蔬阴性样品和模拟阳性样品。结果表明,依据《食品快速检测方法评价技术规范》(食药监办科[2017]43号)的要求,两种方法的符合率为100%,通过卡方检验得出χ2=0.8<3.84,表明本方法与参比方法的阳性确证比率在95%的置信区间内没有显著性差异,能够用于蔬菜水果中腐霉利的检测。
2.10 真实阳性样品验证
利用胶体金试纸条对韭菜(样品A)、黄瓜(样品B)和葡萄(样品C)的真实阳性样品进行验证,平行测定3次,结果见表6。
表6 真实阳性样品验证结果
Table 6 Verification results of true positive sample
注:“+”表示结果阳性,试纸条测试结果为3次平行的结果。
由表6可知试纸条检测结果均为阳性,与参比方法检测结果一致。
3 结论
选用韭菜、黄瓜、葡萄作为研究对象,通过对市场上主流腐霉利胶体金快速检测产品进行方法优化和性能指标考察,结果表明,采用pH 9.0的Tris-盐酸-10%甲醇缓冲溶液作为提取液,解决了单纯缓冲液提取样品中腐霉利提取不完全的问题,并通过对样品提取液进行过滤处理,降低了基质对检测结果的影响,保证了检测结果的准确性。在优化的前处理条件下,腐霉利胶体金快速检测方法的检出限可以达到0.2 mg/kg。经过验证,本方法各项性能指标均符合要求,即方法的灵敏度为100%、特异性100%、假阳性率为0、假阴性率为0;交叉反应结果显示本方法试纸条与百菌清、福美双、多菌灵、啶酰菌胺、乙烯菌核利、异菌脲、五氯硝基苯、三唑酮、三氯杀螨醇、丙溴磷均无交叉反应;与参比方法进行一致性分析比较,结果表明,本方法与参比方法的阳性确证比率在95%的置信区间内没有显著性差异,建立的方法可行。综上所述,本研究建立的腐霉利快速检测方法,可用于蔬菜水果中腐霉利的现场检测,能有效保障蔬菜水果的安全性。
[1]ABE J,IOMIGAHARA Y,TARUI H,et al.Identification of metabolism and excretion differences of procymidone between rats and humans using chimeric mice: Implications for differential developmental toxicity[J].J Agr Food Chem,2018,66(8):1955-1963.
[2]LIN S,HAN Y,JIANG Y C,et al.Revealing the biodiversity and the response of pathogen to a combined use of procymidone and thiamethoxam in tomatoes[J].Food Chem,2019,284:73-79.
[3]LIN S,TANG T,CANG T,et al.The distributions of three fungicides in vegetables and their potential health risks in Zhejiang,China: A 3-year study(2015-2017)[J].Environ Pollut,2020,267:115481.
[4]胡骁飞,魏凤仙,邢云瑞,等.腐霉利检测技术研究进展[J].食品安全质量检测学报,2021,12(10):4076-4082.
[5]GADAGBUI B K,YORK R G,DOURSON M L,et al.Analysis for dataderived extrapolation factors for procymidone[J].Regul Toxicol Pharmacol,2021,124:104972.
[6]CHEN W C,WEI L L,ZHENG H H,et al.Biological characteristics and molecular mechanism of procymidone resistance in Stemphylium eturmiunum from garlic[J].Plant Dis,2021,105(7):1951-1959.
[7]刘玉红,孙彩霞,胡美华.蔬菜中腐霉利残留的膳食暴露风险评估[J].浙江农业科学,2020,61(11):2330-2332,2335.
[8] OZDOGAN N,KAPUKRAN F,MUTLUOGLU G,et al.Simultaneous determination of iprodione,procymidone,and chlorflurenol in lake water and wastewater matrices by GC-MS after multivariate optimization of binary dispersive liquid-liquid microextraction[J].Environ Monit Assess,2018,190(10):607.
[9] ZHANG C,ZHAO H,WU M,et al.Simultaneous determination of procymidone,pyridaben and beta-cypermethrin residues in tea solution by GC-ECD[J].J Chromatogr Sci,2012,50(10):940-944.
[10] CELEIRO M,VAZQUEZ L,NURERK P,et al.Fabric phase sorptive extraction for the determination of 17 multiclass fungicides in environmental water by gas chromatography-tandem mass spectrometry[J].J Separat Sci,2020,43(9-10):1817-1829.
[11]BARRETO A S,DE CÁSSIA DA SILVA ANDRADE P,FARIAS,J M,et al.Characterization and application of a lanthanide-based metal-organic framework in the development and validation of a matrix solidphase dispersion procedure for pesticide extraction on peppers(Capsicum annuum L.)with gas chromatography-mass spectrometry[J].J Sep Sci,2018,41(7):1593-1599.
[12]徐秋生,贺慧琳,朱吕,等.高效液相色谱法测定番茄中腐霉利和异菌脲的残留量[J].食品安全质量检测学报,2017,8(2):486-490.
[13]姚帮本,陈赵然,闫超,等.侧向层析免疫试纸法快速检测蔬菜中的腐霉利[J].食品安全质量检测学报,2021,12(2):479-485.
[14]ZHANG Z,LIN H,SUI J,et al.The effect of chlorophyll on the enzymelinked immunosorbent assay(ELISA)of procymidone in vegetables and the way to overcome the matrix interference[J].J Sci Food Agr,2021,102(8):3393-3399.
[15]周勇,朴秀英,廖先骏,等.韭菜中腐霉利的残留检测及长期膳食暴露评估[J].农药学学报,2021,23(2):373-379.
[16]翟培,韩晋辉.胶体金免疫层析技术在食品安全现场快速检测中的应用[J].现代农业科技,2020(4):225-227,229.
[17]黄一.分子印迹荧光传感器的设计合成及其对腐霉利的检测[D].吉林:吉林大学,2019.
[18]LIN L,SONG S S,WU X L,et al.A colloidal gold immunochromatography test strip based on a monoclonal antibody for the rapid detection of triadimefon and triadimenol in foods[J].Food Agr Immunol,2020,31(1):475-488.
[19]YANG G,CHEN K,GUO W,et al.Development of a test card based on colloidal gold immunochromatographic strips for rapid detection of antibodies against Theileria equi and Babesia caballi[J].Microbiol Spectr,2022,10(1):e0241121.
[20]O'FARRELL B.Lateral flow technology for field-based applications-basics and advanced developments[J].Top Companion Anim Med,2015,30(4):139-147.
[21]李向梅,刘志威,陈晓敏,等.食品安全免疫层析检测技术研究进展[J].食品安全质量检测学报,2020,11(15):4939-4955.
[22]罗俊霞,张刚,申战宾,等.胶体金免疫层析技术应用于农药残留检测的研究进展[J].农产品质量与安全,2022(1):41-49.
[23] SUKUMARAN A,THOMAS T,THOMAS R,et al.Development and troubleshooting in lateral flow immunochromatography assays[J].Indian J Clin Biochem,2021,36(2):208-212.
[24]张琳.快速检测技术在果蔬检测中的应用分析[J].中国果菜,2020,40(12):29-31,35.
[25]王忠兴,郭玲玲,匡华.食品安全免疫层析检测技术研发及应用进展[J].生物产业技术,2019(4):75-81.
[26]国家食品药品监督管理总局.食药监科便函[2017]43号《食品快速检测方法评价技术规范》[EB/OL].[2017-3-28].http://law.foodmate.net/show-190696.html.