除草剂是一类广泛应用在农业发展上,用于防治杂草和有害植物的药剂。其中三嗪类除草剂成本较低,针对于阔叶和禾本科杂草有很好的抑制作用[1]。通过作用于光合系统Ⅱ,影响电子传递,从而抑制植物的光合作用[2-3],达到除草效果。茚嗪氟草胺是拜耳作物科学公司近年来研发的一种新型三嗪类除草剂,因此相关的毒理研究报道尚较少。有研究表明,三嗪类除草剂能对生物体脱氧核糖核酸(deoxyribonucleic acid,DNA)造成一定的损伤[4],并引起生物体的生理紊乱[5]。同时,除草剂的实用也可能对作物的产量造成影响[6-7],甚至会对一些昆虫的生理造成损伤[8-9]。在酿造工业中,作物在预处理不充分的情况下,除草剂较容易在酒中残留[10-11],从而对消费者的健康造成威胁。同时,虽然茚嗪氟草胺目前只在澳大利亚及美国等一些美洲国家登记使用,但在中国仍未登记,因此相关的检测方法和法律法规仍未建立,可能存在贸易输入或不法商家滥用的风险,建立有效测定酒中除草剂的分析方法意义重大。
目前,除草剂的检测方法主要集中在液相色谱法[12]、气相色谱法[13-14]、液相色谱-串联质谱法[15-19]和气相色谱-质谱法[20-25]。其中,液相色谱法和气相色谱法灵敏度相对质谱法较低,对目标物选择性较差,因此,结果容易受到杂质的影响,使结果造成偏差。液相色谱-串联质谱法和气相色谱-质谱法对目标物选择性强,对多组分进行分析时,时间短,且仪器灵敏度较高,适合农药残留量的分析测定。本研究基于分散固相萃取技术,建立了同时测定啤酒中茚嗪氟草胺及其代谢物的液相色谱-串联质谱法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS),该方法相对于目前普遍的三嗪类除草剂分析方法,分析时间短,选择性强,可同时对代谢物残留量进行监测,目前国内外的相关分析方法报道较少,可为后续研究提供参考依据。
1 材料与方法
1.1 材料及试剂
啤酒:广州市售;无水硫酸镁、氯化钠(分析纯):广州化学试剂厂;中性氧化铝(alumina N,Al-N);N-丙基乙二胺(primary secondary amine,PSA)、石墨化碳黑(graphitized carbon black,GCB)、硅胶键合十八烷基(silica gel bonded octadecyl,C18);甲醇、乙酸乙酯、乙腈(均为色谱纯):美国Fisher公司;1-氟乙基三嗪二胺、三嗪-茚满酮、茚嗪氟草胺-烯烃、茚嗪氟草胺标准品(纯度≥93.0%):德国拜尔公司;实验用水为经Milli-Q纯水系统制得的超纯水(电阻率为18.2 MΩ·cm-1)。
1.2 仪器与设备
API4000QTRAP质谱仪:美国ABSCIEX公司;LC-20AD岛津液相色谱系统:日本岛津公司;Milli-Q Advantage A10超纯水系统:法国Merck Millipore公司;TGL-16M\H2050R高速离心机:湘仪离心机仪器有限公司;NMSG-12多管涡旋震荡仪:泰州诺米医疗科技有限公司;KQ-500DE超声波清洗机:昆山市超声仪器有限公司;Vibramax 100台式摇床:德国Heidolph公司。
1.3 方法
1.3.1 标准溶液的配制
分别准确称取4种标准品各0.010 0 g于100 mL棕色具塞容量瓶中,用乙腈定容,配制成100 mg/L储备液,用空白基质溶液稀释至质量浓度分别为1.00 μg/L、2.00 μg/L、5.00 μg/L、10.0 μ g/L、20.0 μg/L、50.0 μg/L的标准工作溶液。
1.3.2 样品前处理
提取:称取2 g试样(精确至0.01 g)于50 mL聚四氟乙烯具塞离心管中,加入8 mL水,振摇使分散均匀,再加入10 mL乙腈,涡旋振荡1 min,加入4 g无水硫酸镁和1.0 g氯化钠的混合粉末,迅速振摇,涡旋振荡提取15 min,以4 000 r/min离心5 min。
净化:称取(100±5)mgC18置于2mL聚四氟乙烯具塞离心管中,移取待净化液1 mL至此离心管中,涡旋混合2 min,以12 000 r/min离心5 min,0.22 μm有机相滤膜过滤,取滤液备用待测。
1.3.3 色谱及质谱条件
色谱条件:Waters Atlantis T3色谱柱(150 mm×2.1 mm,3.0 μm);柱温:40 ℃;进样量:10 μL;流动相A为乙腈,B为0.1%甲酸(含5 mmol/L甲酸铵)-水(V/V),采用等度洗脱方式洗脱分离:0.0~5.0 min,80%A-20%B;流速:0.35 mL/min。
质谱条件:离子源为电喷雾电离源,离子化模式为正离子模式,气帘气35 psi,毛细管电压5 500 V,离子源温度550 ℃,雾化气压力50 psi,加热辅助气压力50 psi,碰撞气(CAD):medium,采集模式为多反应监测(multiple reaction monitoring,MRM)。
1.3.4 前处理条件和基质效应的探讨
以阴性样品为实验对象,回收率为考察指标,优化固相萃取剂及用量和乙腈提取用量,另外,以空白样品处理后的基质液配制标准溶液,使用基质效应公式计算相应结果。
1.3.5 方法学验证
选取阴性样品进行低浓度加标,以信噪比确定方法的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ),按照定量限的1、2、10倍进行加标回收实验,每个水平重复6次平行样品,所得回收率计算相对标准偏差(relative standard deviation,RSD)。
1.3.6 数据处理
所得数据以Excel 2016软件统计并进行计算,以公式拟合标准曲线方程和计算出回收率和相对标准偏差,目标物的定量离子流图导出后,用Origin 8.5软件重新绘制。
2 结果与分析
2.1 色谱条件及质谱条件的确定
由于茚嗪氟草胺及其3种代谢物在结构上均含有N原子[26],属于亲核型化合物,因此在正离子模式下,更趋向于生成稳定的[M+H]+母离子,在流动相中加入甲酸作为质子供体,可提高一级母离子的质谱响应,另外加入甲酸铵可增大流动相离子强度,改善峰型。4种目标物标准溶液分别在混合流动相的情况下,以流动注射的方式对母离子及各子离子进行扫描,逐步优化母离子和各个子离子的去簇电压(declustering potential,DP)和碰撞能量(collision energy,CE)等参数条件,以到达最大响应,最终选取响应最高的子离子作为定量离子,响应次之的作为辅助定性离子。具体定量离子的提取离子流图和质谱参数分别见图1和表1。
表1 4种目标化合物的质谱分析参数
Table 1 Mass spectrometry parameters of 4 targeted compounds
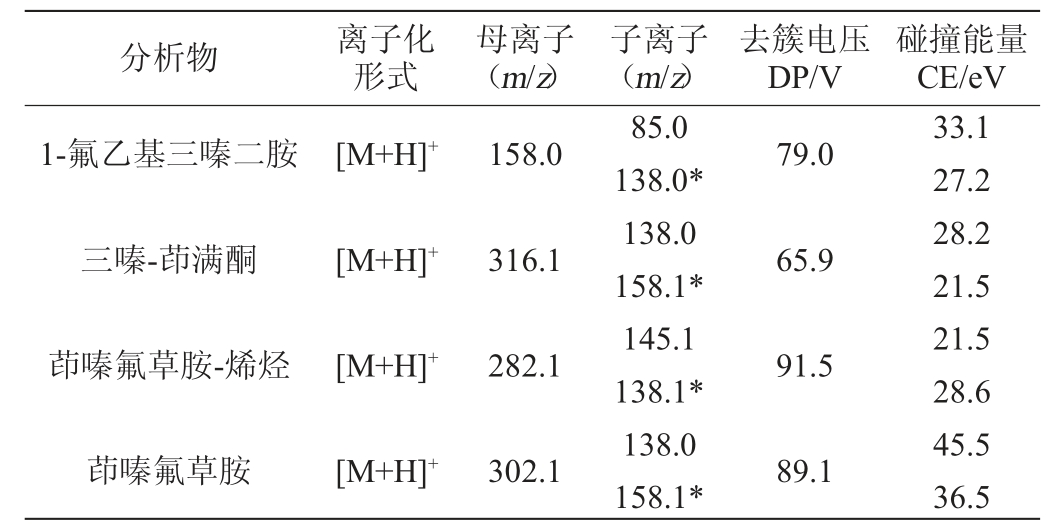
注:“*”为定量离子。
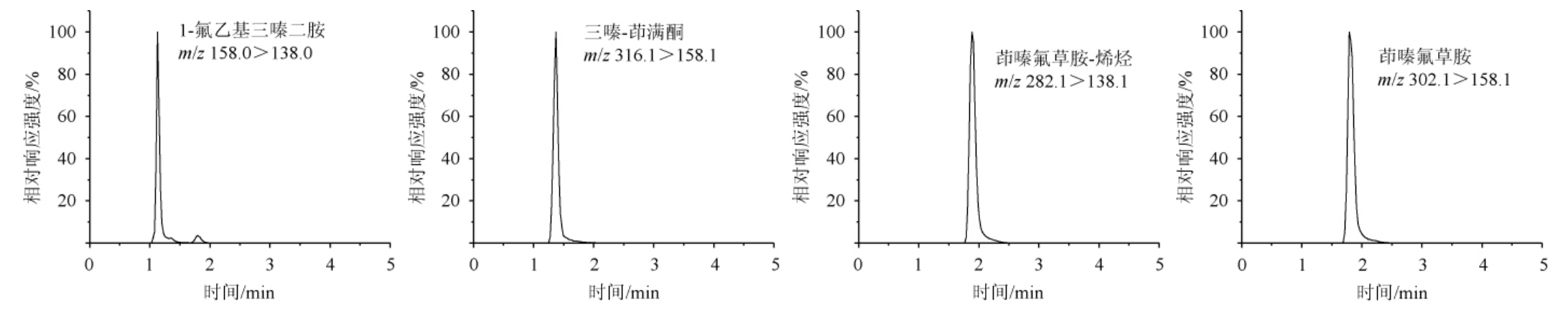
图1 4种目标化合物的UPLC-MS/MS总离子流色谱图
Fig.1 UPLC-MS/MS total ion flow chromatograms of 4 targeted compounds
2.2 茚嗪氟草胺及其代谢物的质谱裂解途径分析
根据茚嗪氟草胺及其代谢物的质谱碎片响应强度,可确定4种目标化合物在质谱中形成的主要碎片为m/z 158和m/z 138,4种目标化合物均选择这两个碎片作为定量离子。在二级质谱碰撞电压的轰击下,三嗪环上的仲胺基-NH所连接的C-N键断裂,三嗪环上的N结合H+形成带正电荷,质荷比为m/z 158和m/z 138的碎片通过四极杆,其余部分带负电或作为中性粒子丢失,而部分m/z 158的碎片进一步丢失一分子的F和H,形成双键,继续产生m/z 138的碎片。具体途径见图2。最终,以化合物的母离子和响应最高的两个子离子的质荷比,结合出峰时间进行定性。
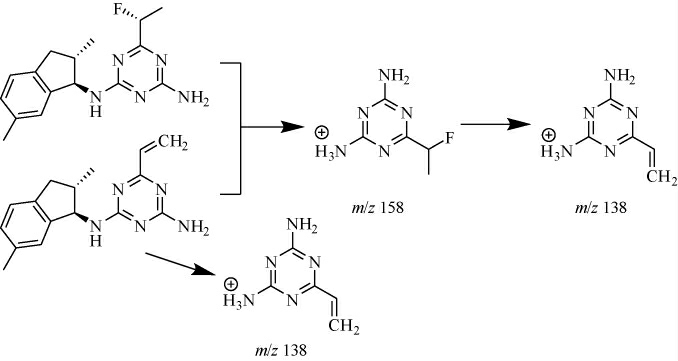
图2 4种目标化合物的质谱裂解途径
Fig.2 Mass spectrometry fragmentation pathways of 4 targeted compounds
2.3 净化剂的种类选择及用量优化
实验前期先使用100 mg的PSA、GCB、C18和Al-N对4种目标物的标准溶液进行吸附,以考察不同的固相萃取剂对4种目标物的吸附程度,结果见图3。由图3可知,C18和Al-N对4种目标物的吸附效果较小,但Al-N相对于C18,对1-氟乙基三嗪二胺的吸附仍然较大,回收率只有57.6%,而C18处理后,4种目标物的回收率均在88%~102%之间,因此C18作为固相萃取剂进行进一步的用量优化。
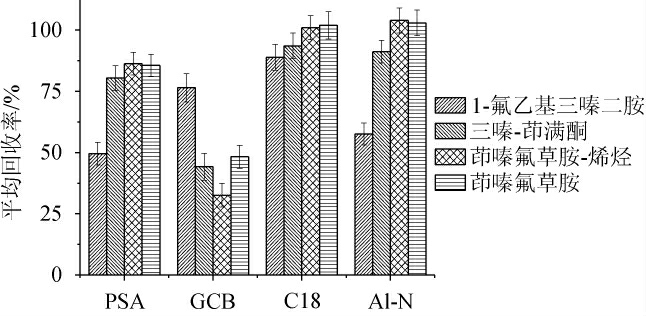
图3 不同萃取剂对4种目标化合物回收率的影响(n=6)
Fig.3 Effect of different extractants on recovery rate of 4 targeted compounds (n=6)
分别使用50 mg、75 mg、100 mg、125 mg、150 mg的C18固相萃取剂进行实验,重复6次平行样品,结果见图4。由图4可知,当用量<100 mg时,4种目标物回收率较低,可能是由于净化不充分,分析结果受到杂质的影响,从而回收率变低。而当用量>100 mg之后,回收率变化不明显,说明C18使用量在100~150 mg之间,不会对目标物产生明显的吸附,为了降低检验成本,最终选择100 mg为净化用量。
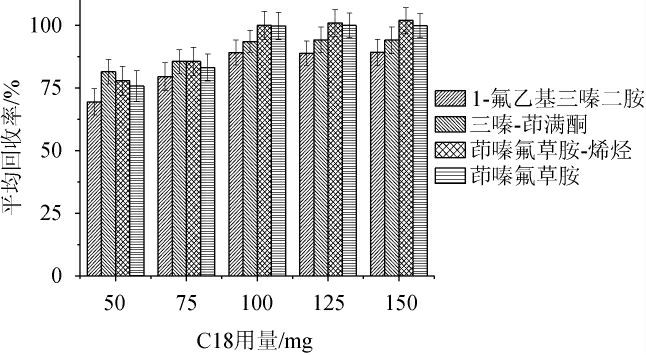
图4 不同C18用量对4种目标化合物回收率的影响(n=6)
Fig.4 Effect different of C18 dosage on recovery rate of 4 targeted compounds (n=6)
2.4 乙腈用量对回收率的影响
在C18用量为100 mg的条件下,以啤酒作为实验样品,选择5 mL、10 mL、15 mL、20 mL、25 mL乙腈进行提取实验,以对应体积空白基质液配得的基质曲线进行校正,以确保基质效应不会因乙腈稀释而变化,最终回收率作为考察依据。结果表明,乙腈用量为10 mL时,回收率达到分析测定要求,当用量继续增大,回收率变化不明显,综合考虑操作便捷性和耗材成本,最终选取10 mL为最佳乙腈用量。
2.5 基质效应分析
由于啤酒经小麦发酵而制得,因此啤酒中含有大量的氨基酸、多肽、酒精和还原糖等小分子物质,在离子化的过程中会产生较强的基质效应(matrix effect,ME)。实验分别使用空白基质溶液和乙腈按照1.3.1的方法配制标准曲线于仪器测定。以ME值计算公式:(k1/k2-1)×100%计算基质效应程度,其中k1为基质曲线斜率,k2为纯溶剂曲线斜率,结果见表2。由表2可知,4种目标化合物基质均呈负效应,且抑制率远超过-20%,抑制效应明显,因此需要使用基质曲线进行定量计算。
表2 4种目标化合物的基质效应值
Table 2 Matrix effect value of 4 targeted compounds

2.6 线性方程、方法检出限和定量限
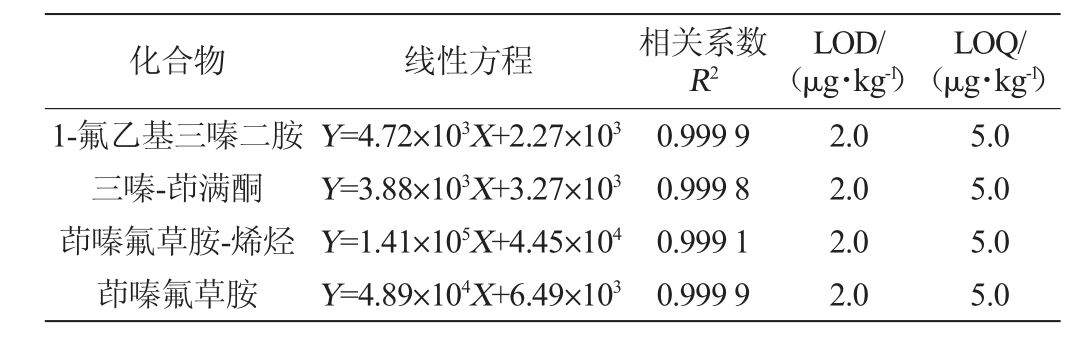
按照1.3.2的前处理方法处理空白样品,所得空白基质液配制基质曲线,质量浓度范围为1.0~50 μg/L。在优化后的仪器条件下进行测定,以质量浓度为横坐标(X)和峰面积为纵坐标(Y)采用Excel 2016软件中拟合曲线方程,并得出相关系数R2。结果表明,相关系数R2均大于0.999,说明线性关系较好,曲线能准确定量。同时通过低浓度的加标实验,以信噪比3倍(S/N=3)和信噪比10倍(S/N=10)确定方法检出限(LOD)和定量限(LOQ),4种目标化合物的LOD为2.0 μg/kg,LOQ为5.0 μg/kg,方法整体灵敏度较高,满足一般产品除草剂残留量的检测需求,具体线性方程和灵敏度参数见表3。
表3 4种目标化合物线性方程及灵敏度参数
Table 3 Linear equations and sensitivity parameters of 4 targeted compounds
2.7 加标回收率试验及精密度试验
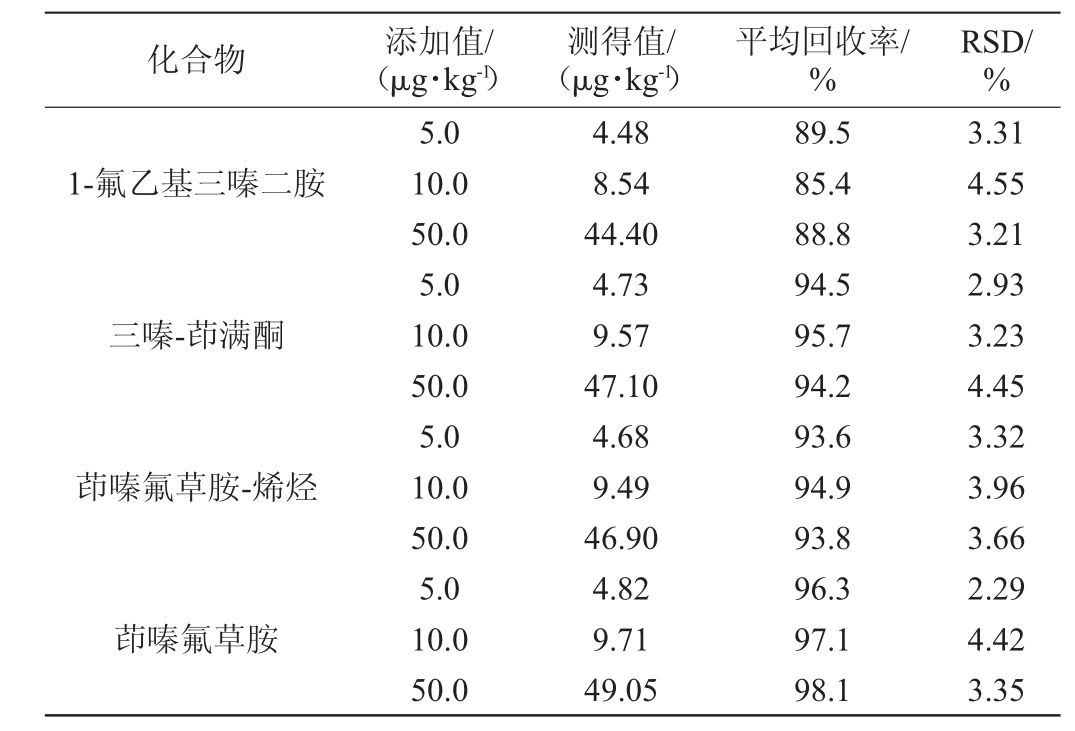
选取市售啤酒作为加标实验样品,以4种目标化合物的方法定量限为基准进行1、2、10倍水平的添加,每个水平日内重复6个平行样品测定,计算出相应的回收率和相对标准偏差。结果见表4。由表4可知,4种目标化合物的平均回收率为85.4%~98.1%,精密度试验的相对标准偏差(RSD)为2.29%~4.55%,结果说明方法的回收率高,重现性较好,可用于日常检测中。
表4 4种目标化合物的加标回收率和精密度实验(n=6)
Table 4 Standard recovery rate and precision test of 4 targeted compounds (n=6)
2.8 方法实际应用
实验随机选取实验室日常啤酒样品(进口样品10个,国内样品10个)进行测定,结果均未检出。但在2017年,美国环保署分别对茚嗪氟草胺的毒理性和致癌性开展了风险评估,其中结果认为干啤酒花中,茚嗪氟草胺的使用限量为0.06 mg/kg。因此,本方法可为后续的分析测定方法开发提供技术储备。
3 结论
实验基于分散固相萃取技术结合UPLC-MS/MS建立了啤酒中茚嗪氟草胺及其3种代谢物的分析方法。通过C18固相萃取剂对提取液进行净化,降低了啤酒中杂质对目标物的基质效应,同时提高了回收率,最终结果使用基质曲线进行校正。结合超高效液相色谱和优化的流动相配比,茚嗪氟草胺及其3种代谢物在2 min内完成出峰,且峰型良好。加标回收实验结果表明,准确度和精密度较高,为啤酒中除草剂检测方法的开发与研究提供了一定参考依据。
[1]顾林玲.三嗪类除草剂研究与开发新进展[J].世界农药,2021,43(12):12-23.
[2]McDOUGALL P.AgriService Products Section 2016 Market[R].Phillips McDougall,2017.
[3] QIN G N,WENG L S,XIAO G Y.The Mat# Gene optimized by codon bias of rice(Oryza sativa) enhances resistance to glufosinate[J].J Agric Biotechol,2016,24(10):1457-1465.
[4]ZELJEZIC D,ZUNEC S,BJELIS M,et al.Effects of the chloro-s-triazine herbicide terbuthylazine on DNA integrity in human and mouse cells[J].Environ Sci Pollut Res Int,2018,25(19):19065-19081.
[5] SMITH G A,PEPICH B V,MUNCH D J.Preservation and analytical procedures for the analysis of chloro-s-triazines and their chlorodegradate products in drinking waters using direct injection liquid chromatography tandem mass spectrometry[J].J Chromatogr A,2008,1202(2):138-144.
[6]冶福春,马文林,杨晓龙.不同除草剂及其组合对燕麦田杂草防效、燕麦生理与产量的影响[J].江苏农业科学,2021,49(13):108-112.
[7]刘华,李明,田永强,等.不同除草剂对黄芪生长的影响及对杂草防控效果的研究[J].黑龙江农业科学,2021(12):74-77,83.
[8]陈亚南,吴雨祺,郑火青,等.除草剂对蜜蜂健康影响的研究进展[J].环境昆虫学报,2021,43(5):1162-1167.
[9]李涛,孟丹丹,郭水良,等.17种常用除草剂对蚯蚓的急性毒性[J].生态环境学报,2021,30(6):1269-1275.
[10]蒲建宇,连玉晶,王明辉,等.固相萃取-气相色谱-质谱联用法检测啤酒中酰胺类除草剂及其中间体物质[J].食品安全质量检测学报,2018,9(6):1369-1376.
[11]王丽娟,柯润辉,安红梅,等.超高效液相色谱-串联质谱法测定黄酒和白酒中20种磺酰脲类除草剂[J].酿酒科技,2015(10):118-122.
[12]朱清,龙冰华,陈星航,等.疏水性低共熔溶剂液液微萃取/高效液相色谱法测定豆奶中三嗪类和苯脲类除草剂[J].分析测试学报,2021,40(10):1467-1473.
[13]方海仙,耿慧春,普娅丽,等.微波处理-气相色谱法测定洋葱中5种氯代酰胺类除草剂残留[J].山西农业科学,2022,50(1):54-60.
[14]王盛男,王岩,李雯雯,等.气相色谱法测定土壤中酰胺类除草剂[J].分析试验室,2021,40(1):30-33.
[15]SAHA A,SHABEER T P A,BANERJEE K,et al.Simultaneous analysis of herbicides pendimethalin,oxyfluorfen,imazethapyr and quizalofopp-ethyl by LC-MS/MS and safety evaluation of their harvest time residues in peanut(Arachis hypogaea L.)[J].J Food Sci Technol,2020,52(7):4001-4014.
[16]CHEN T,LIU Z Y,YAO J T,et al.Fenton-like degradation comparison of s-Triazine herbicides in aqueous medium[J].CLEAN-Soil Air Water,2016,44(10):1315-1322.
[17]PATIL C,CALVAYRAC C,ZHOU Y X,et al.Environmental metabolic footprinting:A novel application to study the impact of a natural and a synthetic β-triketone herbicide in soil[J].Sci Total Environ,2016,566-567:552-558.
[18]周敏,沈雄雅,倪娟桢,等.UHPLC-MS-MS同时测定蔬菜中12种磺酰脲类除草剂[J].食品工业,2022,43(1):281-285.
[19]HU M F,QIU J S,ZHANG H,et al.Method development and validation of Indaziflam and its five metabolites in soil,water,and fruits by modified QuEChERS and UHPLC-MS/MS[J].J Agric Food Chem,2018,66(39):10300-10308.
[20]马杰,石矛,王辉龙,等.GC-MS测定生活饮用水及水源水中6种酰胺类除草剂[J].环境卫生学杂志,2021,11(6):537-541.
[21]易守福,梁锋,何青科,等.QuEChERS-气相色谱—三重四极杆质谱法同时测定黑茶中10种酰胺类除草剂残留[J].食品与机械,2021,37(8):57-62.
[22]杨晓凤,洪雪华,陈敏,等.凝胶渗透色谱净化/气相色谱-串联质谱法同时测定大豆中23种酰胺类除草剂残留量[J].农药,2021,60(3):207-210.
[23]SANAGI M M,MUHAMMAD S S,HUSSAIN I,et al.Novel solid-phase membrane tip extraction and gas chromatography with mass spectrometry methods for the rapid analysis of triazine herbicides in real waters[J].J Sep Sci,2015,38(3):433-438.
[24]付琳,袁艳丽,庄件兵,等.QuEChERS/气相色谱-三重四级杆质谱法同时测定粮谷中7种硫代氨基甲酸酯类除草剂[J].粮食科技与经济,2020,45(9):80-81.
[25]朱萌萌,叶群,胡松,等.气相色谱-串联质谱法测定茶叶中10种酸性除草剂的残留量[J].理化检验(化学分册),2019,55(7):762-768.
[26]张嘉俊,邓伟恒,区硕俊,等.高效液相色谱-四极杆/飞行时间质谱法测定粮谷中茚嗪氟草胺及其代谢物[J].分析化学,2021,49(8):1366-1374.