乳酸菌(lactic acid bacteria,LAB)是一类能利用碳水化合物产生大量乳酸的革兰氏阳性细菌的统称,广泛存在于人和动物的肠道以及传统发酵制品等中[1-2]。发酵乳杆菌(Lactobacillus fermentum)CECT 5716是一株分离自健康人乳的乳酸菌,具有极高的安全性[3]。2016年国家卫生和计划生育委员会发布公告(2016年第6号),将发酵乳杆菌CECT 5716列入《可用于婴幼儿食品的菌种名单》,为该菌株在母婴产品中的应用提供了依据。目前,国内外研究学者已对发酵乳杆菌CECT 5716的益生功能开展了大量的研究工作,研究发现,该菌株具有缓解哺乳期妇女乳腺炎[4]、免疫调节[5]、降血压和降血脂[6]等益生功能。
乳酸菌胞外多糖(exopolysaccharides,EPS)是乳酸菌在生长代谢过程中分泌到细胞外的高分子质量碳水化合物聚合物[7]。产EPS的乳酸菌主要有乳杆菌属(Lactobacillus)、明串珠菌属(Trichococcus)和链球菌属(Streptococcus)等[8]。国内外相关研究表明,EPS除具有增黏性、保水性和抗剪切性等理化特性外,还具有多种生理活性,如抗肿瘤、调节肠道菌群和降低血清胆固醇等[9-10]。而发酵乳杆菌CECT 5716拥有的益生功能是否与其EPS相关,其作用的关键分子尚需进行深入研究与揭示,但目前对其EPS的系统研究鲜见报道,因此迫切需要对其EPS展开研究,而较低的产量是其研究受限的关键因素。
本研究采用单因素及正交试验优化了发酵乳杆菌CECT 5716产EPS的培养基成分,并对优化后获得的EPS进行抗氧化活性研究,以期为该菌株EPS的大规模制备及开发其作为天然抗氧化剂提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
发酵乳杆菌(Lactobacillus fermentum)CECT 5716:百施(上海)生物科技有限公司保藏。
1.1.2 培养基
MRS液体培养基[11]:牛肉膏1.0%,酵母膏0.5%,蛋白胨1.0%,葡萄糖2.0%,磷酸氢二钾0.2%,无水乙酸钠0.5%,硫酸镁0.02%,硫酸锰0.005%,柠檬酸氢二胺0.2%,吐温80 0.1%,pH值6.2,115 ℃高压蒸汽灭菌15 min。固体MRS培养基中添加琼脂2%。
1.1.3 试剂
无水乙醇、三氯乙酸、硫酸、苯酚(重蒸馏)、钼酸铵、硫酸钠、铁氰化钾、三氯化铁、过硫酸钾、维生素C(vitamin C,VC)(均为分析纯):江天化工技术股份有限公司;透析袋(截留分子质量8 000 Da):鼎国生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhy drazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(2,2'-Azino-bis(3-ethyl-benzothiazoline-6-sulfonic acid)diammonium salt,ABTS):国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-9600紫外可见分光光度计:北京瑞利分析仪器有限公司;Avanti J-E大容量冷冻离心机:美国Beckman公司;ALPHA 1-2 LD冷冻干燥机:德国CHRIST公司;Anaerobox IV型厌氧培养箱:美国GeneScience公司;Thermo全波长酶标仪:美国Thermo Fisher公司。
1.3 试验方法
1.3.1 发酵乳杆菌CECT 5716的培养条件
将保藏于-80 ℃的发酵乳杆菌CECT 5716划线接种于MRS固体培养基上,37 ℃静置培养48 h,挑取单菌落,再重复进行2次平板划线,挑取单菌落接种于MRS液体培养基中,37℃静置培养12 h,并传代两次以使菌株的活力最大化。将活化后的菌株以2%(V/V)的接种量接种于MRS液体培养基中,37 ℃静置培养16 h。
1.3.2 发酵乳杆菌CECT 5716产EPS培养基优化单因素试验
碳源种类、复配比例及其添加量的优化:以MRS液体培养基(对照)为基础,使用不同的碳源(麦芽糖、蔗糖、乳糖和果糖)替代MRS培养基中的碳源(葡萄糖),以确定最佳碳源的种类。在最佳碳源种类的基础上,对麦芽糖和蔗糖进行了复配,复配比例为3∶1、2∶1、1∶1、1∶2、1∶3。在最佳复配比(麦芽糖∶蔗糖=2∶1)的基础上进行碳源添加量(1.00%、1.50%、2.00%、2.50%、3.00%、3.50%、4.00%)的优化。
氮源种类及其添加量的优化:以MRS液体培养基(对照)为基础,使用不同氮源(蛋白胨、牛肉膏、酵母膏、胰蛋白胨、3072乳清蛋白水解物和3065乳清蛋白水解物)替代MRS培养基中的氮源(蛋白胨、牛肉膏和酵母膏),以确定最佳氮源的种类。在最佳氮源种类的基础上进行氮源添加量(2.00%、2.50%、3.00%、3.50%、4.00%、4.50%)的优化。
L-半胱氨酸盐酸盐添加量的优化:以MRS液体培养基(对照)为基础,考察L-半胱氨酸盐酸盐不同添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%)对发酵乳杆菌CECT 5716 EPS产量的影响。
1.3.3 发酵乳杆菌CECT 5716产EPS培养基优化正交试验
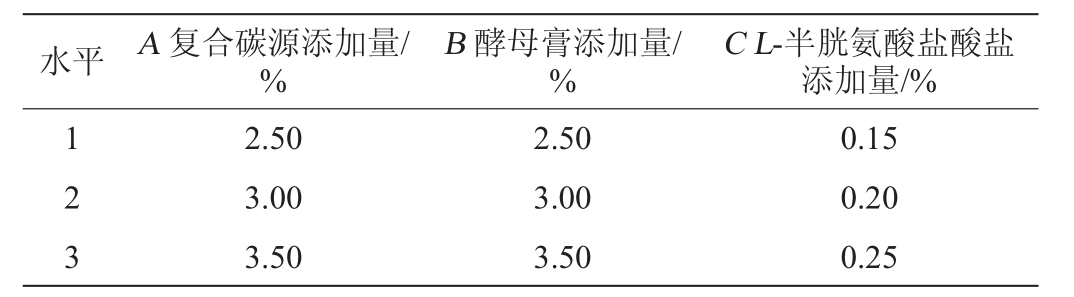
根据单因素试验结果,筛选出显著影响EPS产量的3个因素复合碳源(麦芽糖∶蔗糖=2∶1)添加量(A)、酵母膏添加量(B)、L-半胱氨酸盐酸盐添加量(C)。以EPS产量(Y)为考察指标,设计3因素3水平L9(33)正交试验,优化培养基组成。正交试验因素与水平见表1。
表1 发酵乳杆菌CECT 5716产胞外多糖培养基优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for medium optimization of exopolysaccharide production by Lactobacillus fermentum CECT 5716
1.3.4 EPS的制备及含量的测定
根据BENGOA A A等[12]方法并略作修改制备EPS。取发酵液在100 ℃加热30 min,冷却后离心(4 ℃、8 000 r/min、20 min)。取上清,加入2倍体积的无水乙醇,4 ℃静置过夜后,离心(4 ℃、8 000 r/min、20 min)。将沉淀复溶于适量蒸馏水中,加入10%三氯乙酸,置于磁力搅拌器上冰浴4 h,离心(4 ℃、8 000 r/min、20 min),取上清,将其pH值调至7.0,加2倍体积的无水乙醇进行复醇沉,4 ℃静置过夜后离心(4 ℃、8 000 r/min、20 min),沉淀复溶于少量蒸馏水中,透析(截留分子质量8 000 Da)2~3 d,定容,采用苯酚-硫酸法[13]测定透析液中EPS的含量,将透析液冷冻干燥得EPS。
1.3.5 EPS纯度的测定
精确称取100.00 mg EPS,用适量蒸馏水溶解,转移至100 mL容量瓶中定容,混匀,得样品溶液,采用苯酚-硫酸法[13]测定样品中的多糖含量,计算EPS的纯度,其计算公式如下:
式中:C为稀释后样品的多糖含量,mg/L;N为稀释倍数;V为样品溶液的体积,L;M为样品的质量,mg。
1.3.6 EPS的体外抗氧化活性测定
DPPH自由基清除活性的测定:参考ZHANG Q等[14]的方法;ABTS自由基清除活性的测定:参考XU Y M等[15]的方法;总抗氧化能力的测定:参考SHANKAR T等[16]的方法;Fe3+总还原力的测定:参考WANG K等[17]的方法。
1.3.7 数据处理
使用Graphpad Prism 8.0软件进行数据分析和绘图。所有试验均重复3次,结果表示为“平均值±标准差”。
2 结果与分析
2.1 发酵乳杆菌CECT 5716产EPS培养基优化单因素试验结果
2.1.1 碳源种类、复配比例及添加量的优化
碳源是微生物生长代谢过程中的必需物质,对乳酸菌EPS的产量及其相对分子质量、单糖组成和摩尔比都有较大的影响[18]。不同碳源对EPS产量的影响见图1A。由图1A可知,当碳源为麦芽糖时,EPS的产量最高,为(305.67±9.71)mg/L,是对照组的1.25倍;其余依次为蔗糖、乳糖和果糖。不同碳源导致EPS产量的差异,可能是因为该菌对各种碳源的利用能力不同,导致菌株代谢速率等方面的差异,从侧面也反映出EPS合成途径的调节可能依赖于碳水化合物的不同[19]。
综合考虑EPS产量与降低成本的因素,选择将麦芽糖和蔗糖进行复配作为碳源,考察其复配比例对EPS产量的影响,结果见图1B。由图1B可知,当麦芽糖∶蔗糖=2∶1时,EPS的产量最高,为(364.65±13.89)mg/L。因此,选用麦芽糖和蔗糖以2∶1的比例复配作为碳源。
碳源浓度过低或过高都不利于菌体的正常生长及其代谢产物的合成,故碳源添加量对EPS的产量也有显著影响[20]。不同复合碳源添加量对EPS产量的影响,结果见图1C。由图1C可知,随着复合碳源添加量的升高,EPS产量呈现先上升后下降的趋势。当复合碳源添加量为3%时,EPS产量最高,为(421.11±6.78)mg/L。复合碳源添加量过高导致EPS产量下降,分析原因可能是由于发酵过程中产生了“葡萄糖效应”,导致菌株代谢异常,乳酸等初级代谢产物大量积累,次级代谢受到抑制从而影响了EPS的合成[8]。因此,确定最优复合碳源添加量为3%。
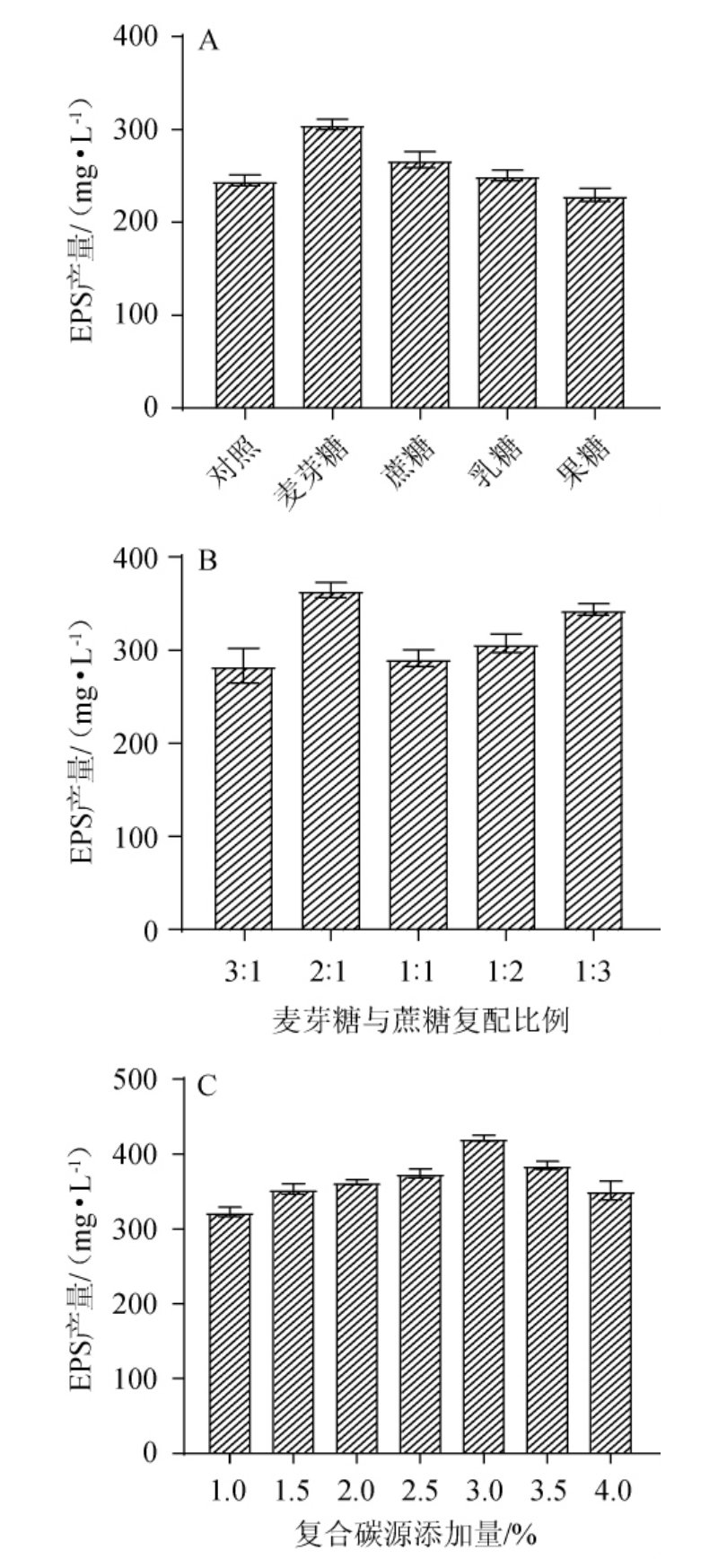
图1 碳源种类(A)、复配比例(B)及复合碳源添加量(C)对发酵乳杆菌CECT 5716产胞外多糖的影响
Fig.1 Effects of carbon source type(A),compound proportion(B)and compound carbon source addition(C)on exopolysaccharide production by Lactobacillus fermentum CECT 5716
2.1.2 氮源种类及添加量的优化
氮源在乳酸菌的生长及其代谢产物的合成中,发挥着重要的作用[21]。不同氮源对EPS产量的影响见图2A。由图2A可知,不同氮源对EPS产量有较大的影响,当氮源为酵母膏时,EPS产量最高,为(740.15±19.64)mg/L,是对照组的3.02倍,显著高于其他氮源。这可能是因为酵母膏富含蛋白质、氨基酸和维生素,可被菌体更好地利用[22]。因此,确定最优氮源为酵母膏。酵母膏添加量对发酵乳杆菌CECT 5716 EPS产量的影响见图2B。由图2B可知,酵母膏添加量对发酵乳杆菌CECT5716 EPS产量的影响显著,随着酵母膏添加量的升高,EPS产量呈先升高后下降的趋势,这可能是由于氮源可作为能源物质而被菌株利用,促进其代谢并合成EPS,而氮源添加量过高,导致菌株产生过量的铵、硝态氮,从而抑制了其EPS的积累[23]。当酵母膏添加量为3%时,EPS产量最高,为(1 077.68±20.67)mg/L。因此,确定酵母膏最优添加量为3%。
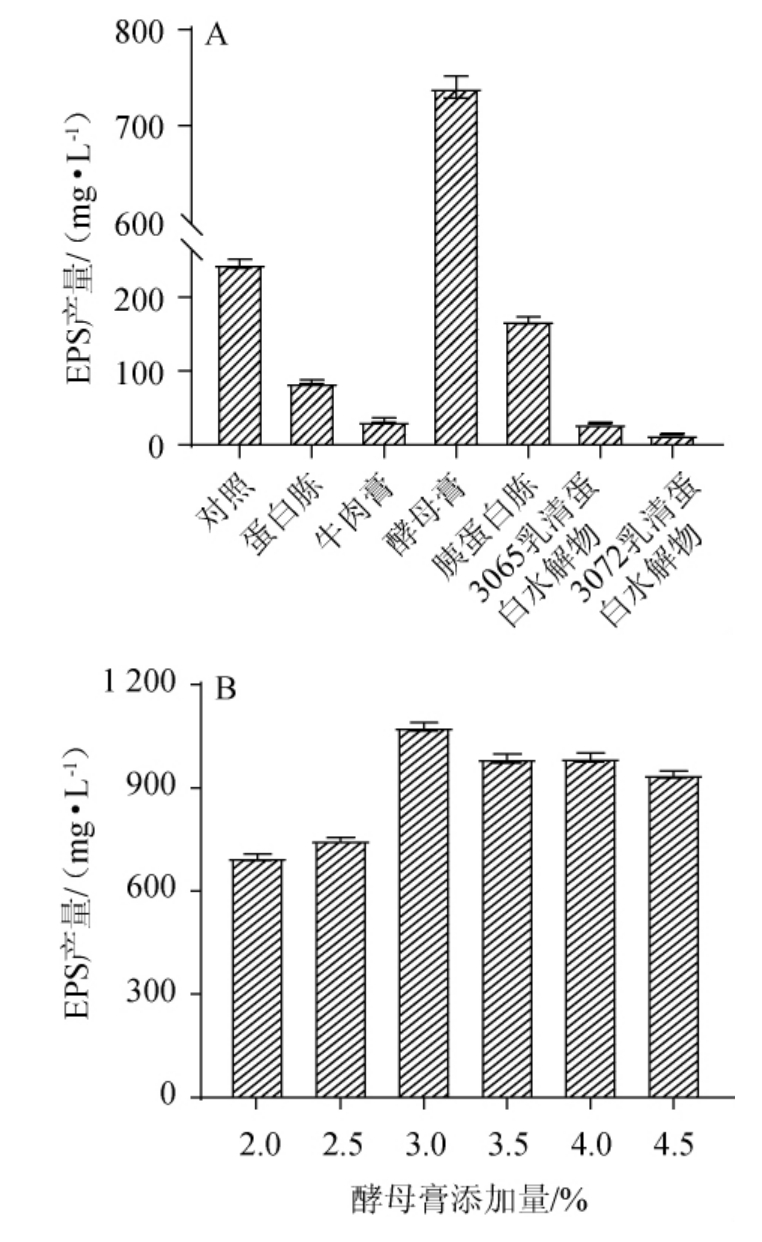
图2 氮源种类(A)及酵母膏添加量(B)对发酵乳杆菌CECT 5716产胞外多糖的影响
Fig.2 Effects of nitrogen source type (A) and yeast extract addition(B) on exopolysaccharide production by Lactobacillus fermentum CECT 5716
2.1.3 L-半胱氨酸盐酸盐添加量的优化
L-半胱氨酸盐酸盐常作为一种还原剂加入培养基中,使培养基保持一个相对厌氧的环境[24]。L-半胱氨酸盐酸盐不同添加量对EPS产量的影响见图3。
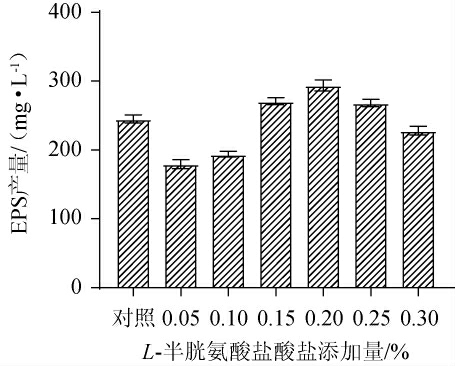
图3 L-半胱氨酸盐酸盐添加量对发酵乳杆菌CECT 5716产胞外多糖的影响
Fig.3 Effects of L-cysteine hydrochloride addition on exopolysaccharide production by Lactobacillus fermentum CECT 5716
由图3可知,与对照组相比,添加一定量的L-半胱氨酸盐酸盐可以提高EPS的产量,当L-半胱氨酸盐酸盐添加量为0.2%时,EPS产量最高,为(293.81±13.79)mg/L,是对照组的1.20倍。这可能与其能够改变培养基的氧化还原电位,从而更有利于发酵乳杆菌CECT 5716的生长及代谢有关[25]。因此,确定L-半胱氨酸盐酸盐最优添加量为0.2%。
2.2 发酵乳杆菌CECT 5716产EPS培养基优化正交试验结果
在单因素试验的基础上,进一步通过正交试验优化培养基组成,正交试验设计及结果见表2。由表2可知,通过极差分析,L-半胱氨酸盐酸盐是影响EPS产量的最主要因素,麦芽糖和蔗糖添加量次之,酵母膏添加量影响最小。最佳培养基配方组合为A3B3C2,因为在A3与A2以及B3与B1水平下,EPS的产量相差不大,考虑到生产成本等因素,最终选择A2B1C2为最佳组合,即碳源添加量3%、酵母膏2.5%、L-半胱氨酸盐酸盐0.2%。在此条件下,EPS产量为(1 560.15±22.64)mg/L。验证试验得EPS产量为(1 575±22.91)mg/L,证明该正交试验设计成功。
表2 发酵乳杆菌CECT 5716产EPS培养基优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for medium optimization of exopolysaccharide production by Lactobacillus fermentum CECT 5716
2.3 胞外多糖的纯度
经测定,优化后所得EPS的纯度为(92.2±1.8)%。
2.4 胞外多糖的抗氧化活性
2.4.1 DPPH自由基清除活性
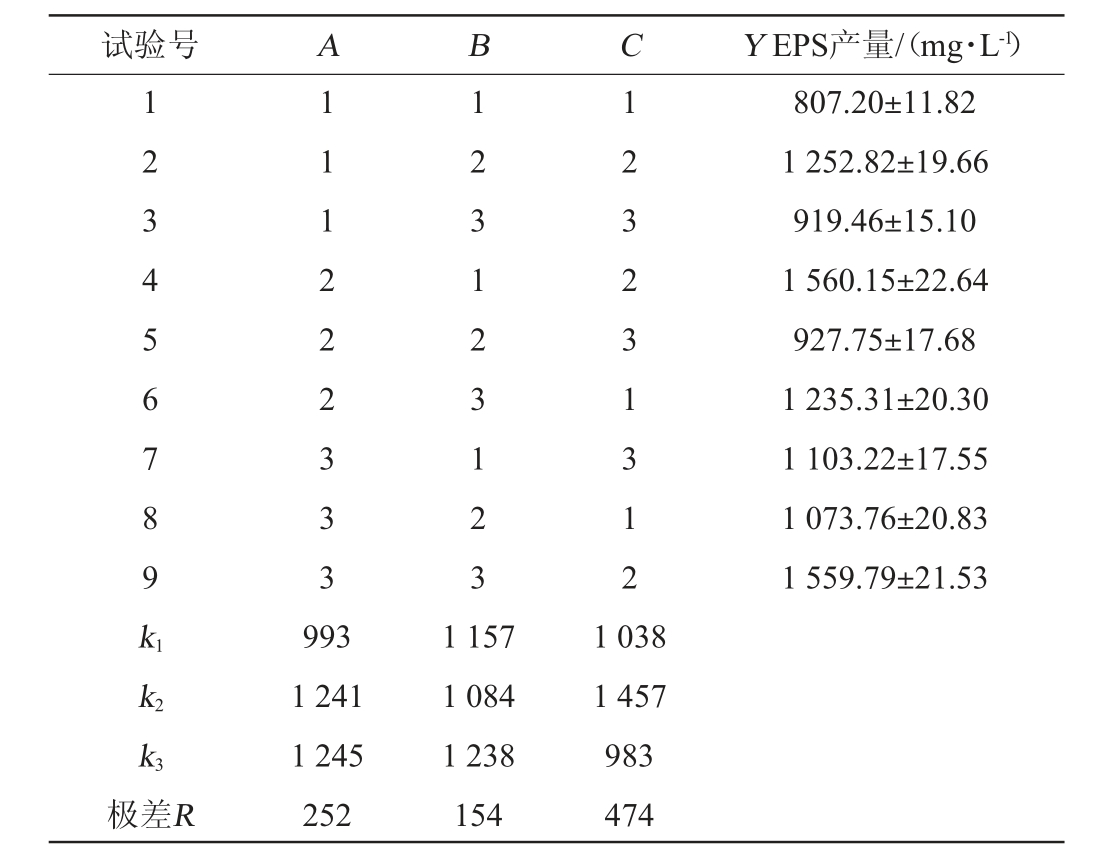
DPPH自由基可与自由基清除剂(如EPS、多酚和维生素E等)反应,其溶液吸光度值的变化可用于评估自由基清除剂的抗氧化能力[26]。不同质量浓度的EPS对DPPH自由基的清除能力见图4。由图4可知,当质量浓度为0~8 mg/mL时,EPS和VC对DPPH自由基的清除能力随着质量浓度的增加而增强,但EPS对DPPH自由基的清除能力低于相同质量浓度的VC,EPS对DPPH自由基的半抑制浓度(50%inhibition concentration,IC50)值为0.24 mg/mL。当EPS质量浓度为8 mg/mL时,EPS、VC对DPPH自由基的清除率分别为(84.17±1.30)%、(89.62±1.55)%。EPS清除自由基的机制可能是由于EPS与自由基结合并形成了稳定的分子条件,从而终止了自由基的进一步反应[27]。
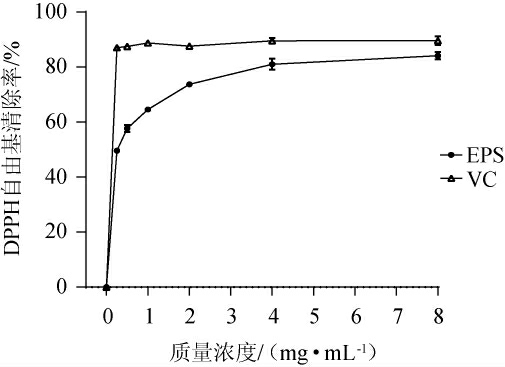
图4 胞外多糖对DPPH自由基的清除活性
Fig.4 Scavenging activity of exopolysaccharide on DPPH radical
2.4.2 ABTS自由基清除活性
不同质量浓度的EPS对ABTS自由基的清除能力见图5。由图5可知,当质量浓度为0~8 mg/mL,EPS和VC对ABTS自由基的清除能力随着质量浓度的增加而增强,但EPS对ABTS自由基的清除能力低于相同质量浓度的VC的清除能力,EPS对ABTS自由基的IC50值为14.81 mg/mL。当EPS的质量浓度为8 mg/mL时,EPS对ABTS自由基的清除率为(35.37±1.24)%。EPS具有较高的ABTS自由基清除能力可能是由于其能够将自由基由活性状态转化为稳定状态,并通过向自由基提供电子来终止自由基链式反应[28]。
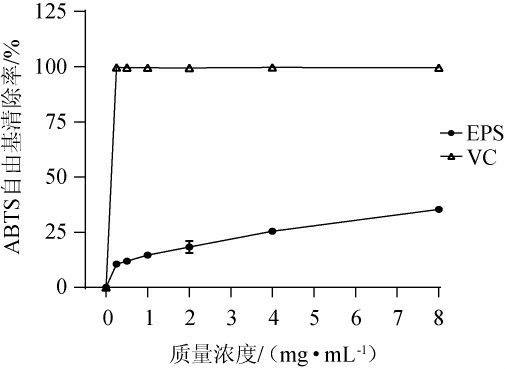
图5 胞外多糖对ABTS自由基的清除活性
Fig.5 Scavenging activity of exopolysaccharide on ABTS radical
2.4.3 总抗氧化能力
总抗氧化能力反映的是非酶促抗氧化的能力[29],不同质量浓度的EPS的总抗氧化能力见图6。由图6可知,当质量浓度为0~8 mg/mL时,EPS和VC的总抗氧化能力随着其质量浓度的增加而增强,且在同一质量浓度下,EPS的总抗氧化能力低于VC,当EPS质量浓度为8 mg/mL时,溶液的吸光度值为0.31±0.004。
图6 胞外多糖的总抗氧化能力
Fig.6 Total antioxidant capacity of exopolysaccharide
2.4.4 Fe3+总还原力
天然活性物质的铁还原能力可作为其电子给体活性的重要指标,常用来评价抗氧化剂的抗氧化能力[30]。为了解EPS将Fe3+还原为其亚铁形式的能力[31],测定不同质量浓度EPS的Fe3+总还原力,结果见图7。由图7可知,当质量浓度为0~8 mg/mL时,EPS和VC的Fe3+总还原力随着其质量浓度的增加而增强,且在同一质量浓度下,EPS的Fe3+总还原力低于VC。当EPS的质量浓度为8 mg/mL时,EPS的Fe3+总还原力为0.55±0.01。
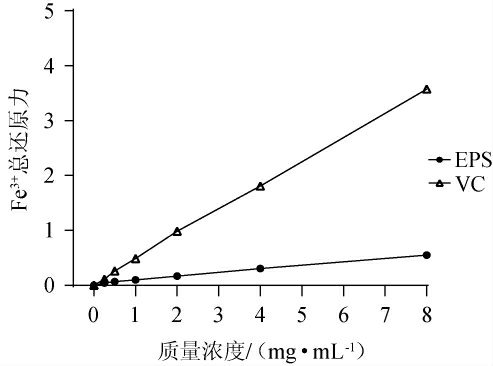
图7 胞外多糖的Fe3+总还原力
Fig.7 Fe3+total reducing power of exopolysaccharide
综上结果表明,该EPS具有一定的抗氧化能力,抗氧化效果与其质量浓度呈正相关。但EPS在各种反应体系中显示出不同的抗氧化能力,可能是由于EPS的单糖组成、羟基含量以及供氢能力不同等因素导致的[32]。
3 结论
通过单因素和正交试验优化得到发酵乳杆菌CECT 5716产EPS的最优培养基组成为:麦芽糖2.0%、蔗糖1.0%、酵母膏2.5%、L-半胱氨酸盐酸盐0.2%、乙酸钠0.5%、磷酸氢二钾0.2%、硫酸镁0.02%、硫酸锰0.005%、柠檬酸氢二胺0.2%、吐温80 0.1%。在此条件下,EPS产量达到(1 575±22.91)mg/L,是优化前的6.38倍。EPS的抗氧化活性与其质量浓度成正比,当EPS的质量浓度为8 mg/mL时,对DPPH自由基的清除率为(84.17±1.30)%、对ABTS自由基的清除率为(35.37±1.24)%、总抗氧化能力为0.31±0.01和Fe3+总还原力为0.55±0.01。本研究优化了发酵乳杆菌CECT 5716产EPS的培养基成分,并研究了该菌株产生的EPS的抗氧化特性,为进一步揭示发酵乳杆菌CECT 5716抗氧化的功能及作用机制的研究奠定了基础,也为发酵乳杆菌CECT 5716的大规模制备及其结构的研究提供了理论依据。
[1]黄承敏,陈绮,游善兵,等.乳酸菌胞外多糖的分类及生物活性研究进展[J].中国乳业,2019,213(9):59-62.
[2]黄宁馨,鲁群,丁士勇,等.复合乳酸菌发酵过程中枸杞果汁品质及抗氧化活性变化[J].华中农业大学学报,2021,40(6):186-194.
[3] OLIVARES M,DÍAZ-ROPERO M P,MARTÍN R,et al.Antimicrobial potential of four Lactobacillus strains isolated from breast milk[J].J Appl Microbiol,2006,101(1):72-79.
[4] BOND D M,MORRIS J M,NASSAR N.Study protocol: evaluation of the probiotic Lactobacillus fermentum CECT5716 for the prevention of mastitis in breastfeeding women: a randomised controlled trial[J].BMC Pregnancy Childbirth,2017,17(1):148-155.
[5]TORAL M,ROMERO M,RODR?GUEZ-NOGALES A,et al.Lactobacillus fermentum improves tacrolimus-induced hypertension by restoring vascular redox state and improving eNOS coupling[J].Mol Nutr Food Res,2018,62(14):1800033.
[6]ROBLES-VERA I,TORAL M,VISITACIÓN N,et al.Probiotics prevent dysbiosis and the rise in blood pressure in genetic hypertension: role of short-chain fatty acids[J].Mol Nutr Food Res,2020,64(6):1900616.
[7] JIANG G Y,GAN L Z,LI X G,et al.Characterization of structural and physicochemical properties of an exopolysaccharide produced by Enterococcus sp.F2 from fermented soya beans[J].Front Microbiol,2021,12:744007.
[8]刘丽娜,郭尚旭,姜静,等.融合魏斯氏菌(Weissella confusa)XG-3产胞外多糖条件研究[J].黑龙江大学工程学报,2020,11(3):85-91.
[9]司天昭,柳陈坚,秦晓萌,等.植物乳杆菌YM-2菌株胞外多糖生物合成工艺优化[J].食品科学,2017,38(10):24-30.
[10]梁增澜,李慧,张睿,等.植物乳杆菌KF5胞外多糖合成条件的优化研究[J].食品研究与开发,2019,40(3):14-18.
[11]严婷,王鑫磊,朱海霞,等.乳酸菌BC299的鉴定及其对免疫抑制小鼠肠道菌群的影响[J].中国酿造,2021,40(5):157-162.
[12]BENGOA A A,DARDIS C,GAGLIARINI N,et al.Exopolysaccharides from Lactobacillus paracasei isolated from kefir as potential bioactive compounds for microbiota modulation[J].Front Microbiol,2020,11:583254.
[13]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28(3):350-356.
[14] ZHANG Q,WANG J,SUN Q,et al.Characterization and antioxidant activity of released exopolysaccharide from potential probiotic Leu-conostoc mesenteroides LM187[J].J Microbiol Biotechnol,2021,31(8):1144-1153.
[15] XU Y M,CUI Y L,WANG X,et al.Purification,characterization and bioactivity of exopolysaccharides produced by Lactobacillus plantarum KX041[J].Int J Biol Macromol,2019,128:480-492.
[16]SHANKAR T,PALPPERUMAL S,KATHIRESAN D,et al.Biomedical and therapeutic potential of exopolysaccharides by Lactobacillus paracasei isolated from sauerkraut:Screening and characterization[J].Saudi J Biol Sci,2021,28(5):2943-2950.
[17]WANG K,LI W,RUI X,et al.Structural characterization and bioactivity of released exopolysaccharides from Lactobacillus plantarum 70810[J].Int J Biol Macromol,2014,67:71-78.
[18]周佳敏.鼠李糖乳杆菌胞外多糖的纯化及降脂和调节肠道菌群活性研究[D].杭州:浙江工商大学,2020.
[19] IMRAN M Y M,REEHANA N,JAYARAJ K A,et al.Statistical optimization of exopolysaccharide production by Lactobacillus plantarum NTMI05 and NTMI20[J].Int J Biol Macromol,2016,93:731-745.
[20]梁雪.Lactobacillus plantarum 12产胞外多糖的条件优化及结构研究[D].大连:大连工业大学,2018.
[21]王毓.柠檬明串珠菌B-2产胞外多糖发酵条件优化及多糖功能特性研究[D].天津:天津大学,2020.
[22] POKHREL C P,OHGA S.Submerged culture conditions for mycelial yield and polysaccharides production by Lyophyllum decastes[J].Food Chem,2007,105(2):641-646.
[23]刘天华,乔梦,李乐乐,等.海洋细菌0417产胞外多糖发酵条件的优化[J].中国酿造,2011,30(6):107-110.
[24] PARK S Y,WOODWARD C L,BIRKHOLD S G,et al. In vitro comparison of anaerobic and aerobic growth response of salmonella typhimurium to zinc addition[J].J Food Safety,2002,22(4):219-229.
[25]HENNESS A A,ROSS R P,DEVERY R,et al.Optimization of a reconstituted skim milk based medium for enhanced CLA production by Bifidobacteria[J].J Appl Microbiol,2010,106(4):1315-1327.
[26]胡佳坤.蒙古黑果枸杞果实多糖的分离工艺、抗氧化活性及其益生元应用[D].杨凌:西北农林科技大学,2021.
[27]FOOLADI T,SOUDI M R,ALIMADADI N,et al.Bioactive exopolysaccharide from Neopestalotiopsis sp.strain SKE15:Production,characterization and optimization[J].Int J Biol Macromol,2019,129:127-139.
[28] LIU Y,ZHANG B,IBRAHIM S A,et al.Purification,characterization and antioxidant activity of polysaccharides from Flammulina velutipes residue[J].Carbohydr Polym,2016,145:71-77.
[29]PAN D D,MEI X M.Antioxidant activity of an exopolysaccharide purified from Lactococcus lactis subsp.lactis 12[J].Carbohydr Polym,2010,80(3):908-914.
[30]屈咪.胃肠液消化对黑木耳多糖抗氧化活性和免疫活性研究[D].上海:华东理工大学,2021.
[31] LAKRA A K,DOMDI L,TILWANI Y M.Physicochemical and functional characterization of mannan exopolysaccharide from Weissella confusa MD1 with bioactivities[J].Int J Biol Macromol,2020,143:797-805.
[32]YE G B,CHEN Y H,WANG C L,et al.Purification and characterization of exopolysaccharide produced by Weissella cibaria YB-1 from pickle Chinese cabbage[J].Int J Biol Macromol,2018,120:1315-1321.