近年来,南极地区微生物学的研究逐步引起了人们的注意,南极的生态系统简单,生物的种类相对较少,而微生物因为具有较强的适应性,成为南极地区生态结构和物质能量循环中的重要组成[1-2]。在研究和开发生物活性物质方面,极地微生物具有明显的优势和特点[3-5]。极地微生物为了适应极地酷寒、干燥、强辐射的自然环境,生理特点和代谢机制会产生不同于陆地微生物的变化,因此更容易产生新的抗菌活性物质[6-8]。如倪孟祥等[9]在南极泥样品中分离出的一株放线菌——生金链霉菌(Streptomyces aure-ofaciens),其代谢产生的抗菌活性物质稳定性好,大部分为极性中等的弱碱性化合物,对多重耐药菌有良好的抑制作用,有很好的研发价值;TEDESCO P等[10]从南极假单胞菌属菌株BNT1的代谢产物中分离得到三种鼠李糖脂,对洋葱伯克霍尔德菌(Burkholderia cepacia)的最低抑菌浓度(minimum inhibitory concentration,MIC)<1 μg/mL。
铜绿假单胞菌(Pseudomonas aeruginosa)是一种典型的条件致病菌,属革兰氏阴性杆菌,是医院感染的主要病原菌之一,广泛分布于土壤、水体和空气中[11-13]。它是一种重要的食源性致病菌,其产生的毒力因子可引起饮用水的污染和食物中毒,导致感染者产生呕吐、头晕、腹泻等症状[14-15]。目前,常用的抗铜绿假单胞菌药物主要有β-内酰胺类(如头孢菌素类、青霉素类、碳青霉烯类等)、氟喹诺酮类、氨基糖苷类等,但是由于抗生素的广泛使用和滥用,铜绿假单胞菌的耐药性不断增强,大大增加了临床治疗的难度[16]。从天然资源中开发新型有效的抗菌化合物已成为研究的趋势,近年来,对利用中草药抑制铜绿假单胞菌的研究较多[17-19],而利用微生物的拮抗作用的研究较少。如陈小春等[20]研究发现,分离自东太平洋海山区的太平洋杆菌(Oceanobacillus sp.)XC22919发酵液粗提物可以抑制野生型铜绿假单胞菌PAO1相关毒素的分泌;ZHOU J W等[21]研究发现,黄瓜织球壳菌(Plectosphaerella cucumerina)的代谢产物有抑制铜绿假单胞菌的作用。
本研究以铜绿假单胞菌为指示菌,从南极团结湖沉积物中分离、纯化、筛选拮抗菌,采用形态观察、生理生化实验及16S rDNA基因序列分析对其进行菌种鉴定,并对其抑菌广谱性进行研究,为下一步研究其抗菌机理、活性代谢产物等奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
南极团结湖沉积物样品:自然资源部第一海洋研究所海洋生态环境科学与技术重点实验室提供,-20 ℃保存。
1.1.2 菌株
铜绿假单胞菌(Pseudomonas aeruginosa)PAO1、肺炎克雷伯氏菌(Klebsiella pneumoniae)BNCC 186113、大肠杆菌(Escherichia coli)CMCC 44102、副溶血弧菌(Vibrio parahaemolyticu)CGMCC 1.1616、金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538、鼠伤寒沙门氏菌(Salmonella typhimurium)CICC 21484、屎肠球菌(Enterococcus faecium)BNCC 336951、鲍曼不动杆菌(Acinetobacter baumannii)BNCC 194496、白色念珠菌(Candida albicans)CMCC 52201:本实验室保藏。
1.1.3 培养基
营养肉汤(nutrient broth,NB)培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,去离子水1 000 mL,pH=7.0。
LB液体培养基:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,去离子水1 000 mL。
脑心浸出肉汤(brain heart infusion broth,BHI)培养基:牛心浸粉10 g,胰蛋白胨20 g,葡萄糖4 g,NaCL 10 g,琼脂20 g,磷酸氢二钠5 g,去离子水1 000 mL。
MRS培养基:蛋白胨10 g、葡萄糖20 g、酵母粉4 g、牛肉粉5 g、柠檬酸氢三铵2 g、吐温80 1 mL、磷酸氢二钾2 g、乙酸钠5 g、硫酸锰0.05 g、硫酸镁0.2 g,琼脂20 g,去离子水1 000 mL。
葡萄糖蛋白胨酵母膏(glucose peptone yeast extract,GPY)培养基:酵母膏0.5 g,蛋白胨2 g,琼脂20 g,葡萄糖10 g,去离子水1 000 mL。
琼脂培养基中加入琼脂20 g/L。以上培养基均在121 ℃高压蒸汽灭菌15 min。
1.1.4 试剂
胰蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;酵母提取物(生化试剂)、氯化钠(分析纯)、SanPrep柱式脱氧核糖核酸(deoxyribonucleic acid,DNA)胶回收试剂盒:上海生工生物工程技术服务有限公司;琼脂(生化试剂):赛国生物科技有限责任公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
RV10旋转蒸发仪:德国IKA公司;HVE-50高压灭菌器:日本HIRAYAMA公司;SW-CJ-2FD超净工作台:日本Airtech公司;VeritiTMDx聚合酶链式反应(polymerase chain reaction,PCR)仪:基因有限公司。
1.3 实验方法
1.3.1 南极微生物的分离及纯化
菌株的分离采用稀释涂布平板法[22],取南极团结湖沉积物0.5 g于试管中,加入4.5 mL生理盐水,混匀,静置2 h,采用生理盐水按10倍梯度稀释至10-6,取10-6~10-2的稀释液各100 μL,涂布于LB琼脂、BHI琼脂、MRS琼脂平板,分别于12 ℃和37 ℃的培养箱中,培养5~6 d后,再用接种针挑取形态不同的细菌单菌落接种于相应培养基,分别在12 ℃和37 ℃恒温培养箱中培养5~6 d。
1.3.2 铜绿假单胞菌拮抗菌株的筛选
初筛:采用双层平板法进行初筛。在LB液体培养基中接种铜绿假单胞菌,37 ℃、180 r/min条件下培养过夜。吸取5 μL待测样菌液点接于LB琼脂平板上,分别放到适宜待测菌种生长温度下培养24 h。待LB琼脂培养基冷却至55 ℃左右时,加入铜绿假单胞菌悬液,立刻混匀,倾倒在有待测菌株的培养基中作为双层平板的上层,37 ℃培养12 h,观察有无抑菌圈出现。
复筛:采用琼脂扩散法进行复筛。吸取100 μL初筛菌的培养液接种到100 mL LB液体培养基中,37 ℃、180 r/min培养24 h,发酵液经8 000 r/min、4 ℃条件下离心10 min,取上清液旋转蒸发浓缩100倍,将浓缩液经0.22 μm无菌微孔滤膜过滤得到粗发酵液[23]。将铜绿假单胞菌悬液加入到LB琼脂培养基中,混匀,待培养基凝固后用打孔器打孔,往孔中加入300 μL初筛得到的南极微生物的粗发酵液,37 ℃培养12 h,采用游标卡尺测量抑菌圈直径,抑菌圈直径>12 mm则有抑菌效果,每个试验重复3次。
1.3.3 铜绿假单胞菌拮抗菌株的鉴定
(1)形态观察及生理生化实验
将筛选出的铜绿假单胞菌拮抗菌株划线接种于LB琼脂培养基,根据《伯杰细菌鉴定手册》[24]和《常见细菌系统鉴定手册》[25]对其形态、生理生化特征进行观察和测定,并进行初步判定。
(2)分子生物学鉴定
选取通用引物1492R(5'-AAGTCGTAACAAGGTAACG-3')和27F(5'-AGAGTTTGATCCTGGCTCAG-3'),采用菌落PCR法对筛选得到的铜绿假单胞菌拮抗菌株的16S rDNA基因序列进行扩增。PCR扩增体系:细菌通用引物27F和1492R各2 μL,模板7 μL,2×Taq Plus Master Mix酶25 μL,双蒸水(ddH2O)14 μL,总体积为25 μL;PCR扩增条件:95 ℃预变性5 min;98 ℃变性30 s,55 ℃退火15 s,72 ℃延伸2 min,共30个循环;72 ℃再延伸5 min。
PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托生工生物工程(上海)股份有限公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 6.0软件的邻接(neighbor-joining,NJ)法构建系统发育树[26]。
1.3.4 抑菌谱研究
参照方法1.3.2采用琼脂扩散法研究其抑菌谱。除了肺炎克雷伯氏菌使用NB琼脂培养基、鲍曼不动杆菌使用BHI琼脂培养基、屎肠球菌使用MRS琼脂培养基外,其他几种待测致病菌均用LB琼脂培养基。
2 结果与分析
2.1 南极微生物的分离及纯化
从南极团结湖沉积物样品中共分离、纯化得到64株菌株。
2.2 铜绿假单胞菌拮抗菌株的筛选
2.2.1 初筛结果
通过初筛,从64株南极微生物中筛选得到8株对铜绿假单胞菌有明显抑制性的菌株,编号分别为TJ25、TJ28、TJ31、TJ34、TJ40、TJ41、TJ59、TJ62,其抑菌效果见图1。由图1可知,8种菌株周围都有抑菌圈,说明这8株菌都具有拮抗铜绿假单胞菌的能力。
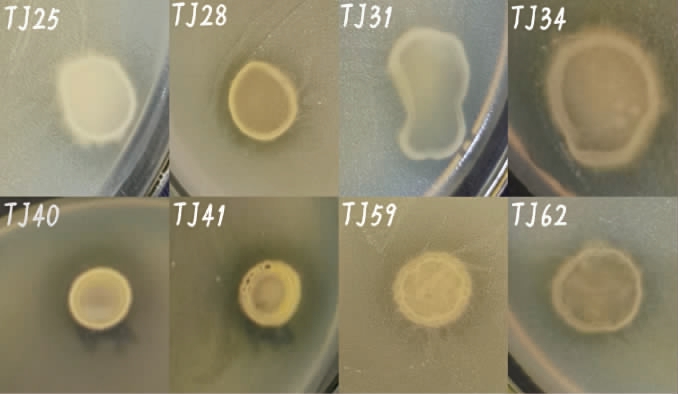
图1 铜绿假单胞菌拮抗菌株的初筛结果
Fig.1 Preliminarily screening results of Pseudomonas aeruginosa antagonistic strains
2.2.2 复筛结果
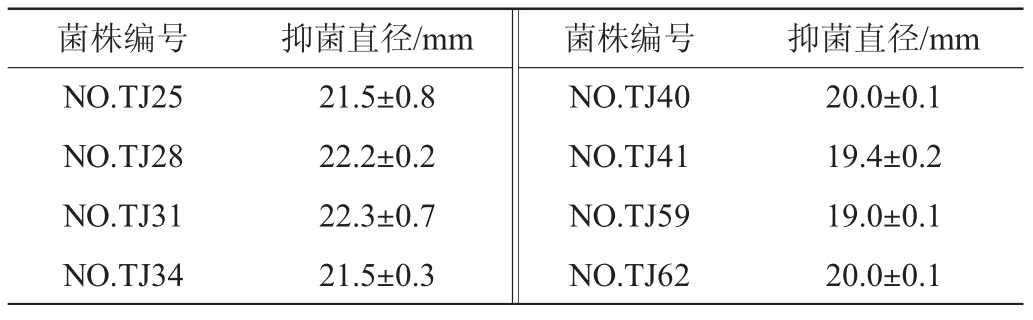
采用琼脂扩散法进行复筛,结果见表1。由表1可知,8株初筛菌株对铜绿假单胞菌的抑菌圈直径为19.0~22.3 mm,其中菌株NO.TJ31发酵液的抑菌效果最好,抑菌圈直径达(22.3±0.7)mm。WONG C等[27]从极地乔治国王岛土壤样品中分离得到2 465株细菌,其中Pedobacter cryoconitis BG5和假单胞菌(Pseudomonas)MTC3有抑制肺炎克雷伯氏菌的作用,抑菌圈直径分别为15 mm和5 mm;王晓彤等[28]从北冰洋沉积物中分离得到一株拮抗大肠杆菌的菌株105号,平均抑菌圈直径为19.3 mm。由此可以看出,本实验中的菌株NO.TJ31抑制铜绿假单胞菌效果较为明显。
表1 8株初筛菌株的抑菌圈直径
Table 1 Inhibition zone diameter of 8 preliminarily screened strains
2.3 菌株NO.TJ31的鉴定
2.3.1 形态学观察
菌株NO.TJ31的菌落及细胞形态见图2。由图2可知,菌株NO.TJ31在LB琼脂培养基上为黄白色不透明菌落,边缘有褶皱。菌株NO.TJ31的革兰氏染色结果为蓝紫色杆状菌,说明该菌是革兰氏阳性菌。
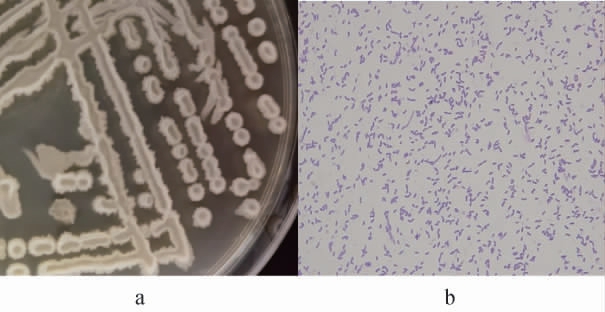
图2 菌株NO.TJ31的菌落(a)及细胞(b)形态特征
Fig.2 Colony (a) and cell (b) morphological characteristics of strain NO.TJ31
2.3.2 生理生化鉴定结果
菌株NO.TJ31的生理生化特征见表2。由表2可知,菌株NO.TJ31能分解葡萄糖产酸且不产气,能使明胶液化,能产生过氧化氢酶,柠檬酸盐试验、吲哚试验、甲基红试验结果均呈阴性。结合形态观察结果,参考《伯杰细菌鉴定手册》[24]和《常见细菌系统鉴定手册》[25],初步判定该菌为芽孢杆菌属(Bacillus sp.)。
表2 菌株NO.TJ31的生理生化特征
Table 2 Physiological and biochemical characteristics of strain NO.TJ31
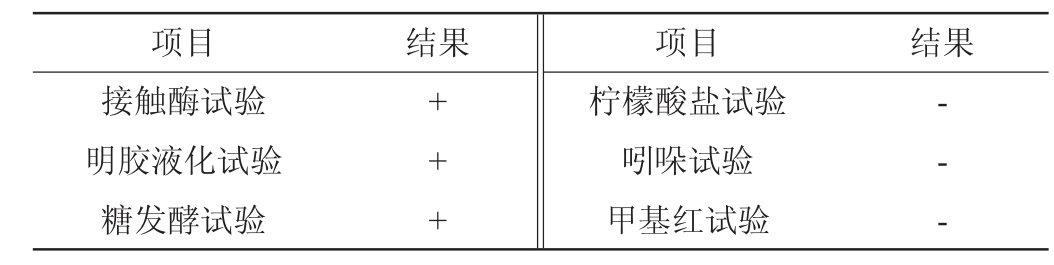
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.3.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株NO.TJ31的系统发育树,结果见图3。由图3可知,菌株NO.TJ31与弗氏甲基杆菌(Methylobacterium frigidaeris)聚于一支,亲缘关系最近,结合形态观察结果及生理生化实验结果,最终鉴定菌株NO.TJ31为弗氏甲基杆菌(Methylobacterium frigidaeris)。
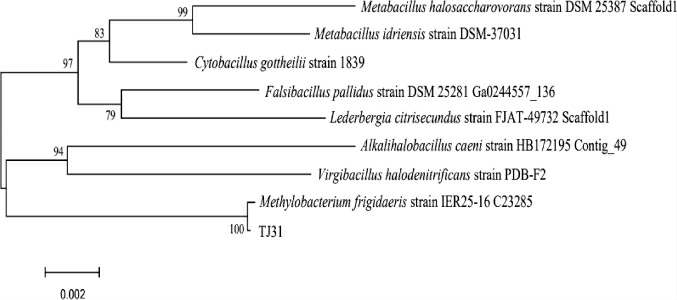
图3 基于16S rDNA基因序列菌株NO.TJ31的系统发育树
Fig.3 Phylogenetic tree of strain NO.TJ31 based on 16S rDNA gene sequence
2.4 菌株NO.TJ31的抑菌谱
测定菌株NO.TJ31对8种常见致病菌的抑制能力,结果见表3。
表3 菌株NO.TJ31抑菌谱的测定结果
Table 3 Determination results of antibacterial spectrum of strain NO.TJ31

由表3可知,菌株NO.TJ31对大肠杆菌、金黄色葡萄球菌、白色念珠菌、副溶血弧菌、鼠伤寒沙门氏菌、鲍曼不动杆菌、屎肠球菌、肺炎克雷伯氏菌均有不同程度的抑制作用,其中,对肺炎克雷伯氏菌、鼠伤寒沙门氏菌和大肠杆菌的抑菌效果更为明显,抑菌圈直径分别为(28.1±1.0)mm、(27.6±0.3)mm、(27.4±0.4)mm,说明该菌株抑菌谱广泛。在抗菌方面芽孢杆菌研究较多,如死亡谷芽孢杆菌ZZ185分离自阔叶冬青,对植物病原菌禾谷镰刀菌、辣椒疫霉菌等有很强的生长抑制性[29];香格里拉土壤来源的芽孢杆菌NBIF-001对黄瓜灰霉病有防治作用[30]。
3 结论
本研究从南极团结湖沉积物中共分离、纯化出64株微生物,从中筛选出1株对铜绿假单胞菌抑菌效果最优的菌株NO.TJ31,其抑菌圈直径达(22.3±0.7)mm。通过形态学观察、生理生化试验及16S rDNA序列分析,鉴定其为弗氏甲基杆菌(Methylobacterium frigidaeris)。该菌对大肠杆菌、金黄色葡萄球菌、白色念珠菌、副溶血弧菌、鼠伤寒沙门氏菌、鲍曼不动杆菌、屎肠球菌、肺炎克雷伯氏菌均有不同程度的抑制作用,抑菌圈直径分别为(27.4±0.4)mm、(20.7±0.1)mm、(18.1±0.9)mm、(20.0±1.4)mm、(27.6±0.3)mm、(17.8±0.7)mm、(18.1±1.4)mm、(28.1±1.0)mm,具有较广的抑菌谱。
[1]朱国平,王敏.南极海洋生物肠道微生物研究进展[J].生态学报,2021,41(21):8320-8330.
[2]GUTT J,ISLA E,XAVIER J C,et al.Antarctic ecosystems in transitionlife between stresses and opportunities[J].Biol Rev Camb Philos Soc,2021,96(3):798-821.
[3]张丽珉,赵琳,丛柏林.南极罗斯海区域可培养微生物分离鉴定及产低温酶能力初步筛选[J].海洋学报,2018,40(8):152-164.
[4]张波涛,缪锦来,李光友,等.极地微生物活性物质研究进展[J].海洋科学,2004,28(2):58-63.
[5]江昇平.几株极地海洋微生物次级代谢产物的分离鉴定研究[D].上海:上海海洋大学,2015.
[6]常俊男.南极微生物的分离鉴定及其次级代谢产物研究[D].上海:上海海洋大学,2019.
[7]李贺.极地微生物抗细菌活性菌株的筛选、鉴定及活性物质的初步研究[D].济南:山东轻工业学院,2011.
[8] COWTON M.Polar microbiology: the ecology,biodiversity and bioremediation potential of microorganisms in extremely cold environments[J].Biodivers,2016,17(1-2):74-75.
[9]倪孟祥,田静.南极放线菌菌株N-1抗菌活性物质的初步研究及其菌种鉴定[J].药物生物技术,2011,18(5):403-406.
[10]TEDESCO P,MAIDA I,PALMA ESPOSITO F,et al.Antimicrobial activity of monoramnholipids produced by bacterial strains isolated from the Ross Sea(Antarctica)[J].Mar Drugs,2016,14(5):83.
[11] KALIL A C,METERSKY M L,KLOMPAS M,et al.Management of adults with hospital-acquired and Ventilator-associated Pneumonia:2016 clinical practice guidelines by the infectious diseases society of America and the American thoracic society[J].Clin Infect Dis,2016,63(5):e61-e111.
[12]郑永珍,李慧伟.35株下呼吸道感染患者中铜绿假单孢菌的分布及其对抗菌药物的耐药性分析[J].抗感染药学,2019,16(8):1328-1330.
[13]张亚会,李文茹,廖康,等.铜绿假单胞菌对青霉素类抗生素异质性耐药研究[J].微生物学通报,2022,49(5):1786-1798.
[14]曾晓琮,周露,苏妙贞,等.81株铜绿假单胞菌16S rRNA基因序列测定及系统发育学分析[J].食品与机械,2016,32(11):21-24.
[15]闫芳,隋英杰,孙静,等.桶装饮用水污染引起学生食物中毒的调查分析[J].中国卫生检验杂志,2011,21(8):2082,2084.
[16]喻容,石燕,齐志强,等.1445株铜绿假单胞菌临床感染的耐药性分析[J].检验医学与临床,2012,9(8):940-941.
[17]牟菁,赵雪颖,赵立芳,等.石榴皮与诃子联合制剂对铜绿假单胞菌抑菌作用的研究[J].广东化工,2018,45(22):19-20.
[18]程强,曾铭,鲁兰,等.四季青水煎液对铜绿假单胞菌生物被膜生成、毒力因子分泌的抑制作用及机制研究[J].中药药理与临床,2019,35(4):111-116.
[19]刘静雪,李凤林,曾英男,等.连翘提取物对铜绿假单胞菌群体感应系统的影响[J].2019(3):118-121,182.
[20]陈小春,严银春,张甲生,等.太平洋杆菌对铜绿假单胞菌毒力因子的抑制作用[J].发酵科技通讯,2017,46(1):25-29.
[21]ZHOU J W,BI S Y,CHEN H J,et al.Anti-biofilm and antivirulence activities of metabolites from Plectosphaerella cucumerina against Pseu-domonas aeruginosa[J].Front Microbiol,2017,8:769.
[22]杨耀刚,郜晋楠,田瑞华.自然发酵玉米秸秆中优良乳酸菌的筛选鉴定及混菌发酵试验[J].黑龙江畜牧兽医,2018(7):145-148.
[23]张静楠,聂灿玉,赵胜楠,等.抗白色念珠菌的海洋微生物的分离与鉴定[J].天津农业科学,2016,22(1):79-81.
[24]BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册[M].北京:科学出版社,1984:729-736.
[25]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001:349-386.
[26]王硕,孟庆丽,武天娇,等.抗金葡菌深海真菌的分离鉴定及抑菌谱研究[J].生物技术,2015,25(2):169-172.
[27]WONG C,TAM H,ALIAS S,et al.Pseudomonas and Pedobacter isolates from King George Island inhibited the growth of foodborne pathogens[J].Pol Polar Res,2011,32(1):3-14.
[28]王晓彤,金黎明,俞勇,等.拮抗大肠杆菌的海洋微生物的筛选与鉴定[J].中国酿造,2020,39(6):43-46.
[29]ZHAO Z Z,WANG Q S,WANG K M,et al.Study of the antifungal activity of Bacillus vallismortis ZZ185 in vitro and identification of its antifungal components[J].Bioresour Technol,2010,101(1):292-297.
[30]黄大野,周婷,姚经武,等.死亡谷芽孢杆菌NBIF-001防治灰霉病研究[J].中国蔬菜,2016(10):63-66.