盐是生产传统发酵肉制品的基本成分之一,具有增强风味、改善质地以及抑制不良微生物生长等作用[1]。传统发酵香肠中食盐的添加量为2%~3%,在香肠发酵过程中由于水分减少,成品中食盐的含量能达到6%[2]。有研究表明,食盐摄入过多会导致高血压、心血管等慢性疾病[3]。直接减少食盐的添加是最简单有效的办法,但是会出现咸味缺失、风味改变以及质构变差等问题,食盐含量的降低也给原料自身携带的微生物的生长创造了条件,对产品的安全性也有一定的影响[4]。
近年来,发酵剂广泛应用于发酵香肠生产中,不同发酵剂对香肠发酵的影响不同[5-6]。低盐发酵香肠研究的一个关键点是产品的风味问题,有研究表明,具有脂肪分解和蛋白质分解活性的发酵剂有助于香肠中风味的形成[7]。王曼等[8]筛选出两株具有蛋白酶和脂肪酶活性的葡萄球菌(Staphylococcus),可用于鲊肉粉发酵;CHEN X等[9]研究发现,植物乳杆菌(Lactiplantibacillus plantarum)CMRC6具有较好的蛋白水解活性,将其应用到干发酵香肠中加速了香肠成熟过程总蛋白的水解,提高了风味化合物的含量。另一个关键点是安全问题,乳酸菌发酵能产生酸类物质和抗菌化合物来防止产品腐败和致病微生物的生长[10]。SIRINE B S等[11]将植物乳杆菌TN8和嗜酸乳酸菌(Lactobacillus acidophilus)MA18添加到牛肉肠中有利于产品色泽的产生,还能降低产品中肠杆菌数量;ZHANG Y等[6]将能产生抑菌物质细菌素的乳酸杆菌LPL-1加入到低盐香肠中进行发酵,减少了细菌群落多样性,并在发酵过程中抑制了腐败细菌的生长。目前,解决低盐产品的安全性和风味问题有着极为重要的意义,筛选适用于低盐发酵香肠的优良菌株,在保证产品安全的同时改善其感官特性,是开发低盐发酵香肠的关键点。
本研究旨在通过筛选具有蛋白酶、脂肪酶活性和抑菌活性的肉用发酵菌株,采用分子生物学技术对其进行菌种鉴定,并将其应用到食盐添加量为1%的发酵香肠中,探究其在低盐发酵香肠中应用的可行性,以期为筛选具有优良性状的低盐发酵剂提供参考,为低盐发酵香肠的研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
猪后臀肉:石家庄北国超市;一耕一耘盐渍猪肠衣:河北河清肠衣有限公司;乳酸菌菌株S2-4、S2-38、BR-12、P-5、C-10、葡萄球菌菌株XP-7、N-4、H-1、Pb-9、YJ3:上海市、广东省、湖南省、金华市等不同地区传统发酵香肠、腊肉制品中分离并保存菌种;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、普通变形杆菌(Proteus vulgaris):中国科学院微生物研究所。
1.1.2 培养基
LB液体培养基:生工生物工程(上海)股份有限公司;MRS液体培养基:山东拓普生物工程有限公司;营养琼脂培养基:北京陆桥技术股份有限公司;平板计数琼脂:北京奥博星生物技术有限责任公司。
1.1.3 试剂
TIANGEN细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;氧化镁(分析纯):天津市河东区红颜试剂厂;硼酸(分析纯):天津奥普升化工有限公司;盐酸(分析纯):天津市永大化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
3K15型离心机:美国SIGMA公司;K9860全自动凯氏定氮仪:海能仪器有限公司;FE28型pH计:梅特勒-托利多(上海)有限公司;CM-700d/600d分光测色计:日本柯尼卡美能达投资有限公司;Veriti96型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国应用生物系统公司;CT3型质构仪:博勒飞(北京)有限公司。
1.3 方法
1.3.1 肉用发酵剂的筛选
(1)肉用发酵菌株的筛选
参照陈亚杰[12]的方法对10株菌株的溶血能力、血浆凝固酶、耐热核酸酶、过氧化氢酶、产黏、产硫化氢、产氨、产气、氨基酸脱羧酶、蛋白酶、脂肪酶活性进行检测。
(2)发酵菌株的抑菌实验
以大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、普通变形杆菌为指示菌,采用牛津杯法测定发酵菌株的抑菌活性。将活化好的葡萄球菌H-1接种到LB液体培养基中,37 ℃、150 r/min培养16 h;将活化好的乳酸菌BR-12接种到MRS液体培养基中,37 ℃静置培养16 h。发酵液在4 ℃条件下经8000r/min离心5min,取上清液备用。将指示菌(105CFU/mL)涂布到营养琼脂培养基,每个平板表面均匀放置两个牛津杯,向牛津杯中加入150 μL菌株上清液,37 ℃培养24 h,采用游标卡尺十字交叉法测量抑菌圈直径。
1.3.2 肉用发酵菌株的鉴定
按照TIANGEN细菌基因组提取试剂盒步骤提取细菌基因组,以其为模板,乳酸菌利用引物Lpw57(5'-AGTTTGATCCTGGCTCAG-3')及Lpw205(5'-CTTGTTACGACTTCACCC-3)进行PCR扩增,葡萄球菌利用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-AAGGAGGTGATCCAGCCGCA-3')PCR扩增16S rDNA基因序列,PCR扩增体系及条件参照陈亚杰[12]的方法。采用琼脂糖凝胶电泳检测PCR扩增产物并回收目的片段,连接pEASY-T1载体,转化大肠杆菌(Escherichia coli)Trans1-T1感受态细胞。重组子经PCR鉴定正确后委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取同源性较高的模式菌株的基因序列,利用MEGA5.05软件中的邻接(neighbor-joining,NJ)法进行菌株系统发育树的构建。
1.3.3 菌株间拮抗实验
将筛选得到的两株菌株以十字交叉接种于平板计数琼脂上,37 ℃条件下培养24 h,观察交叉接种部位是否有菌生长。
1.3.4 低盐发酵香肠的制作工艺
原料肉→绞碎→添加调料→添加发酵剂→灌肠→发酵→成品
操作要点:将瘦肉、肥肉分开绞碎,根据质量比7∶3混合。调料添加量以肉质量计算,添加白砂糖1.5%、食盐1%、味精0.3%、淀粉0.4%,搅拌均匀。添加发酵剂搅拌均匀后灌入天然猪肠衣,37 ℃发酵72 h得到发酵香肠成品。
发酵剂的制备:将活化好的植物乳杆菌BR-12以1%(V/V)的接种量接种到MRS液体培养基中,37 ℃条件下培养14 h;将活化好的木糖葡萄球菌H-1以1%(V/V)的接种量接种到LB液体培养基中,37 ℃、150 r/min培养12 h。8 000 r/min、4 ℃离心5 min,收集菌体,用等体积无菌生理盐水洗涤两次后,使用无菌生理盐水重悬菌体,调整菌液浓度为109 CFU/mL。根据前期发酵香肠感官实验,选择菌株BR-12和H-1以2∶1和1∶5的复配比例复配发酵制备发酵香肠。乳酸菌BR-12添加量为107 CFU/g,葡萄球菌H-1按比例调整添加。
1.3.5 实验分组及取样
CK1组(1%食盐添加量,低盐空白对照组);CK2组(3%食盐添加量,高盐空白对照组);A组(1%食盐添加量,菌株BR-12∶H-1=2∶1);B组(1%食盐添加量,菌株BR-12∶H-1=1∶5)。每24 h采集样品进行pH值测定及肠杆菌数测定,每组平行测定3次;发酵72 h的成品样品进行感官评价及色差、质构、挥发性盐基氮项目的检测,每组平行测定3次。
1.3.6 发酵香肠的感官评价
参照国标GB/T 22210—2008《肉与肉制品感官评定规范》[13]对发酵香肠进行感官评价。感官评价小组由10名专业人员组成,小组成员对所有样品的颜色、气味、组织状态及滋味进行评价,感官评分标准见表1。
表1 发酵香肠的感官评价标准
Table 1 Sensory evaluation standards of fermented sausage

1.3.7 发酵香肠理化指标的检测
pH值:使用pH计测定[14];色差值:参照王宁宁等[2]的方法测定;质构:参照叶翠[15]的方法测定;挥发性盐基氮含量:参照国标GB 5009.228—2016《食品中挥发性盐基氮的测定》[16]测定。
1.3.8 发酵香肠中肠杆菌数的检测
参照国标GB/T 4789.41—2016《食品微生物学检验肠杆菌科检验》[17]进行肠杆菌计数。
1.3.9 数据处理
运用Excel 2016统计所有数据,所有试验数据均采用“平均值±标准差”表示;采用SPSS 22.0软件对数据进行方差分析(analysis of variance,ANOVA)并进行显著性比较,P<0.05为差异显著;采用GraphPad Prism8.02软件作图。
2 结果与分析
2.1 肉用发酵剂的筛选结果
2.1.1 菌株的安全性和酶活性检测结果
10株菌株的安全性和酶活性检测结果见表2。由表2可知,乳酸菌BR-12和葡萄球菌H-1均无溶血能力,无氨基酸脱羧酶、血浆凝固酶、耐热核酸酶活性,不产黏、不产硫化氢、不产氨产气,为安全菌株,均可以应用到香肠中。蛋白质和脂肪是风味物质生产的重要来源[18],乳酸菌BR-12具有蛋白酶和脂肪酶活性,葡萄球菌H-1具有蛋白酶活性,说明这两株菌株在香肠中发酵具有丰富产品风味的潜力。
表2 菌株的安全性和酶活性检测结果
Table 2 Determination results of safety and enzyme activity of strains
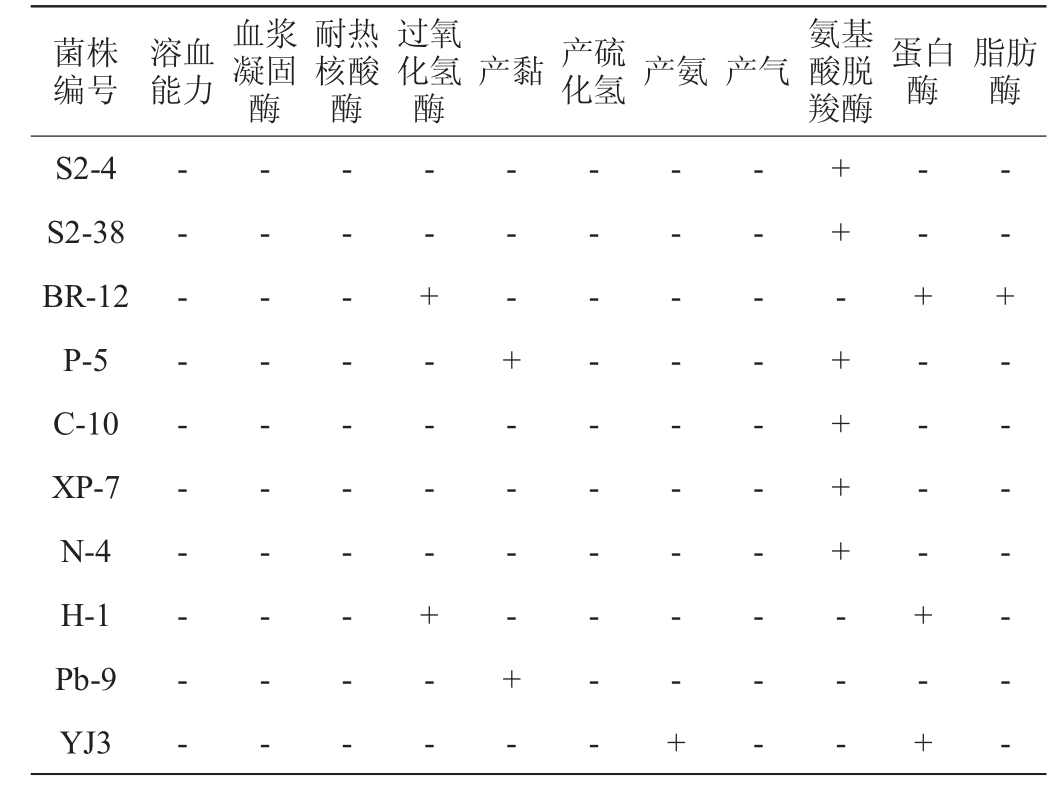
注:“-”表示结果呈阴性;“+”表示结果呈阳性。
2.1.2 菌株的抑菌效果
菌株BR-12和H-1的抑菌性能见表3。由表3可知,这两株菌都具有抑菌活性,菌株BR-12对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和普通变形杆菌均具有抑制作用,对铜绿假单胞菌的抑菌效果最好。而菌株H-1只对普通变形杆菌有抑菌作用,对其余3种菌无抑制作用,说明这两株菌应用到香肠发酵中有利于提高产品的安全性。
表3 菌株的抑菌实验结果
Table 3 Results of bacteriostatic experiments of the strains
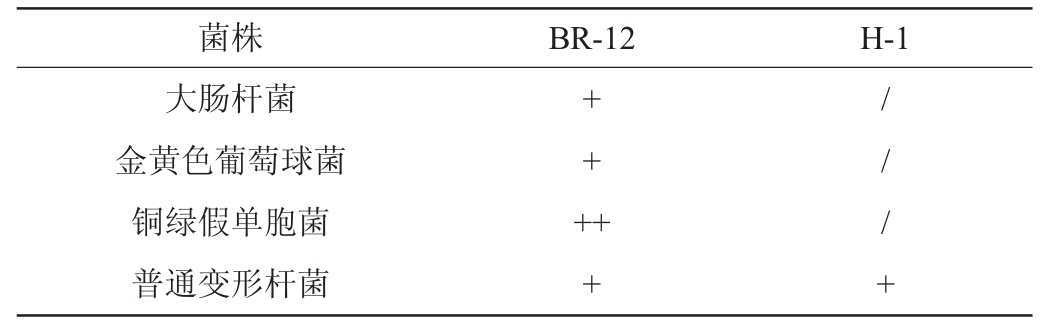
注:“++”表示抑菌圈直径为15~20 mm;“+”表示抑菌圈直径为10~15 mm;“/”表示无抑菌效果。
2.2 肉用发酵剂的分子生物学鉴定
菌株BR-12及菌株H-1的系统发育树见图1。由图1可知,菌株BR-12与植物乳杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近,菌株H-1与木糖葡萄球菌(Staphylococcus xylosus)聚于一支,亲缘关系最近,因此,鉴定菌株BR-12为植物乳杆菌(Lactiplantibacillus plantarum),菌株H-1为木糖葡萄球菌(Staphylococcus xylosus)。
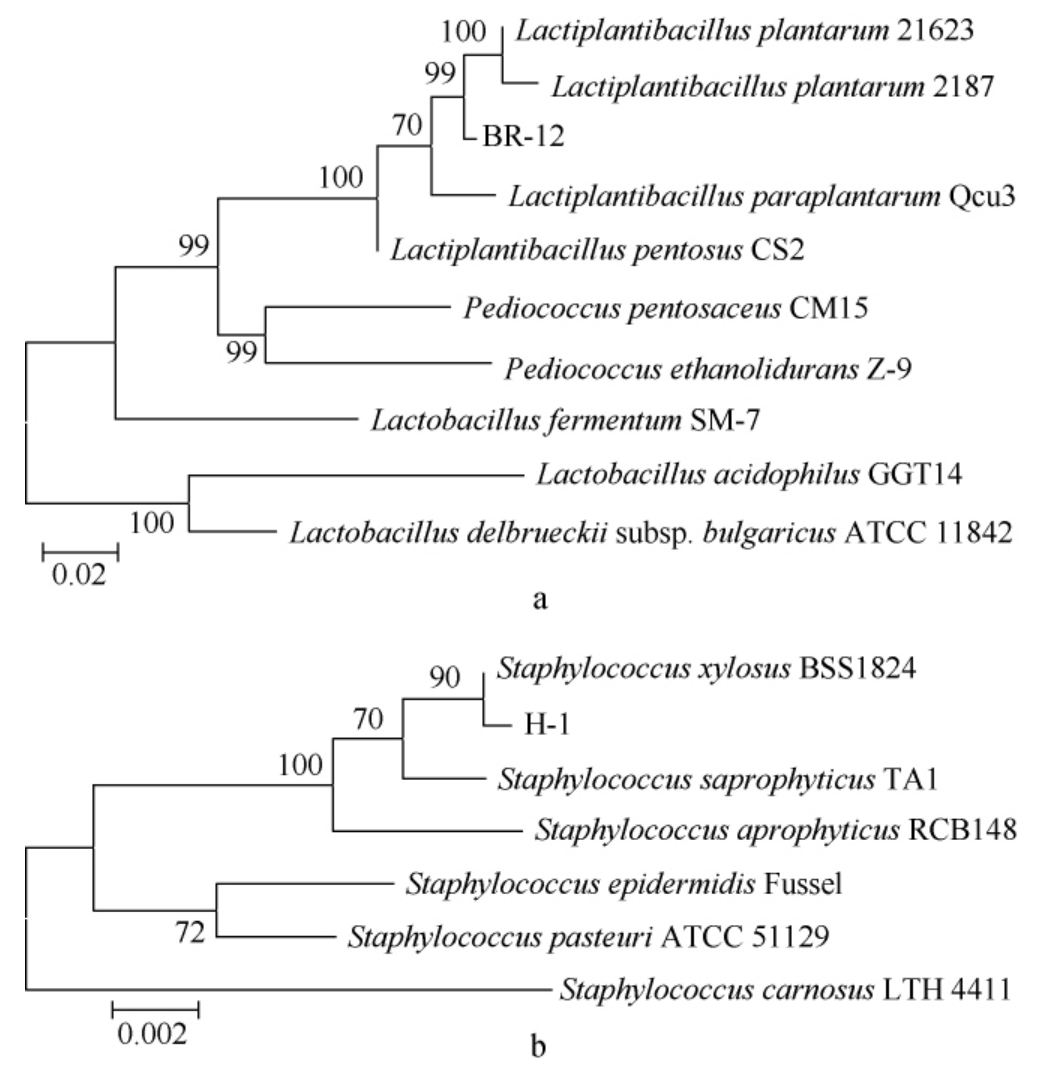
图1 菌株BR-12(a)及H-1(b)的系统发育树
Fig.1 Phylogenetic tree of strain BR-12 (a) and strain H-1 (b)
2.3 植物乳杆菌BR-12与木糖葡萄球菌H-1间的拮抗作用
植物乳杆菌BR-12与木糖葡萄球菌H-1间的拮抗作用见图2。由图2可知,植物乳杆菌BR-12与木糖葡萄球菌H-1在平板计数培养基上长势良好,交叉部分有菌株生长,未出现菌株相互拮抗现象,说明这两株菌可以作为发酵剂复合应用于发酵香肠中。

图2 植物乳杆菌BR-12与木糖葡萄球菌H-1间的拮抗作用
Fig.2 Antagonism between Lactiplantibacillus plantarum BR-12 and Staphylococcus xylose H-1
2.4 发酵剂对低盐发酵香肠的影响
2.4.1 发酵剂对低盐发酵香肠感官评价的影响
由表4可知,A组发酵香肠的各项感官评分均最高,且与B组无显著差异(P>0.05),但显著高于CK1组(P<0.05),在颜色、气味和滋味方面的评分显著高于CK2组(P<0.05),在组织状态上与CK2组无明显差异(P>0.05)。这可能是由于植物乳杆菌BR-12和木糖葡萄球菌H-1的抑菌效果能有效减少其他杂菌对香肠的影响,同时具有蛋白酶、脂肪酶活性,促进了蛋白质、脂肪分解生成风味物质,提高了产品的滋气味[18]。结果表明,在低盐条件下,添加发酵剂BR-12和H-1能够保证产品色泽,提高产品的滋气味和组织形态,提升产品品质,在1%食盐添加量的基础上,保证了发酵香肠良好的感官和风味品质。
表4 不同组发酵香肠的感官评价结果
Table 4 Sensory evaluation results of fermented sausage in different groups
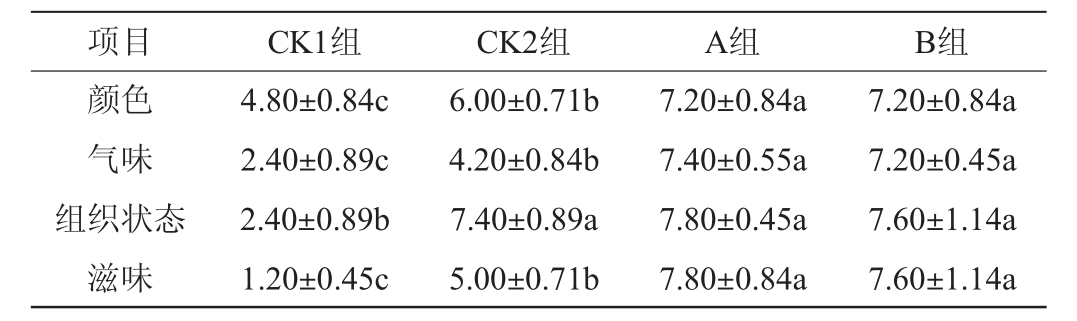
注:同行间不同小写字母表示差异显著(P<0.05)。下同。
2.4.2 发酵剂对低盐发酵香肠色泽的影响
产品的色泽是吸引消费者的一项重要指标,传统肉制品中特有的红色主要由肌红蛋白的衍生物(亚硝基肌红蛋白)来体现[19]。本试验通过测定香肠的明亮度值(L*)、红度值(a*)及黄度值(b*)来分析发酵剂对低盐香肠色泽的影响,结果见表5。
表5 不同组发酵香肠色泽的测定结果
Table 5 Determination results of color of fermented sausage in different groups
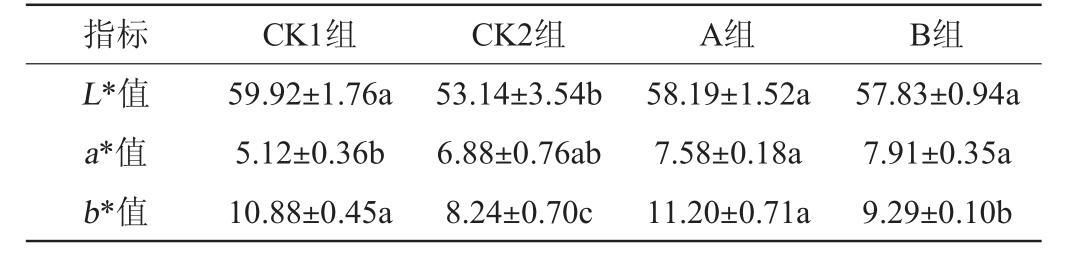
由表5可知,A组、B组、CK1组发酵香肠的亮度值(L*值)无显著差异(P>0.05),均显著高于CK2组(P<0.05)。A组、B组及CK2组发酵香肠的红度值(a*值)无显著差异(P>0.05),但A组、B组显著高于CK1组(P<0.05);A组发酵香肠的黄度值(b*值)与CK1组差异不明显(P>0.05),说明菌株BR-12和H-1复合发酵更有利于香肠色泽的产生,这与LI P J等[20]的研究结果相似,这可能与木糖葡萄球菌的添加有关。木糖葡萄球菌的存在有利于生成一氧化氮(NO),使肌红蛋白生成亚硝基肌红蛋白,促进色泽的形成[21]。结果表明,发酵剂BR-12和H-1在低盐发酵香肠中能提高产品色泽。
2.4.3 发酵剂对低盐发酵香肠质构的影响
不同组发酵香肠质构的测定结果见表6。由表6可知,A组与B组发酵香肠的硬度适中,显著低于CK2组(P<0.05);A组发酵香肠的弹性与CK1组和CK2组差异不显著(P>0.05),且均显著高于B组(P<0.05);A组发酵香肠的胶着性与B组无显著差异(P>0.05),显著高于CK1组(P<0.05),显著低于CK2组(P<0.05);在咀嚼性方面,4组发酵香肠差异不显著(P>0.05)。总体来看,A组发酵香肠的质构品质与CK2组差异较小且优于CK1组,A组弹性显著高于B组(P<0.05),其余质构品质与B组无显著差异(P>0.05)。这表明在1%食盐添加量的基础上,添加发酵剂BR-12与H-1能保证低盐发酵香肠产品的质构品质。
表6 不同组发酵香肠质构的测定结果
Table 6 Determination results of texture of fermented sausage in different groups

2.4.4 发酵剂对低盐发酵香肠pH的影响
pH是产品发酵过程中的关键指标,低pH值是控制发酵香肠安全的关键因素之一[22]。不同组发酵香肠发酵过程中pH值的变化见图3。
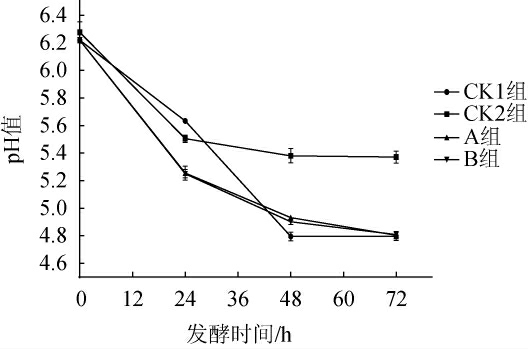
图3 不同组发酵香肠pH值的测定结果
Fig.3 Determination results of pH of fermented sausage in different groups
由图3可知,A组与B组发酵香肠的pH下降速度快于CK1和CK2组。发酵24 h时A组、B组pH值(5.25)均低于安全限值(5.30)[23]。乳酸菌能发酵糖类产酸及其他抑菌物质,使环境中pH值降低,抑制杂菌生长,提高产品安全性[24]。添加发酵剂的A、B组的发酵香肠pH下降速度快于CK1和CK2组。由此可以说明,添加发酵剂BR-12和H-1能迅速发酵产酸,降低产品pH值,在低盐条件下保证了发酵香肠产品的安全性。
2.4.5 发酵剂对低盐发酵香肠挥发性盐基氮含量的影响
挥发性盐基氮主要指的是蛋白质分解产生的氨和胺类等挥发性碱性含氮物,挥发性盐基氮含量越高说明产品中蛋白质和氨基酸被破坏的越多,营养价值越低[25]。发酵过程中各组发酵香肠的挥发性盐基氮含量见图4。由图4可知,A组发酵香肠的挥发性盐基氮含量最低,为(30.57±1.27)mg/100 g,B组次之,CK1组和CK2组含量较高,A组发酵香肠的挥发性盐基氮显著低于其他实验组(P<0.05)。这表明发酵剂BR-12与H-1对抑制香肠中蛋白质的腐败变质有显著作用,可能是添加了发酵剂能改变产品中的菌群结构,发酵菌株的生长繁殖能抑制有害菌的生长,减少挥发性盐基氮的产生[26]。总体上,低盐发酵香肠中添加发酵剂BR-12和H-1有利于抑制产品中蛋白质的腐败变质,提高低盐发酵香肠产品品质。

图4 不同组发酵香肠挥发性盐基氮含量的测定结果
Fig.4 Determination results of volatile base nitrogen of fermented sausage in different groups
不同字母表示差异显著(P<0.05)。
2.4.6 发酵剂对低盐发酵香肠肠杆菌数的影响
测定不同实验组发酵香肠中的肠杆菌数,结果见表7。
表7 发酵期间不同实验组发酵香肠肠杆菌数的变化
Table 7 Changes of Enterobacter count in different experimental groups during fermentation

由表7可知,不同组发酵香肠的肠杆菌数随着发酵时间的延长整体呈下降趋势,这与汤兴宇等[27]的研究结果相似。发酵24 h时,A组和B组发酵香肠的肠杆菌数显著低于CK1组和CK2组(P<0.05)。发酵72 h时,A组和B组发酵香肠无肠杆菌的生长,CK2组发酵香肠肠杆菌数(11 CFU/g)较少,而CK1组发酵香肠肠杆菌数最多(1×104 CFU/g),由此可以看出,菌株BR-12与H-1复合发酵剂的添加能抑制或杀死产品中的肠杆菌,这可能是由于发酵剂菌株的生长繁殖抑制了有害菌的生长[28-29],而植物乳杆菌本身能发酵糖类产酸,低pH能抑制肠杆菌等有害菌的生长。CHEN X等[9]将木糖葡萄球菌SX16和植物乳杆菌CMRC6接种于发酵香肠中,在香肠成熟6 d后未发现肠杆菌科微生物。因此,发酵剂BR-12和H-1的使用对提高低盐发酵香肠的安全性有重要的作用。
3 结论
以是否具有脂肪酶、蛋白酶活性及抑菌活性为指标筛选得到两株肉用发酵菌株,分别编号为BR-12、H-1,经16S rDNA基因序列鉴定,菌株BR-12被鉴定为植物乳杆菌,菌株H-1被鉴定为木糖葡萄球菌。菌株BR-12具有蛋白酶、脂肪酶活性和抑菌活性,菌株H-1具有蛋白酶活性和抑菌活性;两株菌之间无拮抗作用,可复配应用于发酵香肠。菌株BR-12与H-1按2∶1和1∶5的比例接种制备低盐发酵香肠,感官评分较高,发酵香肠呈特有的玫瑰红色;香肠pH值快速下降,保证了产品的质构品质;减少了产品中蛋白质的腐败变质,无肠杆菌生长,降低了低盐发酵香肠的安全风险,符合健康、安全的发酵产品开发理念。
[1] RUUSUNEN M,PUOLANNE E.Reducing sodium intake from meat products[J].Meat Sci,2005,70(3):531-541.
[2]王宁宁,冯美琴,孙健.低钠复合盐对发酵香肠理化特性及风味的影响[J].食品科学,2021,42(16):1-7.
[3]VOLLMER W M,SACKS F M,ARD J,et al.Effects of diet and sodium intake on blood pressure:subgroup analysis of the DASH-sodium trial[J].Annf Int Med,2001,135(12):1019-1028.
[4]HU Y Y,LI Y G,ZHU J M,et al.Improving the taste profile of reducedsalt dry sausage by inoculating different lactic acid bacteria[J].Food Res Int,2021,145:110391.
[5] MARINA G,ANTONIETTA L S,FRANCESCA D F,et al.Impact of Lactobacillus curvatus 54M16 on microbiota composition and growth of Listeria monocytogenes in fermented sausages[J].Food Microbiol,2018,72:1-15.
[6]ZHANG Y,QIN Y,WANG Y,et al.Lactobacillus plantarum LPL-1,a bacteriocin producing strain,changed the bacterial community composition and improved the safety of low-salt fermented sausages[J].LWT-Food Sci Technol,2020,128:109385.
[7]NAJJARI A,BOUMAIZA M,JABALLAH S,et al.Application of isolated Lactobacillus sakei and Staphylococcus xylosus strains as a probiotic starter culture duringthe industrial manufacture of Tunisian dry-fermented sausages[J].Food Sci Nutr,2020,8(8):4172-4184.
[8]王曼,杨琛,覃晓玉,等.鲊肉粉中乳酸菌和葡萄球菌的筛选及鉴定[J].食品与发酵工业,2021,47(5):22-27.
[9]CHEN X,MI R F,QI B,et al.Effect of proteolytic starter culture isolated from Chinese Dong fermented pork(Nanx Wudl)on microbiological,biochemical and organoleptic attributes in dry fermented sausages[J].Food Sci Hum Well,2021,10(1):13-22.
[10] ANNA C,MA G G,MAREK K,et al.The effect of pullulan on the growth and acidifying activity of selected stool microflora of human[J].Curr Pharm Biotechnol,2017,18(2):121-126.
[11]SIRINE B S,NAOUREZ K,IMEN T,et al.Effect of partial replacement of nitrite with a novel probiotic Lactobacillus plantarum TN8 on color,physico-chemical,texture and microbiological properties of beef sausages[J].LWT-Food Sci Technol,2017,86:219-226.
[12]陈亚杰.发酵肉用葡萄球菌和乳酸菌的分离、筛选及应用[D].石家庄:河北经贸大学,2019.
[13]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22210—2008 肉与肉制品感官评定规范[S].北京:中国标准出版社,2008.
[14]卢涵,张香美,彭澎,等.混合发酵剂对发酵香肠脂肪酸败和蛋白质氧化的影响[J].西北农业学报,2019,28(9):1552-1560.
[15]叶翠.混菌发酵香肠工艺优化及理化特性变化研究[D].石家庄:河北经贸大学,2020.
[16]中华人民共和国国家卫生和计划生育委员会.GB 5009.228—2016食品安全国家标准食品中挥发性盐基氮的测定[S].北京:中国标准出版社,2016.
[17]中华人民共和国国家卫生和计划生育委员会.GB 4789.41—2016 食品安全国家标准食品微生物学检验肠杆菌科检验[S].北京:中国标准出版社,2016.
[18]刘英丽,杨梓妍,万真,等.发酵剂对发酵香肠挥发性风味物质形成的作用及影响机制研究进展[J].食品科学,2021,42(11):284-296.
[19]周亚军,李宗豪,李圣桡,等.肉加工中亚硝酸盐的作用及其替代物应用研究进展[J].农产品加工,2019(22):77-81.
[20]LI P J,KONG B H,CHEN Q,et al.Formation and identification of nitrosylmyoglobin by Staphylococcus xylosus in raw meat batters: A potential solution for nitrite substitution in meat products[J].Meat Sci,2013,93(1):67-72.
[21]刘英丽,毛慧佳,李福芳,等.微生物发酵法在肉制品护色中的应用[J].中国食品学报,2017,17(9):182-188.
[22]张晓东.发酵香肠菌种的筛选及对香肠理化性质的影响[D].长沙:湖南农业大学,2017.
[23]杜智慧.不同发酵剂对发酵香肠品质影响的研究[D].晋中:山西农业大学,2014.
[24]王德宝,胡冠华,苏日娜,等.发酵剂对羊肉香肠中蛋白、脂质代谢与风味物质的影响[J].农业机械学报,2019,50(3):336-344.
[25]黄业传,王洋,彭春雷.玫瑰花提取液对发酵香肠品质的影响[J].食品与发酵工业,2022,48(3):205-211.
[26]张香美,卢涵,叶翠,等.不同发酵剂对发酵香肠菌相、挥发性风味成分及品质的影响[J].东北农业大学学报,2021,52(3):45-53.
[27]汤兴宇,王浩东,吴念,等.食盐对传统发酵肉成熟过程中微生物菌群、理化性质及盐溶性蛋白特性的影响[J].肉类研究,2020,34(10):1-7.
[28]XIAO Y Q,LIU Y N,CHEN C G,et al.Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J].Food Resint,2020,135:109247.
[29]李珊珊.传统发酵肉制品中发酵菌株的分离筛选及在牛肉发酵香肠中的应用初探[D].郑州:河南农业大学,2021.