曲乃酒之骨,没有好曲就很难酿出好酒,酒曲中的微生物是白酒酿造的动力[1]。作为主产清香型白酒的山西,所使用的低温大曲,是用小麦、大麦和豌豆等原料,在40~50 ℃之间的温度制曲,其独特而又丰富的微生物群落,能够提供代谢和降解原料并产生风味物质所需的微生物和酶促作用,是清香型白酒酒体风味品质形成的关键因素[2]。而酒曲中的真菌微生物能够分泌淀粉酶、蛋白酶、纤维素酶等多种酶,其群落结构和功能对白酒品质控制有重要的影响[3],故探究山西清徐低温大曲的真菌菌群多样性就显得尤为重要。
Illumina MiSeq高通测序技术因具有免培养、高通量、快速检测、结果精确且能够全面展现大曲样品中复杂微生物群落的结构和多样性等优点被广泛应用于酒曲微生物群落结构分析[4]。如陈申习等[5]通过高通量测序技术对清香型和酱香型酒曲细菌群落特征进行研究,揭示了不同香型酒曲中细菌的主要类群,结果发现清香型大曲QDB中含有较高比例的放线菌属(Actinobacteria);周森等[6]基于高通量测序技术对浓香型白酒大曲的真菌菌群多样性进行分析,结果发现15份大曲样品门分类和纲分类较为一致,但真菌属组成存在较大的差异;薛宇昂等[7]利用Illumina MiSeq高通量测序技术对襄阳市石花酒大曲中微生物的多样性进行分析,结果发现细菌中的假单胞菌属与真菌的曲霉属有显著的正相关性(P<0.05);罗爱国等[8]采用Illumina MiSeq高通量测序技术对清香型白酒酒糟中微生物多样性进行研究发现,酒糟中的细菌丰富度和多样性均高于真菌。同样,现代仿生仪器检测设备电子舌和电子鼻[9]也一直用于食品滋味和香气的检测,由于其客观、快速、简便、灵敏、出错率低等优点,近几年在酒曲上的应用也日益增多,如CAI W C等[10-12]均使用电子舌和电子鼻技术对大曲的滋味和风味进行了分析,但却少有人将两者结合,探究大曲中真菌多样性并研究功能性关联。
本研究使用Illumina MiSeq高通量测序技术对清徐低温大曲真菌菌群多样性进行研究,采用电子鼻和电子舌分别对大曲的滋味和风味进行分析,并结合主成分分析(principal component analysis,PCA)[13]与相关性分析探究清徐大曲中真菌微生物的功能,对后续从清徐大曲中筛选这些相应的真菌,提升酒曲质量,并加以在清香白酒生产中运用提供思路,为进一步利用白酒酿造微生物资源优化提供一些方向。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清徐低温大曲样品:采于山西省太原市清徐县阳顺和曲业有限公司,通过机械进行制曲。从曲库不同位置采集10块大曲,编号为QXDQ 1~QXDQ 10。
1.1.2 试剂
引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3'):武汉天一辉远生物科技有限公司;QIAGEN DNeasy mericon Food Kit试剂盒:德国QIAGEN公司;5×FastPfu Buffer、2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)、FastPfu Polymerase、牛血清白蛋白(bovine serum albumin,BSA):北京全式金生物技术有限公司;酒石酸、无水乙醇(均为分析纯):西陇科学股份有限公司;氯化钾、氢氧化钾(均为分析纯):西陇化工股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
ABI GeneAmp  9700型聚合酶链式反应(polymerase chain reaction,PCR)仪、Illumina MiSeq测序仪:上海美吉生物医药科技有限公司;SA-402B电子舌:日本INSENT公司;PEN3电子鼻:德国Airsense公司;800Y高速万能粉碎机:永康市铂欧五金制品有限公司。
9700型聚合酶链式反应(polymerase chain reaction,PCR)仪、Illumina MiSeq测序仪:上海美吉生物医药科技有限公司;SA-402B电子舌:日本INSENT公司;PEN3电子鼻:德国Airsense公司;800Y高速万能粉碎机:永康市铂欧五金制品有限公司。
1.3 方法
1.3.1 样品处理
使用800Y高速万能粉碎机对曲块进行粉碎并过20目筛,然后装入500 mL样品瓶中于-20 ℃冰箱冷藏备用。
1.3.2 Illumina MiSeq高通量测序
通过上海美吉生物医药科技有限公司对清徐大曲微生物多样性进行测序。按照QIAGEN DNeasy mericon Food Kit试剂盒说明书,从2 g大曲样品中提取微生物宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。以其为模板,采用引物ITS3F和ITS4R对真菌的ITS3F-ITS4R区基因序列进行PCR扩增。PCR扩增体系:5×FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、ITS3F(5 μmol/L)0.8 μL,ITS4R(5 μmol/L)0.8 μL,FastPfu Polymerase 0.4 μL,BSA 0.2 μL,模板DNA 10 ng,使用双蒸水(ddH2O)补充至20 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃再延伸10 min,采用1%琼脂糖凝胶电泳检测DNA完整性,并使用微量紫外可见分光光度法测量其数量和质量,以获得高品质和高浓度的微生物宏基因组DNA,将检测合格的PCR扩增产物委托上海美吉生物医药科技有限公司使用Illumina MiSeq测序仪测序。
1.3.3 生物信息学分析
参考沈馨等[14-15]的方法,对返回的序列进行质量控制并根据核苷酸标签(barcode)区分序列来源,然后利用微生物生态学定量分析(QIIME)包(1.9.1版)对测序结果进行生物信息学分析,使用UCLUST算法[16]以97%的相似度将高质量序列进行序列划分并建立操作分类单元(operational taxonomic units,OTU)[17],利用UNITE数据库[18]对清徐低温大曲中真菌菌群的OTU进行序列同源性比对,确定清徐低温大曲样品中真菌的分类地位,并在测序量均为43010条序列下计算清徐低温大曲样品中真菌的超1(Chaol)指数和香农(Shannon)指数,同时对清徐低温大曲中的优势真菌属(平均相对含量>1.00%)进行分析。
1.3.4 基于电子舌技术对清徐低温大曲滋味的测定
准确称量30 g曲粉,加入120 mL蒸馏水,混匀浸泡0.5 h,于4 ℃、12 000×g条件下离心10 min,取上清液,过滤得到滤液。参照杨小丽等[19-21]的方法,采用电子舌对大曲样品的滋味进行测定,得到每个样品的酸、苦、涩、咸和鲜5个基本味的相对强度值,以及样品的后味A(涩的回味)、后味B(苦的回味)和丰度(鲜的回味)3个回味的相对强度值。
1.3.5 基于电子鼻技术对清徐低温大曲香气的测定
参照郭壮等[22-24]的方法使用PEN3电子鼻对清徐低温大曲中的典型挥发性物质进行分析。电子鼻的金属氧化物传感器列阵的性能描述分别为W1C:芳香成分,W5S:灵敏度大、对氮氧化合物很灵敏,W3C:氨气、对芳香成分灵敏,W6S:主要对氢气有选择性,W5C:烷烃芳香成分,W1S:对甲烷灵敏,W1W:对有机硫化物敏感,W2S:对乙醇灵敏,W2W:芳香成分、对有机硫化物灵敏,W3S:对烷烃灵敏。
1.3.6 数据处理
使用Excel 2021对清徐低温大曲测得的数据进行整理,采用R(4.0.5 版本)、Origin 2021、SAS 9.0软件绘制图、表。通过肠型分析对10个清徐低温大曲进行分组,并结合皮尔逊(Pearson)相关性分析揭示优势菌群与香气及滋味之间的相关性,通过普氏分析(Procrustes)揭示清徐低温大曲的真菌菌群与大曲品质之间是否存在一致性关系。
2 结果与分析
2.1 清徐低温大曲样品中真菌菌群高通量测序结果及α多样性分析
10个清徐低温大曲样品真菌菌群的高通量测序结果及α多样性分析结果见表1。
表1 清徐低温大曲样品中真菌菌群高通量测序及α多样性分析结果
Table 1 High-throughput sequencing and α diversity analysis results of fungal flora in Qingxu low temperature Daqu
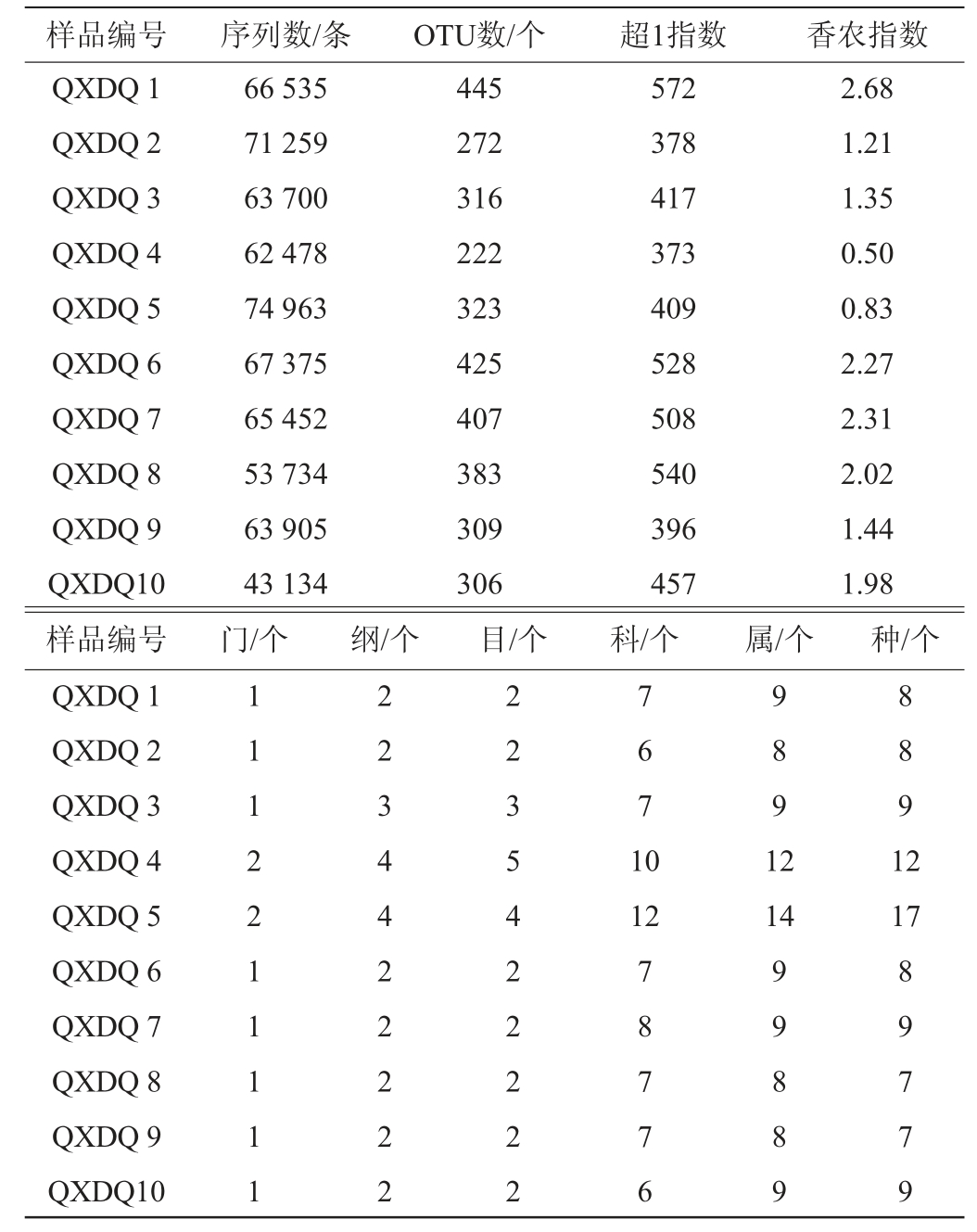
由表1可知,经过序列质控,平均每个样品产生了63 253.5条真菌序列,以97%的相似度进行序列划分共得到703个OTU,平均每个样品341个OTU,通过UNITE数据库将这些序列注释到了2个门、4个纲、5个目、13个科和17个属。作为α多样性指数,超1指数和香农指数分别从丰度和多样性两个维度,对清徐大曲中真菌菌群多样性进行评价,QXDQ 1样品的超1指数和香农指数最大,这说明QXDQ1样品具有最高的真菌物种多样性和物种丰度[25]。
本研究进一步采用稀疏性曲线和α多样性指数分析,对清徐低温大曲的取样深度和物种组成进行综合分析,在97%相似性水平下,划分OTU并制作的稀疏性曲线和香农指数曲线见图1。
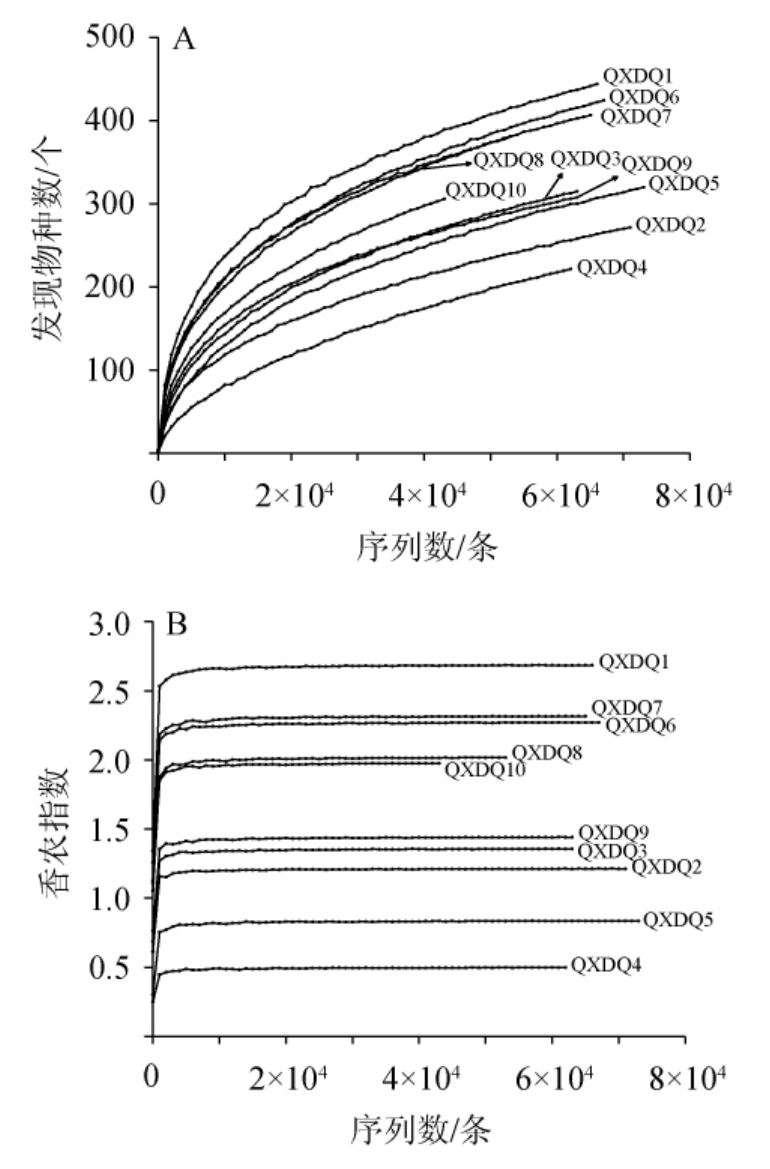
图1 清徐低温大曲样品真菌菌群的稀释曲线(A)和香农指数曲线(B)
Fig.1 Dilution curve (A) and Shannon index curve (B) of fungal flora in Qingxu low temperautre Daqu
由图1可知,清徐低温大曲中真菌菌群的物种多样性都随着测序深度的增加而在缓慢上升,而当测序深度≥10 000条之后,香农指数均随着测序深度的增加而保持不变,均已达到平台期,说明随着测序深度的继续增加,清徐低温大曲中仍有少量新的OTU在不断的被检出,但微生物多样性已不再发生较大的变化,表明本研究的测序深度已经足够满足后续的分析要求[26]。
2.2 清徐低温大曲真菌菌群结构分析
基于门水平,清徐低温大曲中的优势真菌门(平均相对含量>1.00%)只有子囊菌门(Ascomycota),平均相对含量高达(99.99±0.02)%。基于属水平,清徐低温大曲样品中真菌菌群的相对含量见图2。
由图2可知,清徐低温大曲样品中共有4个优势真菌属(平均相对含量>1.00%),分别是复膜孢酵母属(Saccharomycopsis)、热子囊菌属(Thermoascus)、红曲菌属(Monascus)、曲霉属(Aspergillus),其中复膜孢酵母属的平均相对含量最高,为(80.71±8.83)%,其余3个优势真菌属的平均相对含量分别为(8.96±5.03)%、(6.10±4.56)%、(1.54±1.18)%。此外,还有(2.44±1.58)%的序列无法鉴定到真菌属水平。
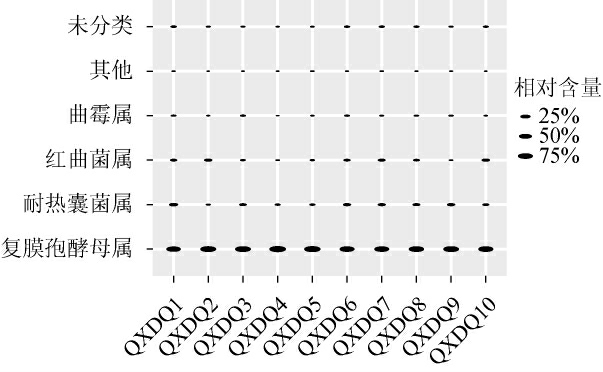
图2 基于属水平清徐低温大曲样品中的真菌菌群结构
Fig.2 Fungal flora structure based on genus level in Qingxu low temperature Daqu
其他:相对含量<1.00%的其他属。
2.3 清徐低温大曲样品的肠型分组及其各组真菌属的群落结构
通过肠型分析对清徐低温大曲进行分组,并基于优势真菌属绘制各组菌属的群落结构图,结果见图3。
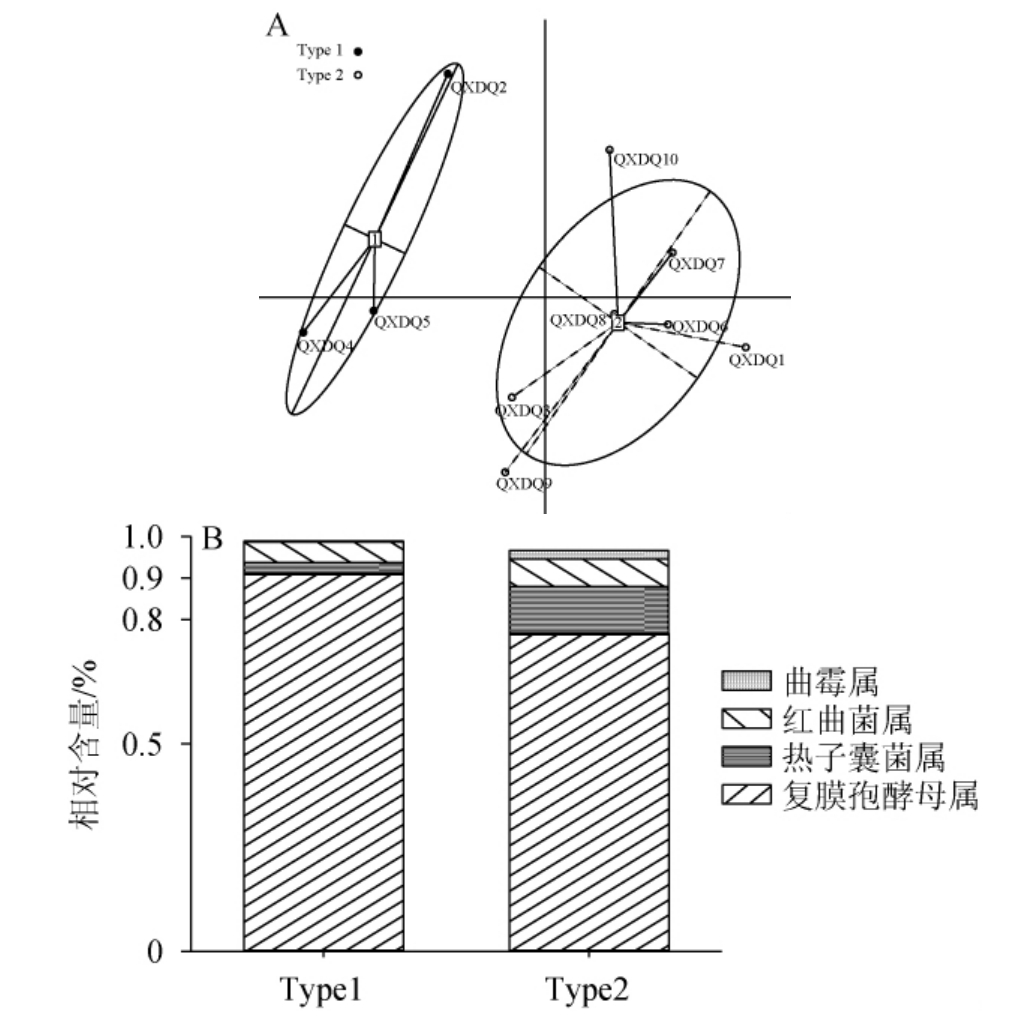
图3 清徐低温大曲样品的肠型分析(A)及各组优势真菌属群落结构(B)
Fig.3 Enterotype analysis (A) and community structure of dominant fungi in each group (B) of Qingxu low temperature Daqu
由图3A可知,经过肠型分析,清徐低温大曲样品被分为两组,分别为Type 1(包含QXDQ2、QXDQ4、QXDQ5)和Type 2(包含QXDQ1、QXDQ3、QXDQ6、QXDQ7、QXDQ8、QXDQ9、QXDQ10)。由图3B可知,Type 1组样品复膜孢酵母属的平均相对含量高于Type2组样品,而热子囊菌属和曲霉属的平均相对含量低于Type2组样品。
2.4 清徐低温大曲样品香气和滋味的解析
采用电子舌和电子鼻分别对清徐大曲的滋味和香气进行解析,并通过PCA直观展现不同样品间香气和滋味的相似性,结果见图4。
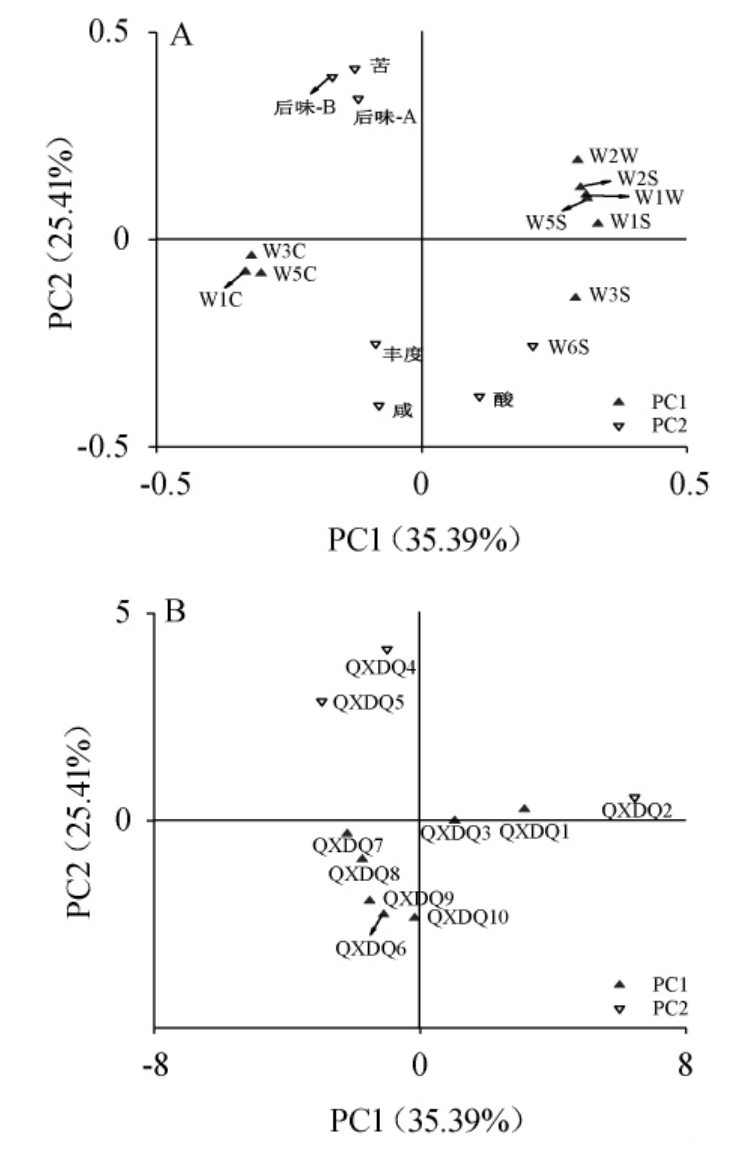
图4 基于滋味和风味指标清徐低温大曲样品主成分分析的因子载荷图(A)及得分图(B)
Fig.4 Factors loading diagram (A) and score (B) of Qingxu low temperature Daqu based on taste and flavor indicators by principal component analysis
由图4A可知,清徐低温大曲的PC1主要包括WIC、W3C、W5C、W3S、W2W、W2S、W1W、W5S、W1S,方差贡献率为35.39%,PC2主要包括W6S、酸、咸、丰度、苦、后味-A、后味-B,方差贡献率为25.41%,前两个主成分的累计方差贡献率为60.80%,说明这两个主成分的代表性强,可以用来代表清徐低温大曲样品的滋味和香气品质。由图4B可知,清徐大曲Type 1都分布在y的正半轴,Type 2大都分布在y的负半轴,将Type 1和Type 2的得分范围映射到图4A因子载荷上,结果发现,Type 1主要受W2W、W2S、W1W、W5S、W1S、苦、后味-A和后味-B的影响,Type 2主要受W3S、W6S、酸、咸和丰度的影响,而Type 1和Type 2是由复膜孢酵母属、热子囊菌属和曲霉属的平均相对含量不同确定的,由此可以推测复膜孢酵母属、热子囊菌属和曲霉属的平均相对含量对清徐低温大曲样品的W3S、W6S和丰度以及W2W、W2S、W1W、W5S、W1S、苦、后味-A和后味-B指标具有关联性,是造成清徐大曲分组的主要原因,因此需进一步对清徐低温大曲样品的优势真菌属与滋味和香气的相关性进行分析,探究清徐低温大曲样品优势真菌属的具体功能。
2.5 清徐低温大曲样品的优势真菌属与滋味和香气的相关性
为进一步探究优势真菌属与功能性指标的关联,基于清徐大曲优势真菌属的平均相对含量与滋味和风味指标进行普氏(Procrustes)分析,并绘制相关性热图,结果见图5。
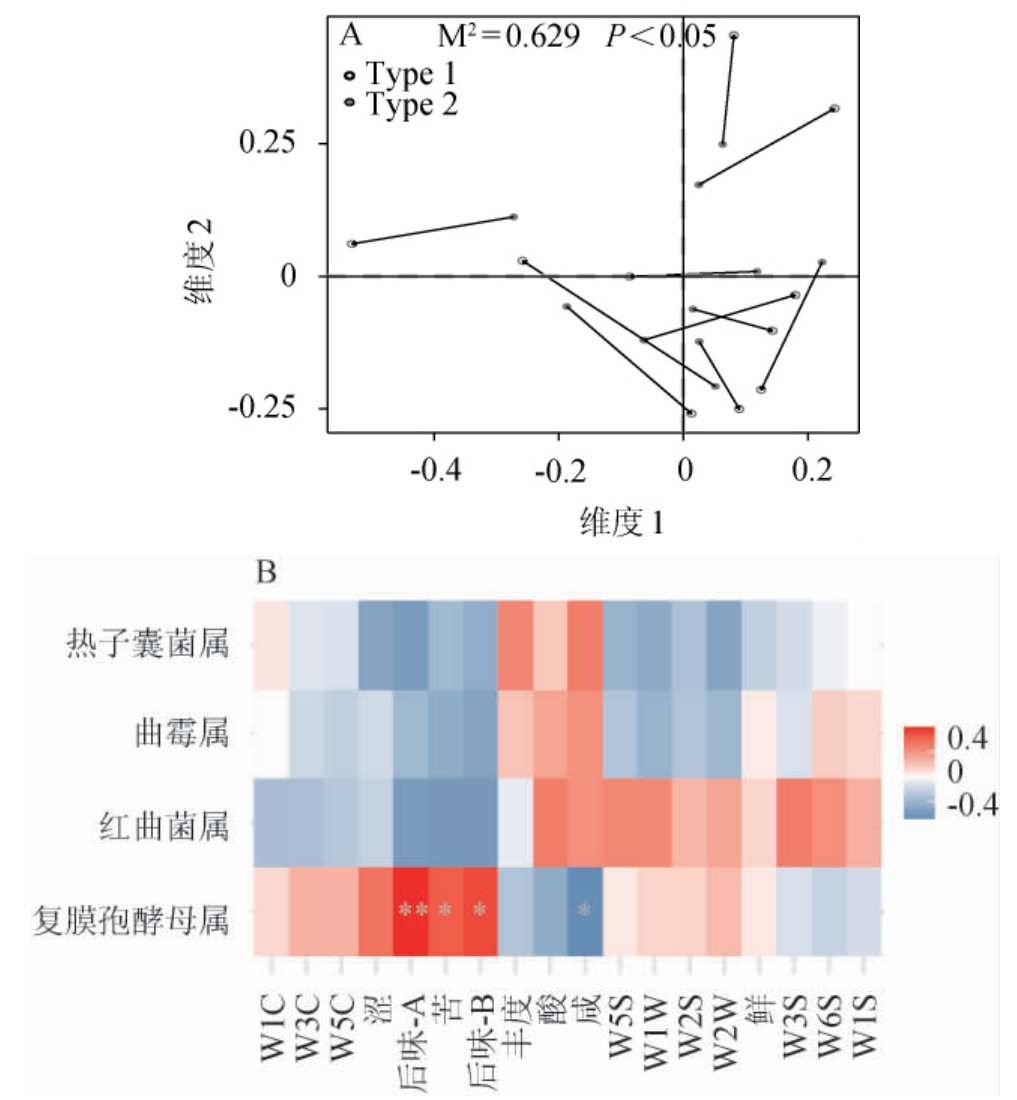
图5 基于清徐低温大曲优势真菌属与滋味、香气的普氏分析(A)和相关性热图(B)
Fig.5 Procrustes analysis (A) and correlation heat map (B) of Qingxu low temperature Daqu based on dominant fungal genera,and taste and aroma
由图5A可知,优势真菌属与清徐大曲功能性指标之间显著相关(P<0.05),说明Type 1和Type 2的功能性指标差异与菌群差异有密切的关系。由图5B可知,复膜孢酵母属与后味-A呈极显著正相关(P<0.01),与苦味和后味-B呈显著正相关(P<0.05),与咸味呈显著负相关(P<0.05),表明清徐大曲中复膜孢酵母属含量越大,大曲的后味-A、苦味和后味-B越强烈,但咸味恰恰相反。同时不难发现,热子囊菌属与曲霉属功能具有较高的一致性,如两者都会抑制W2W、W2S、W1W、W5S、W1S、苦味、后味-A和后味-B这些功能性指标,促进丰度、酸味和咸味,但并不显著(P>0.05)。此外,红曲菌属能够促进酸味、咸味、W5S、W2S、W2W、W6S和W1S,抑制后味-A、后味-B和苦味,但不显著(P>0.05)。以上结果明确了清徐低温大曲样品优势真菌属的具体功能,为后续从清徐大曲中筛选这些相应的真菌,并加以其在清香白酒生产中的运用提供了思路。
3 结论
通过Illumina MiSeq高通量测序分析发现,清徐低温大曲中的优势真菌门(平均相对含量>1.00%)为子囊菌门,平均相对含量为(99.99±0.02)%,优势真菌属(平均相对含量>1.00%)为复膜孢酵母属、热子囊菌属、红曲菌属、曲霉属,平均相对含量分别为(80.71±8.83)%、(8.96±5.03)%、(6.10±4.56)%、(1.54±1.18)%。其中复膜孢酵母属与清徐低温大曲功能性指标之间具有显著相关性(P<0.05),会促进清徐低温大曲的后味-A、苦味和后味-B,是造成清徐低温大曲的功能不同的主要原因。本研究能够在一定程度上丰富人们对清徐清香型大曲真菌菌群的认识,为进一步清香型白酒大曲优势真菌微生物功能性研究及特色菌株应用提供一定理论支撑。
[1]栾春光,郝建国,江伟,等.不同工艺清香型大曲理化指标差异与微生物菌群结构的相关性研究[J].酿酒,2021,48(2):43-48.
[2]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[3]周天慈,孙佳,朱雨婕,等.中高温大曲制作过程中火圈真菌菌群演替规律及其风味功能[J].微生物学通报,2021,48(11):4178-4189.
[4]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2020,9(2):1003-1016.
[5]陈申习,张磊,宿智新,等.基于高通量测序技术对清香型和酱香型酒曲细菌群落特征研究[J].酿酒,2022,49(1):42-46.
[6]周森,王成,朱绍宾,等.基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性[J].中国酿造,2021,40(11):55-59.
[7]薛宇昂,郭壮,赵慧君,等.基于MiSeq测序技术石花酒大曲中微生物多样性解析[J].中国酿造,2020,39(7):163-168.
[8]罗爱国,郗鑫瑞,郑同庆,等.基于Illumina MiSeq高通量测序分析清香型白酒酒糟微生物群落多样性[J].中国酿造,2022,41(1):98-102.
[9]牟心泰,杜险峰.电子鼻与电子舌在食品行业的应用[J].现代食品,2020,6(5):118-119.
[10] CAI W C,WANG Y R,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(PA):110734.
[11]任丽霞.甜酒曲微生物群落结构分析及八二曲的改良研究[D].上海:上海应用技术大学,2020.
[12]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[13]王强,李华佳,邓长阳,等.不同油炸温度对猕猴桃脆片品质的影响[J].食品研究与开发,2020,41(16):150-155.
[14]沈馨,尚雪娇,董蕴,等.基于MiSeq高通量测序技术对3个孝感凤窝酒曲细菌多样性的评价[J].中国微生态学杂志,2018,30(5):525-530.
[15]王玉荣,廖华,赵慧君,等.基于PCR-DGGE与高通量测序技术的恩施地区腊鱼细菌多样性评价[J].现代食品科技,2018,34(11):208-213.
[16]朱香元.大规模生物序列比对算法及其并行化研究[D].长沙:湖南大学,2014.
[17] CALLAHAN B J,MCMURDIE P J,HOLMES S P.Exact sequence variants should replace operational taxonomic units in marker-gene data analysis[J].ISME J,2017,11(12):2639-2643.
[18]KOLJALG U,LARSSON K,ABARENKOV K,et al.UNITE:a database providing web-based methods for the molecular identification of ectomycorrhizal fungi[J].New Phytol,2005,166(3):1063-1068.
[19]杨小丽,邹金,张振东,等.基于电子舌技术常用酸味剂滋味品质的评价[J].食品研究与开发,2017,38(11):140-144.
[20]孙文佳,方毅斐,汪廷彩,等.基于电子舌技术的豉香型白酒分类识别研究[J].中国酿造,2020,39(9):182-185.
[21]吴星茹,王磊,雷敏,等.市售老抽酱油滋味品质的评价[J].食品研究与开发,2020,41(1):66-71.
[22]郭壮,王玉荣,葛东颖,等.腊肠发酵过程中细菌多样性评价及其对风味的影响[J].食品科学,2021,42(6):186-192.
[23]周容,袁琦,夏瑛,等.电子鼻技术在兼香型白酒年份区分中的应用研究[J].中国酿造,2020,39(8):65-69.
[24]董蕴,王强,仇港,等.乳酸菌对红曲黄酒品质的影响研究[J].食品研究与开发,2020,41(3):213-218.
[25]吴悦妮,冯凯,厉舒祯,等.16S/18S/ITS扩增子高通量测序引物的生物信息学评估和改进[J].微生物学通报,2020,47(9):2897-2912.
[26]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲细菌群落结构与理化特性研究[J].中国酿造,2022,41(1):138-142.