浓香型白酒是中国传统白酒的典型香型之一,在酿造上采用泥窖、固态、双边、多微发酵[1-2];酿造过程中涉及到的微生物主要来源于大曲和窖泥,大曲一种自然积温转化并风干而成的多酶多菌多物质的微生物生态制品,具有糖化发酵生香的作用[3];大曲在制作上采用自然接种和开放式发酵,使其充分网罗制曲环境中的各种微生物,主要有细菌和真菌[4];细菌是白酒酿造过程中一类重要的微生物[5],是大曲中产蛋白酶和香味物质的重要菌类,对后续发酵和风味成型均具有重要影响;真菌能够产酒、产酶、产香[6],其中霉菌为大曲提供糖化力、液化力、蛋白质分解能力以及多种有机酸等物质[7],酵母菌为大曲提供发酵力,不仅主导了酒精的产生,而且产生大量风味化合物[8]。而在大曲制作过程中由于制曲环境、培菌管理、后期贮存方法的不同,也使不同酒企的大曲理化性质和微生物群落组成存在差异[9]。因此,研究大曲理化性质及微生物群落的结构,是充分认识酿酒微生物资源,解析浓香型白酒发酵机理的前提和基础。
高通量测序技术近年来被广泛应用于酿酒微生物多样性研究[10],吴树坤等[9]利用高通量测序技术分析四川不同地区浓香型大曲微生物群落结构差异;SUN W等[11]利用高通量测序技术研究不同季节浓香型白酒酒醅的微生物群落演替;李静心等[12]采用高通量测序技术对浓香型白酒高温大曲和中高温大曲进行微生物差异分析比较。大曲的理化性质是反映大曲是否发酵成熟和大曲品质优劣的直接指标[13-14],刘延波等[15]通过测定水分、酸度、糖化力、液化力、发酵力、氨基酸态氮、淀粉含量对赊店老酒三个等级的大曲进行比较研究,制定大曲评价体系;炊伟强等[16]报道泸州老窖大曲优级大曲中水分、酸度高,淀粉质量分数低;优级大曲中的液化酶、糖化酶、蛋白酶的活力均明显高于普级大曲。邢钢等[17]跟踪测定3种不同温度大曲制曲过程中理化指标的变化,结果表明由于大曲发酵温度和制作工艺不同,造成了3种大曲之间糖化力、液化力、酯化力、发酵力4个理化指标相差很大。微生物群落组成及理化性质直接反映了大曲的品质,对白酒的酒体和风味形成起到关键作用,是酿酒生产的关键一环。
目前研究大曲微生物群落结构的报道较多,但从大曲理化性质和微生物群落结构组成相关性方面对河南不同地区浓香型白酒大曲的研究鲜见报道。为探索河南不同地区浓香型白酒大曲之间的异同,本研究采用理化分析结合高通量测序技术,研究河南不同地区浓香型白酒大曲理化性质和微生物群落结构差异,并通过冗余分析(redundancy analysis,RDA)对理化指标和微生物群落结构进行相关性分析,为中原地区制作浓香型白酒大曲建立质量标准体系与微生物数据库,对大曲的制作提供科学依据。
1 材料与方法
1.1 材料与试剂
大曲样品均为用于白酒生产的成品曲,分别取自河南南部、东部、西部、中部四个不同地方的知名酒企,编号为YA、YB、YC和YD,每个地区样品取3个平行样本做理化分析,将采集的样品进行等量混合后提取脱氧核糖核酸(deoxyribonucleic acid,DNA)。
氢氧化钠、无水乙醇、无水葡萄糖、可溶性淀粉、碘、碘化钾(均为分析纯):天津市科密欧化学试剂有限公司;硫酸、盐酸(均为分析纯):天津市永大化学试剂有限公司;甲醛(分析纯):天津市盛奥化学试剂有限公司;酒石酸钾钠、五水硫酸铜(均为分析纯):成都金山化学试剂有限公司;邻苯二甲酸氢钾(分析纯):天津市致远化学试剂有限公司等;FastDNA SPIN Kit for Soil(土壤基因组DNA提取试剂盒):美国MP Biomedicals公司;DNA聚合酶AP221-02、Trans 15K DNA Marker:北京全式金生物技术公司;产物回收试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
FA1104分析天平(感量为0.000 1 g):上海舜宇恒平科学仪器有限公司;PHS-25精密pH计:上海雷磁仪器有限公司;HH-6数显恒温水浴锅:方科仪器(常州)有限公司;NanoDrop 2000紫外可见分光光度计、ST16R高速冷冻离心机、PICO17小型台式离心机:赛默飞世尔科技(中国)有限公司;GeneAmp 9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;QuantiFluorTM-ST DNA定量仪:美国Promega公司;Illumina Miseq高通量测序仪:美国Illumina公司。
9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;QuantiFluorTM-ST DNA定量仪:美国Promega公司;Illumina Miseq高通量测序仪:美国Illumina公司。
1.3 试验方法
1.3.1 理化指标测定
大曲水分、酸度、糖化力、液化力、淀粉含量、酯化力指标:依据吴树坤等[9,15]方法进行测定。
糖化力的定义:在35℃、pH4.6条件下,1 g绝干曲1 h转化可溶性淀粉生成葡萄糖的毫克数为一个单位(U),以mg/(g·h)表示。液化力的定义:在35 ℃、pH 4.6条件下,1 g绝干曲1 h能液化淀粉的克数为一个单位(U),以g/(g·h)表示。酯化力的定义:每50 g大曲在35 ℃,经过7 d催化己酸和乙醇合成己酸乙酯的毫克数为一个单位(U),以mg/(g·h)表示。
1.3.2 高通量测序
(1)总DNA的提取
根据FastDNA SPIN Kit for Soil说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。
(2)PCR扩增和产物回收
细菌16S rDNA V3-V4区的通用引物为:338F(5'-ACTCCTACGGGAGGCAG-3');806R(5'-GGACTACHVGGGTWTCT-3')。真菌18S rDNA V5-V7区的通用引物为:SSU0817F(5'-TTAGCATGGAATAATRRAATAGGA-3');1196R(5'-TCTGGACCTGGTGAGTTTCC-3')。
PCR扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10min。PCR扩增体系:4μL5×FastPfu缓冲液,2μL2.5mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs),0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,1 μL DNA模板(10ng/μL),双蒸水(ddH2O)补至20 μL。使用2%琼脂糖凝胶回收PCR产物,利用DNA纯化回收试剂盒进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTMST进行检测定量。文库的建立和高通量测序由上海美吉生物医药科技有限公司完成。
(3)高通量测序结果分析
使用Uparse(version 7.0.1090 http://drive5.com/uparse/)在97%序列同一性的阈值下将唯一序列分类为操作分类单元(operational taxonomic units,OTU)。采用核糖体数据库项目(ribosomal database project,RDP)classifier(version 2.13 https://sourceforge.net/projects/rdp-classifier/)对97%相似水平的OTU代表序列进行分类学分析,然后将来自每个聚类OTU的代表序列与Silva细菌16S rRNA数据库(Re lease138 http://www.arb-silva.de)和Greengene细菌16S rRNA数据库(Release 13.5 http://greengenes.secondgenome.com/)或Silva真菌18S rRNA数据库(Release138 http://www.arbsilva.de)进行比对,得到各样本的群落物种组成。通过mothur(version1.30.2 https://mothur.org/wiki/calculators/)计算α多样性指数。
1.3.3 理化指标和微生物群落结构相关性分析
采用Origin 2021b中的redundancy analysis插件对细菌和真菌优势菌属与理化指标进行冗余分析(redundancy analysis,RDA),对Pearson相关系数进行显著性检验。
1.3.4 数据分析
利用Excel 2019、SPSS Statistics 21.0、SAS 9.2、Origin 2021b等统计绘图软件进行数据分析及绘图,理化指标结果采用“平均值±标准差”表示。
2 结果与分析
2.1 大曲理化指标分析
由表1可知,四种不同地区浓香型白酒大曲样品水分含量在9.7%~13.1%之间,液化力在(0.62~0.85)g/(g·h)之间,根据浓香型白酒大曲轻工行业标准QB/T 4259—2011《浓香大曲》,全部符合浓香型白酒大曲水分含量<14.0%,液化力≥0.20 g/(g·h)的要求;在水分含量和液化力上YB大曲和YA、YC、YD大曲之间没有显著差异(P>0.05),YC大曲和YD大曲之间没有显著差异(P>0.05),但YC大曲液化力最高为0.85 g/(g·h),YA大曲和YC、YD大曲之间存在显著差异(P<0.05),YA大曲水分含量最高为13.1%,而液化力最低为0.62 g/(g·h);浓香型白酒大曲的糖化力通常在(100~1 000)g/(g·h)范围内,四种大曲在糖化力上均符合要求,四种大曲在糖化力上均两两差异显著(P<0.05),YC大曲的糖化力最高达625 g/(g·h),四个样品中YA大曲糖化力最低为485 g/(g·h);酯化力上均两两差异显著(P<0.05),但YD大曲仅为22g/(g·h),酯化力最高的是YC大曲为224 g/(g·h);四种大曲淀粉含量在(51.0~59.1)g/100 g之间,符合(50.0~65.0)g/100 g的标准,其中YB大曲与YA、YC、YD大曲差异显著(P<0.05),其淀粉含量也最高为59.1 g/100 g,YA、YC、YD大曲两两之间差异不显著(P>0.05);酸度指标在(0.3~1.5)mmol/10 g范围内视为正常,YB大曲和YC、YD大曲差异不显著(P>0.05),YA大曲和YB大曲之间差异显著(P<0.05),YA、YC、YD大曲之间两两差异显著(P<0.05)。
表1 大曲样品理化指标分析结果
Table 1 Analysis results of physical and chemical indexes of Daqu samples
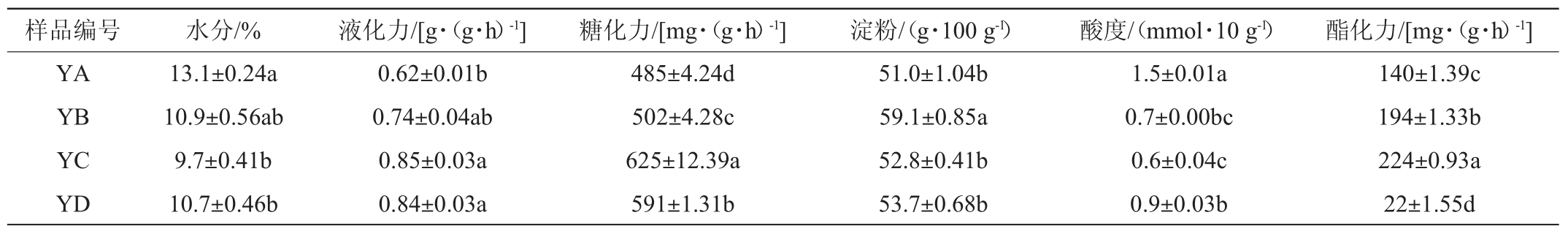
注:同列数据不同字母表示差异显著(P<0.05),相同字母表示无显著差异(P>0.05)。
2.2 大曲样品Alpha多样性分析
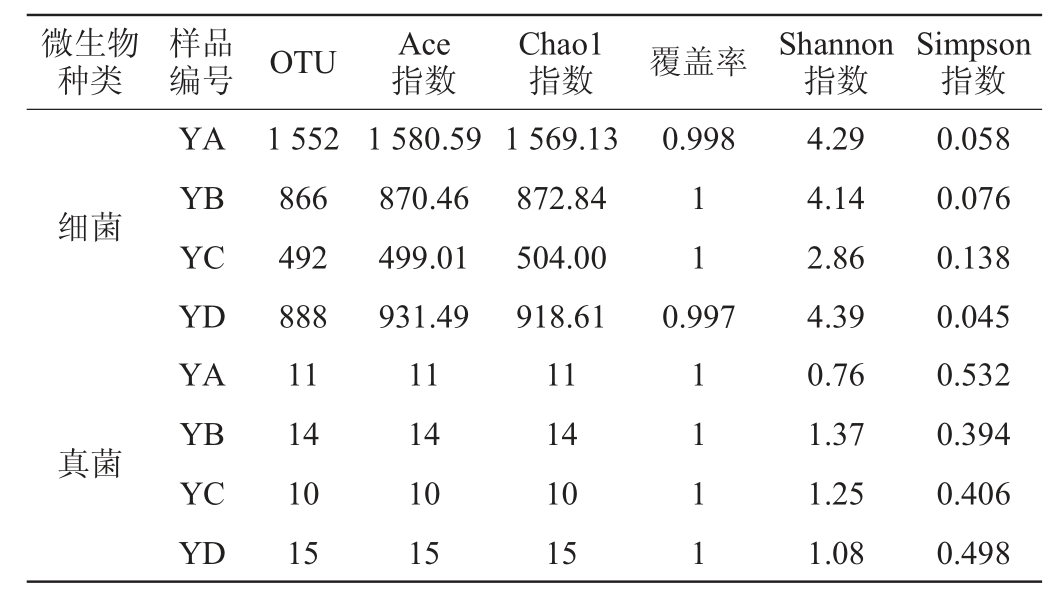
Alpha多样性指数是常用于衡量微生物群落多样性,Shannon指数和Chao1指数常用来衡量微生物群落物种的多样性和丰富度,以Shannon指数最为敏感,即数值越大,物种的多样性越高。由表2可知,YA、YB、YC和YD四个大曲样品细菌分别检测出1 552、866、492和888个OTU,真菌分别检测出11、14、10、15个OTU;四种大曲样本YA、YC、YD和YB细菌的Chao1指数分别为1 569.13、504.00、918.61和872.84,与Ace指数所反映的物种丰富度结果一致,表明四种大曲样本中YA大曲丰富度最高;YD大曲细菌Shannon指数最大为4.39、Simpson指数最小为0.045,基于两种算法都表明该大曲样本细菌群落多样性最高;四种大曲样本的细菌群落多样性YD>YA>YB>YC,物种丰富度YA>YD>YB>YC。YA、YC、YD、YB真菌的Chao1、Ace指数分别为11、10、15、14,YD大曲真菌物种丰富度最高,YB大曲真菌Shannon指数最大为1.37、Simpson指数最小为0.394,基于两种算法都表明该大曲样本真菌群落多样性最高,四种大曲样本的真菌菌群落多样性YB>YC>YD>YA,物种丰富度YD>YB>YD>YC;覆盖率范围99.7%~100.0%,反映本次测序结果代表了样本中微生物的真实情况。
表2 大曲样品中细菌及真菌群落Alpha多样性分析结果
Table 2 Alpha diversity analysis results of bacterial and fungal flora in Daqu samples
2.3 大曲样品细菌群落组成分析
将各类OTU的代表序列与Silva细菌数据库进行比对,根据每个OTU在不同分类水平的物种分类信息,分析不同分类水平上样本群落结构,结果见图1。
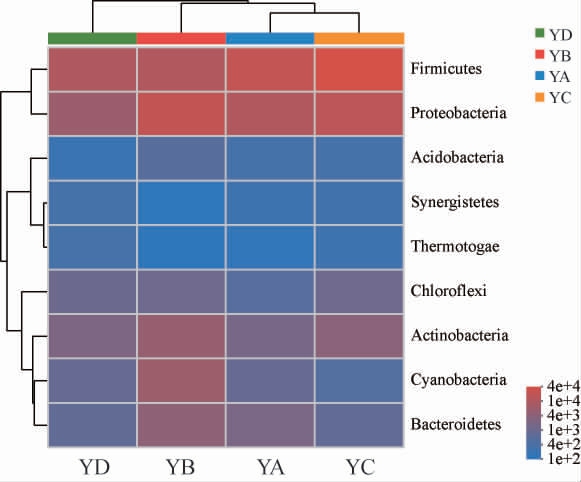
图1 基于门水平的大曲样品的细菌群落结构
Fig.1 Bacterial community structure of Daqu samples at phylum level
由图1可知,在细菌门水平上,四个样品中共检测出9个细菌门,相对丰度较高(>1%)的细菌门有厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes);由于厚壁菌门主要由芽孢杆菌纲和梭菌纲等微生物组成,能很好的适应环境,能够在外界条件极差的条件下保持生长代谢[18];放线菌门菌群广泛分布于土壤、海洋、植物体及其他极端自然生态环境中,与厚壁菌门相似,也具有极强的耐受性[19]。在对不同温度大曲、不同产区大曲和酿造环境的高通量测序研究中均发现厚壁菌门、变形杆菌门、放线菌门和拟杆菌门为优势菌门[9,20-23],本实验对浓香型白酒大曲中微生物多样性的研究结果与前人研究结果一致。
四种不同大曲之间的门水平上细菌群落组成存在差异;YA、YC和YD大曲的第一优势菌门为厚壁菌门(47.59%、59.18%和52.59%),第二优势菌门为变形菌门(24.40%、28.09%和30.20%);YB大曲的第一优势菌门则是变形菌门(40.34%),第二优势菌门为厚壁菌门(23.78%),其蓝细菌门(12.24%)、放线菌门(9.94%)和拟杆菌门(7.37%)相对丰度明显高于其他三种大曲;YD大曲绿弯菌门(4.67%)丰度最高;四种大曲中养菌门、热袍菌门和酸杆菌门在各大曲中丰度不同,但都处于较低水平。
大曲中的细菌四个大曲样本与细菌属物种之间的对应关系见图2。由图2可知,在属水平上,四个样本中共检测到28个细菌属,分别为芽孢杆菌属(Bacillus)、青枯菌属(Ralstonia)、高温放线菌属(Thermoactinomyces)、克罗彭斯特菌属(Kroppenstedtia)、红球菌属(Rhodococcus)、阪崎肠杆菌(Cronobacter)、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、Microcystis_PCC-7914、魏斯氏菌属(Weissella)、Burkholderia-Caballeronia-Paraburkholderia、norank_f__norank_o__Chloroplast、葡萄球菌属(Staphylococcus)、unclassified_p__Proteobacteria、乔治菌属(Georgenia)、不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)、梭形杆菌属(Lysinibacillus)、norank_of__Muribaculaceae、norank_of__Mitochondria、norank_of__norank_o__OPB56、norank_of__norank_o__SBR1031、unclassified_c__Anaerolineae、假单胞菌属(Pseudomonas)、紫杆菌属(Porphyrobacter)、明串珠菌属(Leuconostoc)、Mesotoga、Mariniradius。
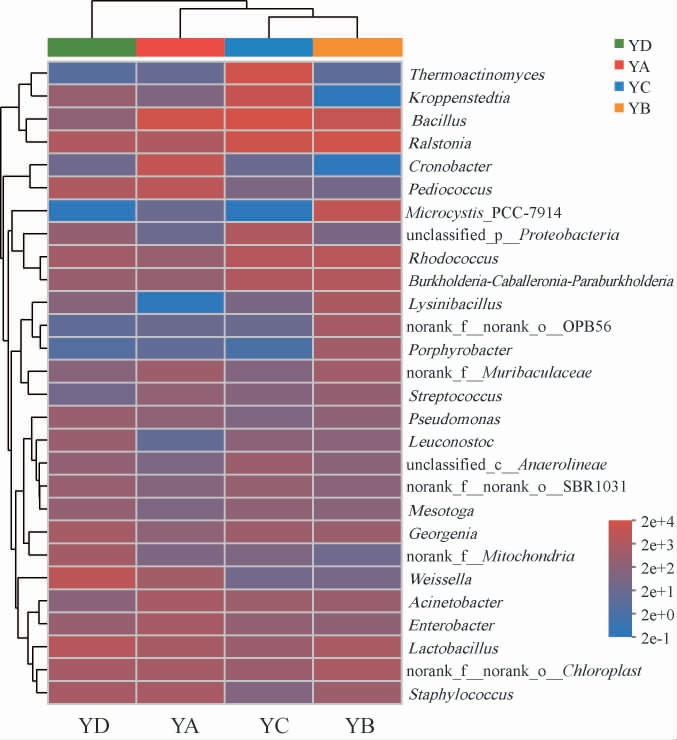
图2 基于属水平的大曲样品的细菌群落结构
Fig.2 Bacterial community structure of Daqu samples at genus level
在四种大曲中相对丰度较高(>1%)的细菌属有芽孢杆菌属、青枯菌属、高温放线菌属、Kroppenstedtia、红球菌属、阪崎肠杆菌属、乳杆菌属、片球菌属、Microcystis_PCC-7914、魏斯氏菌属、葡萄球菌属;其中芽孢杆菌产多种水解酶[24],可以分解淀粉和蛋白质等大分子物质,提高大曲原料利用率,还可以丰富大曲及浓香型白酒的风味成分,是重要的吡嗪类化合物合成菌[25-26];青枯菌属具有天然的CO2固定能力,能高效的完成从CO2到有机物的生物合成[27];高温放线菌属菌株能够产生发达的菌丝体,疏松大曲内部结构,维持大曲骨架[28];Kroppenstedtia多分离自芝麻香型白酒大曲,可能具有产纤维素酶、淀粉酶、几丁质酶的能力[29];红球菌属参与了氨基酸如L-亮氨酸和L-苯丙氨酸的生产以及固醇类的转化[30];阪崎肠杆菌属代谢的挥发性产物主要有异戊醛、乙醇、异戊醇、3-羟基-2-丁酮、乙酸、正十五烷、正十六烷、正十七烷、1-癸醇,增加风味物质[31];乳酸杆菌为传统白酒厌氧发酵重要的功能菌种之一,与浓香型白酒四大酯类之乳酸乙酯的形成具有密切关系,能减弱酵母菌的好氧代谢速度,延长前发酵期,有利于发酵有益菌的生长,对于白酒香味物质增加有利,同时也是与有机酸相关性较强的功能细菌[32-33];此外大曲中的片球菌属也是酿造体系中广泛存在的乳酸菌,对于维持酿造过程的食品安全性具有重要意义[34];魏斯氏菌属可以将原料中的糖类转化生成乳酸等有机酸,进而与乙醇反应生成乙酸乙酯和乳酸乙酯,赋予浓香型白酒浓厚的醇香[35];葡萄球菌属在空气、水、灰尘中均能发现,因此开放式发酵的大曲制曲过程中会富集到此类细菌[36]。本实验中检测到的菌属与前人研究结果一致[37-41],除上述所报道的菌属被检出,还检出大量其他优势菌属。此外,相比较而言,川派浓香型白酒大曲主要细菌属葡萄球菌属、魏斯氏菌属、芽孢杆菌属、糖多孢菌属、高温放线菌属、乳杆菌属和Kroppenstedtia,河南浓香型白酒大曲中虽未发现糖多孢菌属,但检出较多的片球菌属和青枯菌属类细菌,这可能是因为环境差异和大曲制作方法的不同。
属水平细菌属组成及丰度存在差异,芽孢杆菌属是YA和YC大曲的绝对优势菌属,青枯菌属、乳杆菌属分别是YB、YD大曲的绝对优势菌属;高温放线菌属仅在YC大曲中占比为20.48%,阪崎肠杆菌仅在YA大曲中占比为12.99%,Microcystis_PCC-7914仅在YB大曲中占比为9.77%;魏斯氏菌属是YD大曲的绝对优势菌属占比达16.23%,在YA大曲中占比为1.82%,在YC和YB大曲中丰度较低;片球菌属和葡萄球菌属在YA大曲分别占8.43%和1.55%、在YD大曲中分别占2.36%和2.36%;乳杆菌属在YD大曲中占比(10.57%),高于YA大曲(2.54%)和YB大曲(2.38%);红球菌属在YB、YC和YD大曲中的占比分别为5.52%、3.94%和3.11%;Kroppenstedtia在YC大曲中占比为11.16%高于在YD大曲中的1.41%。四个地区的大曲样品中细菌群落组成丰富,不同地区大曲细菌群落组成虽然有一定相似,但是丰度仍存在差异。
2.4 大曲细菌群落与理化性质冗余分析
选择四个地方大曲理化指标作为环境因子与大曲中属水平上细菌丰度前10的微生物进行冗余分析,结果见图3,相关性结果显著性检验分析见表3。由图3可知,冗余分析(RDA)前两个排序轴的累计方差贡献率为83.63%,其中RDA1为58.84%,RDA2为26.79%;YA大曲和水分相关性最大,YB大曲和酸度、淀粉含量及液化力相关性最大,YC大曲和糖化力、液化力及酯化力相关性最大,YD大曲和酸度、淀粉含量相关性最大;Bacillus、Thermoactinomyces、Kroppenstedtia、Rhodococcus、Ralstonia与糖化力、液化力、酯化力变化呈正相关,Microcystis_PCC-7914与酸度、淀粉含量、液化力变化呈正相关,Cronobacter、Pediococcus、Weissella、Lactobacillus与水分和酸度变化呈正相关。
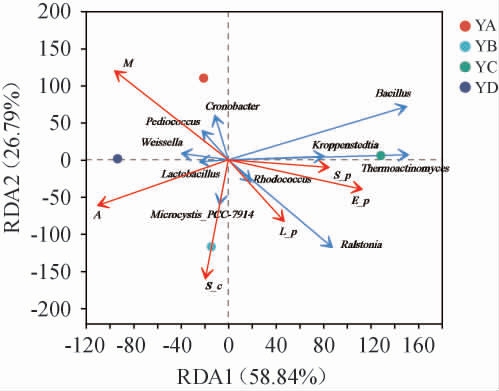
图3 大曲样品细菌群落与理化性质冗余分析
Fig.3 Redundancy analysis of bacterial community and physicochemical properties of Daqu samples
M为水分,A为酸度,L-p为液化力,E-p为酯化力,S-p为糖化力,S-c为淀粉含量。下同。
表3 大曲样品细菌群落与理化性质相关性显著性检验
Table 3 Significance test of correlation between bacterial community and physicochemical properties of Daqu samples
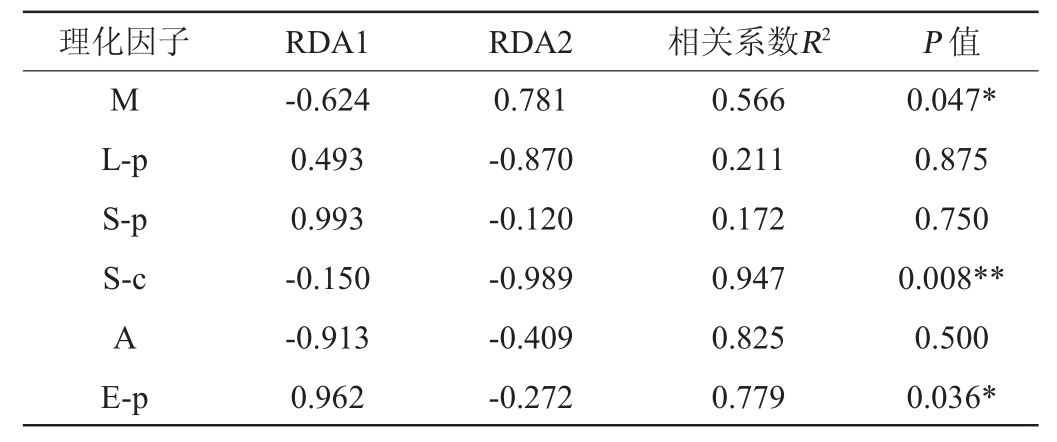
注:“**”表示极显著相关(P<0.01);“*”表示显著相关(P<0.05)。下同。
由表3可知,淀粉含量相关显著性检验(相关系数R2=0.947,P=0.008)对细菌群落结构相关极显著,酯化力(相关系数R2=0.779,P=0.036)和水分含量(相关系数R2=0.566,P=0.047)相关显著。结果表明,大曲的理化性质对细菌群落结构具有相关性。但不同大曲与不同理化性质之间的相关性有一定差异,这势必与制曲环境、气候等自然条件的差异有关。
2.5 大曲样品真菌群落组成分析
由图4可知,在门水平上,四个大曲样品中共检测出3个真菌门,分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)、担子菌门(Basidiomycota)。子囊菌门相对丰度高且在YA、YB、YC、YD大曲样品中均为绝对优势真菌门;毛霉门在四种大曲中也属于优势菌门,在YD、YC、YB大曲中占6.05%~7.90%,在YA大曲中占比较少仅1.06%;担子菌门在YC大曲中占比最高达10.15%;而YA大曲中担子菌门仅占0.03%,属于非优势菌门。子囊菌门、毛霉亚门、担子菌门是大曲的主要真菌门与之前的报道一致[9,42]。四种样品之间真菌群落存在着差异,其中YA大曲的真菌多样性与其他三种大曲差异最大。
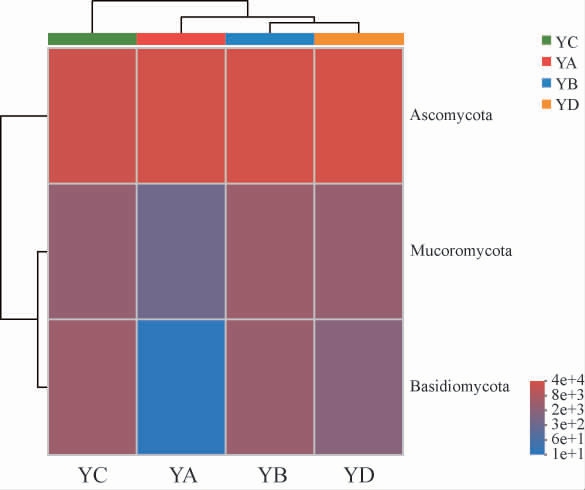
图4 基于门水平的大曲样品的真菌群落结构
Fig.4 Fungi community structure of Daqu samples at phylum level
由图5可知,四个样本中共检测到8个真菌属,分别为嗜热子囊菌属(Thermoascus)、unclassified-o-Eurotiales、复膜孢酵母属(Saccharomycopsis)、norank_p_Mucoromycota、Cutaneotrichosporon、毕赤酵母属(Pichia)、马拉色氏霉菌属(Malassezia)、织球壳菌属(Plectosphaerella)。HUANG Y等[43]借助PCR-变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术分析了不同大曲中微生物组成的差异,结果表明,Saccharomycopsis和Pichia是大曲中主要的酵母属,与本实验所得出的酵母属结果类似;而有研究表明嗜热子囊菌属、根毛霉属为中高温酒曲的优势真菌群[44],本研究与其研究的结果有一定差异,猜测是由于地区的差异、制曲工艺不同等因素造成不同大曲间真菌多样性不同。
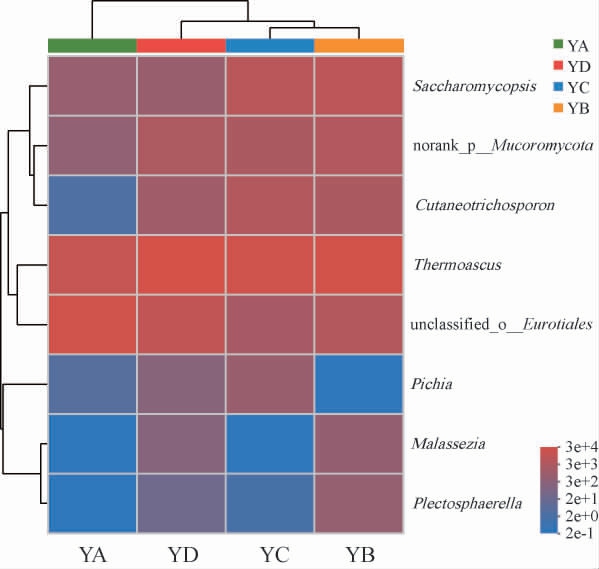
图5 基于属水平大曲样品真菌群落结构
Fig.5 Fungi community structure of Daqu samples at genus level
不同的真菌种类以及占比会赋予大曲各自不同的功能,从而对白酒生产起着至关重要的作用。有关研究表明,嗜热子囊菌属可以产生多种酶(包括过氧化氢酶、葡萄糖苷酶、木聚糖酶、几丁质酶等),它在白酒发酵过程中产生的作用不可忽视[44-45]。此外,本实验中嗜热子囊菌属在四种样品中含量有一定差异,以YA和YD两种大曲样品的差异最大,研究表明嗜热子囊菌属在大曲中的占比与制曲温度是有着密切联系的。在温度较高的大曲中此类真菌群落组成单一,其主要原因可能在于其高温制曲的工艺中,大部分不耐热的微生物会被除掉,因此会形成以嗜热或耐热微生物为主的特殊菌群[46-47]。由此可以发现制曲工艺中选择和控制好适宜的温度会对大曲形成的微生物群落结构具有重要的作用。未分类的散囊菌目(unclassified-o-Eurotiales)具有重要的新陈代谢作用,可以利用各种底物来生产工业上重要的产品,如脂质、壳聚糖、几丁质、多磷酸盐、醇和有机酸等[48-49]。复膜孢酵母属在自然界中存在广泛,具有分泌α-淀粉酶[50]、蛋白酶在内多种水解酶的能力,研究证明该菌属在发酵行业中具有十分重要的作用[4,51]。复膜孢酵母属不仅具有在窖池中发酵产生酒精的能力,还可以提高大曲酒中多种醇、酯的含量,从而可以有效的提高原酒品质[52]。Cutaneotrichosporon在其他大曲样品中未检测到,但此类菌属具有同化多种糖类和甘油的作用,并且能够发酵甘蔗秸秆生产生物乳化剂[53]。毕赤酵母属在白酒堆发酵过程中,是耐热真菌和强大的竞争者,且毕赤酵母属对于自然发酵过程中的质量控制和管理具有重要意义,可以构建白酒发酵微生物群落[54]。
通过对不同样品属水平上的真菌群落结构比较发现,YB、YC、YD三种大曲中嗜热子囊菌属为绝对优势真菌属;YA大曲的绝对优势真菌属为未分类的散囊菌目(unclassified-o-Eurotiales),而该菌属在YB、YC大曲中占比较少;复膜孢酵母属在YB、YC大曲中的含量又远高于YA、YD大曲;Cutaneotrichosporon在三种大曲中占比大小排序分别为YC>YB>YA,在YD大曲中未检出;毕赤酵母属在YC、YD中含有一定比例,前者大于后者。总体来说,YB、YD大曲的物种丰富度要高于YA和YC大曲,由此可见,原因可能是由于区域内环境中存在的微生物种类不同而导致,同时也会受到各自大曲制作工艺的控制。
2.6 大曲真菌群落与理化性质冗余分析
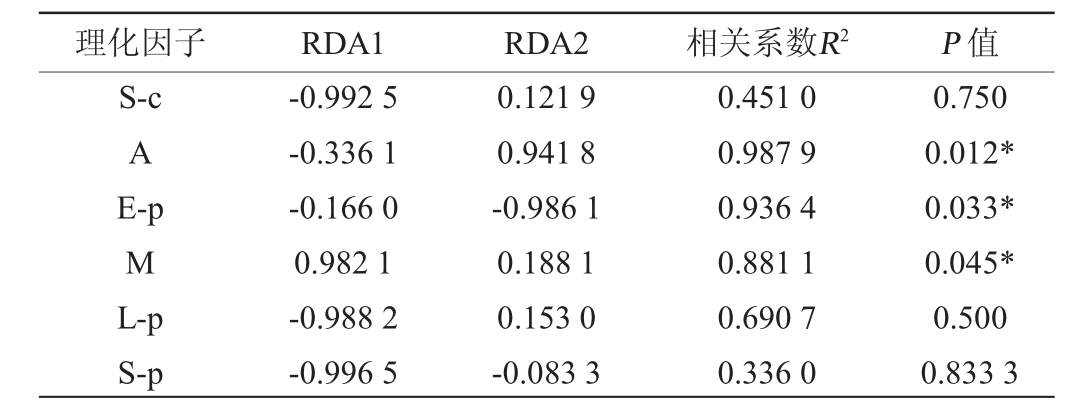
由图6可知,RDA前两个排序轴的累计方差贡献率为98.65%,其中RDA1为85.19%,RDA2为13.46%;YA大曲和水分相关性最大,YB大曲糖化力、淀粉含量及液化力相关性最大,YC大曲和酯化力相关性最大,YD大曲和酸度相关性最大;Thermoascus、Malassezia与水分变化呈正相关,unclassified-o-Eurotiale、norank_p_Mucoromycota、Plectosphaerella与酸度、淀粉含量、液化力、糖化力变化呈正相关,Saccharomycopsis、Cutaneotrichosporon、Pichia 与 酯 化 力、糖化力、淀粉含量、液化力变化呈正相关。由表4可知,酸度(R2=0.987 9,P=0.012)、酯化力(R2=0.936 4,P=0.033)、水分(R2=0.881 1,P=0.045)对真菌群落结构相关显著。
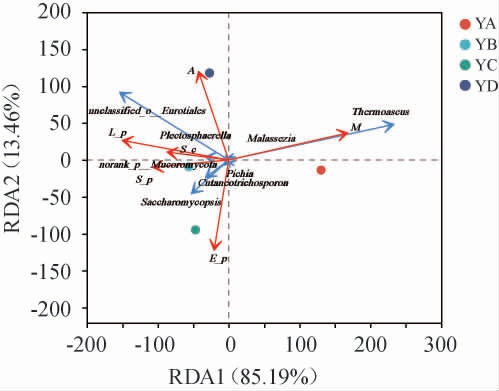
图6 大曲样品真菌群落与理化性质冗余分析结果
Fig.6 Redundant analysis results of fungal community and physicochemical properties of Daqu samples
M为水分,A为酸度,L-p为液化力,E-p为酯化力,S-p为糖化力,S-c为淀粉含量。
表4 大曲样品真菌群落与理化性质相关性显著性检验
Table 4 Significance test of correlation between fungal community and physicochemical properties of Daqu samples
3 结论
该研究采用理化分析结合高通量测序技术,分析河南不同地区浓香型白酒大曲理化性质和微生物群落结构差异;理化性质表明,四个不同地区的大曲在糖化力、酸度和酯化力上存在显著差异;高通量测序分析表明,从四种大曲中共检出9个细菌门和28个细菌属、3个真菌门和8个真菌属;YA、YC和YD大曲中厚壁菌门占绝对优势,其次为变形菌门,YB大曲则相反;YA和YC大曲的绝对优势菌属是芽孢杆菌属,而YB大曲中是青枯菌属,YD大曲中是乳杆菌属。不同大曲中子囊菌门和毛霉门占优势,但毛霉门在YA大曲中占比较小;真菌属水平上,YB、YC、YD大曲中嗜热子囊菌属占绝对优势,而YA大曲的绝对优势真菌属为unclassified-o-Eurotiales。冗余分析表明淀粉含量、酯化力和水分对细菌群落结构显著相关(P<0.05),酸度、酯化力、水分对真菌群落结构显著相关(P<0.05)。
[1]DING X,WU C,HUANG J,et al.Characterization of interphase volatile compounds in Chinese Luzhou-flavor liquor fermentation cellar analyzed by head space-solid phase micro extraction coupled with gas chromatography mass spectrometry(HS-SPME/GC/MS)[J].LWT-Food Sci Technol,2016,66:124-133.
[2]李丽,赵盈盈,曾娟,等.传统固态发酵白酒的酿酒微生物区系研究概况[J].酿酒科技,2014(5):79-83.
[3]YANG J G,DOU X,HAN P J,et al.Microbial diversity in Daqu during production of Luzhou flavored liquor[J].J Am Soc Brew Chem,2017,75(2):136-144.
[4]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[5]WANG Y,CAI W,WANG W,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[6]SAKANDAR H A,HUSSAIN R,KHAN Q F,et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu (starters): A review[J].Food Res Int,2020,138:109830.
[7]章克昌.酒精与蒸馏酒工艺学[M].北京:中国轻工业出版社,2004:79-90.
[8]梁金辉,李安军,李兰,等.基于Biolog ECO技术分离鉴定古井贡酒大曲微生物[J].酿酒,2017,44(1):28-32.
[9]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[10] WANG X,BAN S,HU B,et al.Bacterial diversity of Moutai-flavour Daqu based on high-throughput sequencing method[J].J I Brewing,2017,123(1):138-143.
[11]SUN W,XIAO H,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Ann Microbiol,2016,66(3):1293-1301.
[12]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[13]FAN G,DU Y,FU Z,et al.Characterisation of physicochemical properties,flavour components and microbial community in Chinese Guojing roasted sesame-like flavour Daqu[J].J I Brewing,2020,126(1):105-115.
[14]胡宝东,王晓丹,王婧,等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业,2016,37(2):260-264.
[15]刘延波,刘润雨,赵志军,等.赊店老酒大曲质量差异研究[J].食品工业科技,2019,40(23):77-80,87.
[16]炊伟强,敖宗华,张春林,等.泸州老窖大曲感官特征与微生物、理化指标和生化性能的关联研究[J].食品与生物技术学报,2011,30(5):761-766.
[17]邢钢,敖宗华,王松涛,等.不同温度大曲制曲过程理化指标变化分析研究[J].酿酒科技,2014(6):20-23.
[18]WOLF M,MÜLLER T,DANDEKAR T,et al.Phylogeny of Firmicutes with special reference to Mycoplasma (Mollicutes) as inferred from phosphoglycerate kinase amino acid sequence data[J].Int J Syst Evol Micr,2004,54(3):871-875.
[19] IGARASHI Y,IIDA T,SASAKI T,et al.Isolation of Actinomycetes from live plants and evaluation of antiphytopathogenic activity of their metabolites[J].Actinomycetologica,2002,16(1):9-13.
[20]陈玲,袁玉菊,曾丽云,等.16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J].酿酒科技,2015(12):33-36,40.
[21]HU Y,DUN Y,LI S,et al.Changes in microbial community during fermentation of high-temperature Daqu used in the production of Chinese'Baiyunbian'liquor[J].J I Brewing,2017,123(4):594-599.
[22]HE G,HUANG J,ZHOU R,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[23]翟磊,于学健,冯慧军,等.宜宾产区浓香型白酒酿造生境中细菌的群落结构[J].食品与发酵工业,2020,46(2):18-24.
[24]GANGADHARAN D,SIVARAMAKRISHNAN S,NAMPOOTHIRI K M,et al.Solid culturing of Bacillus amyloliquefaciens for α-amylase production[J].Food Technol Biotech,2006,44(2):269-274.
[25] ZHAO S,ZHOU N,ZHAO Z Y,et al.High-throughput sequencing analysis of the endophytic bacterial diversity and dynamics in roots of the halophyte Salicornia europaea[J].Curr Microbiol,2016,72(5):557-562.
[26]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[27]李仲康.基于罗氏真养菌CO2固定细胞工厂的构建[D].合肥:中国科学技术大学,2019.
[28]YAO S,LIU Y,ZHANG M,et al.Thermoactinomyces daqus sp.nov.,a thermophilic bacterium isolated from high-temperature Daqu[J].Int J Syst Evol Micr,2014,64(1):206-210.
[29]魏金旺.清香型白酒酿造过程中可培养高温放线菌的分离与鉴定[J].酿酒科技,2019(1):56-59,64.
[30]华苟根,郭坚华.红球菌属的分类及应用研究进展[J].微生物学通报,2003,30(4):107-111.
[31]唐静,赵丽青,贾俊涛,等.奶粉中一株阪崎肠杆菌的鉴定及其挥发性产物分析[J].食品安全质量检测学报,2020,11(3):726-733.
[32]唐婧,苏迪,徐小蓉,等.基于宏基因组学的茅台酒酒曲细菌的多样性分析[J].贵州农业科学,2014,42(11):180-183,2.
[33]ZHANG Y,PING Y,ZHOU R,et al.High throughput sequencing-based analysis of microbial diversity in dental unit waterlines supports the importance of providing safe water for clinical use[J].J Infect Public Health,2018,11(3):357-363.
[34] JIAO J,ZHANG L,YI H.Isolation and characterization of lactic acid bacteria from fresh Chinese traditional rice wines using denaturing gradient gel electrophoresis[J].Food Sci Biotechnol,2016,25(1):173-178.
[35] TAKEBE Y,TAKIZAKI M,TANAKA H,et al.Evaluation of the bio-genic amine-production ability of lactic acid bacteria isolated from Tofumisozuke[J].Food Sci Technol Res,2016,22(5):673-678.
[36]郭新梅.葡萄球菌属的鉴定及分类方法研究[D].贵阳:贵州大学,2006.
[37]叶光斌,董瑞丽,王彩虹,等.基于免培养法的中高温大曲细菌群落结构研究[J].江苏农业科学,2013,41(8):333-336.
[38]YANG J G,DOU X,MA Y Y.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].J I Brewing,2018,124(4):498-507.
[39]谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技,2018(9):118-122.
[40]李斌,闫志鹏,李慧星,等.基于高通量测序技术的浓香型和芝麻香型白酒酒曲细菌群落结构分析[J].中国酿造,2018,37(8):148-152.
[41]GUAN T,YANG H,OU M,et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT-Food Sci Technol,2021,139:110544.
[42]张会敏,王杰,何宏魁,等.利用非培养技术初步解析古井贡酒大曲真核微生物群落结构[J].食品工业,2014,35(6):158-162.
[43]HUANG Y,WANG W,YANG B,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J].Lett Appl Microbiol,2011,53(2):134-140.
[44]李斌,胡俊杰,张兰兰,等.基于高通量测序浓香型和芝麻香型白酒酒曲真菌群落结构的分析[J].中国酿造,2019,38(10):96-100.
[45]XIAO C,YANG Y,LU M,et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiol,2021,98(1):103766.
[46]王彩虹,罗惠波,卓毓崇,等.基于ITS基因文库法研究中高温大曲和超高温大曲真菌群落结构[J].食品科技,2014,39(7):41-46.
[47]赵春青,李多川.嗜热子囊菌两个中国新记录种[J].菌物研究,2005(1):27-29.
[48]DZURENDOVA S,ZIMMERMANN B,KOHLER A,et al.Microcultivation and FTIR spectroscopy-based screening revealed a nutrient-induced co-production of high-value metabolites in oleaginous Mucoromycota fungi[J].Plos One,2020,15(6):105-169.
[49]WANG Y,LU S,ZHANG Z,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Res Int,2021,15(1):140-168.
[50]陈蕾.扣囊复膜酵母A11菌株淀粉酶的生产和酒精发酵的研究[D].青岛:中国海洋大学,2010.
[51] LI P,LIN W,LIU X,et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus,Pediococcus,Wickerhamomyces and Saccharomycopsis[J].Food Microbiol,2017,61(1):83-92.
[52]YAO R,LI X,et al.Characterization of bacteria and yeasts isolated from traditional fermentation starter (Fen-Daqu) through a 1H NMR-based metabolomics approach[J].Food Microbiol,2018,15(1):271-357.
[53]IMJ A,AKC A,PRFM A,et al.Comparative data on effects of alkaline pretreatments and enzymatic hydrolysis on bioemulsifier production from sugarcane straw by Cutaneotrichosporon mucoides[J].Bioresource Technol,2020,15(1):301-453.
[54] HE A,LI W,YT A,et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu-science direct[J].Int J Food Microbiol,2020,15(1):336-440.