生物安全问题是影响世界公共卫生安全的主要问题之一。近年来,寄生虫、病毒、细菌等生物危害不仅严重影响着人类的身体健康和正常生活,也阻碍了我国畜牧业、养殖业和种植业的有序发展。因此,如何做到对这些生物危害更为快速、准确的检测成为当务之急。随着分子生物学技术的不断发展,各种新技术层出不穷,等温核酸扩增技术作为一种新型的检测技术,与传统的聚合酶链式反应(polymerase chain reaction,PCR)检测技术相比,凭借其恒温扩增、操作简便、降低成本、应用范围广等特点被广泛应用[1]。环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术和重组酶介导扩增(recombinase-aid amplification,RAA)技术是目前发展比较成熟的3种等温核酸扩增技术,其中,RAA技术是目前唯一可能研究出体内核酸扩增技术的后备技术[2]。本文重点阐述了RAA技术在寄生虫、病毒、细菌、动物源性成分、植物病原等生物安全检测领域的应用,并对其未来发展前景予以展望,以期为RAA技术的应用开发提供依据。
1 RAA技术的简介
RAA技术是一种新型的恒温核酸扩增方法,它的显著特点在于可实现常温下的脱氧核糖核酸(deoxyribonucleic acid,DNA)解链和扩增,且可用于定时定量分析[2-3](见图1)。和传统的PCR技术相比,该技术无疑是一种升级换代的体外核酸快速扩增技术。除此之外,还有一种常温核酸扩增技术—RPA,两者的主要差别在于前者的重组酶是从细菌或真菌中获得的,而后者是较难获得的噬菌体重组酶[4]。RAA技术是我国自主研发的新型检测技术,相对RPA来说,其重组酶来源相对广泛,完全满足我国快速检测的需求。RAA技术凭借其反应迅速、灵敏度高、操作简便等独特优势,吸引了众多生物学者的关注。传统RAA技术的结果判断需要通过凝胶电泳,随着检测技术的飞速发展,RAA通过与其他检测方法相结合衍生出众多新的检测技术,例如实时荧光重组酶介导扩增(real time-recombinase-aid amplification,real time-RAA)、重组酶介导扩增侧向流试纸检测(recombinase-aidamplification-lateralflowdipstic,RAA-LFD)、RAA微流控芯片检测等,已广泛应用于诊断、医疗、食品安全、农业等领域,体现出了极大的应用价值。
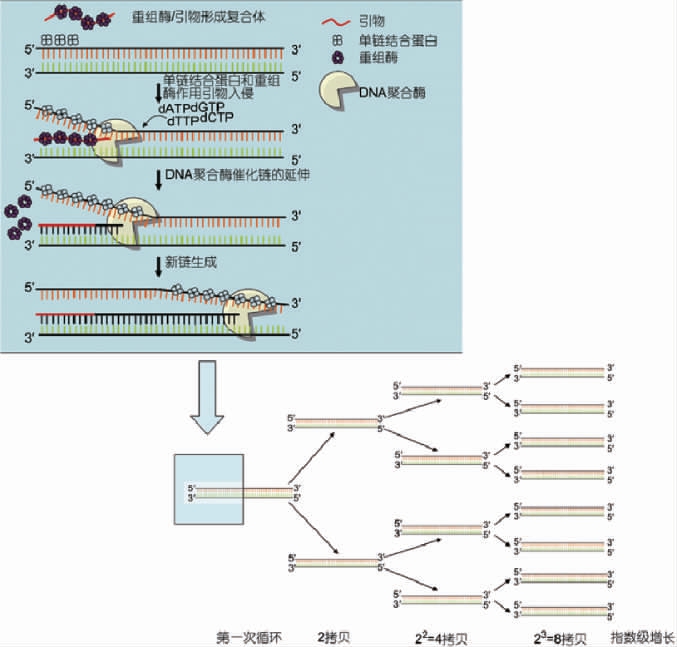
图1 重组酶介导扩增法的原理示意图
Fig.1 Principle schematic diagram of recombinase-mediated amplification
2 RAA技术的应用研究
2.1 在寄生虫检测方面的应用
RAA检测技术凭借其自身的优势,逐渐开始应用于寄生虫病的检测,成为推进寄生虫病防控和现场快速检测的重要手段。丁昕等[5]建立了一种快速、灵敏、特异检测细粒棘球绦虫的荧光RAA法,最低可检测质粒DNA 10拷贝/μL和0.1 ng/μL基因组DNA。同样是针对细粒棘球绦虫的RAA检测方法,周鸿让等[6]建立针对细粒棘球绦虫G1的RAA检测技术,最低可检测量为200 fg/μL,最低检出质粒拷贝数为200拷贝/μL,可望用于该虫种的鉴定以及棘球蚴病基因诊断。上述相同的检测方法和研究对象,检测灵敏度虽有所不同,但均展现出较高的灵敏度。此外,周鸿让研究团队还分别建立了基于RAA技术和双重RAA技术的多房棘球绦虫的检测方法,为多房棘球绦虫鉴定与棘球蚴病诊断提供技术支撑[7-8]。张学勇等[9]则建立了RAA多重核酸检测技术,用于多房棘球绦虫、细粒棘球绦虫和石渠棘球绦虫的快速鉴定,基因组DNA的最低检测限分别为2.0 pg/μL、2.5 pg/μL和3.1 pg/μL,为棘球蚴病病原检测和疫病监测提供了一种新的检测工具。张强等[10]建立了一种可用于广州管圆线虫核酸检测的荧光RAA法,该法最低检出限分别为10拷贝/μL重组质粒和100 pg/μL基因组DNA,具有较好的敏感性和特异性。同时,该团队利用同样的方法检测华支睾吸虫,重组质粒的最低检出限为10拷贝/μL,基因组DNA最低检出限为3 pg/μL[11]。郑伟等[12]建立了可检测疟疾的快速检测方法,可对100个拷贝的目的基因进行扩增,并具有较好的特异性。针对血吸虫病,众多学者利用该技术在血吸虫的检测方面做出了较多研究成果。赵松等[13-14]建立了一种可用于检测日本血吸虫特异性基因片段的RAA方法,可特异性扩增成虫及虫卵基因组DNA,最低可检出的质粒拷贝数为20个/μL,具有应用于日本血吸虫病基因诊断的价值。随后,该研究团队又建立了可检测日本血吸虫核酸片段的实时荧光RAA方法,在5 min时即可观察到明显的荧光信号,不同拷贝数的扩增均可在10 min内完成,最低可检出的质粒浓度为10拷贝/μL。此外,该团队还基于该方法建立了曼氏血吸虫的检测技术,最低可检出质粒拷贝数为10拷贝/μL和0.1 fg/μL[15]。董萱等[16]前期建立的RAA方法能辨别出包括早期感染在内的血吸虫感染性钉螺,检测结果一致性高、重复性好,可用于日本血吸虫感染性钉螺的早期检测。此外,该研究团队基于荧光RAA法最低可检测出100只阴性钉螺中混有1只感染性钉螺[17],同时也对该方法检测日本血吸虫感染性钉螺的效能进行评价,证明该方法具有良好检测效能,在日本血吸虫感染性钉螺筛查中具有一定应用前景[18]。针对生活饮用水中比较受关注的贾第鞭毛虫和隐孢子虫,有学者也基于上述方法做了相关研究。倪碧娴等[19-20]分别建立了可检测蓝氏贾第鞭毛虫和隐孢子虫的荧光RAA方法,其中蓝氏贾第鞭毛虫以重组质粒和基因组DNA为模板,检测敏感性可达102拷贝/μL和1 pg/μL;隐孢子虫对重组质粒、不同浓度隐孢子虫卵囊基因组DNA和不同数量隐孢子虫卵囊基因组DNA的最低检出限分别为102拷贝/μL、1 pg/μL和1个/50 μL。两者的检测灵敏度高且一致,特异性强,检测过程中无交叉反应,相比现有的检测方法,适用性更强。
2.2 在病毒检测方面的应用
针对目前口岸传染病巡查手段局限,主要靠测温仪发现发热病人,而引起发热症状的传染病涵盖广泛,主要包括虫媒传染病和呼吸道传播疾病。目前对该类病毒感染的确诊主要基于核酸检测,RAA技术依靠自身优势在输入性传染病排查方面显示出明显的优越性。郑伟等[21]基于RAA技术建立了黄热病毒的口岸快速检测方法,检测下限可达100 copy,与登革热病毒、西尼罗病毒等蚊媒病毒无交叉反应。此外,针对该类虫媒病毒,李樊等[22]采用反转录重组酶介导核酸扩增(reverse translation-recombinase-aid amplification,RT-RAA)法建立了塔希纳病毒检测方法,质粒标准品的检测下线为100拷贝/反应,病毒培养物最低检出限为10空斑形成单位/反应。吕沁风等[23]则建立了西尼罗病毒的RT-RAA检测方法,检测限可达10 copies,与其他蚊媒病毒无交叉反应。张勤等[24]基于RT-RAA技术建立了日本脑炎病毒(Japanese encephalitis virus,JEV)分型鉴定方法,检测灵敏度可达100拷贝/μL,其中JEV I的灵敏度可达10拷贝/μL,适用于口岸现场JEV的快速检测。此外,该团队还建立了快速鉴定登革病毒血清型的方法,检测的灵敏度可达102 copies/μL,为确定登革病毒分子流行病学趋势提供技术支持[25]。针对新冠病毒的爆发,研究学者也做出快速反应。XUE G H等[26]建立了该病毒的RT-RAA快速检测方法,检测结果与实时PCR结果一致,为该病毒的检测提供了一种简单可靠的方法。ZHENG Y Z等[27]建立了新冠病毒的反转录重组酶介导核酸扩增-侧流层析试纸条(RT-RAALFD)检测方法,该方法检出限达1 copy/μL,在检测临床样本时,与实时定量PCR检测结果保持高度一致的特异性和灵敏度。赵凯颖等[28]为建立非洲猪瘟病毒简便且高效的基层临床检测方法,基于RAA技术建立了与世界动物卫生组织(Office International Des Épizooties,OIE)推荐的荧光定量PCR方法灵敏度相当的检测方法,灵敏度可达10 copies/μL。徐超等[29]建立了检测鸭瘟病毒的普通和荧光RAA方法,其灵敏度分别为100 copies/μL和10 copies/μL,检测结果与商业化PCR试剂盒的符合率为100%。赵康辰等[30]建立了H7N9禽流感病毒的反转录重组酶介导核酸扩增(RT-RAA)技术,H7反应体系和N9反应体系的最低检出限分别为10 copy/μL和100 copy/μL,为该病毒快速检测提供了新的分子工具。陈淑丹等[31]采用反转录重组酶介导核酸扩增技术建立检测人鼻病毒的快速方法,最低扩增拷贝数为100拷贝。该研究团队同样利用该技术建立了禽流感病毒H5N1的快速检测方法,对质粒检测灵敏度可达10拷贝[32]。
2.3 在细菌检测方面的应用
RAA技术由于弥补了传统培养和依赖温变设备技术的不足,能在现场和非实验室环境进行即时检测,所以进一步奠定了其在细菌检测这方面的应用前景。首先,在食源性致病菌的检测方面展现了巨大的潜力。方微微等[33]基于RAA技术建立了快速、灵敏、特异检测哈维弧菌的方法,检测细菌纯培养物的最低检测浓度为7.55×10-1 copies/μL,且与其他食源性致病菌无交叉反应。郝林慧等[34]建立了水产品中副溶血性弧菌(Vibrio parahemolyticus)的RAA快速检测方法,检出限为5.3 CFU/mL,与其他弧菌属菌种不存在交叉反应,和传统培养法结果高度一致。同样是对于副溶血性弧菌(Vibrio parahemolyticus)的检测,孙晓红等[35]则将RAA技术与侧流层析试纸条结合,建立可准确、高效地检测副溶血性弧菌(Vibrio parahemolyticus)的方法,灵敏度比常规PCR高出十倍数量级,细菌纯培养物最低检测限可达1.89×10 copies/μL。同样基于RAA与侧流层析试纸条结合技术,后来旺等[36]则建立了金黄色葡萄球菌(Staphy-lococcus aureus)的可视化快速检测方法,检出限分别为4 fg/μL DNA与183 CFU/mL纯菌液,为牛奶中金黄色葡萄球菌(Staphylococcus aureus)的检测提供新的发展方向。魏莹等[37]利用RAA技术建立快速检测A族乙型溶血性链球菌(Streptococcus hemolytic-β)的方法,在39 ℃,20 min内即可完成检测,灵敏度为10 拷贝/μL。张小平等[38]基于该技术建立了沙门氏菌(Salmonella)的快速检测方法,检测下限为102拷贝/μL,与大肠杆菌(Escherichia coli)、志贺氏菌(Shigella)无交叉反应,特异性良好。同样是基于对沙门氏菌(Salmonella)的检测,周冬根等[39]建立的方法对细菌纯培养物的灵敏度为19 CFU/mL,对模拟样品的灵敏度为190 CFU/mL,该方法在食源性疫情现场调查以及监测中将发挥重要作用。崔荣飞等[40]基于该技术建立了食品中单核细胞增生李斯特菌(Listeria monocytogenes)的快速检测方法,最低可检出的质粒拷贝数为10拷贝/反应。王金凤等[41]建立了一种快速检测铜绿假单胞菌(Pseudomonas aeruginosa)的实时荧光RAA检测方法,对基因组DNA的检出限为3.0×103 fg/μL,对纯培养物的检出限为1.0×103 CFU/μL。成簇的规律间隔短回文重复序列及其相关蛋白(clustered regularly interspaced short palindromic repeats/CRISPR associated protein,CRISPR/Cas)系统是原核生物用来抵御外来遗传物质入侵的免疫防御系统,现已被改造成一种高效的基因编辑工具[42]。葛以跃等[43]将该检测系统与RAA技术相结合,建立了快速检测副溶血性弧菌(Vibrio parahemolyticus)的RAA-Cas13a检测方法,灵敏度为10拷贝DNA分子/反应,与实时PCR对临床样本的检测结果一致性较高。其次,在环境病原微生物的检测方面也颇具竞争力。郭雨等[44]建立一种快速、灵敏检测土壤沙门氏菌(Salmonella)的实时重组酶介导等温核酸扩增(RT-RAA)方法,最低检测质粒拷贝数为10拷贝/反应。此外,朱立苇等[45]则采用该技术监测血站采供血过程中的金黄色葡萄球菌(Staphylococcus aureus)和溶血性链球菌(Streptococcus pyogens),对两种致病菌的最低检出限均为102 CFU/mL,检测结果与形态学-生化法相同,为血站采供血过程中致病菌的检测提供一种快捷的检测方法,提高了临床用血安全。综上所述,RAA技术可以替代PCR技术作为新型恒温核酸检测技术用于食源性致病菌检测。
2.4 在动物源性成分检测方面的应用
肉制品掺杂掺假是食品安全问题的一个重要方面,不仅侵犯了消费者的权益,甚至会影响畜牧业的健康发展和进出口贸易的有序进行。随着核酸扩增技术的发展,目前应用于动物源性成分检测的主流技术是实时荧光PCR。RAA作为一种新兴的检测技术,凭借其自身的优势为肉源性成分的快速检测提供了新的发展方向。苗丽等[46]为了快速准确检测出肉制品中的鸡源性成分,建立了实时荧光RAA方法,可稳定检出最低质量分数为0.1%的鸡源性成分,与猪肉、牛肉、羊肉均没有交叉反应。沈泓等[47]以水牛角鉴别为例建立中药RAA快速鉴别方法,用于水牛角及其混伪品牦牛角的鉴别,在中药现场鉴定、药检抽查等方面有着广阔的应用前景。周新丽等[48]将离心式微流控芯片和RAA技术相结合,用于牛、羊、猪、鸭和鸡源性成分的快速检测,检出的最小质量分数分别为1.0%、1.0%、0.1%、0.1%、1.0%,检测的特异性良好,无交叉反应。新方法的建立为有快速检测需求的食品安全监管部门提供了有效的技术支撑。
2.5 在植物病原检测方面的应用
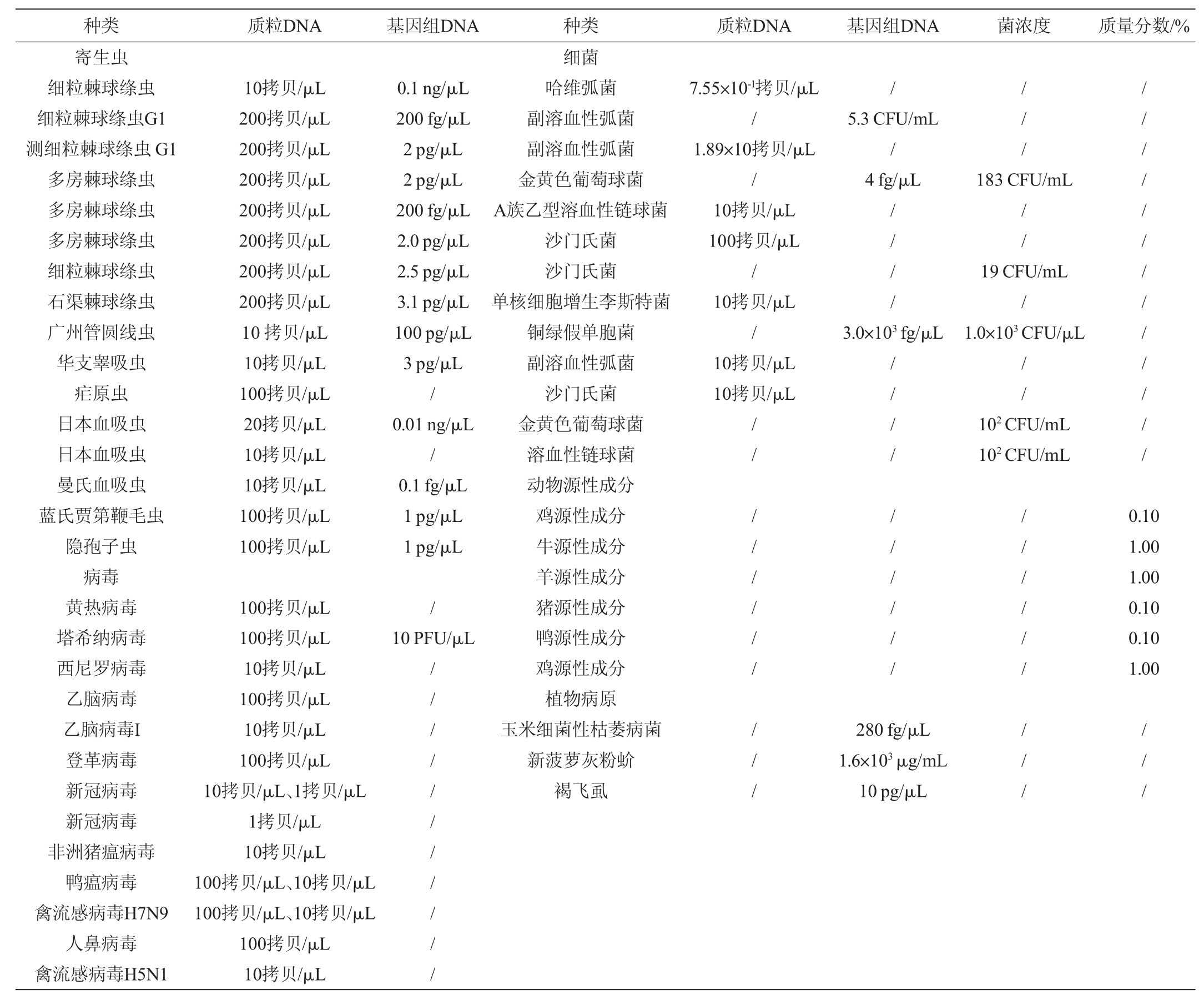
RAA技术在植物病原检测方面开始崭露头角,尤其在农作物病害田间早期诊断、种子病害以及贮藏期病害快速检测等方面。玉米细菌性枯萎病菌是我国进境植物检疫性病原物之一,单长林等[49]基于荧光RAA技术建立了该病菌的快速检测技术,灵敏度达280 fg/μL,可用于现场检测。新菠萝灰粉蚧是我国进境植物检疫性害虫,能传播凤梨凋萎病毒,唐慧骥等[50]利用RAA技术建立了该害虫的快速鉴定方法,检测DNA质量浓度限值为1.6×103μg/mL,可大大提高一线口岸截获粉蚧的鉴定效率。褐飞虱是亚洲稻区最严重的水稻害虫之一,还可以传播病毒,因此,准确预测预报虫情是防治的关键。罗举等[51]建立了褐飞虱的RAA-LFD鉴定技术可用于其与近似种的快速区分,为植保领域的现场即时检测提供了新的契机。RAA技术的应用研究成果见表1。
表1 重组酶介导扩增法的应用研究成果
Table 1 Application research results of the recombinase-mediated amplification
综上所述,RAA技术在各研究领域的应用都展现出较高的灵敏度。虽然对于相同的研究对象,不同的研究学者得出的灵敏度略有不同,但基本与现有的实时荧光PCR检测技术表现出较为一致的灵敏度。在保证较高灵敏度的前提下,RAA检测方法的优势将进一步凸显,为其更广阔的发展领域奠定坚实基础。
3 展望
传统PCR技术自研发之初,一直饱受仪器设备、人员能力、空间、电力等诸多因素的限制。基于此,常温核酸扩增技术的优势显而易见,其中RPA和RAA作为该技术的典型代表,主要区别在于重组酶的获取来源不同。RPA技术已经被英国TwistDx公司申请专利,基于该技术的相关研究都需要依托TwistDx研发的系列试剂盒[52]。RAA技术目前已经在国内申报了专利,技术的便携性能充分扩大核酸扩增技术的应用领域,使其有望在很大程度上突破传统PCR技术的使用限制。RAA技术虽然还处于前期阶段,但作为一种基础的研究手段,取得的成绩已不俗。RAA技术的产生和发展促进了分子生物学的研究,在未来有可能进一步促进功能基因组学和植物分子生物学获得突破性进展。同时,随着该技术的进一步深化、完善,其检测对象可以从核酸扩大到蛋白质、糖类及其他大分子化合物,并可能开发出系列快速诊断产品,定时定量检测特定疾病。以RAA技术为基础的各类核酸快速扩增技术或产品,将为人类健康和动植物疫病的防治提供及时的诊断。
[1]YAN L,ZHOU J,ZHENG Y,et al.Isothermal amplified detection of DNA and RNA[J].Mol Biosyst,2014,10(5):970-1003.
[2]吕蓓,程海荣,严庆丰,等.用重组酶介导扩增技术快速扩增核酸[J].中国科学,2010,40(10):983-988.
[3]吕蓓,程海荣,严庆丰,等.体外核酸快速扩增技术的发展和不断创新[J].中国生物工程杂志,2011,31(3):91-96.
[4]孙晓红,后来旺,李达容,等.重组酶等温扩增技术在分析检测中的应用研究进展[J].食品与发酵工业,2020,46(24):265-270.
[5]丁昕,刘燕红,倪碧娴,等.基于重组酶介导等温扩增技术的细粒棘球绦虫核酸检测方法的建立[J].中国血吸虫病防治杂志,2020,32(4):340-344.
[6]周鸿让,王晓玲,许秋利,等.重组酶介导等温核酸扩增技术检测细粒棘球绦虫方法的建立及初步应用评价[J].中国病原生物学杂志,2020,15(6):655-660.
[7]周鸿让,陈木新,余晴,等.重组酶介导的等温核酸扩增技术检测多房棘球绦虫方法的建立及初步应用[J].中国血吸虫病防治杂志,2020,32(2):168-173,180.
[8]周鸿让,茅光耀,王晓玲,等.重组酶介导的多重核酸等温扩增法鉴别细粒棘球绦虫和多房棘球绦虫技术的建立与应用[J].中国寄生虫学与寄生虫病杂志,2020,38(3):310-316.
[9]张学勇,简莹娜,郭志宏,等.基于重组酶介导的等温扩增技术的3种棘球绦虫核酸检测方法的建立及初步应用[J].中国血吸虫病防治杂志,2021,33(4):339-345.
[10]张强,丁昕,刘燕红,等.基于重组酶介导等温扩增技术的广州管圆线虫核酸检测方法的建立[J].中国血吸虫病防治杂志,2020,32(4):350-354.
[11]张强,丁昕,吴小珉,等.重组酶介导的华支睾吸虫特异性核酸等温扩增方法的建立及初步评价[J].中国血吸虫病防治杂志,2019,31(5):468-472.
[12]郑伟,麻慧君,鲁婕,等.实时荧光重组酶介导核酸扩增在疟原虫快速检测中的应用研究[J].中国卫生检验杂志,2017,27(2):295-296,304.
[13]赵松,李婷,杨坤,等.重组酶介导的日本血吸虫特异性基因片段核酸等温扩增检测方法的建立[J].中国血吸虫病防治杂志,2018,30(3):273-277,306.
[14]赵松,刘燕红,李婷,等.结合重组酶介导的核酸等温扩增和荧光探针快速检测日本血吸虫基因片段[J].中国寄生虫学与寄生虫病杂志,2019,37(1):23-27.
[15]赵松,刘燕红,叶钰滢,等.基于重组酶介导核酸等温扩增反应的曼氏血吸虫基因检测方法的建立[J].中国血吸虫病防治杂志,2020,32(4):335-339,344.
[16]董萱,熊春蓉,李婷,等.重组酶介导核酸等温扩增荧光法用于日本血吸虫感染性钉螺早期检测的研究[J].中国病原生物学杂志,2019,14(11):1245-1249.
[17]李婷,刘燕红,赵松,等.重组酶介导的核酸等温扩增荧光法快速检测日本血吸虫感染性钉螺[J].中国血吸虫病防治杂志,2019,31(2):109-114,120.
[18]叶钰滢,赵松,刘燕红,等.重组酶介导的核酸等温扩增荧光法检测日本血吸虫感染性钉螺的效能评价[J].中国血吸虫病防治杂志,2021,33(2):185-188.
[19]倪碧娴,刘燕红,徐祥珍,等.重组酶介导的蓝氏贾第鞭毛虫特异性等温核酸扩增方法的建立及评价[J].中国血吸虫病防治杂志,2020,32(4):345-349.
[20]倪碧娴,吴小珉,刘燕红,等.重组酶介导的隐孢子虫属特异性等温核酸扩增方法的建立及评价[J].中国血吸虫病防治杂志,2019,31(4):388-392.
[21]郑伟,徐琦,罗鹏,等.重组酶介导扩增方法快速检测黄热病毒[J].中国卫生检验杂志,2016,26(1):1-3.
[22]李樊,郭晓芳,般启凯,等.塔希纳病毒的重组酶介导扩增快速检测方法[J].疾病监测,2020,35(3):192-196.
[23]吕沁风,廖静,罗鹏,等.西尼罗病毒的逆转录重组酶介导扩增检测方法[J].微生物学通报,2020,47(2):659-664.
[24]张勤,高洁,张芳,等.乙脑病毒实时荧光重组酶介导逆转录扩增方法的建立[J].中国国境卫生检疫杂志,2020,43(6):385-388.
[25]张勤,王永亮,曹晓婉.应用重组酶介导逆转录扩增技术快速登革病毒血清型鉴定[J].口岸卫生控制,2020,25(6):21-25.
[26]XUE G H,LI S L,ZHANG W W,et al.Reverse-transcription recombinase-aided amplification assay for rapid detection of the 2019 novel coronavirus(SARS-CoV-2)[J].Anal Chem,2020,92(14):9699-9705.
[27]ZHENG Y Z,CHEN J T,LI J,et al.Reverse transcription recombinaseaided amplification assay with lateral flow dipstick assay for rapid detection of 2019 novel coronavirus[J].Front Cell Infect Microbiol,2021,11:1-7.
[28]赵凯颖,曾德新,胡永新,等.非洲猪瘟病毒实时荧光RAA检测方法的建立[J].中国兽医科学,2021,51(1):1-8.
[29]徐超,董新吉,王超群,等.基于重组酶介导扩增技术诊断鸭瘟方法的建立[J].中国家禽,2019,41(17):20-24.
[30]赵康辰,崔仑标,葛以跃,等.重组酶介导的等温扩增法检测H7N9禽流感病毒[J].江苏预防医学,2016,27(5):524-530.
[31]陈淑丹,张小平,李杰,等.重组酶介导恒温扩增快速检测人鼻病毒的方法学研究[J].中国卫生检验杂志,2020,30(19):2305-2307.
[32]陈淑丹,廖静,王玲,等.禽流感病毒H5N1的重组酶介导检测方法学研究[J].中国口岸科学技术,2021(3):4-9.
[33]方微微,陈璐萍,王恒樑,等.重组酶介导等温扩增技术检测哈维氏弧菌[J/OL].上海海洋大学学报,2020,https://kns.cnki.net/kcms/detail/31.2024.s.20201208.1717.002.html
[34]郝林慧,梁莹,罗纪军,等.重组酶介导扩增技术快速检测水产品中副溶血性弧菌[J].食品安全质量检测学报,2021,12(13):5266-5272.
[35]孙晓红,后来旺,郜蓉.一种重组酶等温扩增技术检测副溶血性弧菌地方法:CN 110564881 A[P].2019-10-21.
[36]后来旺,李达容,邓波,等.金黄色葡萄球菌RAA-LFD快速检测方法的建立与应用[J].食品科学,2021,43(4):331-339.
[37]魏莹,郭利川,张小平,等.重组酶介导扩增方法快速检测A族乙型溶血性链球菌[J].中国国境卫生检疫杂志,2018,41(5):314-316,323.
[38]张小平,郑乐怡,魏莹,等.重组酶介导扩增技术快速检测沙门菌方法的建立[J].中国国境卫生检疫杂志,2017,40(5):317-319.
[39]周冬根,罗洁.沙门菌荧光重组酶介导等温扩增检测方法的应用研究[J].中国热带医学,2019,19(2):107-110,119.
[40]崔荣飞,赵义良,田梅,等.重组酶介导扩增技术快速检测食品中单核细胞增生李斯特菌[J].食品安全质量检测学报,2021,12(5):1773-1776.
[41]王金凤,项佳林,孙晓霞,等.铜绿假单胞菌实时荧光重组酶介导链替换核酸扩增方法建立及应用[J].中国食品卫生杂志,2020,32(5):524-529.
[42] JINEK M,CHYLINSKI K,FONFARA I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[43]葛以跃,苏璇,张倩,等.CRISPR-Cas13a结合重组酶介导的扩增快速检测副溶血性弧菌方法的建立[J].现代预防医学,2019,46(20):3777-3781.
[44]郭雨,刘常宏,卜元卿,等.重组酶介导等温核酸扩增方法快速检测土壤沙门氏菌[J].微生物学通报,2021,48(3):1041-1047.
[45]朱立苇,王拥军,丁威,等.重组酶等温扩增技术监测采供血环境中致病菌的应用研究[J].中国卫生检验杂志,2020,30(1):43-45.
[46]苗丽,张秀平,王建昌,等.肉制品中鸡源性成分重组酶介导等温扩增检测方法的建立及应用[J].江苏农业学报,2019,35(4):954-959.
[47]沈泓,袁媛,陈碧莲,等.基于重组酶介导扩增技术的水牛角快速现场鉴别方法[J].中国实验方剂学杂志,2019,25(17):130-135.
[48]周新丽,申炳阳,高丽娟,等.用于五种动物源性成分快速检测的离心式微流控芯片系统研制[J].食品与发酵工业,2020,46(3):229-234.
[49]单长林,周圆,李孝军.玉米细菌性枯萎病菌荧光重组酶介导等温扩增检测方法的建立与应用[J].广东农业科学,2021,48(1):111-118.
[50]唐慧骥,党志浩,郭长宁,等.应用重组酶介导核酸扩增技术快速鉴定新菠萝灰粉蚧[J].植物检疫,2019,33(2):37-42.
[51]罗举,唐健,王爱英,等.基于重组酶介导扩增—侧流层析试纸条的褐飞虱快速鉴定方法[J].中国水稻科学,2021,36(1):96-104.
[52]王晓勋,徐嘉良.重组酶聚合酶扩增技术及其在食品安全领域的应用[J].食品科技,2018,43(6):1-7.