我国是食用豆生产与消费大国,食用豆资源丰富,食用豆加工产品在食品工业中占有重要地位。食用豆不仅含有蛋白质、维生素和矿物质等营养物质[1],还具有多酚和多肽等生物活性成分,使食用豆具有抗氧化、抑菌、降血糖和降血压等[2]多种生物学功能。王何柱等[3]研究发现,不同芸豆种皮总酚含量为0.76~48.73 mg/g,其中黑芸豆种皮总酚含量最高,表现出良好的抗氧化能力。发酵、膨化、发芽和酶处理等加工方式对食用豆的营养组分、生物活性成分和生物学功能等都具有显著影响。
发酵是一种传统的食品生物加工技术,由于微生物生物化学代谢作用,能够改善食用豆及其制品的营养性能和生物活性。目前,发酵食用豆最常用菌种包括枯草芽孢杆菌(Bacillus subtilis)、乳酸菌以及少数真菌[4]。乳酸菌对人体健康有益,作为益生菌具有开发发酵食品的潜力[5]。LI S L等[6]研究发现,利用干酪乳杆菌(Lactobacillus casei)发酵能提高大豆酚类化合物含量和抗氧化活性。LIMÓN R I等[7]利用植物乳杆菌(Lactobacillus plantarum)发酵增加了菜豆酚类含量和血管紧张素转换酶抑制活性,表现出较高的抗氧化活性和降血压能力。此外,GAN R Y等[8]利用副干酪乳杆菌(Lactobacillus paracasei)和植物乳杆菌分别发酵绿豆和红豆,发现发酵对绿豆和红豆总酚含量、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis-(3-ethylbenzthiazoline-6-sulfonic acid)diammonium salt,ABTS)自由基清除活性和铁离子还原能力均有影响。发酵过程对单一品种食用豆生物活性影响已有较多研究,但是对多品种食用豆发酵的抗氧化活性比较少有报道。
本实验选取绿豆、红豆、豇豆、蚕豆、菜豆、大豆、扁豆和豌豆8种常见食用豆作为研究对象,以干酪乳杆菌(Lactobacillus casei)NRRL B-441为发酵菌株,采用固态发酵的方式,研究8种食用豆发酵前后总酚、总黄酮含量以及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性、ABTS自由基清除活性和铁离子还原能力(ferric ion reducing antioxidant power,FRAP)的变化,为利用食用豆发酵开发不同功能食品提供理论基础。
1 材料与方法
1.1 材料与试剂
绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆:湖北省豆类(蔬菜)植物工程技术研究中心;干酪乳杆菌(Lactobacillus casei)NRRL B-441:湖北省豆类(蔬菜)植物工程技术研究中心;芦丁、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(2,4,6-tri(2-pyridyl)-1,3,5-triazine,TPTZ):索莱宝公司;DPPH、ABTS:麦克林公司;MRS(de Man Rogosa and Sharpe)肉汤培养基、MRS琼脂培养基、没食子酸、七水合硫酸亚铁、福林酚试剂、丙酮、甲醇和无水乙醇(均为分析纯或生化试剂)等试剂:国药集团化学试剂有限公司。
1.2 仪器与设备
SPX-150B-Z型生化培养箱:上海博讯实业有限公司医疗设备厂;SMF01磨粉机:苏泊尔电器公司;AE224C电子天平:上海舜宇恒平科学仪器有限公司;YRE-201D旋转蒸发器、SHZ-DⅢ循环水式真空泵:巩义市予华仪器有限责任公司;美国LABCONCO冷冻干燥机;HWS-24电热恒温水浴锅:上海尚道仪器制造有限公司;Multiskan Go 1510全波长酶标仪:Thermo Fisher公司。
1.3 实验方法
1.3.1 菌种活化
MRS肉汤培养基和MRS琼脂培养基于121 ℃灭菌15 min。将冻藏于-80 ℃的干酪乳杆菌NRRL B-441菌株接种于MRS琼脂培养基上,在培养箱中37 ℃培养2 d,挑取干酪乳杆菌NRRL B-441单菌落于MRS肉汤培养基中,在37 ℃静置培养24 h,得到种子液。
1.3.2 固态发酵与样品制备
参考LI S L等[6,9]的方法,将8种食用豆用磨粉机磨成直径<1 mm的粉末。分别称取10 g豆粉置于发酵瓶内,于121 ℃灭菌15 min,待其冷却后,以5%的接种量分别接种至8种豆粉中,置于培养箱,37 ℃发酵培养7 d。未发酵豆粉作为对照。发酵结束后,将发酵、对照组豆粉置于冷冻干燥机,在-80 ℃条件下冷冻干燥12 h,将冻干豆粉置于-20 ℃储存备用。
1.3.3 总酚和总黄酮提取
参考王何柱等[10]的提取方法,分别称取1 g冻干豆粉,加入20 mL体积分数80%的丙酮,振荡10 min,上清液通过0.22 μm滤膜过滤,收集滤液,此操作重复两次。将两次得到的滤液旋蒸至10 mL,蒸馏水定容至25 mL,提取物在-20 ℃条件下冷藏备用。
1.3.4 总酚和总黄酮测定
总酚含量的测定:参考白周亚等[11]的方法,采用福林酚法测定食用豆中的总酚含量。以没食子酸作为标准,制备0.1 mg/mL的没食子酸标准溶液,分别配制质量浓度为0、0.01 mg/mL、0.02 mg/mL、0.03 mg/mL、0.04 mg/mL、0.05 mg/mL的系列标准溶液。吸取系列标准溶液或样品溶液0.5 mL,加入福林酚试剂0.5 mL,摇匀静置30 s后,加入10 g/100mL碳酸钠溶液3.0 mL,定容至5.0 mL,避光反应30 min。取100 μL反应液于96孔板中,在波长760 nm处测定吸光度值,绘制标准曲线。结果用毫克没食子酸当量(GAE)每克豆粉表示(mg GAE/g),以干质量计。
总黄酮含量测定:参考李秀凉等[12]的方法,采用亚硝酸钠-硝酸铝-氢氧化钠显色法测定总黄酮含量。以芦丁作为标准,制备0.1 mg/mL芦丁标准液。分别取0、0.5 mL、1 mL、2 mL、3 mL、4 mL标准液,用60%乙醇定容至5.0 mL,加入0.3 mL的5%亚硝酸钠溶液,摇匀后放置5 min,加入0.3 mL的10%硝酸铝,摇匀放置6 min,最后加入2.0 mL的1 mol/L氢氧化钠溶液,用体积分数60%乙醇定容至10 mL,摇匀静置15 min,在波长510 nm处测定吸光度值。以标准液质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。样品溶液测定方法同上。结果用毫克芦丁当量(RE)每克豆粉表示(mg RE/g),以干质量计。
1.3.5 抗氧化活性测定
DPPH自由基清除活性测定:参考白周亚等[11]的方法。以Trolox作为标准,制备0.02 mg/mL Trolox标准溶液和0.1 mmol/LDPPH溶液。分别取0.125 mL、0.250 mL、0.500 mL、1.000 mL、2.000 mL标准溶液于10 mL容量瓶,甲醇定容。按照如下要求分别配制A0(1mLDPPH和1mL蒸馏水)、A1(1mL标准液和1 mL无水乙醇)和A2(1 mL标准液或样品溶液和1 mL DPPH溶液),摇匀避光静置30 min。分别取A0、A1和A2 200 μL置于酶标板中,于波长517 nm处测定吸光度值。结果以DPPH自由基清除率表示,清除率计算公式如(1)所示。
ABTS自由基清除活性测定:参考MOGHADAM M等[13]的方法。将7.4 mol/L ABTS溶液和2.6 mmol/L过硫酸钾溶液等体积混合,避光反应12 h得到母液。制备1 000 μmol/L Trolox标准溶液,用甲醇稀释至0、50 μmol/L、100 μmol/L、150 μmol/L、200 μmol/L、250 μmol/L、300 μmol/L,并且将ABTS母液吸光度值调整到0.700±0.001。分别取100 μL稀释液或样品溶液,加入1 mL ABTS稀释液为Ai,100 μL甲醇加入1mLABTS稀释液为A0,避光静置10min。在波长734nm处测定吸光度值Ai和A0。横坐标为标准溶液浓度,纵坐标为清除率绘制标准曲线。样品结果以每克干重豆粉所含Trolox当量(TE)的微摩尔数表示(μmol TE/g),以干质量计。清除率计算公式如(2)所示。
FRAP铁离子还原能力测定:参考白周亚等[11]的方法。将300 mmol/L醋酸盐缓冲液、10 mmol/L TPTZ溶液和20 mmol/L氯化铁溶液以10∶1∶1(V/V)混合,制成FRAP工作液,置于37 ℃水浴预热。
制备1 mmol/L FeSO4·7H2O标准溶液,分别配制为0.5 mmol/L、0.25 mmol/L、0.125 mmol/L、0.062 5 mmol/L系列标准溶液。取100 μL标准液或样品溶液,分别加入1.8 mL预热的FRAP工作液,摇匀后37 ℃反应10 min,取100 μL反应液于96孔板,波长593 nm处测定吸光度值。以标准液浓度作为横坐标,吸光度值为纵坐标绘制标准曲线。样品结果以每克豆粉所含硫酸亚铁当量(FE)的微摩尔数表示(μmol FE/g),以干质量计。
1.3.6 数据分析
实验均重复3次。运用Microsoft Excel 2010整理数据,SPSS 20进行显著性和相关性分析,运用Origin Pro 2021绘制相关图示。
2 结果与分析
2.1 8种食用豆发酵前后总酚和总黄酮含量变化
8种食用豆发酵前后总酚含量变化如图1所示。由图1可知,发酵前绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆总酚含量分别为(1.36±0.09)mg GAE/g、(4.13±0.15)mg GAE/g、(5.53±0.18)mg GAE/g、(1.68±0.31)mg GAE/g、(2.57±0.12)mg GAE/g、(1.29±0.02)mg GAE/g、(1.44±0.03)mg GAE/g和(1.28±0.13)mg GAE/g;发酵后绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆总酚含量分别为(3.84±0.06)mg GAE/g、(3.76±0.19)mg GAE/g、(3.13±0.26)mg GAE/g、(1.90±0.08)mg GAE/g、(1.57±0.07)mg GAE/g、(2.20±0.02)mg GAE/g、(1.98±0.04)mg GAE/g、(1.64±0.10)mg GAE/g。相比发酵前,发酵后红豆、豇豆和菜豆总酚含量分别下降8.96%、43.40%和38.91%;绿豆、蚕豆、大豆、豌豆和扁豆总酚含量分别上升182.35%、13.10%、70.54%、37.50%、28.13%;其中豇豆下降最显著,绿豆增加最显著。由于发酵时多酚氧化酶作用,酚类化合物氧化分解,导致总酚含量下降[14]。ALI N M等[15]研究表明,发酵处理增加绿豆、大豆和蚕豆总酚含量。LIMÓN R I等[7]利用枯草芽孢杆菌发酵菜豆,菜豆的总酚含量从(15.89±0.56)mg GAE/g增加至(35.93±0.69)mg GAE/g,表明利用不同微生物发酵对食用豆总酚含量具有显著影响。
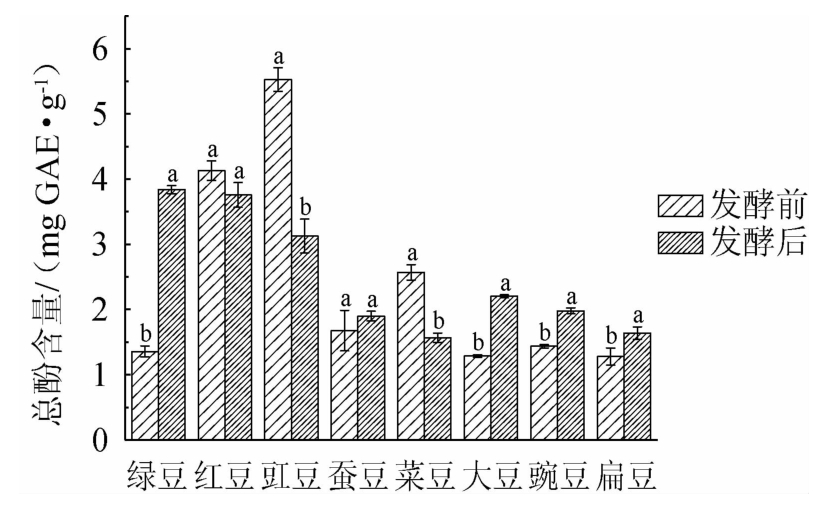
图1 8种食用豆发酵前后总酚含量变化
Fig.1 Changes of total phenol contents in 8 kinds of edible beans before and after fermentation
小写字母不同表示同种食用豆发酵前后有显著性差异(P<0.05)。下同。
8种食用豆发酵前后总黄酮含量变化如图2所示。由图2可知,发酵前的绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆总黄酮含量分别为(0.97±0.04)mg RE/g、(11.55±0.16)mg RE/g、(9.47±0.21)mg RE/g、(1.29±0.02)mg RE/g、(4.98±0.08)mg RE/g、(1.74±0.02)mg RE/g、(1.30±0.18)mg RE/g和(1.28±0.05)mg RE/g。发酵前红豆总黄酮含量最高,绿豆总黄酮含量最低。发酵后绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆中总黄酮含量分别为(1.24±0.14)mg RE/g、(6.67±0.16)mg RE/g、(3.40±0.57)mg RE/g、(1.25±0.07)mg RE/g、(0.89±0.05)mg RE/g、(0.72±0.07)mg RE/g、(1.17±0.02)mg RE/g和(1.08±0.11)mg RE/g。相比发酵前,发酵后绿豆总黄酮含量上升27.84%,红豆、豇豆、菜豆和大豆总黄酮含量分别下降42.25%、64.10%、82.13%和58.62%,蚕豆、豌豆和扁豆总黄酮含量无显著变化(P>0.05)。黄酮化合物属于酚类化合物的一种,发酵过程中多酚氧化酶将黄酮类化合物氧化生成其他物质是黄酮含量降低的主要原因[14,16]。刘伟伟等[17]也研究发现,利用蛹虫草真菌发酵绿豆,总黄酮含量从(0.67±0.03)mg RE/g增加至(0.97±0.02)mg RE/g,增加44.78%。
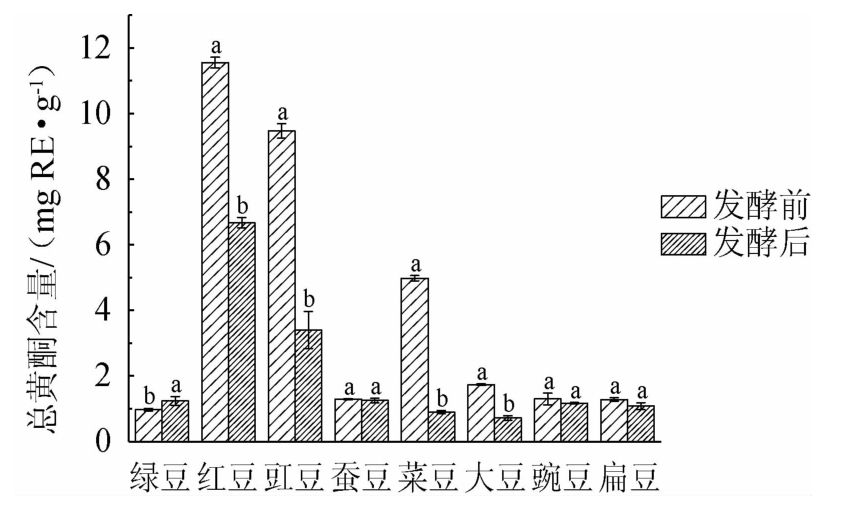
图2 发酵前后8种食用豆总黄酮含量变化
Fig.2 Changes of total flavonoid contents of 8 kinds of edible beans before and after fermentation
2.2 8种食用豆发酵前后抗氧化活性
2.2.1 8种食用豆发酵对DPPH自由基清除率的影响
8种食用豆发酵前后提取物DPPH自由基清除活性比较如图3所示。由图3可知,发酵前绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆提取物DPPH自由基清除率分别为(37.09±2.12)%、(95.67±1.10)%、(96.16±0.47)%、(38.56±0.60)%、(92.01±3.19)%、(34.42±2.52)%、(32.17±1.30)%和(47.62±4.27)%,红豆和豇豆原料提取物有较高的DPPH自由基清除率。发酵后绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆提取物DPPH自由基清除率分别为(46.37±3.29)%、(76.41±2.90)%、(67.47±2.71)%、(53.08±3.47%)、(38.44±2.58)%、(37.92±2.15)%、(44.93±2.54)%和(48.60±4.07)%。相比发酵前,发酵后绿豆、蚕豆、大豆、豌豆和扁豆提取物DPPH自由基清除率分别上升25.02%、37.66%、10.17%、39.66%、2.06%;红豆、豇豆、菜豆提取物DPPH自由基清除率分别下降20.13%、29.84%和58.22%。其中豌豆提取物上升最显著,菜豆提取物下降最显著。SANJUKTA S等[18]通过Bacillus subtilis MTCC1747发酵大豆,大豆提取物DPPH自由基清除率由(4.12±0.33)mg AAE/g增加至(17.11±0.50)mg AAE/g,提升了3.15倍。VERNI M等[19]利用乳酸菌发酵不同生物型蚕豆,发酵48 h后蚕豆提取物DPPH自由基活性上升11%,与本研究有类似效果。DPPH自由基清除活性与酚类含量相关,酚类含量下降,DPPH自由基清除率下降[20]。
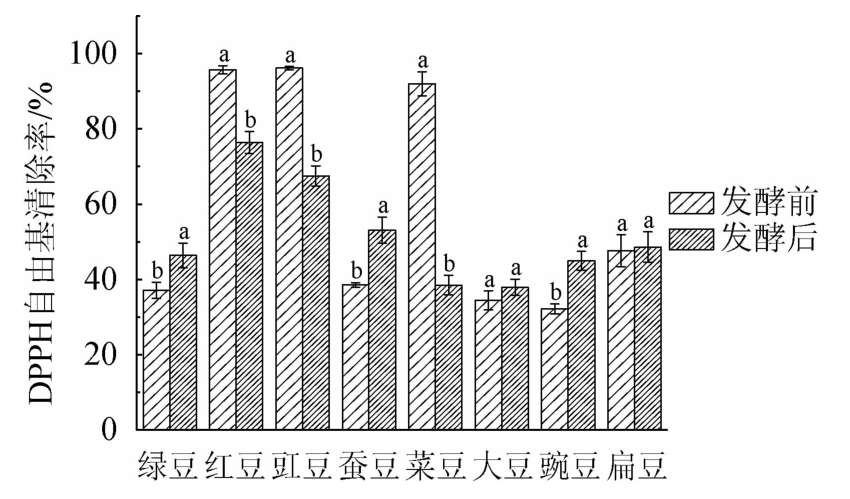
图3 发酵前后8种食用豆提取物DPPH自由基清除活性变化
Fig.3 Changes of DPPH radical scavenging activity of 8 kinds of edible beans extracts before and after fermentation
2.2.2 8种食用豆发酵对ABTS自由基清除活性的影响
8种食用豆发酵前后ABTS自由基清除活性比较见图4。由图4可知,发酵前绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆提取物ABTS自由基清除活性为(6.18±0.54)μmol TE/g、(35.62±2.25)μmol TE/g、(49.92±3.18)μmol TE/g、(36.99±0.70)μmol TE/g、(26.34±2.18)μmol TE/g、(14.57±2.51)μmol TE/g、(6.22±0.84)μmol TE/g和(7.73±1.55)μmol TE/g。红豆、豇豆和蚕豆原料提取物ABTS自由基清除活性较高。发酵后绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆提取物ABTS自由基清除活性分别为(10.12±2.79)μmol TE/g、(18.57±0.87)μmol TE/g、(18.22±0.59)μmol TE/g、(11.85±1.46)μmol TE/g、(6.52±0.98)μmol TE/g、(7.21±0.27)μmol TE/g、(6.86±1.91)μmol TE/g和(8.92±2.37)μmol TE/g。相比发酵前,发酵红豆、豇豆、蚕豆、菜豆和大豆提取物ABTS自由基清除活性分别下降了47.87%、63.50%、67.96%、75.25%和50.51%;绿豆、豌豆和扁豆提取物ABTS自由基清除活性分别增加了63.75%、10.29%和15.39%。其中绿豆提取物上升最显著(P<0.05),菜豆提取物下降最显著(P<0.05)。GAN R Y等[8]研究发现,发酵大豆提取物ABTS自由基清除活性下降51.67%,POLANOWSKA K等[21]利用3种少孢根霉发酵蚕豆,蚕豆提取物ABTS自由基清除活性下降44%~53%。微生物发酵过程能显著影响食用豆ABTS自由基清除活性。
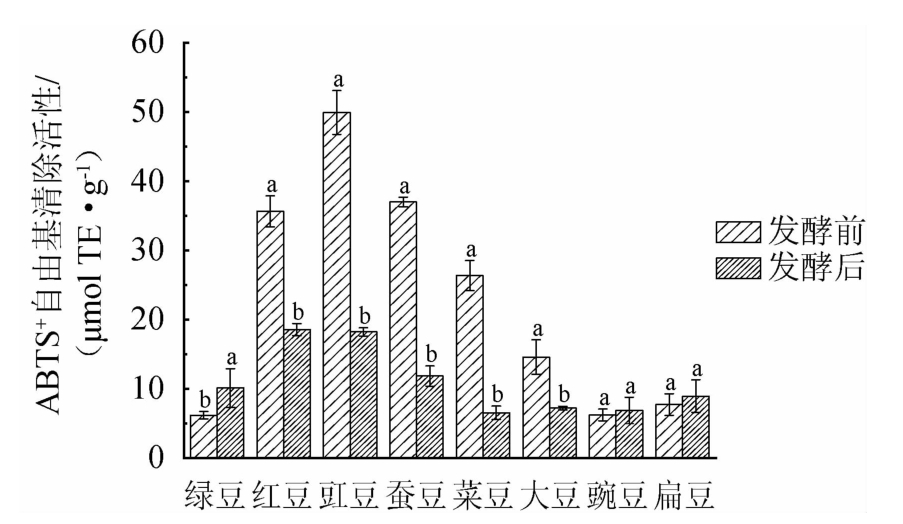
图4 发酵前后8种食用豆提取物ABTS自由基清除活性变化
Fig.4 Changes of ABTS radical scavenging activity of 8 kinds of edible beans extracts before and after fermentation
2.2.3 8种食用豆发酵对铁离子还原能力的影响
8种食用豆发酵前后铁离子还原能力比较如图5所示。由图5可知,发酵前绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆提取物铁离子还原能力分别为(8.65±0.39)μmol FE/g、(41.13±2.47)μmol FE/g、(64.27±4.40)μmol FE/g、(16.88±0.85)μmol FE/g、(28.44±2.45)μmol FE/g、(5.75±0.08)μmol FE/g、(5.44±0.14)μmol FE/g和(6.70±0.15)μmol FE/g,发酵后分别为(10.14±1.55)μmol FE/g、(19.09±2.55)μmol FE/g、(21.94±0.71)μmol FE/g、(15.50±0.76)μmol FE/g、(8.25±0.98)μmol FE/g、(7.92±0.16)μmol FE/g、(11.97±1.52)μmol FE/g和(8.59±0.37)μmol FE/g。相比发酵前,发酵后红豆、豇豆和菜豆提取物铁离子还原能力分别下降53.59%、65.86%和70.99%;绿豆、大豆、豌豆和扁豆提取物铁离子还原能力分别上升17.23%、37.74%、120.04%和28.21%;其中菜豆下降最显著(P<0.05),豌豆上升最显著(P<0.05)。MUHIALDIN B J等[9]利用乳酸菌发酵苦豆,苦豆提取物铁离子还原能力从311 mmol Fe(Ⅱ)/g下降到290 mmol Fe(Ⅱ)/g。XIAO Y等[22]利用蛹虫草(Cordyceps militaris)SN-18发酵绿豆,绿豆提取物铁离子还原能力也显著增加。
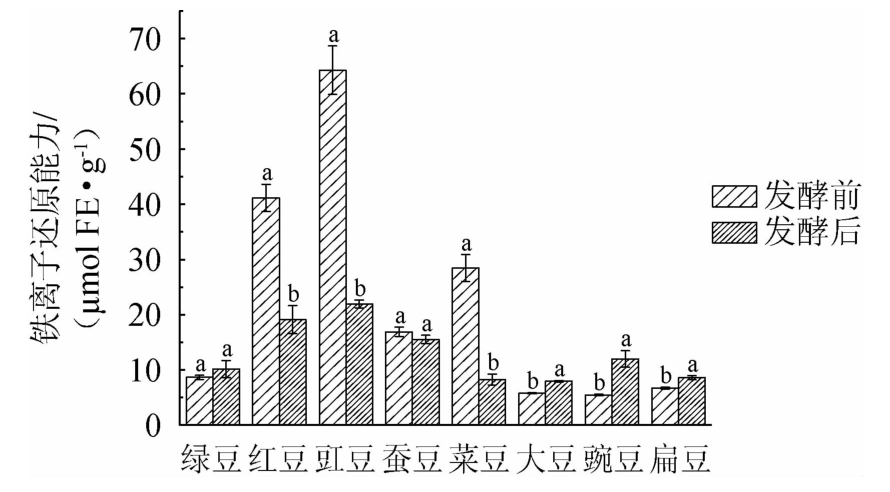
图5 发酵前后8种食用豆提取物铁离子还原能力变化
Fig.5 Changes of iron ion reduction capacity of 8 kinds of edible beans extracts before and after fermentation
2.3 8种食用豆发酵前后总酚、总黄酮含量与抗氧化活性的相关性分析
8种食用豆总酚、总黄酮含量与抗氧化活性的相关性如表1所示。
表1 发酵前后8种食用豆总酚、总黄酮含量与抗氧化活性的相关性分析
Table 1 Correlation analysis between total phenol,total flavonoid and antioxidant activity of 8 kinds of edible beans before and after fermentation
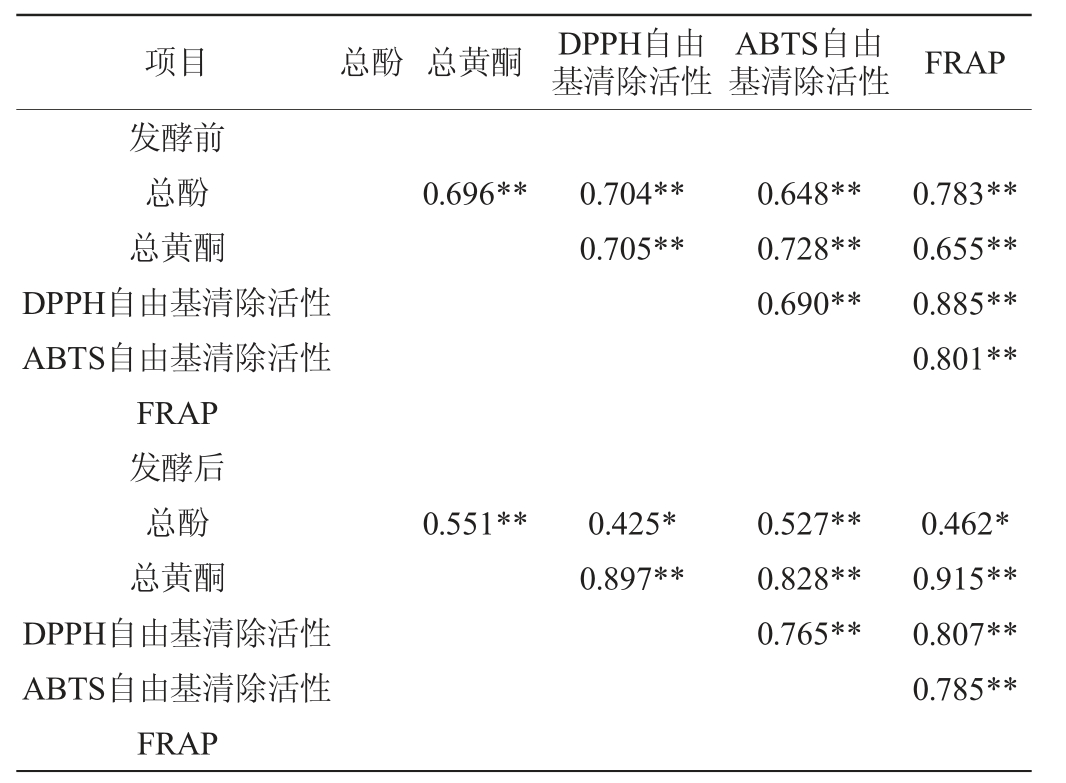
注:“**”表示极显著相关(P<0.01),“*”表示显著相关(P<0.05)。
由表1可知,发酵前8种食用豆总酚与总黄酮极显著相关(P<0.01),食用豆总酚和总黄酮含量与3个抗氧化指标均极显著相关(P<0.01),总酚与FRAP的相关性大于总黄酮与FRAP的相关性,并且3个抗氧化活性之间也极显著相关(P<0.01),DPPH与FRAP之间的相关性最高。发酵后8种食用豆总酚与总黄酮、ABTS极显著相关,与DPPH和FRAP显著相关(P<0.05),3个抗氧化指标之间极显著相关(P<0.01)。刘仙俊等[23]分析5种食用豆总酚与总黄酮含量相关性中得出两者极显著相关的关系。梁亚静等[24-25]研究分析也有类似结果。研究结果表明,酚类化合物与抗氧化之间有良好的相关性。
3 结论
利用干酪乳杆菌NRRL B-441固态发酵绿豆、红豆、豇豆、蚕豆、菜豆、大豆、豌豆和扁豆,对食用豆总酚、总黄酮含量和抗氧化活性均有显著影响。豇豆原料具有最高总酚含量(5.53±0.18)mg GAE/g;发酵后红豆、豇豆和菜豆总酚含量下降,而发酵后绿豆、大豆、豌豆和扁豆总酚含量提高且绿豆总酚含量提高182.35%。红豆原料总黄酮含量最高,达到(11.55±0.16)mg RE/g;发酵后红豆、豇豆、菜豆和大豆总黄酮含量下降显著(P<0.05)。发酵后红豆、豇豆和菜豆提取物DPPH自由基清除活性、ABTS自由基清除活性和FRAP能力均下降,而绿豆、豌豆和扁豆抗氧化能力增强。总酚、总黄酮与抗氧化活性之间显著相关(P<0.05)。红豆、豇豆和菜豆是多酚类物质含量较高的食用豆,更适宜于鲜食。干酪乳杆菌固态发酵能显著改良绿豆、蚕豆、大豆、豌豆和扁豆抗氧化活性,提高其营养品质。
[1]叶夕苗,李俊,毛堂芬,等.贵州不同品种芸豆营养品质差异分析[J].食品工业科技,2021,42(18):73-80.
[2]MEJRI F,SELMI S,MARTINS A,et al.Broad bean(Vicia faba L.)pods:a rich source of bioactive ingredients with antimicrobial,antioxidant,enzyme inhibitory,anti-diabetic and health-promoting properties[J]. Food Funct,2018,9(4):2051-2069.
[3]王何柱,朱勇,朱怡,等.不同花色芸豆种皮酚类化合物组成及抗氧化活性[J].食品科学,2020,41(12):204-210.
[4]王晓燕,孙培利,焦捷,等.发酵技术对食用种子及其制品改性的研究进展[J].食品研究与开发,2021,42(18):197-203.
[5]孙钰薇,张诗瑶,刘志佳,等.发酵食品中乳酸菌的健康功效研究进展[J].食品与发酵工业,2021,47(23):280-287.
[6]LI S L,JIN Z Y,HU D J,et al.Effect of solid-state fermentation with Lactobacillus casei on the nutritional value,isoflavones,phenolic acids and antioxidant activity of whole soybean flour[J]. LWT-Food Sci Technol,2020,125:109264.
[7]LIMÓN R I,PEÑAS E,TORINO M I,et al.Fermentation enhances the content of bioactive compounds in kidney bean extracts[J]. Food Chem,2015,172:343-352.
[8]GAN R Y,SHAH N P,WANG M F,et al.Fermentation alters antioxidant capacity and polyphenol distribution in selected edible legumes[J].Int J Food Sci Technol,2016,51(4):875-884.
[9]MUHIALDIN B J,RANI N F A,HUSSIN A S M.Identification of antioxidant and antibacterial activities for the bioactive peptides generated from bitter beans(Parkia speciosa)via boiling and fermentation processes[J].LWT-Food Sci Technol,2020,131:109776.
[10]王何柱,朱勇,朱怡,等.7种芸豆中酚类化合物组成及其抗氧化活性[J].中国粮油学报,2020,35(9):28-33.
[11]白周亚,阚丽娇,李昌,等.不同豇豆中酚类含量与抗氧化活性[J].食品科学,2017,38(15):153-157.
[12]李秀凉,倪庆圆,杨宸,等.纳豆芽孢杆菌发酵菜用大豆中总黄酮的提取及其降血脂效果评价[J].食品工业科技,2021,42(7):223-230.
[13]MOGHADAM M,SALAMI M,MOHAMMADIAN M,et al.Development of antioxidant edible films based on mung bean protein enriched with pomegranate peel[J]. Food Hydrocolloid,2020,104:105735.
[14]POLANOWSKA K,SZWENGIEL A,KULIGOWSKI M,et al.Degradation of pyrimidine glycosides and L-DOPA in the faba bean by Rhizopus oligosporus[J].LWT-Food Sci Technol,2020,127:109353.
[15]ALI N M,YEAP S K,YUSOF H M,et al.Comparison of free amino acids,antioxidants,soluble phenolic acids,cytotoxicity and immunomodulation of fermented mung bean and soybean[J]. J Sci Food Agr,2016,96(5):1648-1658.
[16]张宏愿.黄酮类化合物药理学研究概况[C]//全国感染药学学术会议.中国药学会,2006.
[17]刘伟伟.蛹虫草—豆类固态发酵及产物活性研究[D].济南:山东大学,2018.
[18]SANJUKTA S,RAI A K,MUHAMMED A,et al.Enhancement of an-tioxidant properties of two soybean varieties of Sikkim Himalayan region by proteolytic Bacillus subtilis fermentation[J]. J Funct Foods,2015,14:650-658.
[19]VERNI M,MASTRO G,CILLIS F,et al.Lactic acid bacteria fermentation to exploit the nutritional potential of Mediterranean faba bean local biotypes[J].Food Res Int,2019,125:108571.
[20]JUAN M Y,CHOU C C.Enhancement of antioxidant activity,total phenolic and flavonoid content of black soybeans by solid state fermentation with Bacillus subtilis BCRC 14715[J].Food Microbiol,2010,27(5):586-591.
[21]POLANOWSKA K,GRYGIER A,KULIGOWSKI M,et al.Effect of tempe fermentation by three different strains of Rhizopus oligosporus on nutritional characteristics of faba beans[J].LWT-Food Sci Technol,2020,122:1-9.
[22]XIAO Y,ZHANG Q Q,MIAO J Q,et al.Antioxidant activity and DNA damage protection of mung beans processed by solid state fermentation with Cordyceps militaris SN-18[J]. Innov Food Sci Emerg,2015,31:216-225.
[23]刘仙俊,张慧珍,王潇潇,等.5种豆类中总多酚、总黄酮含量及抗氧化活性比较研究[J].食品研究与开发,2020,41(7):52-57.
[24]梁亚静,韩飞,梁盈,等.萌发对芸豆酚类物质及抗氧化活性的影响[J].食品工业科技,2015,36(16):142-146.
[25]赵天瑶,苌淑敏,李少华,等.豌豆萌发过程中生长特性、酚类含量及抗氧化性变化[J].中国农业大学学报,2019,24(12):1-9.