氨基甲酸乙酯(ethyl carbamate,EC)又称尿烷,是一种具有遗传毒性且多位点致癌的化合物。2007年,世界卫生组织的国际癌症机构将EC归为2A类致癌物[1-2]。EC广泛存在于发酵食品和饮料酒中[3-4],其中,饮料酒中EC含量较高[5-6]。饮料酒中EC的形成途径主要有两种:①酸性环境下,由原料带入及L-精氨酸经酵母菌代谢所产生的尿素与乙醇反应生成EC[7-8];②生氰糖苷经酶解或热裂解生成氰醇,氰醇进一步分解生成氢氰酸,氢氰酸在Cu(II)的催化下(无催化剂Cu(II)且酸性条件下反应较慢)生成氰酸盐,最终与乙醇反应生成EC[9-10]。
白酒是以粮谷为主要原料,以大曲、小曲或麸曲及酒母等为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏而制成的饮料酒[11-12]。因酿造原料、生产工艺等原因,白酒中含有一定量的EC[13-14]。加拿大、捷克和日本等国家针对蒸馏酒中EC制订的限量标准为150 μg/L,EC已成为我国白酒走向国际化的技术壁垒之一。如何降低白酒中EC含量,提高产品品质,打破贸易壁垒并走向国际化,是行业面临的共性问题[15-16]。
白酒中EC生成机理复杂,高晓娟等[17]研究了清香型白酒贮存过程中EC的变化规律,结果表明,在发酵、蒸酒过程中只有少量的EC形成,清香型白酒中EC急剧增加的环节是贮存阶段。张顺荣[18]研究了不同香型原酒贮存过程中EC、氰化物和尿素的含量,并采用同位素示踪法研究了原酒贮存期间EC形成的主要前体,结果表明:白酒贮存过程中EC形成的主要前体物是氰化物。白酒酿造的重要原料高粱是一种含生氰糖苷的作物,生氰糖苷在高粱中以蜀黍氰苷的形式存在[19],高粱中的蜀黍氰苷经β-葡萄糖苷酶水解或者高温酸解之后生成β-D-葡萄糖和不稳定的对羟基-(S)-扁桃腈,对羟基-(S)-扁桃腈在内源性α-羟基裂解酶或碱性条件下分解生成对羟基苯甲醛和氰化物,因沸点较低,在蒸酒过程中,氰化物极易进入到酒体中[20-23]。
作为中国三大主要香型白酒之一,浓香型白酒具有窖香浓郁、绵甜醇厚、协调爽净等特点[24],是市场占有率最高、消费人群最多的白酒[25]。本研究通过水解试验、模拟蒸酒试验和酿酒试验,探究高粱中蜀黍氰苷与浓香型白酒中氰化物、EC之间的关系。旨在从原料控制角度探讨浓香型白酒中氰化物、EC的控制方法,为白酒生产企业降低酒体中EC含量、提高产品质量安全水平、应对国际食品安全发展形势提供理论基础和实践依据。
1 材料与方法
1.1 材料与试剂
氨基甲酸乙酯(99%):梯希爱(上海)化成工业发展有限公司;D5-氨基甲酸乙酯(98%)、蜀黍氰苷(95%):美国Sigma-Aldrich公司;水中氰标准溶液(CN-质量浓度为50 mg/L):中国计量科学研究院;正己烷、乙酸乙酯(均为色谱纯)、乙酸锌(分析纯):天津市科密欧化学试剂有限公司;乙醚(色谱纯)、磷酸、酒石酸、氢氧化钠、氯胺T(均为分析纯):成都市科隆化学品有限公司;甲醇(色谱纯):德国Merck公司。
高粱样品(编号为S1~S10),S1高粱:产地为中国西南地区,S2~S4高粱:产地为中国西北地区,S5~S8高粱:产地为中国东北地区,S9~S10高粱:产地为澳大利亚;五粮浓香型白酒出窖糟醅、糠壳、中高温大曲:宜宾地区某酒厂提供。
1.2 仪器与设备
7890A型气相色谱仪、7890A-5975C型气相色谱-质谱联用仪:美国Agilent公司;ExionLC-5500型三重四级杆液相色谱-质谱联用仪:美国AB Sciex公司;DMA 35型手持式密度计:奥地利安东帕公司;SBEQ-CG1012型固相萃取装置:上海安谱实验科技股份有限公司;SHB ⅢA型循环水式真空泵:杭州大卫科教仪器有限公司;TTL-DCⅡ型氮吹仪:北京同泰联科技发展有限公司;Milli-Q型超纯水仪:美国Millipore公司;ML1602型百分之一分析天平、AE200型万分之一分析天平:美国梅特勒-托利多公司;LRH-250型生化培养箱:上海一恒科学仪器有限公司;FSJ-Ⅱ型锤片式粮食粉粹机:中储粮成都粮食贮藏科学研究院;YM-060S型超声波清洗机:深圳市雨盟超声波清洗机设备厂;DL-1型万用电炉:北京市永光明医疗仪器厂。
1.3 实验方法
1.3.1 水解试验
分别将10种高粱(S1~S10)粉粹,过120目筛,每种样品称取1.50 g,分别采用20 mL甲醇水溶液(95∶5,V/V)超声提取1 h,8 000 r/min离心10 min,取上清液0.4 mL,用超纯水稀释3倍,经0.2 μm滤膜过滤后进三重四级杆液相色谱-质谱联用仪,测量并计算10种高粱中蜀黍氰苷含量[26]。
参考GB 5009.36—2016《食品安全国家标准食品中氰化物的测定》[27]中方法对高粱进行酸水解:称取S1高粱粉10.00 g(以绝干计)于全玻璃蒸馏器的500 mL烧瓶中,加入200 mL蒸馏水,塞严瓶口,搅拌2 h后加入20 mL 100 g/L的乙酸锌溶液和2.00 g酒石酸后迅速连接好蒸馏装置,将与冷凝管下端相连的乳胶软管插入盛有10 mL 20 g/L氢氧化钠溶液的200 mL容量瓶中,进行蒸馏,收集蒸馏液约190 mL时停止加热,以蒸馏水定容至200 mL,混匀。按上述方法依次对S2~S10高粱进行水解,每种高粱各进行三次平行实验,测定馏出液中氰化物含量,方法参照GB 5009.36—2016《食品安全国家标准食品中氰化物的测定》中气相色谱法,对高粱粉中蜀黍氰苷含量及其水解馏出液中氰化物含量进行直线回归和双变量相关分析。
1.3.2 模拟蒸酒试验
分别以1.3.1中的蜀黍氰苷含量最低的S1高粱粉(739 μg/kg,以绝干计)和蜀黍氰苷含量最高的S2高粱粉(9 160 μg/kg,以绝干计)为原料,进行实验室模拟蒸酒试验。取固态白酒出窖糟醅10.5 kg,充分拌匀,分别设置空白组、实验组和对照组进行试验。
空白组:称取1 000.00 g出窖糟醅,放置1 h;
实验组:称取1 000.00 g出窖糟醅,加入S1高粱粉150.00 g(以绝干计),混匀,润粮1 h;
对照组:称取1 000.00 g出窖糟醅,加入S2高粱粉150.00 g(以绝干计),混匀,润粮1 h。
向空白组、实验组和对照组酒糟中各加入糠壳30.00 g,拌匀,分别采用实验室小型蒸酒装置进行蒸馏,分段接馏分酒,每段接取100 mL,各接取4段,分别以D1、D2、D3和D4表示,空白组、实验组和对照组各进行三次平行实验,采用气相色谱法[27]测定馏分酒中氰化物含量。
1.3.3 酿酒试验
酿酒原料的组成为:高粱36%,大米22%,糯米18%,小麦16%,玉米8%(均为质量分数)。按以下步骤进行酿酒试验:选择宜宾地区某酒厂小试基地6口正常生产的小窖池(长、宽、高均为1.2 m),以其中3口作为实验组,编号分别为1号窖、2号窖和3号窖,以另外3口作为对照组,编号分别为4号窖、5号窖和6号窖。配制原料以备用:(1)实验组原料:采用S1高粱作为原料,按照配比加入另4种原料后粉碎;(2)对照组原料:采用S2高粱作为原料,加入和实验组相同的另4种原料后粉碎。
第一轮酿酒试验:将实验组1号窖和对照组4号窖中的出窖糟醅全部起出置于一起,充分拌匀后平均分成两部分,一半加入实验组原料后拌匀润粮,加糠壳拌匀,物料上甑,蒸酒蒸粮(实验组第一轮酒取样),物料出甑,打量水,摊晾下曲,入1号窖池发酵;另一半加入对照组的原料后拌匀润粮,加糠壳拌匀,物料上甑,蒸酒蒸粮(对照组第一轮酒取样),物料出甑,打量水,摊晾下曲,入4号窖池发酵。按照此方法依次完成2号窖、5号窖及3号窖和6号窖的全部实验。
第二轮酿酒试验:发酵60 d后,实验组:将1号窖池中的糟醅起出,加入实验组原料后拌匀润粮,加糠壳拌匀,物料上甑,蒸酒蒸粮(实验组第二轮酒取样),物料出甑,打量水,摊晾下曲,入1号窖池发酵。对照组:将4号窖池中的糟醅起出,加入对照组的原料后拌匀润粮,加糠壳拌匀,物料上甑,蒸酒蒸粮(对照组第二轮酒取样),物料出甑,打量水,摊晾下曲,入4号窖池发酵。按照此方法依次完成2号窖、5号窖及3号窖和6号窖的全部实验。
第三轮酿酒试验:按第二轮酿酒试验步骤完成第三轮酿酒试验和取样。
白酒蒸馏出来后,测定原酒酒精度和酒中氰化物含量,按GB 5009.223—2014《食品安全国家标准食品中氨基甲酸乙酯的测定》方法测定EC含量[28],将所有酒样置于28 ℃恒温培养箱中贮存,分别于第10天、第20天时测定原酒中氰化物和EC含量,之后每隔30 d测定一次氰化物和EC含量,总监测时间为350 d。
1.3.4 数据处理
采用Microsoft Excel 2010进行作图和数据分析,并使用SPSS 22.0软件对数据进行显著性分析,重复试验3次,结果以“平均值±标准差”(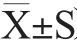 )表示。
)表示。
2 结果与分析
2.1 水解试验结果
本试验将10种高粱粉碎,过120目筛,高粱粉粒度较小,再采用蒸馏水搅拌浸提2 h,让高粱中蜀黍氰苷溶解到蒸馏水中,加入乙酸锌溶液和酒石酸,进行酸水解,让蜀黍氰苷充分转化为氢氰酸,氢氰酸沸点较低,蒸馏过程中极易被蒸出,以氢氧化钠溶液吸收后测定馏出液中氰化物含量,结果见表1,对高粱粉中蜀黍氰苷含量与其水解馏出液中氰化物含量进行直线回归和双变量相关分析,结果见图1。
表1 高粱粉中蜀黍氰苷含量与其水解馏出液中氰化物含量
Table 1 Content of dhurrin in sorghum powder and cyanide in its hydrolytic distillate μg/kg
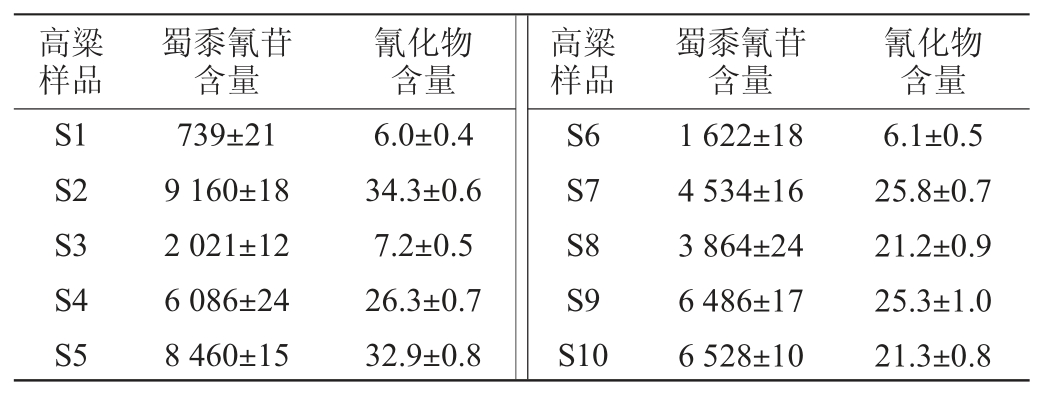
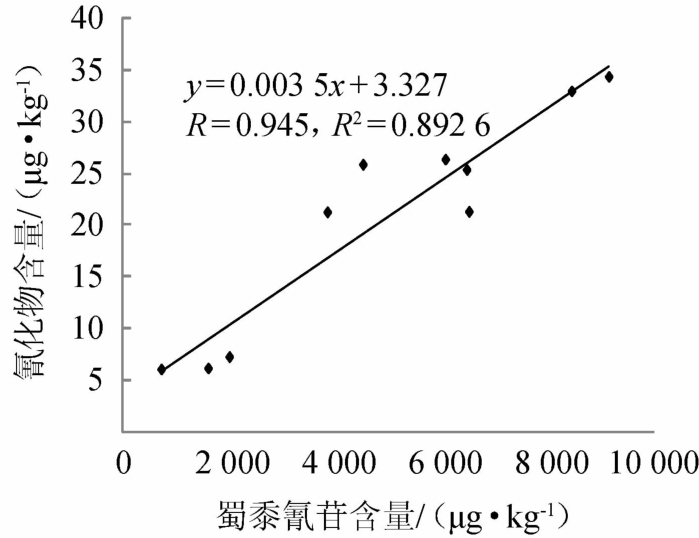
图1 高粱粉中蜀黍氰苷含量与其水解馏出液中氰化物含量的相关曲线
Fig.1 Correlation curve of dhurrin content in sorghum powder and cyanide content in hydrolysis distillate
由表1可知,10种高粱粉中蜀黍氰苷含量与其水解馏出液中氰化物含量具有一定的差异性,其中,S1高粱中蜀黍氰苷含量最低,平均值为739 μg/kg,S2高粱中蜀黍氰苷含量最高,平均值为9 160 μg/kg。由图1可知,高粱中蜀黍氰苷含量与其水解生成的氰化物呈现一定的线性关系(相关系数R2为0.892 6),说明高粱中蜀黍氰苷水解可生成氰化物,且高粱中蜀黍氰苷含量与其水解所生成的氰化物总量呈正相关。
2.2 模拟蒸酒试验结果与分析
在实验室采用小型蒸酒装置进行蒸酒试验,糟醅量较少,蒸馏速度快,测定各段馏分酒中氰化物含量并进行显著性分析,结果见表2。
表2 各段馏出酒中氰化物含量
Table 2 Cyanide content in distillates of each stage μg/kg
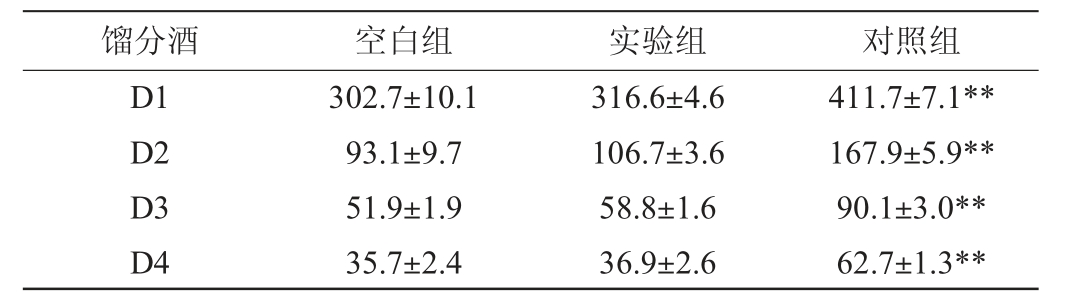
注:“**”表示差异极显著(P<0.01)。
由表2可知,空白组、实验组和对照组各段馏分酒中氰化物含量变化趋势一致,前段馏分酒(D1)中氰化物含量最高,随着蒸馏的进行,馏分酒中氰化物快速降低,末段馏分酒(D4)中氰化物含量最低。从表2还可看出,实验组各段馏分酒中氰化物含量显著低于对照组中相对应馏分酒中氰化物含量(P<0.01)。馏分酒中的氰化物主要来自于两个方面:①糟醅中由β-葡萄糖苷酶水解所生成的氰化物在蒸酒时进入到馏分酒中;②高粱粉中的蜀黍氰苷在高温下发生酸水解,最终生成氰化物,蒸酒时进入到馏分酒中。本试验的空白组、实验组和对照组所使用的出窖糟醅相同,馏出酒中来自于糟醅的氰化物相同,排除了基底干扰,引起馏分酒中氰化物含量差别大的主要因素是原料,实验组所使用的S1高粱蜀黍氰苷含量远低于对照组所使用的S2高粱,其蜀黍氰苷水解所生成的氰化物含量也相应低于S2高粱。
2.3 酿酒试验结果与分析
采用手持式密度计测定三轮酿酒试验原酒的酒精度,结果发现,原酒酒精度差别较小,约为71%vol。监测第一轮、第二轮、第三轮酒样中氰化物和EC含量,结果分别见图2A、图2B和图2C。
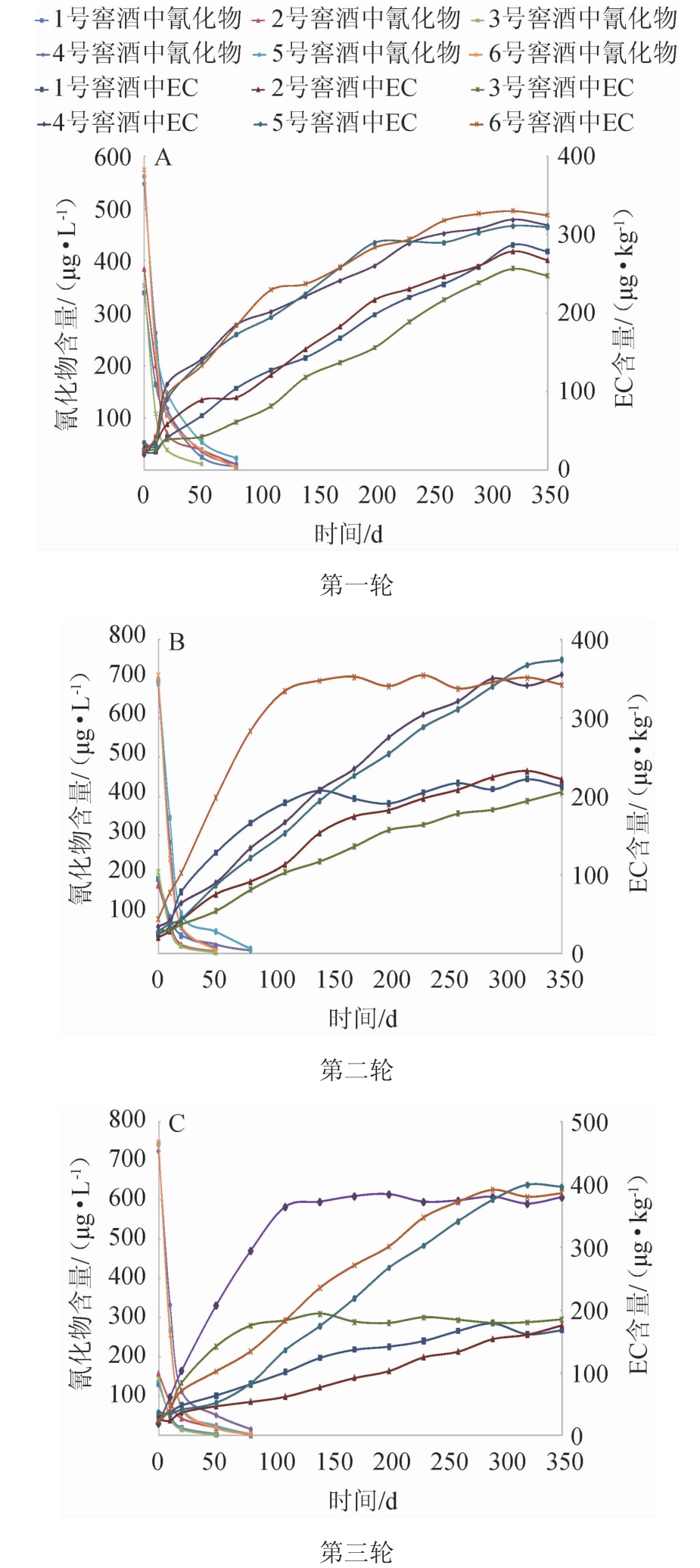
图2 三轮酿酒试验原酒中氰化物和氨基甲酸乙酯含量的变化
Fig.2 Changes of cyanide and EC contents in base Baijiu of three rounds of brewing tests
从图2A~2C可看出,三轮酿酒试验的实验组和对照组原酒中氰化物降低趋势一致,EC上升趋势也相一致:原酒中初始氰化物含量较高,随着贮存时间的延长,酒体中氰化物含量急剧降低,贮存前10 d,氰化物降低速度最快,其后降低速度有所减缓,贮存50~80 d时,酒中氰化物检出值极低;实验组和对照组刚蒸馏出来的原酒中EC含量均较低,约为20~40 μg/kg,随着贮存时间的延长,酒体中EC含量缓慢上升,贮存350 d时,所有原酒样品中EC含量达到了相对稳定状态,原酒中绝大部分EC是在贮存过程中生成的,这与高晓娟等[17]的贮存阶段是清香型白酒中EC急剧增加环节的研究发现相似。从图2B和图2C可看出,6号窖池的第二轮酒、3号窖池及4号窖池的第三轮酒中EC生成速度比其他酒样快,酒体中EC达到平衡状态所需时间比其他酒样短,表明EC的生成还有其他影响因素。从图2A~2C还可看出,三轮酿酒试验的实验组原酒中氰化物初始含量低于对照组原酒中氰化物初始含量,达到了相对稳定状态时(贮存350 d),实验组原酒中EC含量低于对照组原酒中EC含量。
对原酒中氰化物初始含量和贮存350 d时EC值进行直线回归和双变量相关分析,结果见图3。由图3可知,原酒中氰化物初始含量和贮存350 d时EC值线性关系良好,相关系数R2=0.966 9,二者在0.01水平上显著相关,说明在原酒贮存过程中,氰化物是EC的重要前体物。
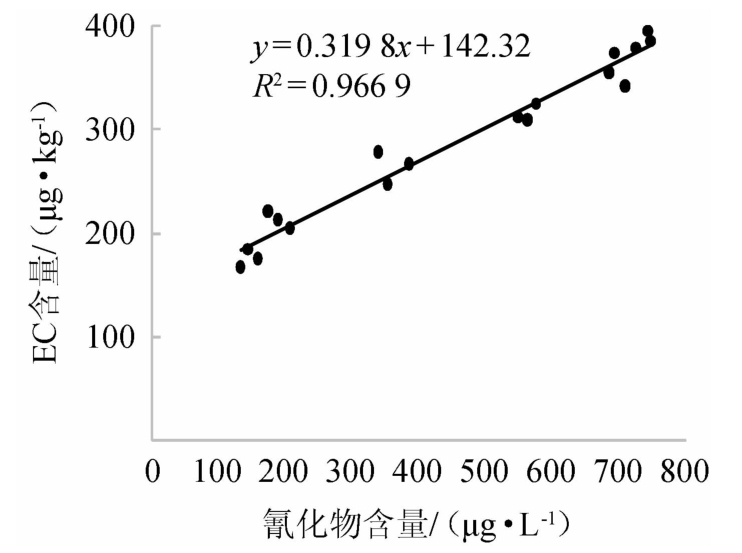
图3 原酒中氰化物初始含量和贮存350 d时氨基甲酸乙酯含量的相关曲线
Fig.3 Correlation curve of initial cyanide content in base Baijiu and ethyl contents at 350 d of storage
2.4 讨论
在第一轮酿酒试验中,实验组1号窖和对照组的4号窖出窖糟相同,实验组2号窖和对照组的5号窖出窖糟相同,实验组3号窖和对照组的6号窖出窖糟相同,相对应窖池的第一轮酒中来自于出窖糟醅的氰化物也相同,引起酒体中氰化物含量不同的主要因素是酿酒原料,实验组采用的高粱原料为蜀黍氰苷含量低的S1高粱,对照组采用的高粱原料为蜀黍氰苷含量高的S2高粱,S1高粱水解所生成的氰化物也低于S2高粱,因此,实验组各窖池原酒中氰化物初始含量均低于对照组相应窖池原酒中氰化物初始值,贮存350 d时,实验组各窖池原酒中EC含量低于对照组相应窖池原酒中EC含量。
在第二轮酿酒试验中,实验组与对照组原酒中氰化物初始含量和达到稳定状态时EC含量差别更大。引起酒体中氰化物初始含量不同的主要因素有两个:①酒体中来自于糟醅的氰化物不同。第二轮酒的出窖糟醅由两部分组成,一部分是循环发酵的母糟,另一部分是上一轮粮食发酵形成的糟醅;②蒸酒过程中,酒体中来自于原料的氰化物不同。因实验组持续采用S1高粱作为高粱原料,对照组则采用S2高粱作为高粱原料,在第三轮酿酒试验中,实验组与对照组原酒中氰化物含量差别继续扩大,EC含量差别也进一步增大,实验组原酒中来自于糟醅部分的氰化物几乎全部由S1高粱及另四种原料发酵所形成的糟醅所贡献,对照组原酒中来自于糟醅部分的氰化物则几乎全部由S2高粱和另四种原料发酵所形成的糟醅所贡献。
3 结论
高粱是白酒酿造的重要原料,本研究以不同高粱为对象,分别进行了水解试验、模拟蒸酒试验和酿酒试验,探索了高粱中蜀黍氰苷与浓香型白酒中氰化物、EC之间的关系。试验结果表明:高粱中蜀黍氰苷含量与其水解所生成的氰化物总量呈正相关,采用蜀黍氰苷含量低的高粱作为酿酒原料时,酒中氰化物含量较低,EC生成量也较少,浓香型白酒中绝大部分EC是在贮存过程中生成的,氰化物是EC的重要前体物。
浓香型白酒酿造工艺复杂,生产周期长,酒体中微量成分多,EC研究难度较大。本研究发现浓香型白酒中绝大部分EC是在贮存过程中生成的,因此,研究者在探索浓香型白酒中EC生成机理时,可重点关注贮存阶段。感官风味是白酒香型判别和品质鉴定的重要基础,中国白酒香型众多,每一种香型的白酒都有其独特的生产工艺,研究者在探索白酒中EC控制措施时,应以不改变原有生产工艺、不影响酒体风格为前提。
本研究首次从生产水平上证实了高粱中蜀黍氰苷是浓香型白酒中EC的一个关键控制点,浓香型白酒生产企业采用蜀黍氰苷含量低的高粱作为酿酒原料,可有效降低酒中氰化物和EC含量。本研究为浓香型白酒生产企业控制酒体中EC含量、提高产品安全水平提供了实践依据,也为其他香型白酒EC控制提供了参考。
[1]NETTLESHIP A,HENSHAW P S,MEYER H L.Induction of pulmonary tumors in mice with ethyl carbamate[J].J Natl Cancer Inst,1943,4(3):309-331.
[2]BELAND F A,BENSON R W,MELLICK P W,et al.Effect of ethanol on the tumorigenicity of urethane(ethyl carbamate) in B6C3F1 mice[J].Food Chem Toxicol,2005,43(1):1-19.
[3]周勇,王力清,刘嘉亮,等.气相色谱-串联质谱法(GC/MS/MS)测定酱油中氨基甲酸乙酯的含量[J].粮油加工,2010,33(4):100-102.
[4]石维妮,刘晓毅,赵玉琪,等.发酵性食品中的氨基甲酸乙酯含量调研[J].中国酿造,2009,28(11):124-126.
[5]WU P G,PAN X D,WANG L Y,et al.A survey of ethyl carbamate infermented foods and beverages from Zhejiang,China[J]. Food Control,2012,23(1):286-288.
[6]HASNIP S,CREWS C,POTTER N,et al.Survey of ethyl carbamate in fermented foods sold in the United Kingdom in 2004[J]. J Agr Food Chem,2007,55(7):2755-2759.
[7]DELLEDONNE D,RIVETTI F,ROMANO U.Developments in the production and application of dimethylcarbonate[J].Appl Catalysis A: General,2001,221(1-2):241-251.
[8]WANG D P,YANG B L,ZHAI X W,et al.Synthesis of diethyl carbonate by catalytic alcoholysis of urea[J]. Fuel Process Technol,2007,88(8):807-812.
[9]BATTAGLIA R,CONACHER B S,PAGE B D.Ethyl carbamate in alcoholic beverages and foods:a review[J].Food Add Contam,1990,7(4):477-496.
[10]ARESTA M,BOSCOLO M,FRANCO D W.Copper (II) catalysis in cyanate conversion into ethyl carbamate in spirits,and relevant reactions[J].J Agr Food Chem,2001,49(6):2819-2824.
[11]国家市场监督管理总局,国家标准化管理委员会.GB/T 15109—2021白酒工业术语[S].北京:中国标准出版社,2008.
[12]吴继红,黄明泉,郑福平,等.健康白酒的研究进展[J].食品科学技术学报,2019,37(2):17-23.
[13]张顺荣,范文,徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业,2016,42(5):198-202.
[14]苏占元,郑若欣,杨晓军,等.白酒中氨基甲酸乙酯含量检测与分析[J].酿酒,2019,46(5):55-57.
[15]WEBER J V,SHARYPOV V I.Ethyl carbamate in foods and beverages:a review[J].Environ Chem Lett,2009,7(3):233-247.
[16]董蔚,施苛,孙啸涛,等.白酒中潜在化学污染物的研究进展[J].中国食品学报,2018,18(5):185-194.
[17]高晓娟,王凤仙,李文硕,等.清香型白酒贮存过程中氨基甲酸乙酯变化研究[J].酿酒,2020,47(6):90-93.
[18]张顺荣.白酒中氨基甲酸乙酯形成的氰化物途径研究[D].无锡:江南大学,2016.
[19]PETER K B,BIRGER L M.Dhurrin synthesis in sorghum is regulated at the transcriptional level and induced by nitrogen[J].Plant Physiol,2002,129(3):1222-1231.
[20]VETTER J.Plant cyanogenic glycosides[J].Toxicon,2000,38(1):11-36.
[21]FRANCISCO I A,PINOTTI M H P.Cyanogenic glycosides in plants[J].Brazil Arch Biol Technol,2000,43(5):487-492.
[22]JOHANSEN H,RASMUSSEN L H,OLSEN C E,et al.Rate of hydrolysis and degradation of the cyanogenic glycoside-dhurrin-in soil[J].Chemosphere,2007,67(2):259-266.
[23]SARLA M,PANDIT M,TYAGI D K.Oxidation of cyanide in aqueous solution by chemical and photochemical process[J]. J Hazard Mats,2004,116(1-2):49-56.
[24]国家市场监督管理总局,国家标准化管理委员会.GB/T 10781.1—2021白酒质量要求第1部分:浓香型白酒[S].北京:中国标准出版社,2021.
[25]刘保建.浓香大业,未来可期[N].华夏酒报,2019-10-29(D01).
[26]周韩玲,安明哲,李杨华,等.高效液相色谱-串联质谱法测定高粱中蜀黍苷的含量[J].酿酒科技,2020,311(5):78-82.
[27]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.36—2016 食品安全国家标准食品中氰化物的测定[S].北京:中国标准出版社,2016.
[28]中华人民共和国国家卫生和计划生育委员会.GB 5009.223—2014食品安全国家标准食品中氨基甲酸乙酯的测定[S].北京:中国标准出版社,2014.