光皮木瓜[Chaenomeles sinensis(Thouin)Koehne]为蔷薇科木瓜属植物,又名土木瓜、榠楂、海棠、木李等,在我国山东、陕西、河南、湖北、重庆等地分布较多[1-2]。据资料显示,我国光皮木瓜资源丰富,仅陕西省白河县光皮木瓜种植面积就已超过9 000 hm2[3-5]。《本草经集注》上述木瓜味酸、涩,性平,具有祛风湿、和胃平肝舒筋、消炎化痰止痢等功效,可治疗风湿痹痛、咳嗽痰多、吐泻、痢疾、跌打伤痛、脚气水肿等多种病症[6-7]。现代中药药理药效研究表明,光皮木瓜果实不仅富含糖类、维生素C、有机酸等,而且含有类黄酮、木脂素、多酚、三萜以及甾体类活性物质,具有抗氧化、抗炎、抑菌、降血糖、抗肿瘤、抗病毒以及保护肝肾脏等生理活性,因此其干燥切片一直是常见的中药原料[8-13]。目前,光皮木瓜作为中药材原料广泛应用于临床,但刘世尧等[14]研究发现,光皮木瓜药效成分齐墩果酸、熊果酸及皂苷等药效成分含量较少,仅以次品作为中药材原料,市场价格较低廉。因此,以光皮木瓜为原料开发功能性产品已成为研究热点[3,15-19]。
目前市场上光皮木瓜食品种类较多,有木瓜酒、木瓜醋、木瓜果脯、木瓜低糖果酱,其中木瓜酒尤其受到人们的喜爱。传统光皮木瓜果酒酿造过程常受发酵原料光皮木瓜含糖量低、酸度大的影响,导致成品酒的酒精度偏低、需外加大量糖进行发酵,严重制约光皮木瓜酒产业发展[18]。因此,本研究以陕西白河县光皮木瓜和市售荞麦米为主要原料,探索混合基质发酵酿造木瓜荞麦果酒新工艺,以期为改良和提升传统光皮木瓜果酒发酵工艺以及开发更多木瓜类功能产品提供理论依据。
1 材料与方法
1.1 材料与试剂
荞麦米、白砂糖:购自安康市喜盈门生活超市;SY葡萄酒果酒专用酵母:安琪酵母股份有限公司;光皮木瓜:分别于2020、2021年10月采自安康市白河县仓上镇境内。
芦丁标椎品(纯度>98%):合肥博美生物公司;高温淀粉酶(50 000 U/g):刑台万达生物工程有限公司;糖化酶(50 000 U/g):江苏博立生物制品有限公司;果胶酶(30 000 U/g):山东隆科特酶制剂有限公司。无水乙醇、亚硝酸钠、氯化铝、氢氧化钠(均为分析纯):天津科密欧化学试剂有限公司。
1.2 仪器与设备
UV-1800PC紫外可见分光光度计:上海菁华科技仪器有限公司;LHS-150恒温恒湿培养箱:常州市万丰仪器制造有限公司;DR101糖度计:上海力辰邦西仪器科技有限公司;RE-52AA旋转蒸发仪、YR-PTB真空泵:上海亚荣生化仪器厂;HH-4数显恒温水浴锅、JYL-CO22E九阳榨汁搅拌机:国华电器有限公司;CDUPF/UPFL系列企业实验室超纯水器:成都越纯科技有限公司;TDL-60B低速离心机:上海市安亭科学仪器厂;CP214电子天平:上海市奥豪斯仪器有限公司。
1.3 实验方法
1.3.1 木瓜荞麦果酒酿造工艺流程与操作要点

操作要点:
木瓜酶解液制备:新鲜木瓜去皮去籽切块,加2倍质量的饮用水混合匀浆。向其中添加1%果胶酶,50 ℃酶解1 h,95 ℃灭酶活10~30 s,待用。
荞麦糖化液制备:荞麦米洗净,沥干,加4倍质量的饮用水室温浸泡12 h,粉碎打浆。将荞麦浆加热至60 ℃,糊化30 min;再添加0.5%高温淀粉酶,95 ℃液化45 min;荞麦液化液降温至60 ℃,添加6%糖化酶糖化2~3 h,至糖度达到要求停止糖化[17-18]。
调配:将荞麦糖化液与木瓜酶解液按一定比例混匀,调节初始糖度和pH。
主发酵:发酵液加入一定量活化的果酒酵母(5%蔗糖水中30 ℃活化20 min)和焦亚硫酸钾(125 mg/kg),混匀装瓶发酵,控温密闭发酵14 d。
后熟:主发酵结束将发酵液上清转移到无菌容器,15 ℃静置至糖度降至1°Bx以下。
澄清与分离:发酵液过滤,滤液加1.4%的皂土,静置12 h。酒液过滤,滤液转移到洁净容器,得木瓜荞麦发酵原酒液。
1.3.2 木瓜荞麦果酒发酵条件优化单因素试验
木瓜酶解液与荞麦糖化液配比的影响:按1.3.1制备木瓜酶解液和荞麦糖化液,将木瓜酶解液和荞麦糖化液以质量比分别为3∶1、2∶1、1∶1、1∶2、1∶3的比例进行均匀混合,调节初始糖度为22°Bx,pH为4.5,酵母接种量为0.4%,22 ℃条件下进行发酵,主发酵14 d。结束后,以发酵原酒液的酒精度和总黄酮含量为评价指标,确定荞麦糖化液与木瓜酶解液的最佳料比。
发酵液初始糖度的影响:按1.3.1进行木瓜酶解液和荞麦糖化液制备,并依据已确定的发酵原料液最佳配比,取一定量荞麦、木瓜发酵原料液。在发酵温度为22 ℃,酵母接种量为0.4%条件下进行发酵,主发酵14 d,考察初始发酵液糖度分别为18°Bx、20°Bx、22°Bx、24°Bx、26°Bx对荞麦木瓜发酵酒液的酒精度、总黄酮含量影响情况,确定最佳初始发酵液糖度。
发酵液初始pH的影响:按1.3.1制备木瓜酶解液和荞麦糖化液,以最佳料比调整发酵原料液。用碳酸氢钾或柠檬酸调发酵原料液pH为3.5、4.0、4.5、5.0、5.5,在发酵温度22 ℃,酵母接种量0.4%条件下进行发酵,主发酵14 d,考察不同初始发酵液pH对发酵原酒液酒精度、总黄酮含量影响情况,确定初始发酵液pH。
酵母接种量的影响:按1.3.1制备木瓜酶解液和荞麦糖化液,调整已确定的最佳发酵条件。取调整后的木瓜、荞麦发酵原料液,酵母接种量分别设置为0.2%、0.3%、0.4%、0.5%、0.6%,在发酵温度22 ℃条件下进行发酵,主发酵14 d,考察酵母接种量对荞麦木瓜发酵原酒液酒精度、总黄酮含量的影响,确定发酵原料液酵母的最佳接种量。
发酵温度的影响:按1.3.1制备木瓜酶解液和荞麦糖化液,按照已确定的最佳发酵条件对木瓜、荞麦发酵原液进行调配。调整后的木瓜荞麦发酵原料液,发酵温度分别设置为18 ℃、20 ℃、22 ℃、24 ℃、26 ℃条件下进行发酵,主发酵14 d,考察发酵温度对荞麦木瓜发酵原酒液酒精度、总黄酮含量的影响,最终确定最佳发酵温度。
1.3.3 木瓜荞麦果酒发酵工艺优化正交试验
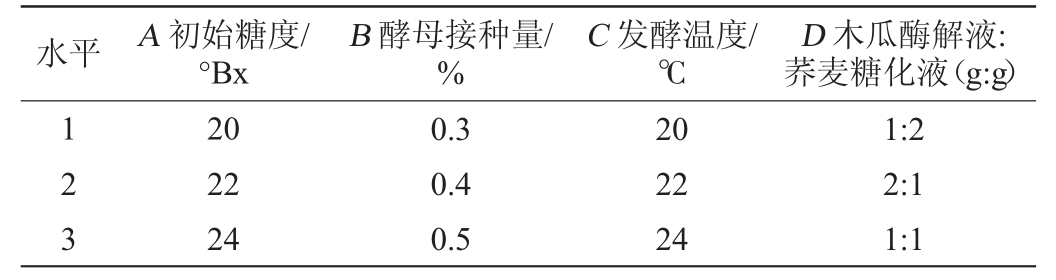
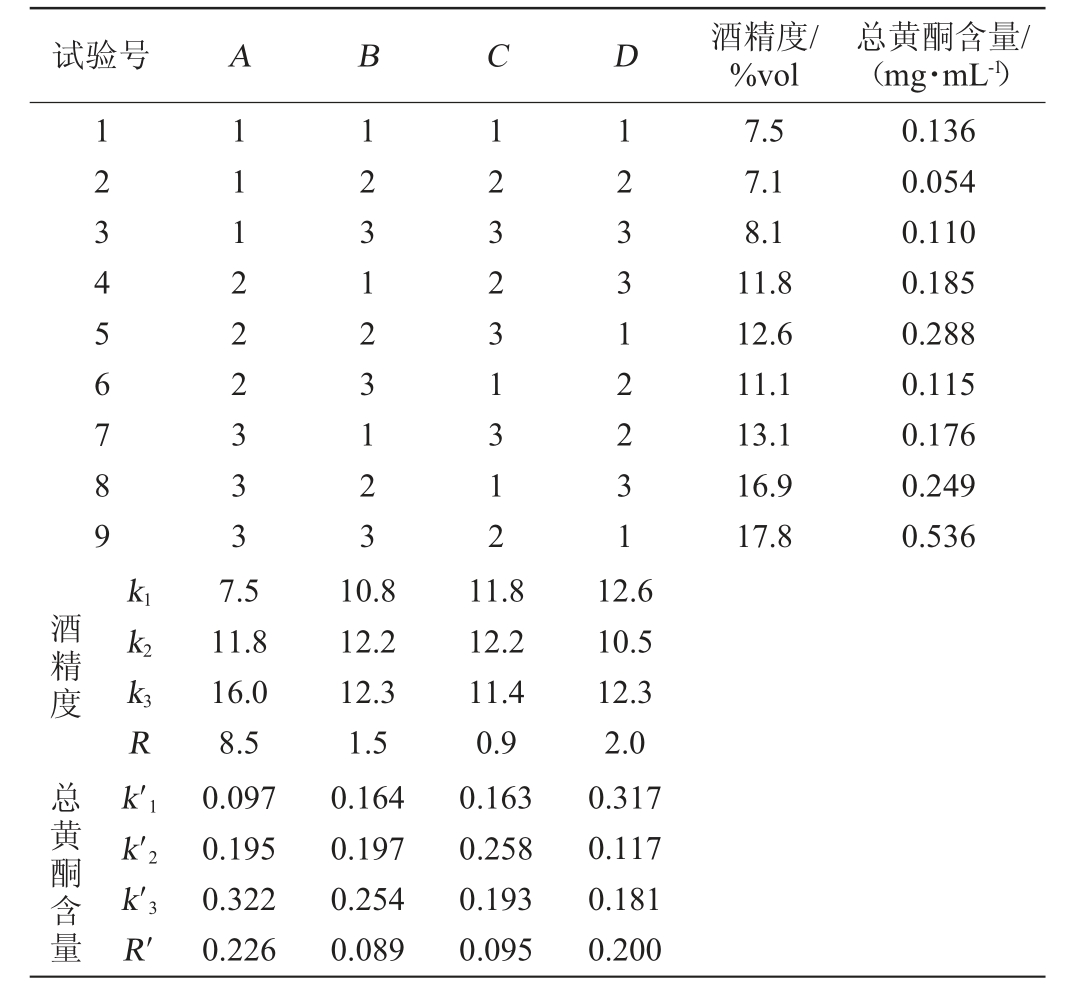
在单因素试验的基础上,以初始糖度(A)、酵母接种量(B)、发酵温度(C)、木瓜酶解液与荞麦糖化液配比(D)为试验因素,木瓜荞麦果酒的酒精度、总黄酮含量为考察指标进行4因素3水平正交试验对木瓜荞麦果酒发酵工艺进行优化。正交试验因素与水平见表1。
表1 木瓜荞麦果酒发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation process optimization of papaya and buckwheat wine
1.3.4 测定方法
感官评价:依据GB/T 15038—2006《葡萄酒、果酒通用分析法》和NY/T1508—2017《绿色食品果酒》中果酒评分细则进行评定,具体评价标准见表2。
表2 木瓜荞麦果酒的感官评价标准
Table 2 Sensory evaluation standards of papaya and buckwheat wine

酒精度测定:参考GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[20];总酸、总糖含量测定:参考NY/T 1508—2017《绿色食品果酒》中的检测分析法[21];还原糖的测定:参考GB/T 15038—2006《葡萄酒、果酒通用分析法》中的直接滴定法[22];总黄酮含量的测定:参考文献[23]的方法。
1.3.5 数据处理
所有试验均重复3次,样品检测重复3次,采用Excel 2016进行绘图,采用软件SPSS 18.0进行数据统计分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 木瓜酶解液与荞麦糖化液质量比的确定
不同木瓜酶解液与荞麦糖化液配比对木瓜荞麦果酒发酵的影响见图1。由图1可知,随着木瓜酶解液与荞麦糖化液配比的变化,木瓜荞麦果酒酒精度和总黄酮含量均呈先升高后降低的趋势。当木瓜酶解液∶荞麦糖化液质量比为1∶2时,木瓜荞麦果酒酒精度和总黄酮含量均达到最大,分别为17.5%vol、0.479 mg/mL。当两者质量比为1∶3时,木瓜荞麦果酒的酒精度和总黄酮含量均下降明显,这可能是由于随着荞麦糖化液量的持续增加,荞麦中的生物碱、黄酮类等物质抑制酵母菌生长,进而影响酒精发酵造成的。因此综合考虑,选择最佳木瓜酶解液与荞麦糖化液质量比为1∶2。
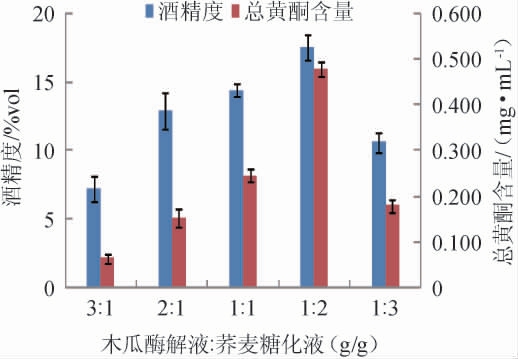
图1 木瓜酶解液与荞麦糖化液配比对木瓜荞麦果酒酒精度及总黄酮含量的影响
Fig.1 Effect of papaya enzymatic hydrolysate and buckwheat saccharification liquid ratio on the alcohol content and total flavonoids contents of papaya and buckwheat wine
2.1.2 发酵液初始糖度的确定
在果酒发酵过程中,酵母菌利用果糖、葡萄糖等糖类物质进行生长繁殖,并代谢产出醇、酯、酸等物质,因此发酵初始糖度高低会直接影响果酒品质。不同初始发酵液糖度对木瓜荞麦果酒发酵的影响见图2。
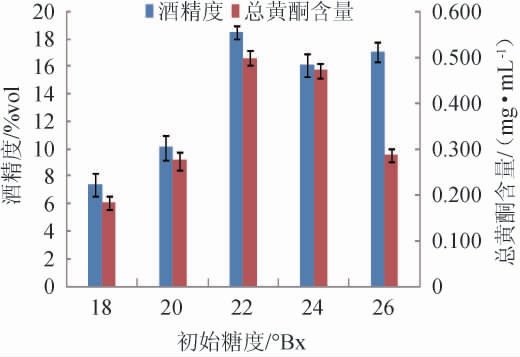
图2 初始糖度对木瓜荞麦果酒酒精度及总黄酮含量的影响
Fig.2 Effect of initial sugar degree on the alcohol content and total flavonoids contents of papaya and buckwheat wine
由图2可知,随着发酵液初始糖度的升高,木瓜荞麦果酒酒精度和总黄酮含量均呈先升高后降低的趋势。当发酵液初始糖度为22°Bx时,木瓜荞麦果酒的酒精度和总黄酮达到最大,分别为18.5%vol、0.478 mg/mL;当发酵液初始糖度>22°Bx时,木瓜荞麦果酒的酒精度和总黄酮含量随初始糖度的增加而缓慢下降。发酵液初始糖度较低时,酵母菌菌体生长需要一定的糖,使得酒精发酵不足导致酒精度低,进一步影响发酵液中黄酮类物质的溶解;但过高的发酵液初始糖度会抑制酵母菌生长繁殖,使得发酵不完全,糖转化为酒精量少,同时发酵液中残糖较多使黄酮类物质溶解度下降。因此,选择最佳发酵液初始糖度为22°Bx。
2.1.3 发酵液初始pH的确定
酵母菌生长繁殖与代谢产醇需要适宜的pH条件。不同发酵液初始pH对木瓜荞麦果酒发酵的影响见图3。由图3可知,发酵液初始pH值对木瓜荞麦果酒酒精度和总黄酮的影响不大。当发酵液初始pH为4.0时,木瓜荞麦果酒的酒精度和总黄酮含量达最大值,分别为19.0%vol、0.618 mg/mL。当发酵液初始pH>4.0时,木瓜荞麦果酒的酒精度和总黄酮含量呈下降趋势,且酒精度下降趋势更为明显。发酵液初始pH<4.0时,酵母生长繁殖和代谢产醇活性低,导致发酵液酒精含量减少,酒体呈现寡淡酸涩口感影响木瓜荞麦果酒的品质。而当初始发酵液pH>4.0时,酵母菌生长繁殖旺盛,发酵液糖分很快被利用,发酵产醇不足导致酒精度下降较快,影响果酒品质。因此,选择最佳发酵液初始pH为4.0。
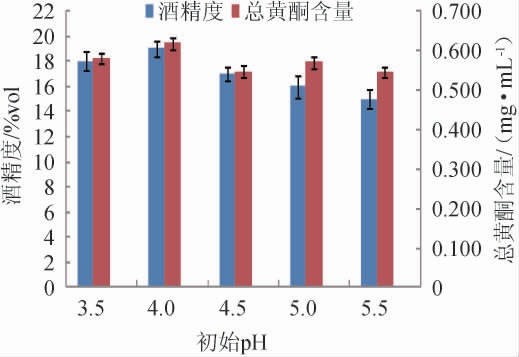
图3 初始pH值对木瓜荞麦果酒酒精度及总黄酮含量的影响
Fig.3 Effect of initial pH on the alcohol content and total flavonoids contents of papaya and buckwheat wine
2.1.4 酵母菌接种量的确定
酵母菌接种量对木瓜荞麦果酒发酵的影响见图4。
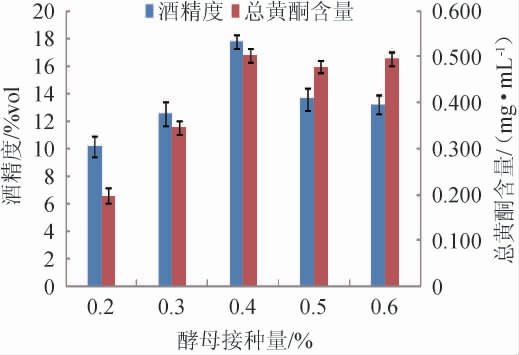
图4 酵母接种量对木瓜荞麦果酒酒精度及总黄酮含量的影响
Fig.4 Effect of yeast inoculum on the alcohol content and total flavonoids contents of papaya and buckwheat wine
由图4可知,随着酵母菌接种量在0.2%~0.6%范围内增加,木瓜荞麦果酒的酒精度、总黄酮含量呈先升高后降低的趋势。当酵母接种量为0.4%时,木瓜荞麦果酒的酒精度和总黄酮含量到达最大值,分别为17.8%vol、0.504 mg/mL;当酵母菌接种量>0.4%后,随酵母接种量的增大,发酵前期大量酵母进行自身生长繁殖消耗发酵液中的糖分和其他营养物质,导致酒精发酵不良,导致木瓜荞麦果酒的酒精度、总黄酮含量下降以及口感风味变差。因此,选择最佳酵母接种量为0.4%。
2.1.5 发酵温度的确定
发酵温度对木瓜荞麦果酒发酵的影响结果见图5。由图5可知,随着发酵温度升高,木瓜荞麦果酒的酒精度和总黄酮含量均呈先升高后降低的趋势。发酵温度为22 ℃时,木瓜荞麦果酒的酒精度和总黄酮含量均达到最大值,分别为17.8%vol、0.524 mg/mL。当发酵温度高于22 ℃时,木瓜荞麦果酒的酒精度、总黄酮含量下降明显。原因可能是发酵温度较低使酵母生长繁殖受抑制,糖转化率低,发酵产醇不完全,酒精度低、总黄酮溶解量低导致果酒品质降低和口感平淡;发酵温度过高虽有利于酵母生长繁殖,但发酵前期消耗发酵液中大量的糖等营养成分,使得代谢产醇不足,酒精度较低,总黄酮含量也降低,同时温度过高不利于乙醇及香气成分保留在酒液中,导致酒精度低、口感寡淡。因此,选择最佳发酵温度为22 ℃。
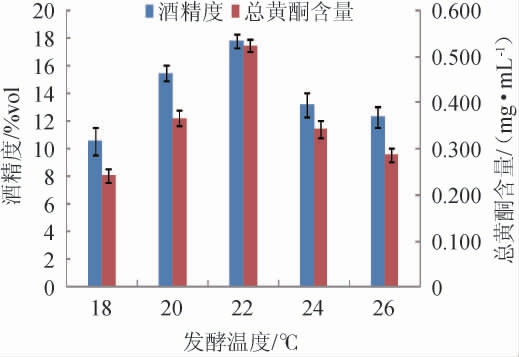
图5 发酵温度对木瓜荞麦果酒酒精度及总黄酮含量的影响
Fig.5 Effect of fermentation temperature on the alcohol content and total flavonoids contents of papaya and buckwheat wine
2.2 正交试验结果
由表3可知,以酒精度为考察指标时,各因素对木瓜荞麦果酒酒精度影响大小为A>D>B>C,即初始糖度>木瓜酶解液∶荞麦糖化液>酵母接种量>发酵温度;最优组合为A3B3C2D1,即初始糖度24 °Bx、酵母接种量0.5%、发酵温度22 ℃、木瓜酶解液∶荞麦糖化液质量比为1∶2。以总黄酮含量为考察指标时,各因素对木瓜荞麦果酒总黄酮含量影响大小为A>D>C>B,即初始糖度>木瓜酶解液∶荞麦糖化液质量比>发酵温度>酵母接种量,最佳组合为A3B3C2D1,即初始糖度24 °Bx、酵母接种量0.5%、发酵温度22 ℃、木瓜酶解液∶荞麦糖化液质量比为1∶2。因此最终确定最佳发酵工艺组合为A3B3C2D1,即初始糖度24 °Bx、酵母接种量0.5%、发酵温度22 ℃、木瓜酶解液∶荞麦糖化液质量比为1∶2。在此条件下重复3次平行验证试验,制得的木瓜荞麦果酒的酒精度为(17.8±1.09)%vol,总黄酮含量为(0.536±0.05)mg/mL。
表3 正交试验结果与分析
Table 3 Results and analysis of orthogonal tests
2.3 感官评价及理化指标
在最佳条件下制得的木瓜荞麦果酒感官评分为(82.1±2.0)分,色泽金黄,澄清透亮,滋味醇厚柔和,具有浓郁果、醇香味;总酸含量为(3.78±0.16)g/L,总糖含量为(24.31±0.97)g/L,还原糖含量为(4.32±0.23)g/L,符合NY/T 1508—2017《绿色食品果酒》检测分析法要求。
3 结论
本试验通过单因素、正交试验研究探索以光皮木瓜酶解液、荞麦糖化液为混合基质制备木瓜荞麦果酒的最佳工艺参数。研究结果表明,木瓜荞麦果酒最佳酿造工艺为初始糖度24°Bx、酵母接种量0.5%、发酵温度22 ℃、木瓜酶解液:荞麦糖化液质量比为1∶2,主发酵14 d,转至15 ℃后熟到原酒液糖度降至1°Bx以下。在此工艺条件下酿制的木瓜荞麦果酒,色泽金黄,澄清透亮,滋味醇厚柔和,具有浓郁果、醇香味;酒精度为17.8%vol,总黄酮含量为0.54 mg/mL,总酸含量为3.78 g/L,总糖含量为24.31 g/L,还原糖含量为4.32 g/L,符合果酒行业标准NY/T 1508—2017要求,是一款营养、功效与风味较好的新型功能果酒。该工艺充分结合木瓜、荞麦自身特点,成功实现了对传统木瓜酒酿造工艺的改良,提升了木瓜酒的风味、营养和保健功效,为高附加值光皮木瓜、荞麦功能产品的研发提供理论依据。
[1] 石静亚,张志广,李孟,等.光皮木瓜中酚性成分研究[J].中国药学杂志,2020,55(20):1666-1672.
[2] 潘琳.皱皮木瓜与光皮木瓜的临床鉴别运用[J].中国典型病例大全,2020,15(5):193-196.
[3] 杨旭.浑浊型光皮木瓜果汁的稳定性研究[J].食品工业科技,2021,42(8):194-198.
[4] 纪桢,许佳林,白巧秀,等.三种抗氧化剂对光皮木瓜籽油的抗氧化效果研究[J].粮油食品科技,2018,26(6):29-32.
[5] 沈大刚,姚姚,汪远斌.白河县木瓜属种质资源调查研究[J].陕西农业科学,2019,65(11):99-101.
[6] 尹震花,赵晨,张娟娟,等.光皮木瓜的化学成分及药理活性研究进展[J].中国实验方剂学杂志,2017,23(9):221-229.
[7] 张冬松,高慧媛,吴立军.光皮木瓜的化学成分药理活性及临床研究进展[J].沈阳药科大学学报,2007,24(11):721-726.
[8] 李孟,张志广,王梦梦,等.光皮木瓜化学成分研究及其神经保护活性[J].中成药,2020,42(10):2635-2639.
[9] 张瑞,何静仁,蔡小双,等.四种方法提取光皮木瓜籽油及成分分析的比较研究[J].粮食与油脂,2015,28(8):56-61.
[10] ZHANG R,ZHAN S Y,LI S Y,et al.Anti-hyperuricemic and nephroprotective effects of extracts from Chaenomeles sinensis(Thouin)Koehne in hyperuricemic mice[J].Food Funct,2018,9(11):5778-5790.
[11] CHA K J,SONG C S,LEE J S,et al.Chaenomeles sinensis Koehne extract suppresses the development of atopic dermatitis-like lesions by regulating cytokine and filaggrin expression in NC/Nga mice[J]. Int J Med Sci,2019,16(12):1604-1613.
[12] KIM D H,SUBEDI L,KIM H R,et.al.Phenolic constituents of Chinese Quince (Chaenomeles sinensis Koehne) and their anti-neuroinflammatory,neurotrophic,and cytotoxic activities[J].Antioxidants,2021,10(4):551.
[13] 沈大刚,苗貂,汪远斌,等.白河县6 个木瓜优良单株果实主要营养成分测定与分析[J].陕西农业科学,2020,66(8):41-43,75.
[14] 刘世尧,白志川,李加纳.皱皮木瓜与光皮木瓜品质多性状指标综合评价[J].中国中药杂志,2012,37(7):901-907.
[15] 邢婕.CMC-Na在光皮木瓜涂膜保鲜中的应用[J].湖北农业科学,2020,59(17):132-136.
[16] 胡军.柚子木瓜发酵酒工艺研究[J].酿酒,2019,46(5):107-109.
[17] 纪桢,第五昺昺,俎花花,等.响应面法优化光皮木瓜粉制备工艺[J].食品工业,2021,42(5):106-110.
[18] 韦广鑫,龙立利,杨笑天,等.野木瓜果酒发酵工艺优化研究[J].酿酒科技,2015(5):83-93,95.
[19] 向进乐,罗磊,马丽苹,等.木瓜酒和木瓜醋发酵工艺及其有机酸组成分析[J].2016,37(23):191-195.
[20] 中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2016食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[21] 中华人民共和国农业部.NY/T 1508—2017 绿色食品果酒[S].北京:中国农业出版社,2017.
[22] 国家质量监督检验检疫总局.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[23] 姜莹,周文美.发酵罐发酵荞麦酒工艺研究[J].中国酿造,2017,36(1):83-87.
[24] 尉杰,陈庆富,郭菊卉.普通荞麦发芽种子的液态发酵荞麦酒工艺研究[J].中国酿造,2014,33(8):43-46.
[25] 肖作为,谢梦洲,甘龙,等.山银花、金银花中绿原酸和总黄酮含量及抗氧化活性测定[J].中草药,2019,50(1):210-216.
[26] 何伟,王莉,黄景凤,等.罗布麻茶中总黄酮测定方法[J].食品工业,2021,42(8):180-184.