蓝莓中含有较丰富的糖、氨基酸、膳食纤维、维生素C(vitamin C,VC)、超氧化物歧化酶(superoxide dismutase,SOD)、多酚(花青素、酚酸和黄酮类化合物)等营养成分,是抗氧化作用最强的水果之一[1-2]。蓝莓果酒是以蓝莓为原料经过一系列处理后发酵而成的富含有机酸、氨基酸、多糖、多酚、维生素等功能性成分的酒精性饮料。
由于蓝莓种皮中含有花青素等抗氧化活性成分,有关蓝莓全果酒的报道很多,主要集中在果酒的加工工艺优化、果酒加工过程中的基本成分及抗氧化活性分析等[3-5]。硒作为人体必需的微量元素,具有抗氧化、抗肿瘤、增强机体抵抗力的作用,同时还对一些重金属离子有解毒作用。大量研究表明,乳酸菌、酵母菌等具有富硒能力,而富硒后的乳酸菌、酵母菌发酵的果汁、果酒具有更高的抗氧化活性[6-8]。MANGIAPANE E 等[9]对富硒金莲果芽孢杆菌(Fructobacillus tropaeoli)CRL 2034发酵牛奶果汁混合饮料在低温贮藏和模拟胃肠液环境下菌体的存活率研究时发现,富硒金莲果芽孢杆菌的存活率可以提高1 lg(CFU/mL)。ZHOU M Z等[10]报道富硒植物乳杆菌发酵降低了泡菜的亚硝酸盐含量,提高了抗氧化活性,生成了独特的风味物质(乙酸、己烯醇、2-侧柏烯、壬醛和1-壬醇)。PALOMO M等[11]研究报道硒存在情况下乳酸菌可以提高氧化应激水平和对胆盐的胁迫抵抗能力。SUN Y H等[12]报道在紫红曲霉(Monascus purpureus)M12发酵开始时添加亚硒酸钠10 μg/mL,调节pH5.5~6.5时接种5%,发酵10 d后硒的富集和转化率达到最佳。EKUMAH J N等[13]研究发现,富硒酵母(100 μg,300 μg)发酵桑葚果酒较对照提高了总花青素、总黄酮和总多酚含量,提高了酒的抗氧化活性,而对发酵效率和总体酒的品质没有显著影响。
本研究以当地蓝莓为原料,在酵母培养基中添加亚硒酸钠以获得富硒酵母,以酵母JK10酿造蓝莓全果果酒为对照,以富硒酵母酿造富硒蓝莓全果果酒,以总酸、酒精度、感官评分和残糖量为评价指标,通过单因素试验及正交试验优化富硒蓝莓全果果酒的发酵工艺,评价果酒中的硒、总多酚、总黄酮、总花色苷含量及其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS)自由基、羟自由基的清除率。以期为开发风味独特、富含营养成分且具有一定功能的富硒蓝莓果酒提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 原料及菌株
蓝莓:市售;酿酒酵母(Saccharomyces cerevisiae)JK10:烟台帝伯仕有限公司。
1.1.2 化学试剂
亚硒酸钠(分析纯):天津市西亚食品有限公司;焦亚硫酸钠(分析纯):安庆新亚菱化工有限公司;氯化钾、乙酸钠、碳酸钠、硝酸钠、硝酸铝、氢氧化钠(均为分析纯)、没食子酸、芦丁(纯度均>98%):成都科龙化学试剂厂;亚甲基蓝、酒石酸钾钠、氢氧化钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、苯酚、福林酚、ABTS(均为分析纯):索莱宝(北京)有限公司;DPPH(分析纯):美国Sigma公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:蛋白胨20 g,酵母粉10 g,葡萄糖20 g,蒸馏水1 000 mL,pH6.0,115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
CP114电子天平:奥豪斯仪器有限公司;HPX-9052MBE恒温培养箱:上海博讯生物仪器有限公司;THM-75005289低温高速离心机、iCAP QC电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)仪:美国Thermo Fisher公司;UV-1100紫外/可见分光光度计:上海MAPADA公司;RHB80手持式糖量折光仪:天津市泰斯特仪器有限公司;FE28酸度计:梅特勒托利多(中国)有限公司;CM-5色差仪:日本KONICA MINO-LTA公司;JYL-Y99打浆机:九阳股份有限公司。
1.3 试验方法
1.3.1 富硒蓝莓全果果酒加工工艺流程及操作要点
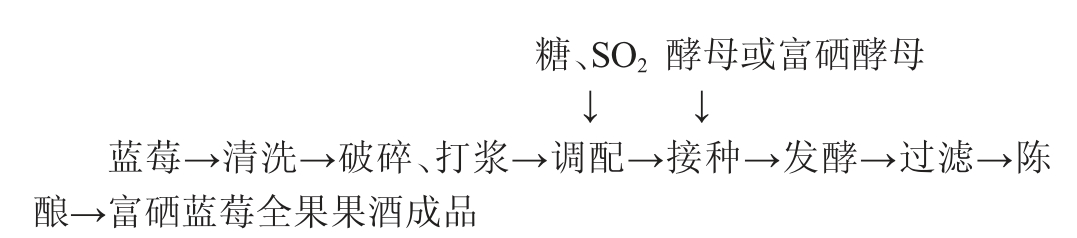
预处理:将蓝莓原料清洗干净、晾干,打浆机进行打浆,得到蓝莓全果浆。
调配:加入白砂糖调整蓝莓全果浆初始糖度为20°Bx,同时加入50 mg/L焦亚硫酸钠,充分搅拌均匀。
酵母活化:干酵母按照0.4 g/L添加量,在5%糖水中36 ℃活化30 min,得到活化酵母。
接种:活化酵母或富硒酵母按照4.5%添加量添加至调配后的蓝莓全果浆中。
发酵:装罐封口发酵(25 ℃,7 d),适当搅拌并增加溶氧量[3]。当酒精度和还原糖含量基本保持稳定时,视作发酵终点。
过滤:发酵完成后用滤布滤去酒渣,再于120目的过滤机上过滤。
陈酿:将过滤后的果酒进行低温(16 ℃)陈酿1~2个月,得到富硒蓝莓全果果酒成品。
1.3.2 富硒酵母的制备
在5%糖水中36℃活化30min后的酵母菌(2×106CFU/mL)按照4.5%接种于亚硒酸钠质量浓度分别为0、25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL的YEPD培养基中[12-13],测定发酵(25 ℃、200 h)过程中酵母菌的活菌数,绘制其生长曲线,测定富硒率及酒精度,在富硒率、酒精度最高同时不影响酵母的正常生长以确定合适的亚硒酸钠质量浓度。
1.3.3 发酵工艺优化
(1)单因素试验
在发酵温度25 ℃,SO2的添加量90 mg/L,分别设置富硒酵母接种量为0.5%、1.5%、3.0%、4.5%、6.0%,初始pH值分别为2.5、3.0、3.5、4.0、4.5,初始糖度分别为18°Bx、20°Bx、22°Bx、24°Bx、26°Bx条件下发酵7 d,分别考察富硒酵母接种量、初始pH值及初始糖度对富硒蓝莓全果果酒感官评分、总酸、酒精度、残糖量的影响。
(2)正交试验
在单因素试验的基础上,以富硒酵母接种量(A)、初始糖度(B)及初始pH值(C)为影响因素,以酒精度及感官评分为评价指标,设计3因素3水平正交试验,考察上述各因素对富硒酵母菌发酵蓝莓全果果酒酒精度和感官评分的影响,正交试验因素与水平见表1。
表1 发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for fermentation technology optimization

1.3.4 分析检测
硒含量测定:采用ICP-MS法[12]。富硒率计算公式如下:
颜色参数(明亮度L*值、黄蓝b*值、红绿a*值、色调(H)及饱和度(C))的测定:采用色差仪直接测定,色调(H)及饱和度(C)计算公式如下[13]:
总酸(以酒石酸计)测定:参照国标GB/T 32783—2016《蓝莓酒》的滴定法;酒精度的测定:参照国标GB/T 32783—2016《蓝莓酒》比重计法;残糖量测定:参照农业行业标准NY/T 2637—2014《水果和蔬菜可溶性固形物含量的测定折射仪法》;总多酚测定:采用福林酚法;花色苷测定:采用pH示差法;总黄酮测定:采用Al(NO3)3-NaNO2-NaOH显色法;DPPH、ABTS、羟自由基清除率测定:参照文献[14-16]。
感官评价:取一定量的富硒蓝莓全果果酒样品于烧杯中,由10名具有一定专业知识且经过培训的感官评定小组成员依照感官评分标准对其色泽、滋味及气味、组织状态进行打分,满分100分。富硒蓝莓全果果酒感官评分标准见表2[17-18]。
表2 富硒蓝莓全果果酒感官评分标准
Table 2 Sensory evaluation standards of Se-enriched whole blueberry fruit wine

1.3.5 数据处理
采用Sigmplot 10.0作图,利用SPSS 17.0软件进行显著性分析,P<0.05表明差异显著,结果以“平均值±标准差”表示。
2 结果与分析
2.1 不同浓度亚硒酸钠对酵母的生长、产酒精及富硒率的影响
不同亚硒酸钠浓度下酵母的生长曲线,产酒精及富硒率见图1。
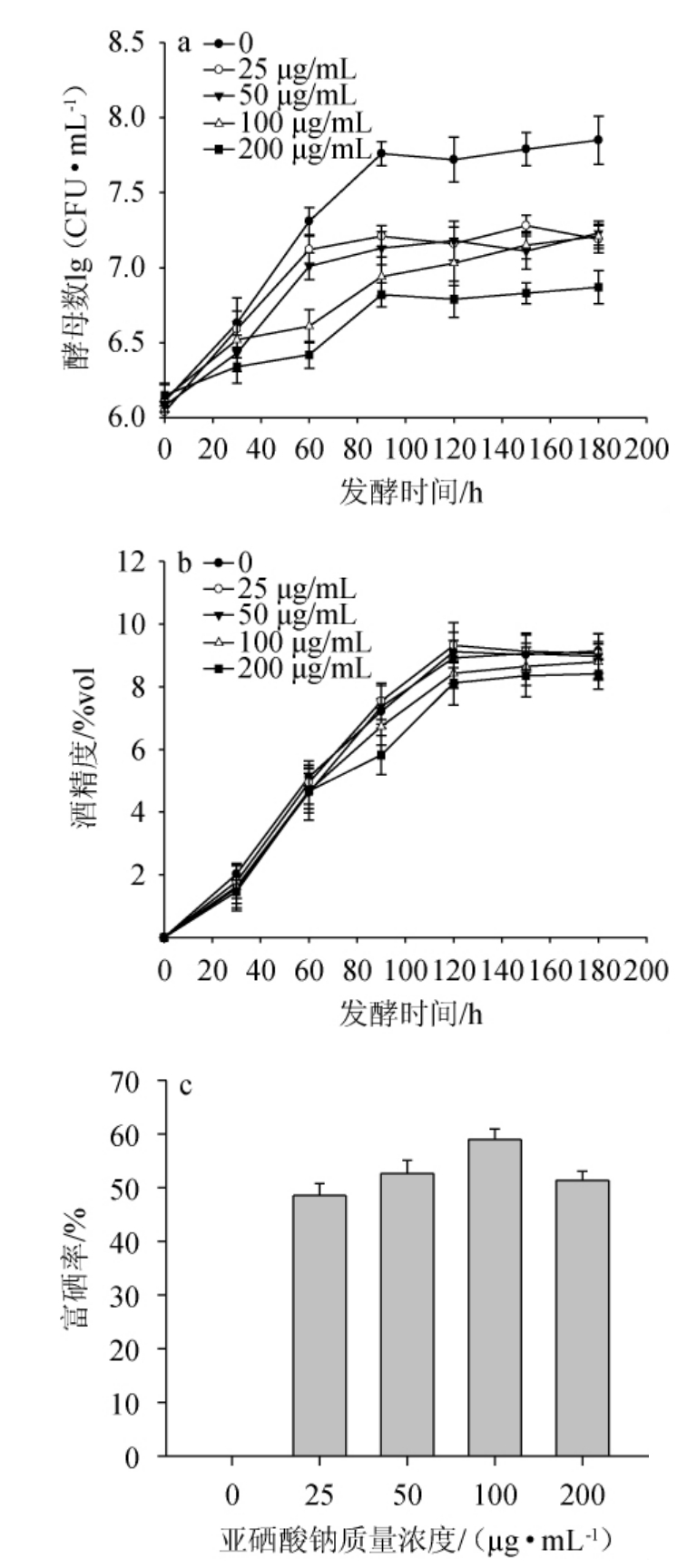
图1 不同亚硒酸钠浓度下酵母的生长曲线(a)、产酒精度(b)及富硒率(c)
Fig.1 Growth curves (a),alcohol content (b) and Se-enriched rate(c) under different disodium selenite concentration
由图1a可知,在最初的30 h发酵时段内,不同质量浓度亚硒酸钠对酵母的生长没有明显的影响,ZHOU N等[19]报道在0.5~1.2 μg/mL硒质量浓度下酵母缩短迟滞期而尽快进入生长期,当硒被酵母吸收后形成的谷胱甘肽还原酶使酵母细胞适应了培养基的渗透压等应激环境,从而加快了其生长代谢速率。发酵时间>30 h之后,不同亚硒酸钠质量浓度对酵母的生长代谢有一定的抑制作用,质量浓度越大抑制越明显,与KHUJIN M H等[20-21]报道的提高硒的浓度会抑制酵母菌的增殖相一致,而25 μg/mL和50μg/mL两个质量浓度下酵母菌生长接近,从对酵母生长影响来看,亚硒酸钠质量浓度25 μg/mL为宜。由图1b可知,不同亚硒酸钠浓度下对酵母发酵0~90 h时生成酒精度的影响不大,在发酵时间>90 h之后,100 μg/mL和200 μg/mL质量浓度下的酒精度明显低于其他处理,从对酵母产酒精来看,亚硒酸钠质量浓度50 μg/mL为宜。由图1c可知,亚硒酸钠的质量浓度越大,富硒率也越大,100 μg/mL质量浓度下的富硒率最高,但与50 μg/mL质量浓度下差异不显著(P>0.05),从对酵母富硒率来看,亚硒酸钠质量浓度100 μg/mL为宜。
综合酵母生长曲线、酒精度和富硒率,选择最佳亚硒酸钠质量浓度为50 μg/mL。
2.2 发酵工艺优化单因素试验
2.2.1 富硒酵母接种量对富硒蓝莓全果果酒品质的影响
果酒的发酵过程主要是糖酵解生成丙酮酸,并在无氧条件下生成乙醇[22],酵母添加量少时,发酵不充分,分解糖不完全,生成的酒精量也较少,致使果酒的评分较低。而当酵母添加量过多,酵母大量繁殖需消耗大量营养物质,也会使生成酒精量减少,同时增大接种量导致发酵过程加速而对风味物质形成不利。因而合适的酵母添加量对成品酒的品质有重要影响。不同富硒酵母接种量对富硒蓝莓全果果酒的总酸、酒精度、残糖量和感官评分的影响结果见表3。由表3可知,随着接种量的增加,总酸、酒精度和感官评分呈先上升后下降的趋势,而残糖量不断降低。当接种量为3.0%时,感官评分最高,为83.98分;接种量为4.5%时,总酸和酒精度最高,分别为8.81 g/L、11.65%vol;残糖量则在接种量6.0%时最低,为13.17 g/L。接种量为3.0%和4.5%时的总酸、酒精度、残糖量、感官评分差异不显著(P>0.05)。因此,选择最适富硒酵母添加量为3.0%。
表3 不同富硒酵母接种量对富硒蓝莓全果果酒品质的影响
Table 3 Effect of different selenium enriched yeast inoculum on the quality of Se-enriched whole blueberry fruit wine
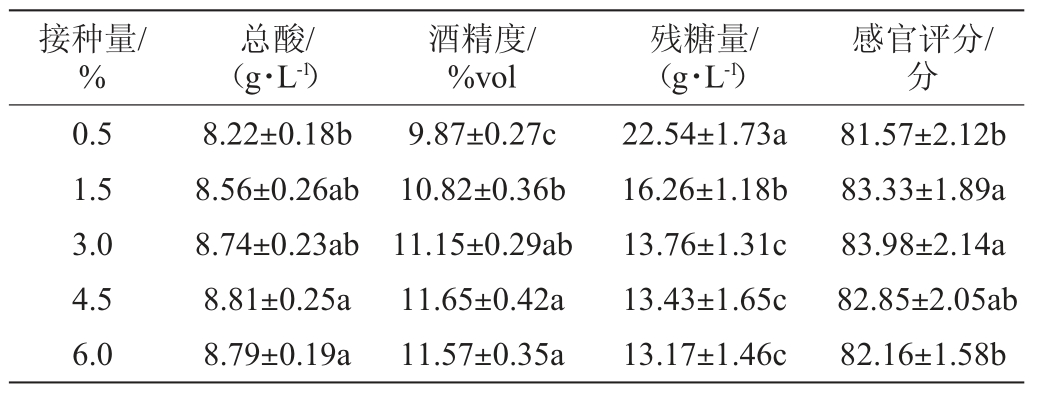
注:同列数据不同小写字母表示差异显著(P<0.05)。下同。
2.2.2 初始糖度对富硒蓝莓全果果酒品质的影响
糖作为酵母发酵的能源物质,同时也是形成酒精和酯类物质的底物,因此初始糖度直接决定果酒酒精度和风味形成[23],当初始糖度过低时不利于酒精度和风味的形成,造成酒体过于单薄从而感官评分不高。而初始糖度过高,葡萄糖阻遏和高渗透压会抑制酵母的繁殖代谢[24],导致残糖量较高,酒体出现浑浊和沉底的现象。
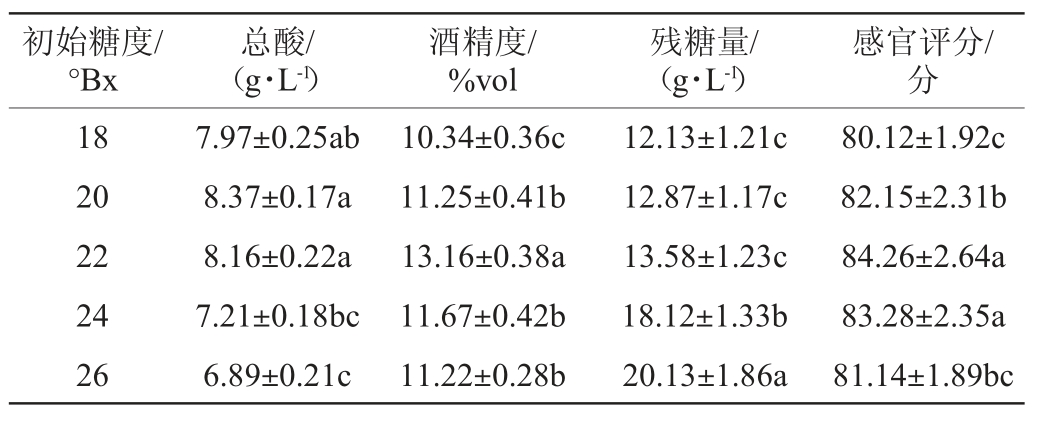
不同初始糖度对富硒蓝莓全果果酒的总酸、酒精度、残糖量和感官评分的影响结果见表4。由表4可知,随着初始糖度的增加,总酸、酒精度、感官评分呈先上升后下降的趋势,而残糖量则不断增加。当初始糖度为20°Bx时,总酸含量最高,为8.37 g/L;当初始糖度为22°Bx时,酒精度和感官评分最高,分别为13.16%vol、84.26分;残糖量在初始糖度22°Bx 与20°Bx间差异不显著(P>0.05);当初始糖度>22°Bx之后,除残糖量外的各项指标呈下降趋势。为避免过高的初始糖度在发酵过程中降糖缓慢且残糖量较高,同时高渗透压使酵母转化酒精能力受限,出现酒精度相对较低、残糖高的现象,而较低的初始糖度致使其残糖量很低,同时发酵迅速并且发酵提前结束,导致糖类全部转化成酒精,而发酵过程中产生香气成分等物质的基质不足,造成酒体风味寡淡的现象。因此,选择最佳初始糖度为22°Bx。
表4 不同初始糖度对富硒蓝莓全果果酒品质的影响
Table 4 Effect of initial sugar content on the quality of Se-enriched whole blueberry fruit wine
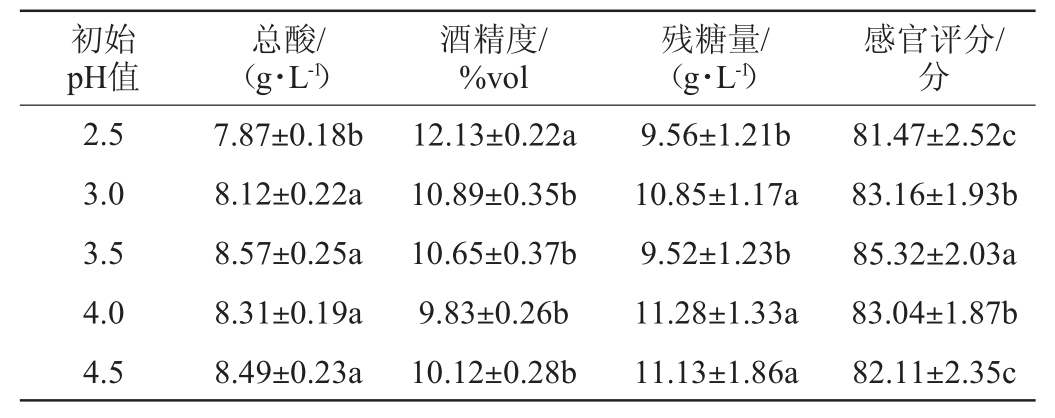
2.2.3 初始pH值对富硒蓝莓全果果酒品质的影响
合适的起始pH值对于酵母的快速生长代谢进而完成酒体的发酵至关重要,酵母适合在偏酸性的环境下生长,但较低的酸会造成酵母生长延迟现象,富硒后的酵母菌对酸、热、高渗透压等不良环境应激的适应性更强。不同初始pH值条件下,发酵完成后的酒体的总酸、酒精度、残糖量和感官评分见表5。由表5可知,当初始pH值在2.5~3.5之间时,总酸的含量呈上升的趋势,初始pH 值在3.5、4.0、4.5之间的总酸差异不显著(P>0.05)。而酒精度随着初始pH值的不断升高呈下降的趋势,在初始pH值2.5时酒精度最高,初始pH值在3.0~4.5之间,酒精度趋于平缓。在初始pH值为3.5时,残糖量最低同时感官评分最高。因此,选择初始pH值为3.5。
表5 不同初始pH对富硒蓝莓全果果酒品质的影响
Table 5 Effect of initial pH on the quality of Se-enriched whole blueberry fruit wine
2.3 发酵工艺优化正交试验
在单因素试验的基础上,以富硒酵母接种量(A)、初始糖度(B)及初始pH值(C)为影响因素,以酒精度及感官评分为评价指标,设计3因素3水平正交试验,正交试验结果与分析见表6,方差分析分别见表7和表8。
表6 发酵工艺优化正交试验结果与分析
Table 6 Result and analysis of orthogonal tests for fermentation technology optimization
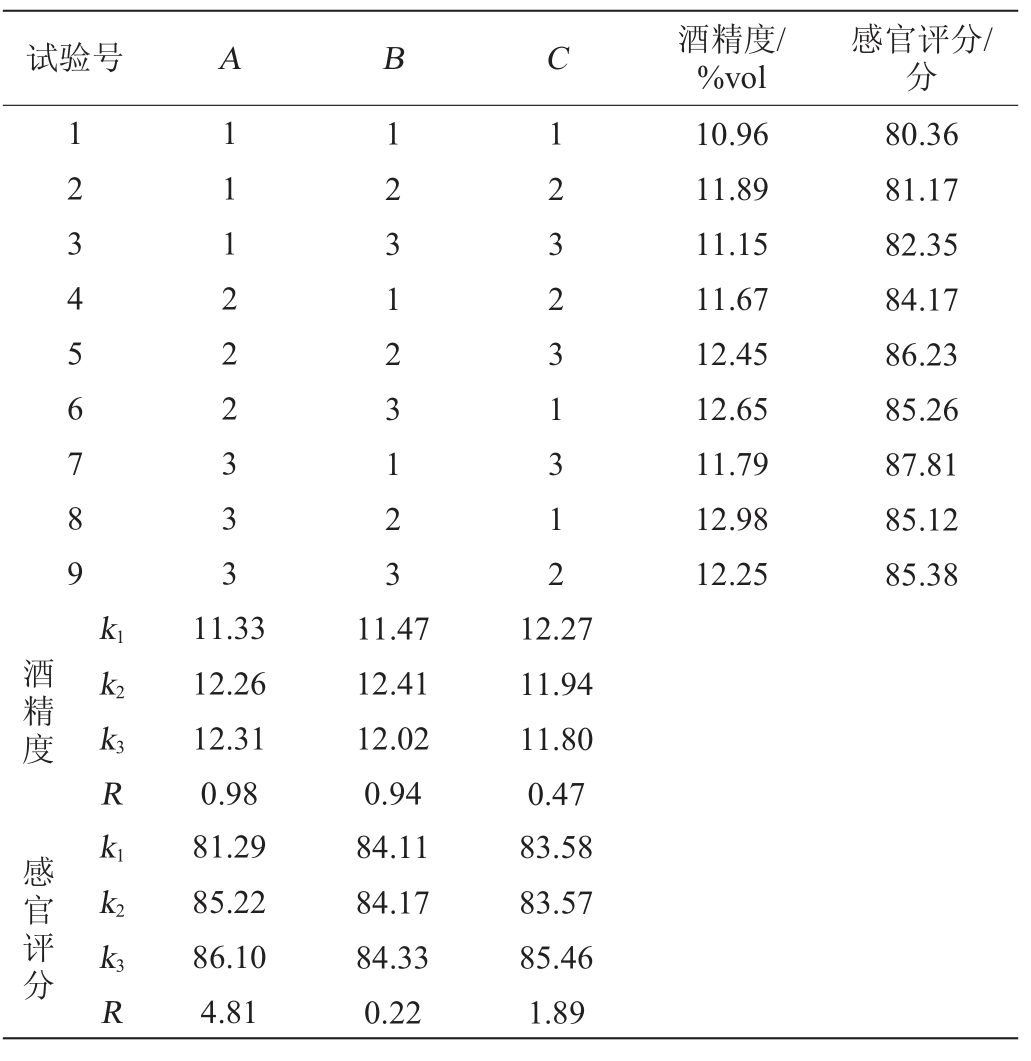
表7 以酒精度为评价指标正交试验结果方差分析
Table 7 Variance analysis of orthogonal tests results using alcohol contents as evaluation index
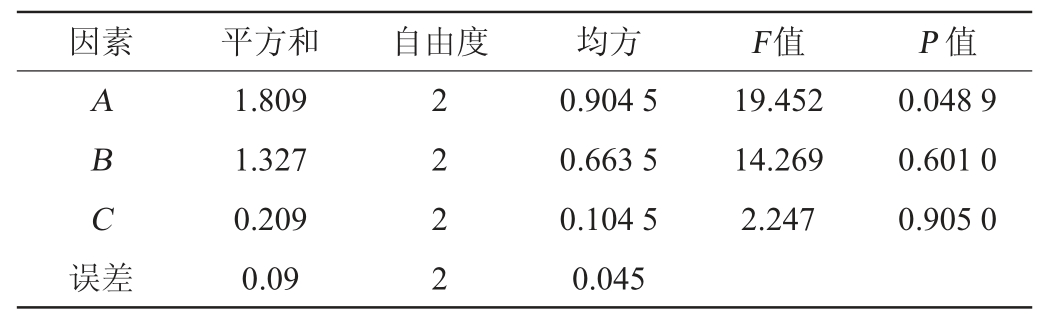
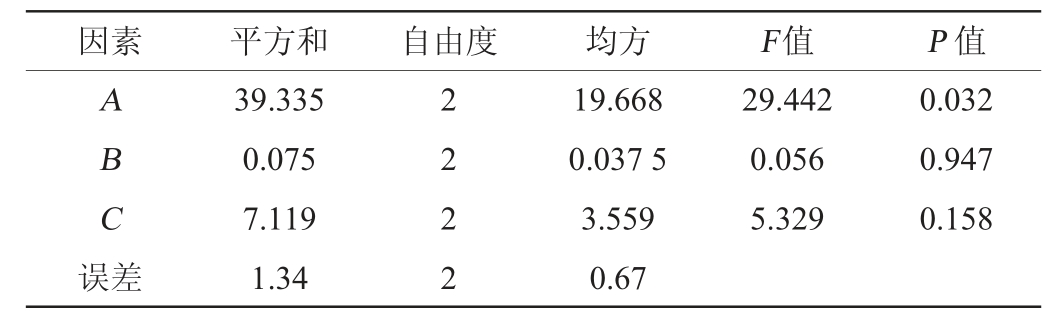
表8 以感官评分为评价指标正交试验结果方差分析
Table 8 Variance analysis of orthogonal tests results using sensory evaluation as evaluation index
由表6可知,以酒精度作为评价指标,由极差分析可知,各因素对酒精度的影响的主次顺序为A>B>C,即富硒酵母接种量>初糖糖度>初始pH值,最佳发酵工艺组合为A3B2C1,即富硒酵母接种量4.5%、初始糖度22°Bx及初始pH值3.0。由表7可知,富硒酵母接种量对酒精度影响显著(P<0.05),初始糖度和初始pH值对酒精度影响不显著(P>0.05)。
由表6可知,以感官评分作为评价指标,由极差分析可知,对感官评分的影响的主次顺序为A>C>B,即富硒酵母接种量>初始pH值>初始糖度,最佳发酵工艺组合为A3B3C3,即富硒酵母接种量4.5%、初始糖度24°Bx及初始pH值4.0。由表8可知,富硒酵母接种量对感官评分影响显著(P<0.05),初糖浓度和pH对感官评分影响不显著(P>0.05)。
综合酒精度和感官评分,得出发酵工艺组合A3B2C1和A3B3C3不一致,又由于B因素对感官评分的影响最小,同时B2和B3水平的感官评分均值84.17分和84.33分接近,因而B因素选B2水平,C因素对酒精度的影响最小,因而C以感官评分的分析选C3,综合确定最优的发酵工艺组合为A3B2C3,即富硒酵接种量4.5%、初始糖度22°Bx、初始pH值为4.0。在此优化条件下,富硒蓝莓全果果酒感官评分88.12分,酒精度13.23%vol。
2.4 富硒蓝莓全果果酒理化指标及抗氧化活性
对富硒蓝莓全果果酒的pH值、颜色参数、硒含量、总固形物、总多酚、总黄酮、总花色苷以及抗氧化活性进行检测,结果分别见表9和图2。由表9和图2可知,与对照果酒比较,富硒蓝莓全果果酒样品中的明亮度(L*值)、黄蓝(b*值)、色调(H)降低,而红绿(a*值)、饱和度(C)、硒含量、总固形物以及pH值均较对照增加,而同时样品中的总多酚、总花色苷和总黄酮含量都显著高于对照(P<0.05),相应的对DPPH、ABTS自由基以及羟自由基的清除率显著高于对照(P<0.05)。果酒中色度的增加尤其是a*值的增加、L*值和b*值的降低都与花色苷的增加有关,EKUMAH J N等[13,25]报道富硒酵母发酵桑葚果酒中a*值的增加与果酒中单体花色苷的含量增加有显著的正相关性,而L*值和b*值与花色苷的增加呈显著的负相关。FAIRCHILD M D等[26]报道,在pH>3.8时,单体花色苷呈现稳定的红色;TCHABO W等[25]研究发现,在pH>3.8的环境下花青素不易被降解成葡萄糖和苷元,因而更有利于保持酒体的红色。另外样品中的硒含量达到21.43 mg/L,是对照的9.6倍,而水溶性的硒呈现砖红色,也是酒体a*值增加的重要原因。样品中总固形物含量较高,说明样品中残留较多的糖、较高的pH。ARRIZON J等[27]报道,富硒后酒体中的总固形物含量高于对照是由于对照中合适的酸度环境下大部分的糖被代谢成酸。样品中较高的总多酚、总黄酮和总花色苷,与报道的富硒后桑葚酒中的总多酚含量显著高于对照一致,可能与富硒后酵母生成β-葡萄糖苷酶有关,这种酶能催化烷基糖苷和芳基-β-D-葡萄糖苷的糖苷键的水解转化,从而释放葡萄酒中的酚醛苷元[14,28]。当有硒存在时酵母在谷胱甘肽激活下生成的乙醛和丙酮酸有利于花色苷的稳定性因而富硒后的酒体花色苷更稳定,其含量也高于对照[21,29-30]。
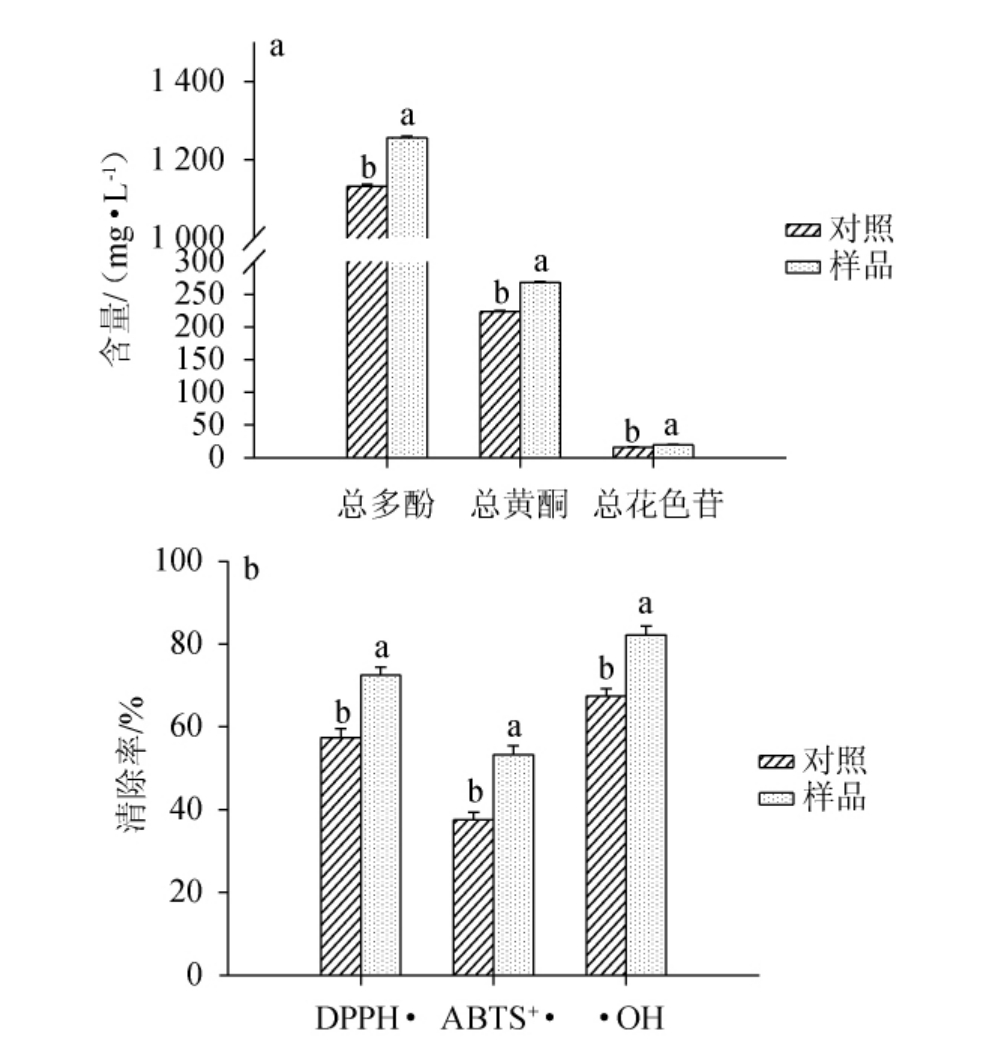
图2 富硒蓝莓全果果酒中多酚类物质含量(a)及抗氧化活性(b)
Fig.2 Polyphenols contents (a) and antioxidant activities (b) of Se-enriched whole blueberry fruit wine
不同字母表示差异显著(P<0.05)。
表9 富硒蓝莓全果果酒基本理化指标测定结果
Table 9 Determination results of physicochemical indicators of Se-enriched whole blueberry fruit wine

样品中较高的抗氧化活性与富硒后酚酸释放氢离子后对自由基的清除活性有关,也可能富硒后酵母代谢生成了硒代蛋氨酸和硒代半胱氨酸等含硒化合物,同时释放更多的氢离子使多酚物质清除自由基。报道加入硒后酚酸在其芳香苯环和自由电子对之间发生共振,从而诱导电子离域,有效的电子离域增加了对ABTS自由基的清除[13,28-29]。本研究中样品较高的对ABTS自由基的清除活性与较低浓度下的硒对酚酸电子的稳定性和离域性的影响有关。
各检测指标的相关性分析结果见表10。由表10可知,总多酚、总黄酮、总花色苷与硒含量之间呈显著正相关(P<0.05),硒、总多酚、总黄酮、总花色苷含量与清除自由基的活性呈显著正相关(P<0.05),充分说明富硒酵母发酵蓝莓全果果酒不仅提高了酒体中的硒含量,同时提高了酒体中的抗氧化活性物质形成,对酒体的保健功能有积极作用。
表10 富硒蓝莓全果果酒中多酚类物质、硒和抗氧化活性相关性分析结果
Table 10 Analysis results of Pearson's correlation of polyphenols,selenium and antioxidant activities of Se-enriched whole blueberry fruit wine

3 结论
加入50 μg/mL的亚硒酸钠时酵母可以获得较高的富硒率同时对其生长和产酒精影响不大,单因素试验及正交试验设计优化富硒蓝莓全果果酒的发酵工艺为:富硒酵母接种量4.5%、初始糖度22°Bx,初始pH4.0。在此优化工艺下发酵的富硒蓝莓全果果酒感官评分和酒精度分别为88.12分、13.23%vol,同时总多酚、总黄酮和总花色苷,抗氧化活性也显著高于对照样品。总多酚、总黄酮、总花色苷与硒含量之间呈显著正相关(P<0.05),硒、总多酚、总黄酮、总花色苷含量与清除自由基的活性呈显著正相关(P<0.05)。富硒酵母发酵蓝莓果酒具有较高的生物活性,利用富硒酵母可以制作功能性果酒。
[1] 徐雯.蓝莓酒发酵过程中关键成分的特性研究[D].常州:常州大学,2021.
[2] 刘小莉,仇小姝,王英等.蓝莓果酒发酵工艺条件及品质研究[J].食品研究与开发,2016,37(11):85-89.
[3] 刘彩婷,周鸿翔.不同发酵工艺对蓝莓果酒品质的影响[J].食品与发酵工业,2020,46(4):172-179.
[4] 陈小玲.蓝莓果酒酵母筛选及发酵工艺优化的研究[D].汉中:陕西理工大学,2018.
[5] 刘美玲.蓝莓果酒发酵工艺及超声波催陈的研究[D].天津:天津科技大学,2016.
[6] POPHALY S D,POONAM,SINGH P,et al.Selenium enrichment of lactic acid bacteria and bifidobacteria:A functional food perspective[J].Trends Food Sci Tech,2014,39(2):135-145.
[7] SONKUSRE P,CAMEOTRA S.Biogenic selenium nanoparticles inhibit Staphylococcus aureus adherence on different surfaces[J].Colloids Surfaces B,2015,136:1051-1057.
[8] MARTÍNEZ F G,BARRIENTOS M E C,MOZZI F,et al.Survival of selenium-enriched lactic acid bacteria in a fermented drink under storage and simulated gastro-intestinal digestion[J].Food Res Int,2019,123:115-124.
[9] MANGIAPANE E,LAMBERTI C,PESSIONE A,et al.Selenium effects on the metabolism of a Se-metabolizing Lactobacillus reuteri:Analysis of envelope-enriched and extracellular proteomes[J].Mol BioSyst,2014,10:1272-1280.
[10] ZHOU M Z,ZHENG X,ZHU H J,et al.Effect of Lactobacillus plantarum enriched with organic/inorganic selenium on the quality and microbial communities of fermented pickles[J].Food Res Int,2021,365:130495.
[11] PALOMO M,GUTIÉRREZ A M,PÉREZ-CONDE M C,et al.Se metallomics during lactic fermentation of Se-enriched yogurt[J].Food Chem,2014,164:371-379.
[12] SUN Y H,GAN Y,ZHANG L,et al.Isolation and identification of Monascus and evaluation of its selenium accumulation[J]. LWT-Food Sci Technol,2022,154:112887.
[13] EKUMAH J N,MA Y K,AKPABLI-TSIGBE N D,et al.Effect of selenium supplementation on yeast growth,fermentation efficiency,phytochemical and antioxidant activities of mulberry wine[J].LWT-Food Sci Technol,2021,146:111425.
[14] KWAW E,MA Y,TCHABO W,et al.Impact of ultrasonication and pulsed light treatments on phenolics concentration and antioxidant activities of lactic-acid-fermented mulberry juice[J]. LWT-Food Sci Technol,2018,92:61-66.
[15] CHAVES N,SANTIAGO A,ALÍAS J C.Quantification of the antioxidant activity of plant extracts:Analysis of sensitivity and hierarchization based on the method Used[J].Antioxidants,2020,9(76):1-14.
[16] YANG H,SU W,WANG L H,et al.Molecular structures of nonvolatile components in the Haihong fruit wine and their free radical scavenging effect[J].Food Chem,2021,353:129298.
[17] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2008.
[18] 刘彩婷,周鸿翔,王晓丹,等.八种商业酵母制备蓝莓苹果复合果酒的品质对比[J].中国酿造,2019,38(3):51-58.
[19] ZHOU N,LI D,WU S,et al.Acceleration effect of sodium selenite on yeast growth and fermentative capability[J]. J Gen Appl Microbiol,2015,61(1):27-30.
[20] KHUJIN M H,ZARE H.Isolation of indigenous selenium tolerant yeast and investigation of the relationship between growth and selenium biotransformation[J].Adv Pharm Bull,2020,10(1):146-149.
[21] KIELISZEK M,BLA ZEJAK S,BZDUCHA-WR′OBEL A,et al.Effect of selenium on growth and antioxidative system of yeast cells[J]. Mol Biol Rep,2019,46(2):1797-1808.
[22] 李华,王华,袁春龙.葡萄酒工艺学[M].北京:科学出版社,2007:76-77.
[23] 郑万明.蓝莓果酒制备工艺优化研究[D].哈尔滨:黑龙江大学,2018.
[24] 郭志刚.甘肃野生酵母菌株发酵特性评价及产地葡萄酒酿造研究[D].兰州:甘肃农业大学,2008.
[25] TCHABO W,MA Y,KWAW E,et al.Influence of fermentation parameters on phytochemical profile and volatile properties of mulberry(Morus nigra)wine[J].J I Brewing,2017,123(1):15-158.
[26] FAIRCHILD M D.The colors of wine[J]. Int J Wine Res,2018,10:13-31.
[27] ARRIZON J,GSCHAEDLER A.Increasing fermentation efficiency at high sugar concentrations by supplementing an additional source of nitrogen during the exponential phase of the tequila fermentation process[J].Can J Microbiol,2002,48(11):965-970.
[28] MINNAAR P P,DU PLESSIS H W,JOLLY N P,et al.Non-Saccharomyces yeast and lactic acid bacteria in Co-inoculated fermentations with two Saccharomyces cerevisiae yeast strains:A strategy to improve the phenolic content of Syrah wine[J].Food Chem X,2019,4,100070.
[29] MEDINA K,BOIDO E,DELLACASSA E,et al.Effects of non-Saccharomyces yeasts on color,anthocyanin and anthocyanin-derived pigments of tannat grapes during fermentation[J].Am J Enol Viticult,2017,69(2):1148-1156.
[30] MARQUEZ A,SERRATOSA M P,MERIDA J.Pyranoanthocyanin derived pigments in wine:Structure and formation during wine making[J].J Chem-NY,2013,1(15):1-15.