低聚糖(又名寡糖)是指由2~10个单糖(可以是同种或不同单糖)经糖苷键连接而成的聚合物[1],有直链和支链之分。因构成低聚糖的单糖种类不同及其结合位点和方式的差异,低聚糖种类繁多,且不同结构的低聚糖具有各种特殊功能[2]。功能性低聚糖在肠道中无法被分解,人体无法消化吸收,对肠道菌群具有益生作用[3-4]。
裙带菜(Undaria pinnatifida),又称“海芥菜”、“裙带”,属于褐藻门,褐子纲,海带目,翅藻科,是一种生长于潮水下可食用和药用的褐藻[5-7]。裙带菜主要化学成分是多糖和蛋白质,并含有色素、甾醇、挥发油、维生素、甘油酯、不饱和脂肪酸及钠、钾等矿物元素[8-10]。裙带菜中含有大量多糖,其孢子叶中多糖含量高达52.52%[11]。多糖作为裙带菜中活性成分之一,具有抗肿瘤、抗病毒、免疫调节、降血压血脂等生物活性[12-13]。目前,对裙带菜的研究主要集中在多糖及肽的活性方面[14-15]。COOPER R等[16]研究发现,裙带菜褐藻多糖可抑制疱疹病毒;THOMPSON K D等[17]研究发现,裙带菜褐藻多糖可阻止宿主细胞和病毒结合,具有抗病毒作用。而SATO M等[18]用酶水解裙带菜后,得到的水解多肽能有效降低血压。低聚糖的制备一般有两种方法:①是天然原料提取[13],缺点是得率低,难以保证产物的纯度;②是多糖降解,从原料中提取多糖后,再用超声波法、辐照改性法、氧化酸化法、酸酶结合法和酶法等降解多糖[14,19]。酶降解法可特异性地切断糖苷键,得到均一产物,且不会破坏底物的有效功能基团和寡糖的自身结构。与化学降解法和物理降解法相比,酶法反应条件温和、易控制,不需要加入大量的化学试剂,对环境污染少,降解速度快,是一种较为理想的降解方法[20]。
本研究采用酶解法制备裙带菜功能低聚糖,以其得率及对副干酪乳杆菌(Lactobacillus paracasei)TYM201的增殖效果为考察指标,筛选出最适水解酶,并以低聚糖得率为响应值,通过单因素试验和响应面试验优化低聚糖的制备工艺,以期为裙带菜低聚糖的功能产品开发与利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株干裙带菜:广西北海市云南路水产市场;副干酪乳杆菌(Lactobacillus paracasei)TYM201:本实验室保存。
1.1.2 化学试剂
葡萄糖、磷酸二氢钾、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰(均为分析纯):西陇科学股份有限公司;吐温80(化学纯)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠(均为分析纯):国药集团化学试剂有限公司;果胶酶(酶活50 000 U/mL)、纤维素酶(酶活700 U/mL)、植物水解酶(酶活5 086 U/mL):诺维信(中国)生物技术有限公司;蛋白胨(生化试剂):南京全隆生物技术有限公司;牛肉膏(生化试剂):杭州百思生物技术有限公司;酵母粉(生化试剂):南京茂捷微生物科技有限公司。
1.1.3 培养基
MRS液体培养基:蛋白胨10 g、牛肉膏5 g、酵母粉4 g、葡萄糖20 g、磷酸二氢钾2 g、柠檬酸三铵2 g、乙酸钠5 g、硫酸镁0.2 g、硫酸锰0.05 g、吐温80 1 g、去离子水1 L。调pH值为6.2±0.2。121 ℃高压灭菌15 min,备用。
1.2 仪器与设备
XT-A400多功能粉碎机:永康市红太阳机电有限公司;HH-4数显恒温水浴锅:上海博讯实业有限公司医疗设备厂;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;HJ-3恒温磁力搅拌器:常州国华电器有限公司;TF-FF-1冷冻干燥机:上海田枫实业有限公司;pHS-3E pH计:上海雷磁仪器厂;InfiniteM200PRO酶标仪:奥地利Tecan Austria GmbH有限公司;3-18R离心机:湖南恒诺仪器设备有限公司。
1.3 方法
1.3.1 裙带菜粗多糖的制备
干裙带菜粉碎至粉末,100目过滤,按照料液比1∶20(g∶mL)加入去离子水提取,80 ℃恒温水浴加热,立式搅拌器400 r/min搅拌浸提5 h,120目滤布趁热过滤,滤液在8 000 r/min离心15 min后,取上清液在真空(压力0 Pa)、恒温60 ℃条件下,以90 r/min的转速将溶液旋蒸呈黏稠状,冷却至室温后加入体积分数为95%乙醇,于4 ℃醇沉过夜。120目纱布过滤取沉淀,样品在压力1 Pa,温度-60 ℃下冷冻干燥后得到裙带菜粗多糖。
1.3.2 不同水解酶及其组合的筛选
称取10 mg裙带菜多糖粉末溶解于10 mL磷酸盐缓冲液(pH 4.5)中,加入0.2%(V/V)的酶,50 ℃恒温水浴酶解4 h后,沸水加热5 min灭酶,冷却,得裙带菜多糖酶解液,测定酶解液中的低聚糖含量。分别用单酶∶果胶酶、纤维素酶、植物水解酶及混合酶∶果胶酶-纤维素酶(1∶1)、果胶酶-植物水解酶(1∶1)、纤维素酶-植物水解酶(1∶1)、果胶酶-纤维素酶-植物水解酶(1∶1∶1)酶解裙带菜多糖,以低聚糖得率及低聚糖对副干酪乳杆菌TYM201增殖效果为评价指标,筛选出最佳的水解酶。
1.3.3 裙带菜低聚糖对副干酪乳杆菌TYM201增殖效果的影响
将副干酪乳杆菌TYM201以5%(V/V)的接种量接种至MRS液体培养基,37 ℃静置培养12 h,进行菌种活化。去除MRS培养基配方中的水和葡萄糖,加入上一步筛选出的酶所对应的酶解液,配制低聚糖培养基。按MRS液体培养基配方,将碳源换成裙带菜多糖和酶,配制多糖+酶培养基。同时,无碳源的MRS液体培养基作为空白对照。分别将副干酪乳杆菌TYM201以5%(V/V)的接种量接种至低聚糖培养基、多糖+酶培养基、空白对照培养基中,37 ℃培养24 h,每隔3 h测定波长600 nm处的吸光度值(OD600nm值),绘制在不同碳源条件下菌株的生长曲线,与空白对照培养基比较,得出对副干酪乳杆菌TYM201增殖效果最好的酶解液。
1.3.4 裙带菜功能低聚糖制备工艺优化
(1)单因素试验
以裙带菜低聚糖得率为评价指标,分别考察酶解pH(5.0、5.5、6.0、6.5、7.0)、酶解温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)、酶解时间(1 h、2 h、3 h、4 h、5 h)、加酶量(0.1%、0.3%、0.5%、0.7%、0.9%,V/V)对酶解效果的影响。
(2)响应面试验
①Plackett-Burman试验设计
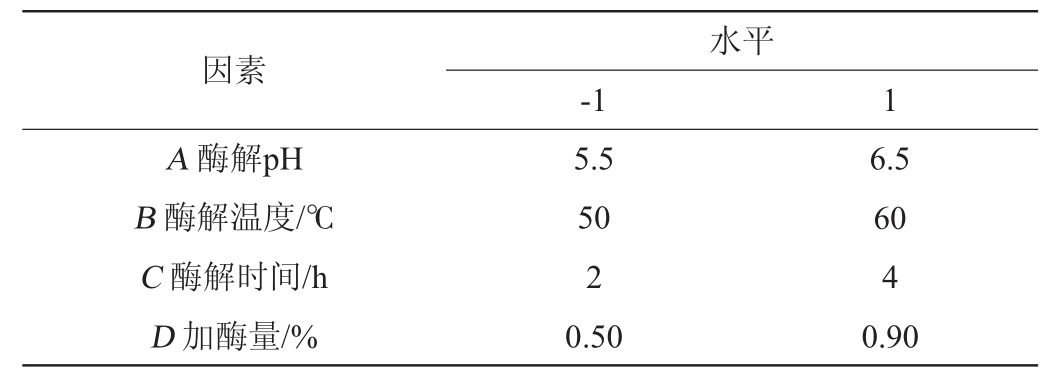
在单因素试验的基础上,以裙带菜低聚糖得率为响应值,选取酶解pH(A)、酶解温度(B)、酶解时间(C)、加酶量(D)4个因素为自变量,进行4因素2水平的Plackett-Burman(PB)试验设计(变量个数N=12),每个因素取高(1)和低(-1)两个水平,确定4个因素的影响因子大小。试验设计因素与水平见表1。
表1 PB试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design
②最陡爬坡试验设计
根据PB试验结果,选取对裙带菜低聚糖得率影响显著的3个因素酶解pH(A)、酶解温度(B)、酶解时间(C),以试验值的正负效应确定爬坡方向,根据各因素效应值确定最陡爬坡试验的适当步长。以最陡爬坡实验结果的最大响应值作为下一步Box-Behnken试验分析的中心点。
③Box-Behnken试验设计
在前述PB设计试验和最陡爬坡试验结果基础上,将最陡爬坡试验得出的最高响应值点作为中心点,固定加酶量为0.6%,以酶解pH(A)、酶解温度(B)、酶解时间(C)3个因素作为自变量,低聚糖得率(Y)为响应值,利用Design-Expert 11.1.0软件进行3因素3水平的响应面优化试验设计[21-23]。Box-Behnken试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design

1.3.5 分析检测
(1)生物量的测定
采用InfiniteM200PRO酶标仪测定波长600 nm处的吸光度值(OD600nm值)。
(2)低聚糖含量的测定
以低聚糖得率为评价指标评估酶解效果,低聚糖含量与还原糖含量呈正相关。采用DNS法测定还原糖含量[24-25],低聚糖得率的计算公式如下:
式中:T为裙带菜多糖酶解液的葡萄糖质量浓度,mg/mL;T0为裙带菜多糖溶液的葡萄糖质量浓度,mg/mL;D为多糖溶液质量浓度,mg/mL。
1.3.6 数据处理
每组试验重复3次,试验数据均以“平均值±标准差”表示。PB试验设计、最陡爬坡试验和Box-Behnken试验设计均由Design-Expert 11.1.0软件完成。通过Excel 2019进行数据处理,Design-Expert 11.1.0软件及Minitab 19.2020.1软件对数据进行单因素方差分析和t检验。当P<0.05时判定为显著差异,P<0.01时判定为极显著差异。
2 结果与分析
2.1 水解酶的筛选
2.1.1 不同水解酶及其组合对低聚糖得率的影响
不同水解酶及其组合酶解液中低聚糖得率结果见图1。由图1可知,混合酶的酶解效果整体优于单酶的酶解效果。混合酶酶解裙带菜多糖制备的低聚糖得率均>9%,其中,组合酶果胶酶-纤维素酶(1∶1)的低聚糖得率最高为(13.89±0.509)%,其次为组合酶果胶酶-植物水解酶、果胶酶-纤维素酶-植物水解酶(1∶1∶1)、纤维素酶-植物水解酶(1∶1),低聚糖得率分别为(13.48±0.151)%、(12.82±0.225)%、(10.02±0.635)%;单酶酶解制备的低聚糖得率较低,说明不同水解酶之间结合对酶解效果有相互促进作用。为得到酶解效率高且酶解液对副干酪乳杆菌TYM201增殖效果好的酶,选择果胶酶-纤维素酶(1∶1)、果胶酶-植物水解酶(1∶1)、纤维素酶-植物水解酶(1∶1)、果胶酶-纤维素酶-植物水解酶(1∶1∶1)进行下一步实验。
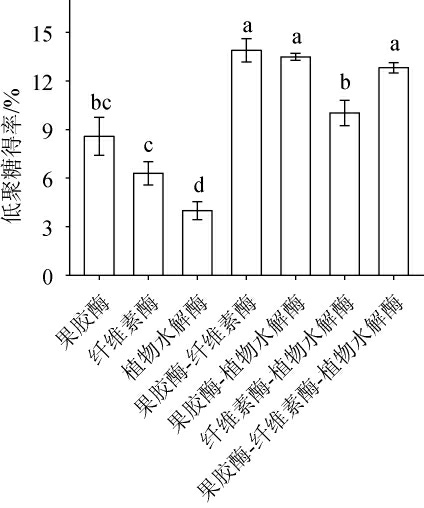
图1 不同酶及其组合的酶解液低聚糖得率
Fig.1 Oligosaccharide yield of enzymatic hydrolysate of different enzymes and their combinations
不同字母表示差异显著(P<0.05)。下同。
2.1.2 不同组合酶酶解液对副干酪乳杆菌TYM201增殖作用的影响
由图2a可知,在不同的培养基中,随着培养时间的延长,OD600nm值均呈升高趋势,当培养时间为24 h时,果胶酶-纤维素酶低聚糖培养基的OD600nm值最高,OD600nm值为0.182±0.006;多糖+果胶酶-纤维素酶培养基的OD600nm值为0.172±0.003;空白对照培养基的OD600nm值为0.141±0.005,且前两者培养基均显著高于空白培养基(P<0.01)。结果表明,果胶酶-纤维素酶酶解后的溶液对副干酪乳杆菌TYM201增殖效果较好。由图2b、图2c、图2d可知,当培养时间为24 h时,多糖+酶溶液培养基的OD600nm值均高于酶解液低聚糖培养基,但酶本身会对菌的生长产生明显影响[26]。综合考虑,选择果胶酶-纤维素酶作为本研究的实验用酶。

图2 不同酶组合的酶解液对副干酪乳杆菌TYM201增殖作用的影响
Fig.2 Effect of enzymatic hydrolysate with different enzyme combinations on the proliferation effect of Lactobacillus paracasei TYM201
2.2 单因素试验结果
2.2.1 酶解pH的确定
酶解pH对裙带菜低聚糖得率的影响见图3。由图3可知,随着酶解pH在5.0~6.0范围内的增加,裙带菜低聚糖得率呈上升趋势;当酶解pH为6.0时,低聚糖得率显著提高(P<0.05),达到最大值,为(11.31±0.28)%;酶解pH>6.0之后,低聚糖得率随之下降。其原因可能是,pH值过高或过低都会降低果胶-纤维素酶的酶活力,甚至使其失活[27]。因此,确定最适酶解pH值为6.0。
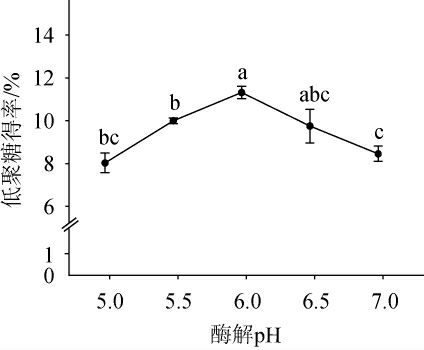
图3 酶解pH对裙带菜低聚糖得率的影响
Fig.3 Effect of enzymolysis pH on the yield of Undaria pinnatifida oligosaccharides
2.2.2 酶解温度的确定
酶解温度对裙带菜低聚糖得率的影响见图4。由图4可知,随着酶解温度在40~55 ℃范围内的增加,低聚糖得率逐渐增加;当酶解温度为55 ℃时,低聚糖得率达到最大值,为(11.25±0.05)%;酶解温度>55 ℃之后,低聚糖得率下降。其原因可能是,温度过高或过低都会使果胶-纤维素酶酶活力降低甚至失活[28]。因此,最适酶解温度为55 ℃。
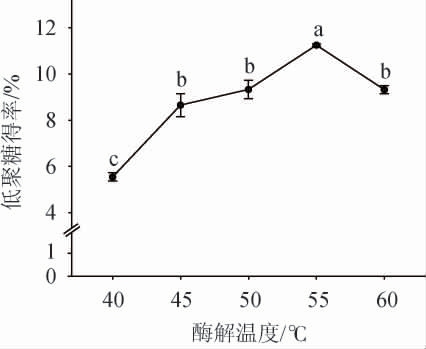
图4 酶解温度对裙带菜低聚糖得率的影响
Fig.4 Effect of enzymolysis temperature on the yield of Undaria pinnatifida oligosaccharides
2.2.3 酶解时间的确定
酶解时间对裙带菜低聚糖得率的影响见图5。由图5可知,随着酶解时间在1~3 h内的延长,低聚糖得率逐渐增加;当酶解时间为3 h时,低聚糖得率达到最大值,为(12.13±0.34)%;酶解时间>3 h之后,低聚糖得率呈下降趋势。其原因可能是,随着酶解反应时间增加,酶的活力逐渐下降和部分低聚糖发生水解,造成得率下降[29-30]。因此,确定最适的酶解时间为3 h。
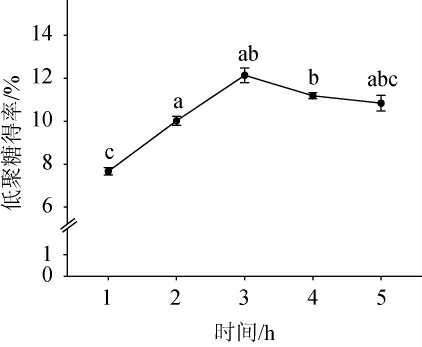
图5 酶解时间对裙带菜低聚糖得率的影响
Fig.5 Effect of enzymolysis time on the yield of Undaria pinnatifida oligosaccharides
2.2.4 加酶量的确定
加酶量对裙带菜低聚糖得率的影响见图6。由图6可知,随着加酶量在0.1%~0.7%范围内的增加,裙带菜低聚糖得率整体呈上升的趋势,其原因可能是,纤维素酶是由多种水解酶组成的复杂酶系,此时酶处于过量状态可以迅速酶解裙带菜多糖[31];当加酶量为0.7%时,低聚糖得率最高,为(11.29±0.19)%;加酶量>0.7%之后,低聚糖得率下降,其原因可能是,在低底物质量浓度情况下,酶分子过饱和,降低了酶解效率[29],从而导致低聚糖得率下降。因此,确定最适的加酶量为0.7%。
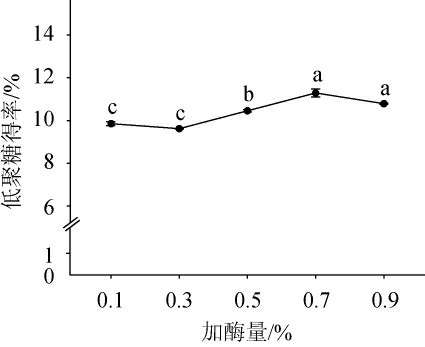
图6 加酶量对裙带菜低聚糖得率的影响
Fig.6 Effect of enzyme addition on the yield of Undaria pinnatifida oligosaccharides
2.3 裙带菜低聚糖制备工艺优化响应面试验分析
2.3.1 Plackett-Burman试验结果
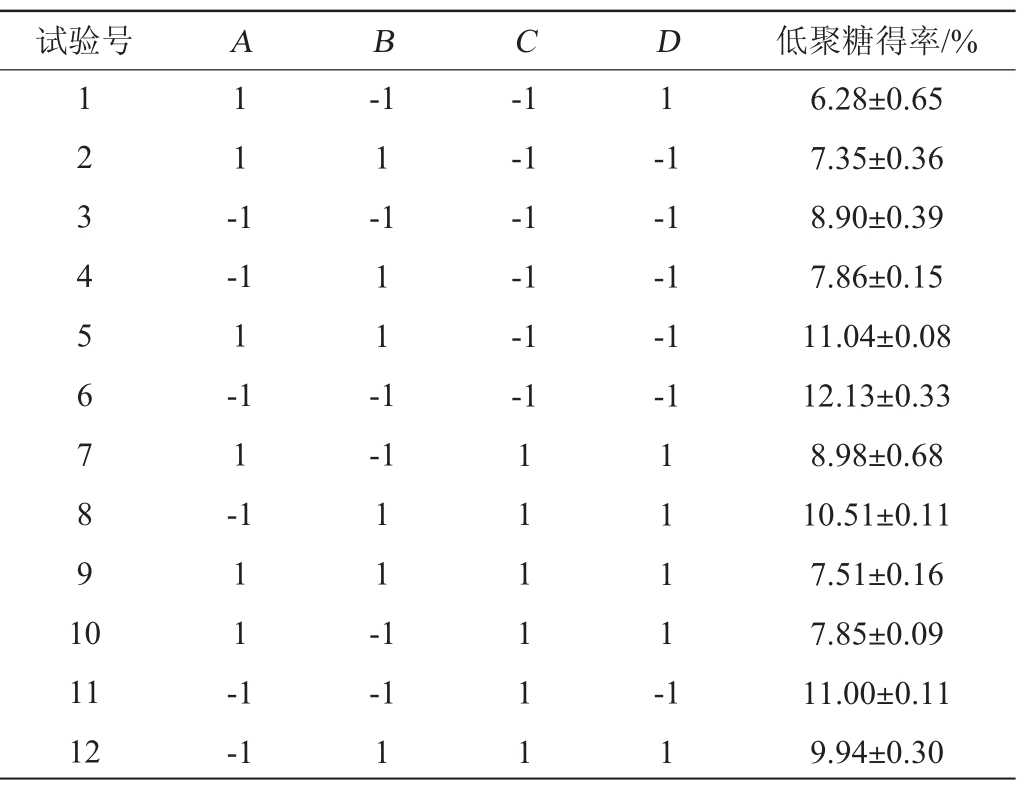
对影响低聚糖得率的酶解pH(A)、酶解温度(B)、酶解时间(C)、加酶量(D)4个因素进行Plackett-Burman试验设计,利用Design-Expert 11.1.0软件及Minitab 19.2020.1软件列出了12组PB试验设计方案,以低聚糖得率为响应值,试验结果见表3,对PB试验结果进行方差分析,结果见表4。
表3 裙带菜低聚糖制备工艺优化Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman experiments for preparation process optimization of Undaria pinnatifida oligosaccharides
由表4可知,模型的决定系数R2=0.870 3,调整决定系数R2adj=0.796 2,说明存在87.03%的试验数据可用该模型解释。酶解时间表现为正效应,加酶量、酶解温度、酶解pH为负效应。影响低聚糖得率的4个因素顺序为A(酶解pH)、C(酶解时间)、B(酶解温度)、D(加酶量),其中酶解pH(A)对低聚糖得率影响极显著(P<0.01)、酶解时间和酶解温度对低聚糖得率影响显著(P<0.05),而加酶量影响不显著(P>0.05)。因此,选择酶解pH、酶解温度、酶解时间这3个主要影响因素进行裙带菜功能低聚糖制备工艺优化。
表4 Plackett-Burman试验各因素水平、效应值及显著性分析Table 4 Level,effect value and significance analysis of each factor of Plackett-Burman experiments
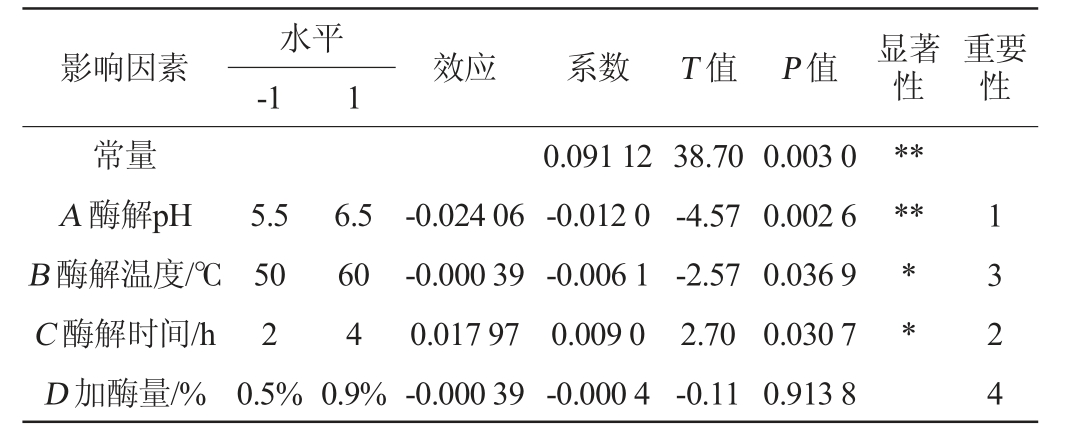
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。下同。
2.3.2 最陡爬坡试验
用Plackett-Burman试验筛选出的对低聚糖得率影响显著的3个因素设计最陡爬坡试验设计,根据因素的正、负效应确定最陡爬坡试验的变化方向,参照因素效应比例,确定变化步长,快速逼近最大响应区域。最陡爬坡试试验设计及结果见表5。
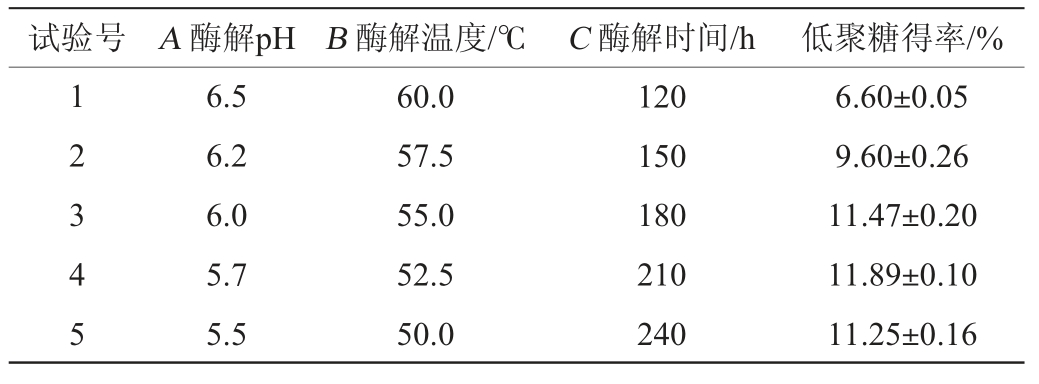
由表5可知,随着酶解pH、酶解温度和酶解时间的变化,低聚糖得率先增加后下降。当酶解pH、酶解温度和酶解时间分别为5.7、52.5 ℃、210 min时,低聚糖得率最高,以试验4的3个因子水平作为响应面试验的中心点,进行Box-Behnken试验优化。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest climbing experiments
2.3.3 Box-Behnken试验设计及结果
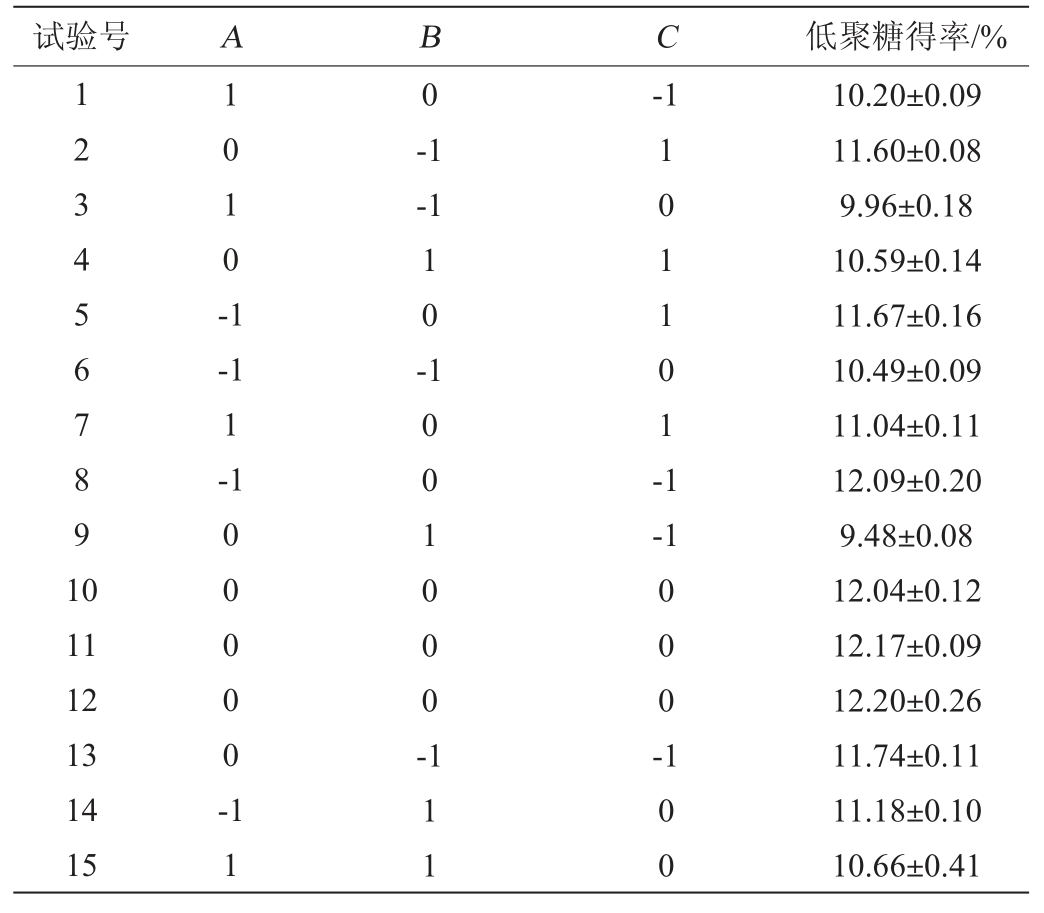
通过最陡爬坡试验得到了影响响应值的显著因素较优区域。固定加酶量为0.6%,以酶解pH(A)、酶解温度(B)和酶解时间(C)3个显著因素为自变量,以低聚糖得率为响应值,进行裙带菜低聚糖制备工艺优化Box-Behnken试验设计,Box-Behnken试验结果见表6。响应面模型构建序贯分析见表7,方差分析结果见表8。
表6 裙带菜低聚糖制备工艺优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments for preparation process optimization of Undaria pinnatifida oligosaccharides
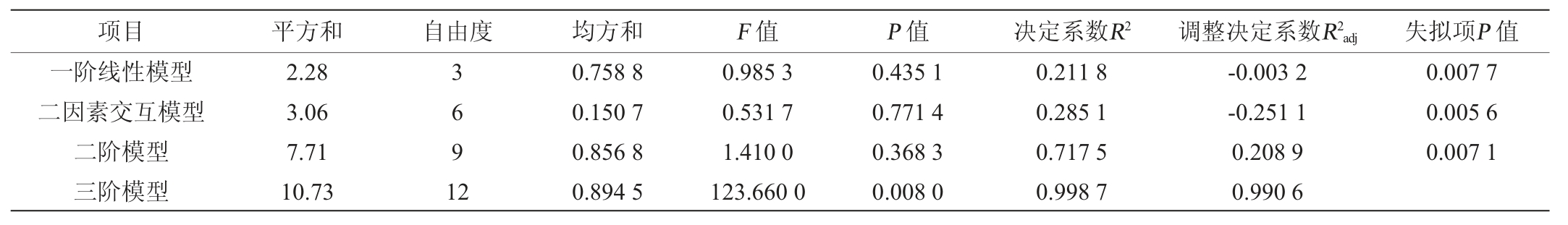
由表7可知,一阶线性模型、二因素交互模型和二阶模型均不显著(P>0.05),此三个模型的失拟项对结果极其显著(P<0.01),表明模型出现失误的概率比较大,不宜用于数据拟合,因此需要选用更高阶的模型[32]。三阶模型F值=123.66,P值=0.008 0<0.01,说明该三阶模型达到了极显著水平,且回归方程的多项式的次数越高,模型的拟合度越好[33],因此用三阶模型对本试验数据进行拟合。
表7 响应面模型构建的序贯分析
Table 7 Sequential analysis of response surface model construction
利用Design-Expert 11.1.0软件对表6的数据进行三阶方程拟合分析,以低聚糖得率(Y)为响应值,得到3个因素的三次多元回归方程如下:

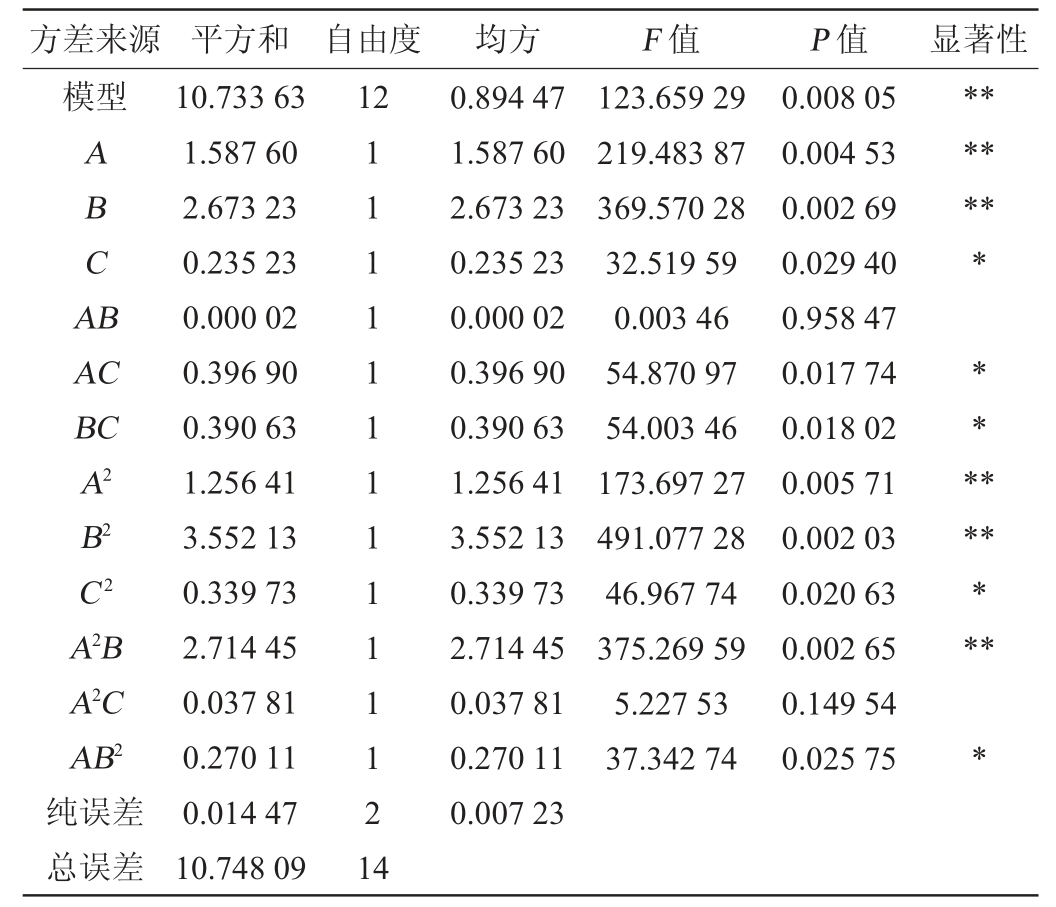
由表8可知,该三阶模型与试验拟合良好,能较好地反映酶解过程中3个因素与低聚糖得率(Y)之间的关系。模型的决定系数R2=0.998 7,调整决定系数R2adj=0.990 6,变异系数(coefficient of variation,CV)为0.763 41,说明在模型可以解释响应值(低聚糖得率)99.06%的变化,试验误差小,各因素与低聚糖得率之间有高度相关性,可对低聚糖得率进行准确预测及分析。由P值可知,一次项A、B,二次项A2、B2、交互项A2B对低聚糖得率的影响表现为极显著(P<0.01),反映了酶解pH和酶解温度对低聚糖得率影响极显著(P<0.01),且一次项C,二次项C 2,交互项AC、BC、AB2对低聚糖得率影响显著(P<0.05),其他项均不显著(P>0.05)。由F值可知,在影响裙带菜低聚糖得率的3个关键因素中,对结果影响顺序为B>A>C,即酶解温度>酶解pH>酶解时间。
表8 回归方程方差分析
Table 8 Variance analysis of regression equation
2.3.4 不同因素之间交互作用分析
根据响应面的坡度和等高线的形状可以看出每个因素对低聚糖得率影响的强弱及因素间相互作用的显著程度[34]。酶解pH、酶解温度和酶解时间对低聚糖得率影响的响应曲面及等高线见图7。由图7a可知,AB等高线平缓,说明两者交互作用对低聚糖得率影响不显著(P>0.05)[35];由图7b、图7c可知,AC和BC的等高线呈椭圆形,说明两者交互作用对低聚糖得率影响较大,达到显著效果(P<0.05)[36]。
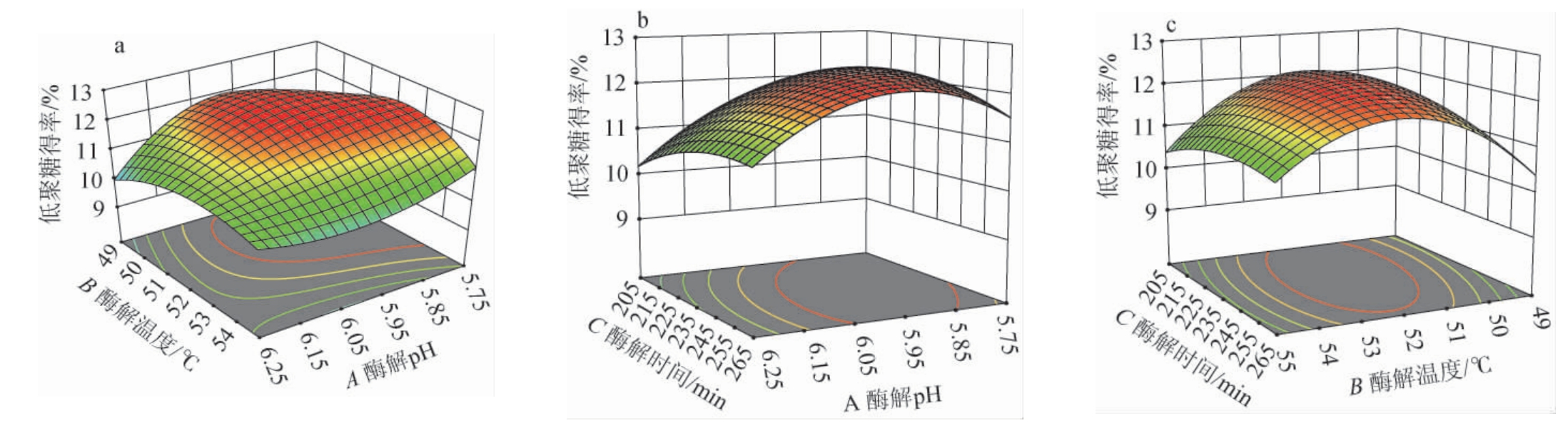
图7 各因素间交互作用对低聚糖得率影响的响应曲面及等高线
Fig.7 Response surface plots and contour lines of effect of interaction between each factor on the yield Undaria pinnatifida oligosaccharides
2.3.5 模型验证
借助Design-Expert 11.1.0软件对建立回归模型并进行分析,得出裙带菜功能低聚糖的最佳制备条件为酶解pH 5.925,酶解温度51.045 ℃、酶解时间236.808 min,低聚糖得率的预测值为12.391%。综合考虑实际操作情况,将裙带菜功能低聚糖制备的工艺参数修正为:酶解pH 5.9,酶解温度51 ℃,酶解时间237 min。在此最佳酶解条件下重复3次验证试验,得到裙带菜功能低聚糖的得率实际值为12.43%,预测值与实际值基本吻合。表明该模型可靠,可以用于裙带菜功能低聚糖制备工艺的预测。
3 结论
本研究以酶解法制备裙带菜功能低聚糖,结果表明,果胶酶-纤维素酶(1∶1)酶解效果最好,通过单因素试验及响应面试验,得到裙带菜功能低聚糖制备的最佳工艺参数为:酶解pH 5.9、酶解温度51 ℃、酶解时间237 min、加酶量0.6%。在此优化工艺条件下,制备裙带菜功能低聚糖的得率可以达到12.43%。该研究建立了酶解制备裙带菜功能低聚糖的工艺条件,对裙带菜功能低聚糖的研究与开发利用具有一定指导意义。
[1] IBRAHIM O O.Functional oligosaccharide: Chemicals structure,manufacturing,health benefits,applications and regulations[J]. J Food Chem Nanotechnol,2018,4(4):65-76.
[2] GALAN M C,BENITO-ALIFONSO D,WAT G M.Carbohydrate chemistry in drug discovery[J].Org Biomol Chem,2011,9(10):3598-3610.
[3] MANO M C R,NERI-NUMA I A,SILVA J B D,et al.Oligosaccharide biotechnology: an approach of prebiotic revolution on the industry[J].Appl Microbiol Biotechnol,2018,102(1):17-37.
[4] SINGH R D,BANERJEE J,ARORA A.Prebiotic potential of oligosaccharides:A focus on xylan derived oligosaccharides[J].Bioact Carbohydr Diet Fibre,2015,5(1):19-30.
[5] 苌钊.裙带菜的综合利用研究[D].青岛:中国海洋大学,2013.
[6] 叶贤英,朱丽军,陈瑶,等.裙带菜多糖对动脉粥样硬化并发非酒精性脂肪肝小鼠的保护作用[J].中药新药与临床药理,2021,32(8):1065-1072.
[7] 唐茹萌,焦文雅,桑亚新,等.裙带菜多糖体外和体内降血脂活性[J].食品科学,2022,43(1):142-149.
[8] 陈露,嵇晶,金佳颖,等.高效液相色谱-电感耦合等离子体质谱法测定海藻中5种砷形态[J].食品与发酵工业,2020,46(15):270-275.
[9] 张文竹,刘红兵,管华诗.裙带菜的化学成分及其生物活性研究进展[J].海洋科学,2009,33(4):72-75.
[10] PEREIRA L.Seaweeds as source of bioactive substances and skin care therapy-osmeceuticals,algotheraphy,and thalassotherapy[J].Cosmetics,2018,5(4):68.
[11] 石颖,侯和胜.裙带菜的生理作用及药用价值研究进展[J].食品与药品,2013,15(3):213-215.
[12] 闫程程,刘海梅,赵芹,等.裙带菜孢子叶的生物活性物质及其在食品中的应用[J].食品与发酵工业,2021,47(7):307-315.
[13] 董秀芳,李楠,韩冬,等.裙带菜孢子叶多糖的超声辅助提取工艺优化及其抗氧化活性研究[J].食品与机械,2015,31(4):162-166.
[14] 冯建岭,刘海燕,王丽丽,等.裙带菜蛋白的提取工艺研究[J].食品研究与开发,2016,37(19):51-54.
[15] 毕秋芸.裙带菜多肽的制备及其抗氧化活性的研究[J].中国调味品,2019,44(5):104-110.
[16] COOPER R,DRAGAR C,ELLIOT K,et al.GFS,a preparation of Tasmanian Undaria pinnatifida is associated with healing and inhibition of reactivation of herpes[J].BMC Complement Altern Med,2002,2:11.
[17] THOMPSON K D,DRAGAR C.Antiviral activity of Undaria pinnatifida against herpes simplex virus[J].Phytother Res,2004,18(7):551-555.
[18] SATO M,HOSOKAWA T,YAMAGUCHI T,et al.Angiotensin I-converting enzyme inhibitory peptides derived from wakame(Undaria pinnatifida)and their antihypertensive effect in spontaneously hypertensive rats[J].J Agr Food Chem,2002,50(21):6245-6252.
[19] 刘紫征.甘露低聚糖的酶法制备工艺及功能研究[D].武汉:华中农业大学,2016.
[20] 蒋越,姚子昂,陈丰嘉,等.藻酸盐寡糖制备工艺及生物活性研究进展[J].中国酿造,2018,37(8):19-23.
[21] 白卫东,沈棚,钱敏,等.响应面优化花生酸奶发酵工艺研究[J].中国乳品工业,2012,40(4):51-54.
[22] IMANDI S B,BANDARU V V R,SOMALANKA S R,et al.Application of statistical experimental designs for the optimization of medium constituents for the production of citric acid from pineapple waste[J].Bioresource Technol,2008,99(10):4445-4450.
[23] XU C P,KIM S W,HWANG H J,et al.Application of statistically based experimental designs for the optimization of exo-polysaccharide production by Cordyceps militaris NG3[J].Biotechnol Appl Biochem,2002,36(2):127-131.
[24] 王天龙,仇宏伟,陈海华,等.3,5-二硝基水杨酸法测定果胶酶活力的条件研究[J].食品与机械,2008,24(3):96-99.
[25] 高文军,李卫红,王喜明,等.3,5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量[J].中国药业,2020,29(9):113-116.
[26] 李艳丽,许少春,柳永,等.低聚木糖的制备及其对益生菌体外增殖的作用[J].浙江大学学报(农业与生命科学版),2011,37(3):245-251.
[27] 陈淑琼,李晓月,吴晨烁,等.酶解制备褐藻寡糖工艺优化及活性研究[J].食品研究与开发,2019,40(13):51-56.
[28] MIYAZAWA T,OHTSU S,FUNAZUKURI T.Hydrothermal degradation of polysaccharides in a semi-batch reactor:product distribution as a function of severity parameter[J].J Mater Sci,2008,43:2447-2451.
[29] 杜涓,安晓萍,刘娜,等.酶解对玉米芯多糖结构及体外抗氧化活性的影响[J].饲料工业,2021,42(21):45-50.
[30] 王双毅,谢玮,崔少宁,等.响应面分析法优化黑松松花粉多糖提取工艺[J].粮食与油脂,2021,34(11):113-116.
[31] 刘艳兰,刘爽,林本平,等.米糠膳食纤维纤维素酶水解工艺优化及其功能特性研究[J].食品与机械,2021,37(11):6-11.
[32] 陈文超,张锦华,叶峥,等.响应面法优化超声波辅助提取苹果渣低聚糖的工艺[J].食品工业科技,2017,38(12):277-281.
[33] 肖怀秋,李玉珍,林亲录,等.BoX-Behnken响应面优化冷榨花生粕酶解制备花生肽工艺[J].中国粮油学报,2014,29(10):106-111.
[34] 唐国旺,刘嘉露,郑承纲,等.响应面法优化中高温低浓度香豆胶压裂液体系[J].油田化学,2017,34(1):29-32.
[35] 陈建福,林洵,陈仲巍.响应面法优化超声辅助提取黄瓜多酚工艺及其对酪氨酸酶的抑制作用[J].中国瓜菜,2021,34(12):16-22.
[36] 范金波,蔡茜彤,冯叙桥,等.咖啡酸体外抗氧化活性的研究[J].中国食品学报,2015,15(3):65-73.