硒是人体和动物所必需的微量元素,也是生物体中硒蛋白质和抗氧化物酶的重要组成成分[1-2]。研究发现,硒在人体抗氧化、调节免疫、预防心血管疾病、抗病毒、抗衰老、抗癌等方面均具有重要作用[3]。我国属于严重缺硒国家,人体硒摄入量明显低于卫生组织推荐的最低的摄入量[4]。已知硒的存在主要包含有机硒和无机硒两种形态,无机硒一般多指亚硒酸钠和硒酸钠,不易被人体吸收,且有较大的毒性,不适合人体和动物食用。有机硒主要包括以硒蛋白、含硒氨基酸为代表的生物合成硒类和以硒醚、二硒醚、有机硒杂环化合物等为代表的化学合成硒类,与无机硒相比,有机硒具有生物利用度高,生物活性强,毒副作用小等特点[5]。
硒对微生物同样具有一定的毒副作用,微生物则通过吸收环境中的无机硒并合成有机硒从而降低其毒性,同时也因为微生物硒的低毒易吸收是理想的硒源补充剂。白酒酿造过程是一种自然接种、多菌种的复合发酵过程,酿造过程中微生物可以把无机硒转化为硒蛋白、硒多糖等有机硒从而降低其毒性[6]。
关于硒对白酒就酒醅菌群的影响,国内暂无相关研究。目前在硒和白酒相互领域的研究方面,主要是通过富硒原料和富硒微生物发酵应用来实现[7]。但李勤等[8]研究发现,当硒质量浓度超过一定范围(>5 mg/L)会抑制根霉和酵母的生长,同样细菌的生长也受硒质量浓度的影响,一定的硒质量浓度对于细胞的正常生长及其生物活性至关重要,而当硒质量浓度>10 mg/L时,就主要表现为毒性作用[9]。
本研究以二氢杨梅素(dihydromyricetin-selenium,DMS)硒化合物作为二硒醚类的有机硒代表,以亚硒酸钠作为无机硒代表,通过对特定含量(5 mg/kg)的不同形态硒元素对白酒酒醅菌群结构的影响进行研究,初步评价外源硒的添加对白酒酒醅微生物的影响,为后续研究提供参考。
1 材料与方法
1.1 材料与试剂
二氢杨梅素硒(DMS):上海爱启医药技术有限公司;亚硒酸钠:山东西亚化学工业有限公司;酒醅:从浓香型白酒实验车间获取。
MoBio 强力土壤提取试剂盒:德国QIAGEN公司;聚合酶链式反应(polymerase chain reaction,PCR)2×预混液:南京诺唯赞生物科技有限公司;Agencourt AMPure XP核酸纯化试剂盒:美国Beckman Coulter公司;Ultra II 脱氧核糖核酸(deoxyribonucleic acid,DNA)文库制备试剂盒:美国NEB公司;文库定量试剂盒:美国KAPA公司;MiSeq Reagent Kit v3基因测序试剂盒:美国Illumina公司。
1.2 仪器与设备
3141型三气培养箱、5906型超低温冷冻冰箱、ABI 9700 PCR仪、ABI StepOnePlus实时荧光定量PCR系统:美国ThermoFisher科技公司;LabChip GX Touch HT微流控毛细管电泳系统:美国PerkinElmer公司;2100型生物分析仪:安捷伦科技有限公司;MiSeq高通量二代测序仪:美国Illumina公司。
1.3 方法
1.3.1 酒醅发酵及取样方法
从浓香型生产车间取入池前酒醅,分为12份,每份(800±10)g:其中2份酒醅未做任何处理作为空白对照,标记为CK1、CK2;5份酒醅均匀喷洒有机硒溶液使硒元素最终含量为5 mg/kg[8],标记为Or_Se1、Or_Se2、Or_Se3、Or_Se4和Or_Se5;5份酒醅均匀喷洒无机硒(亚硒酸钠)溶液使硒元素最终含量为5 mg/kg,标记为In_Se1、In_Se2、In_Se3、In_Se4和In_Se5;分别装在1.5 L瓶口设有发酵栓的玻璃瓶中,然后于培养箱中30 ℃恒温进行封闭发酵20 d,发酵结束后,去除瓶中上层1/3的酒醅,其余酒醅混合后进行取样,-80 ℃保存。
1.3.2 酒醅微生物多样性检测
将酒醅样品在干冰保护下送于北京奥维森基因科技有限公司,提取酒醅样品的总基因组脱氧核糖核酸(DNA),确定合格后,以其为模板进行细菌和真菌PCR扩增,其中细菌扩增16S rRNA基因的V3-V4区,真菌扩增ITS rDNA的ITS2区,细菌PCR扩增体系及参数参考文献[10],真菌PCR扩增体系和扩增条件参考文献[11]。使用生物分析仪检测PCR扩增产物,并用Agencourt AMPure XP核酸纯化试剂盒纯化。利用纯化后的PCR产物构建微生物多样性测序文库,确定DNA文库合格,采用Illumina Miseq PE300高通量测序平台进行Paired-end测序。
1.3.3 数据处理与统计学分析
下机数据经过QIIME1(v1.8.0)[12]软件根据Barcode序列拆分样本,使用Pear(v0.9.6)[13]软件对数据进行过滤、拼接;然后使用Vsearch(v2.7.1)[14]软件去除长度<120 bp的序列,并根据Unite数据库用uchime方法[15-16]比对去除嵌合体序列。使用Vsearch(v2.7.1)软件uparse算法对优质序列按照相似度97%进行操作分类单元(operational taxonomic units,OTU)聚类。与Unite数据库使用基本局部比对搜索工具(basic local alignment search tool,BLAST)算法进行比对,对OTU进行注释。再利用QIIME1(v1.8.0)软件进行α多样性指数分析(包括Shannon和Chao1等指数)。基于物种注释及相对丰度结果,使用软件R(v3.6.0)进行物种组成柱状图分析。使用QIIME1(v1.8.0)计算beta多样性距离矩阵,使用R软件对Unweighted的UniFrac距离矩阵[17]进行非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析(R3.3.2),并对丰度靠前属进行聚类分析并绘制热图。柱状图由Origin2018完成,差异显著性分析通过SPSS 25.0方差分析(analysis of variance,ANOVA)实现。
2 结果与分析
2.1 酒醅微生物菌群的α-多样性
Chao1指数和Shannon指数分别用于评估样品中微生物的丰度与其群落多样性,分析外源添加不同形态硒元素酒醅样品的细菌和真菌α-多样性,结果见表1。
表1 酒醅微生物菌群的α多样性
Table 1 Alpha-diversity of microbial flora in fermented grains
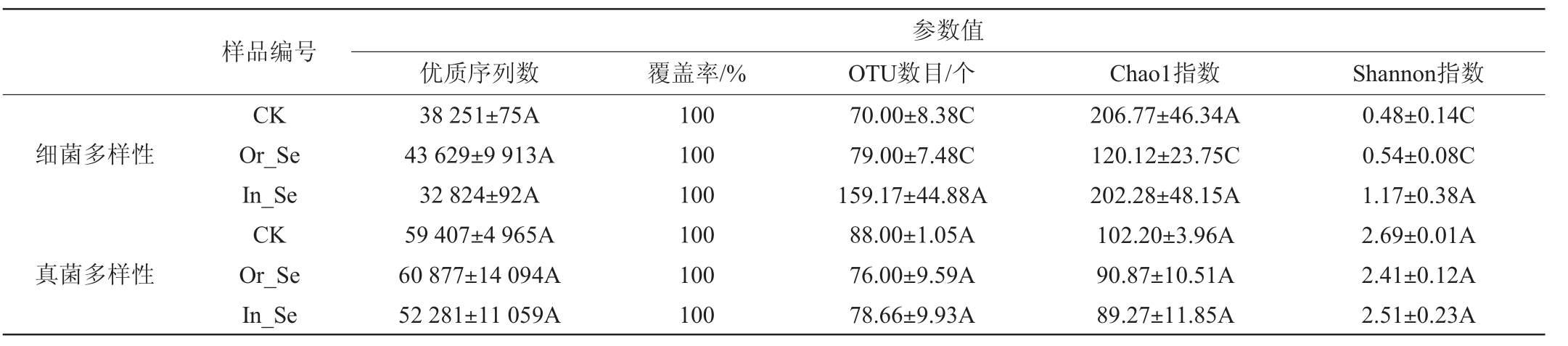
注:同列不同字母表示差异显著(P<0.05)。
由表1可知,酒醅样品细菌和真菌测序覆盖率均为100%,说明测序结果能完整反映酒醅的微生物群落组成信息。细菌α-多样性方面,与CK相比,Or_Se酒醅样中OTUs数目和Shannon指数略有升高,但不显著(P>0.05),Chao1指数则显著降低(P<0.05);而In_Se酒醅样中OTUs数目和Shannon指数均显著提高(P<0.05),Chao1指数则无明显变化。真菌α-多样性结果表明,与CK相比,Or_Se和In_Se酒醅样中的OTUs数目、Chao1指数和Shannon指数均略有降低,但无显著差异(P>0.05),与已知在硒质量浓度≥5 mg/L时对根霉和酵母等真菌均具有抑制作用,结论基本一致[8]。表明当硒含量为5 mg/kg时,不管是有机硒还是无机硒均对酒醅发酵过程中真菌数量、多样性和丰富度有一定的抑制,但抑制程度不明显;而对细菌多样性和数量则有促进作用,尤其是无机硒的添加对细菌促进作用明显。这与樊俊等[18]研究外源添加5 mg/kg的无机硒对土壤细菌和真菌数量的增加均有促进作用,略有不同。
2.2 酒醅微生物菌群的β-多样性分析结果
2.2.1 优势菌门组成
添加不同形态硒元素的酒醅中基于门水平的细菌及真菌群落结构见图1。
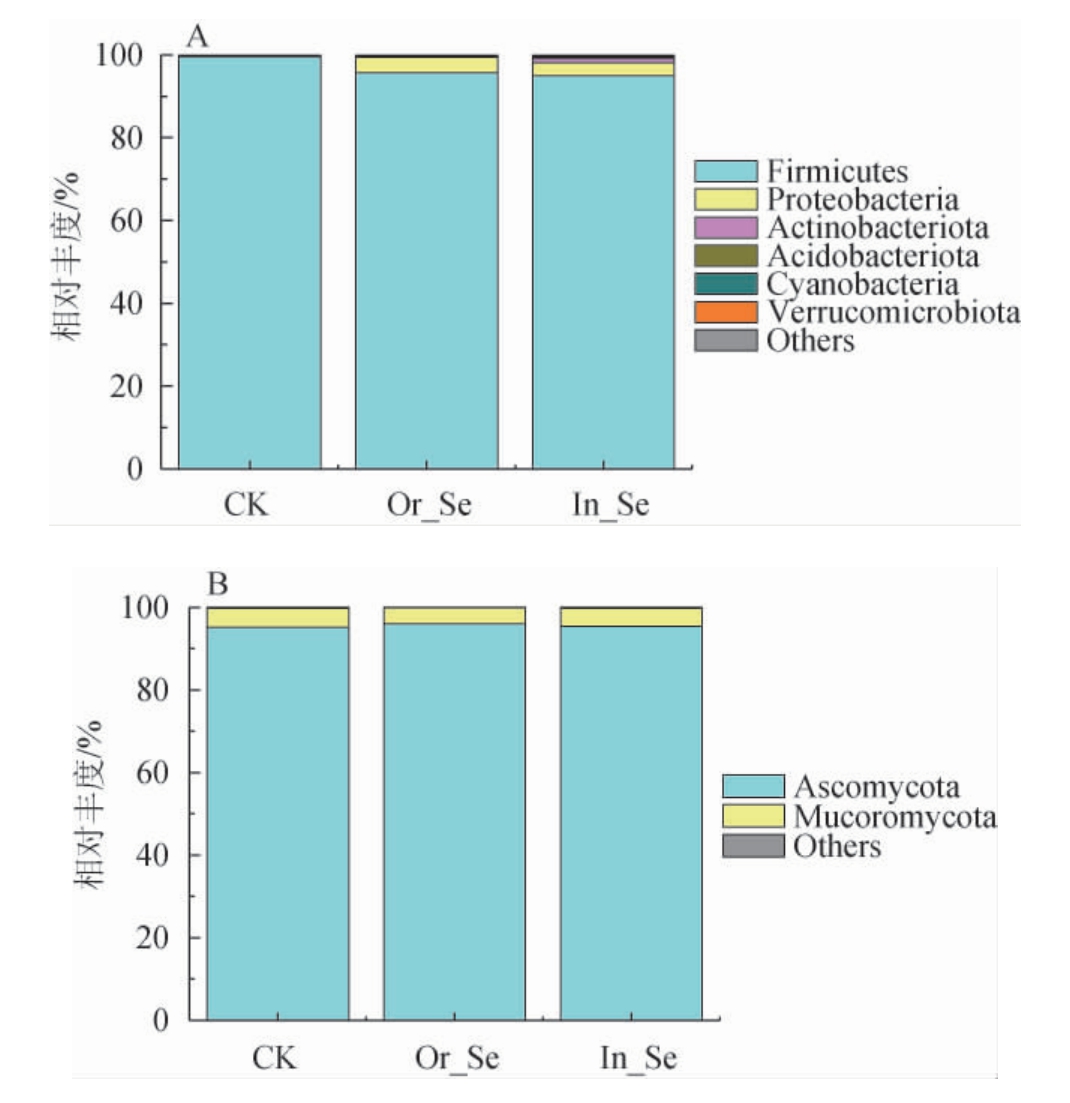
图1 基于门水平添加不同形态硒元素的酒醅中的细菌(A)及真菌(B)群落结构
Fig.1 Community structure of bacteria (A) and fungi (B) in fermented grains with different forms of selenium addition based on phylum level
由图1A可知,酒醅样品中存在6个细菌门,其中相对丰度>1%的优势菌门有3个,包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),均对硒具有还原作用[19]。酒醅样CK、Or_Se和In_Se中,均是厚壁菌门为绝对优势菌门(分别占99.55%、95.69%和95.00%),与胡晓龙等[20]研究发现酒醅发酵15~60 d厚壁菌门为唯一优势菌门结论一致;变形菌门(Proteobacteria)和放线菌门(Actinobacteria)在Or_Se和In_Se酒醅样中转为优势菌门(相对丰度>1%)。说明外源添加有机硒或无机硒利于酒醅发酵过程中Proteobacteria和Actinobacteria丰度的积累。
由图1B可知,酒醅样CK、Or_Se和In_Se中存在2个真菌门,分别为子囊菌门(Ascomycota)和毛霉菌门(Mucoromycota),其中子囊菌门为绝对优势菌门(分别占95.25%、95.99%和95.42%),其次是毛霉菌门(分别占4.55%、3.86%和4.34%),这与已知浓香型出池酒醅以及富硒矿区土壤中均是以子囊菌门为优势真菌结论一致[21-22]。酒醅样CK、Or_Se和In_Se中子囊菌门和毛霉菌门两真菌门相对丰度基本一致,说明外源添加有机硒或无机硒对酒醅发酵过程中真菌门组成无影响,与表2结论基本一致。
2.2.2 优势菌属组成
添加不同形态硒元素的酒醅中基于属水平的细菌及真菌群落结构组成见图2。
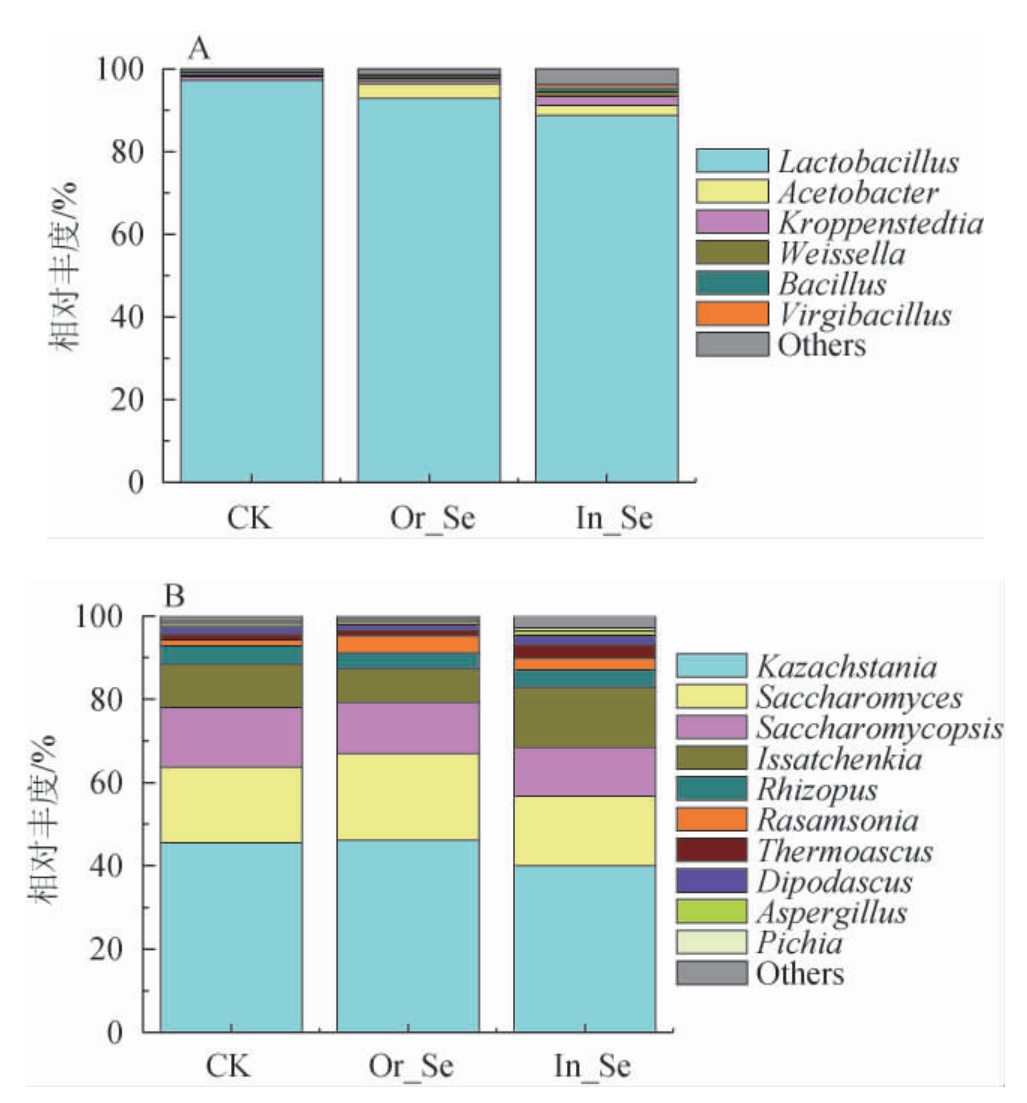
图2 基于属水平添加不同形态硒元素的酒醅中细菌(A)及真菌(B)群落结构
Fig.2 Community structure of bacteria (A) and fungi (B) in fermented grains with different forms of selenium addition based on genus level
由图2A可知,共得到6个主要细菌属,其中相对丰度>1%的优势属有4个,包括乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、克罗彭斯特菌属(Kroppenstedtia)和魏斯氏菌属(Weissella)。CK、Or_Se和In_Se酒醅样中,均是乳杆菌属(Lactobacillus)为绝对优势菌属(97.19%、92.86%和88.81%),其次是醋杆菌属(0.10%、3.53%和2.43%)、克罗彭斯特菌属(0.80%、0.77%和2.12%)和魏斯氏菌属(0.37%、0.54%和1.15%)。与CK酒醅样相比,加硒酒醅样中的乳杆菌属相对丰度明显降低,这与已有研究[23-24]在一定硒浓度条件下不具有富硒功能的乳杆菌生长会受到抑制,结论一致。而加硒酒醅样中的醋杆菌属相对丰度则明显增加,可能与醋杆菌属的硒耐受性较高有关[25];此外加无机硒酒醅样中克罗彭斯特菌属和魏斯氏菌属的相对丰度也明显增加。推测外源添加有机硒或无机硒由于降低了酒醅发酵过程乳杆菌属的优势地位,促进了其他菌属的生长,进而增加了物种多样性。
由图2B可知,共得到10个真菌属,其中在酒醅样CK、Or_Se和In_Se中丰度占比前4的优势属均为酵母菌类,包括Kazachstania属、酿酒酵母属(Saccharomyces)、覆膜酵母属(Saccharomycopsis)和伊萨酵母属(Issatchenkia),总占比分别为88.42%、87.38%和82.84%。然后是霉菌类,包括根霉属(Rhizopus)、Rasamsonia属、嗜热子囊菌属(Thermoascus)、双足囊菌属(Dipodascus)和曲霉属(Aspergillus),总占比分别为9.75%、11.17%和13.70%。各酵母菌属与各霉菌属在酒醅样CK、Or_Se和In_Se中的丰度占比基本一致,说明添加有机硒或无机硒对酒醅发酵过程中真菌属的组成无明显影响,与表1和图1B结论一致。
2.3 不同形态硒元素对酒醅菌群影响比较
为了说明外源添加不同形态硒元素的酒醅发酵过程中物种组成的相似性情况,对酒醅样CK、Or_Se和In_Se中细菌及真菌的OTU进行韦恩图绘制,结果见图3。由图3可知,在OTUs组成上,细菌群落中分别得到1、14和112个特有OTU,共有OTU数为86个(图3A);真菌群落分别得到2、13和19个特有OTU,共有OTU数为91个(图3B)。除酒醅样CK外,酒醅样Or_Se和In_Se中细菌种类多于真菌种类,尤其是酒醅样In_Se,说明外源添加无机硒利于促进酒醅发酵过程中细菌种类的提高,与表1结论一致。

图3 基于OTU添加不同形态硒元素的酒醅中细菌(A)及真菌(B)韦恩图
Fig.3 Venn diagrams of bacteria (A) and fungi (B) in fermented grains with different forms of selenium addition based on OTU
基于属水平,对12个酒醅样本的细菌和真菌菌群分别进行非度量多维尺度(NMDS)聚类分析,结果见图4。椭圆代表本组(同颜色)数据的95%置信水平,两图的胁强系数(stress index)均<0.1,表示数据拟合较好。图中酒醅样本之间的距离代表了酒醅菌群之间的差异程度,距离越近,样本菌群组成越相似。由图4可知,在细菌(图4A)和真菌(图4B)的NMDS图上,所有酒醅样距离均较近,说明各酒醅样细菌及真菌群落组成相似。
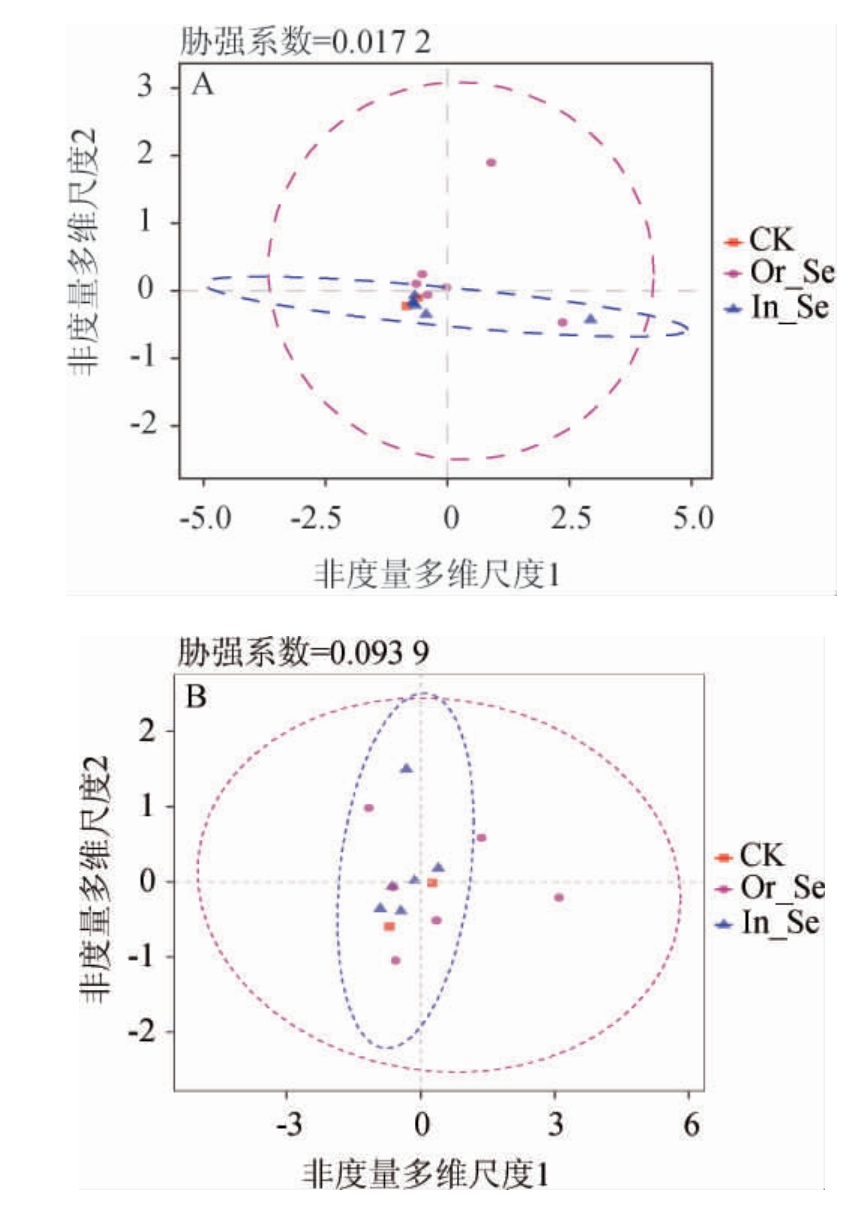
图4 基于属水平添加不同形态的硒元素的酒醅中细菌(A)及真菌(B)的非度量多维尺度分析结果
Fig.4 Non-metric multidimensional scaling analysis results of bacteria(A)and fungi(B)in fermented grains with different forms of selenium addition based on genus level
基于属水平,进一步比较酒醅样CK、Or_Se和In_Se群落组成的相似性和差异性,根据酒醅样品属水平的物种注释和丰度信息,选取相对丰度>0.5%优势菌属进行差异聚类分析,得到聚类热图,结果见图5。
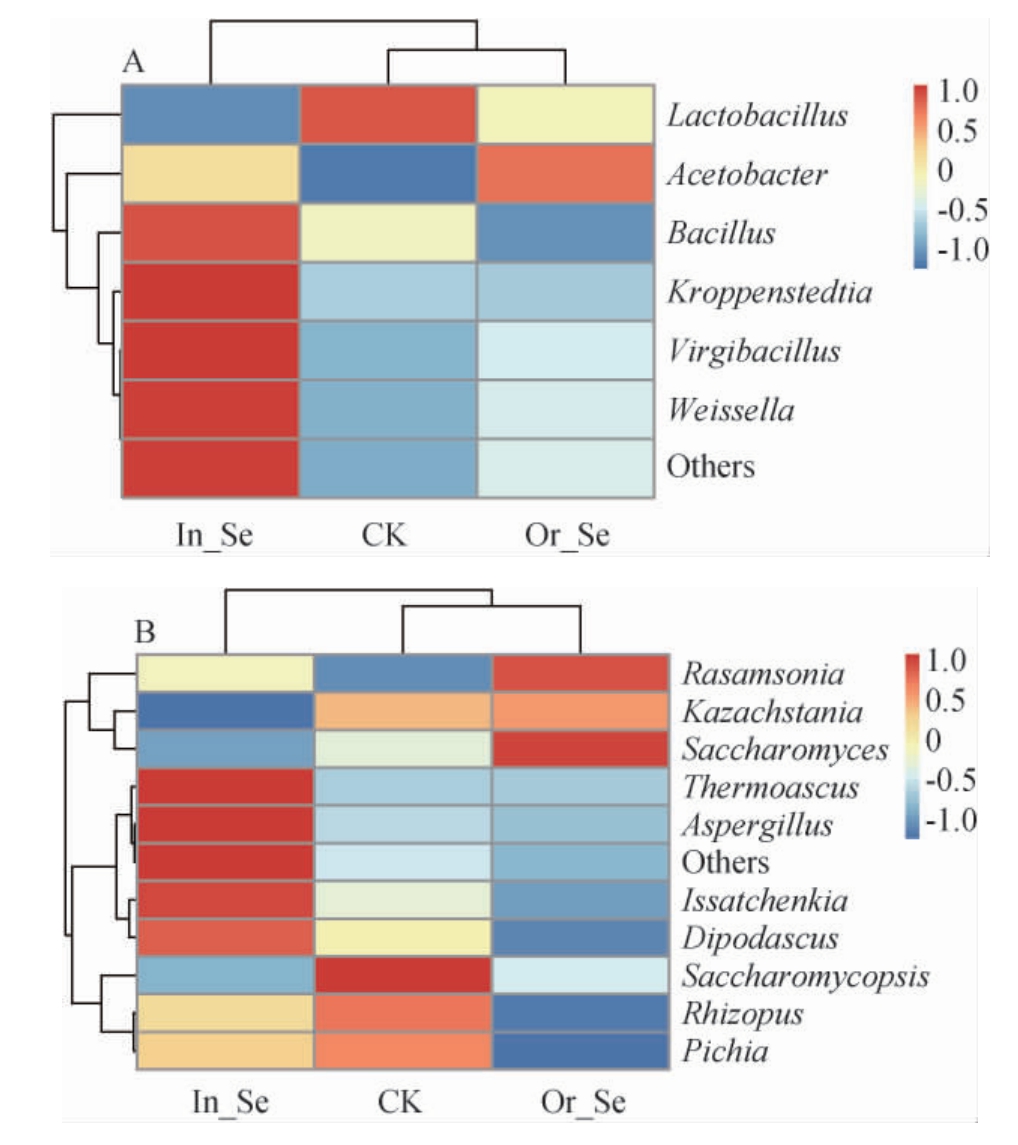
图5 基于属水平细菌(A)及真菌(B)群落物种相对丰度聚类热图
Fig.5 Clustering heat map of relative abundance of bacterial (A)and fungal (B) communities based on genus level
由图5A可知,酒醅样CK和Or_Se聚类在一起,而酒醅样In_Se单独分开,说明酒醅样CK和Or_Se在细菌属组成上更接近,且与酒醅样In_Se差异明显。酒醅样CK中优势细菌属乳杆菌属(Lactobacillus)相对偏高,酒醅样Or_Se的优势细菌属醋杆菌属相对偏高,酒醅样In_Se的优势细菌属为芽孢杆菌属、克罗彭斯特菌属、枝芽孢杆菌属(Virgibacillus)和魏斯氏菌属(Weissella)相对偏高。
由图5B可知,与图5A结果一致,酒醅样CK和Or_Se聚类在一起,而酒醅样In_Se单独分开,说明酒醅样CK和Or_Se在真菌属组成上也更接近,且与酒醅样In_Se差异明显。在酒醅样CK、Or_Se和In_Se中的组成聚类分析结果表明,三组样品在优势真菌属上差异明显,Rasamsonia、Kazachstania和酵母属在酒醅样Or_Se中相对丰度偏高,嗜热子囊菌属、曲霉属、伊萨酵母属和双足囊菌属(Dipodascus)在酒醅样In_Se中相对丰度偏高;覆膜酵母属、根霉属(Rhizopus)和毕赤酵母属(Pichia)在酒醅样CK中相对丰度偏高。
白酒酒醅细菌和真菌菌属群落结构上差异不大,但各类菌属在不同样品中相对丰度都存在一定的差异,样品CK和Or_Se细菌和真菌群落有较高的相似度,但其第一大优势菌属发生了演替,CK中的细菌第一大优势菌属乳酸杆菌属,在Or_Se中演替为醋杆菌,CK中的真菌第一大优势菌属覆膜酵母属,在Or_Se中演替为Rasamsonia,而酒醅样In_Se区别于其它酒醅样品,In_Se中第一大优势细菌芽孢杆菌属和真菌嗜热子囊菌属在CK和Or_Se中均不占第一大优势,说明外源添加有机和无机硒都导致酒醅微生物群落发生了演替,且添加无机硒造成的酒醅微生物群落演替更明显。
3 结论
本研究通过高通量测序技术分析了外源添加5 mg/kg有机和无机硒对发酵酒醅中微生物群落多样性及优势菌分布的影响。研究结果表明,外源硒的添加对酒醅中细菌和真菌微生物多样性均产生了一定的影响。样品α-多样性结果表明,外源硒的添加对酒醅中细菌群落影响较大;样品β-多样性结果表明,外源硒的添加会导致酒醅细菌和真菌微生物群落发生演替,且造成的细菌微生物群落演替更明显;样品NMDS聚类和微生物菌群热图聚类结果表明,添加无机硒造成的酒醅微生物群落演替更明显。综上,白酒酒醅细菌菌群更易受外源硒的影响发生群落演替,且白酒酒醅微生物多能利用无机硒促进微生物群落发生演替,本文为后续白酒富硒微生物的研究提供了研究方向和理论支撑。
[1] RAYMAN M P.The importance of selenium to human health[J].Lancet,2013:233-241.
[2] ZHANG J,SPALLHOLZ J E.Toxicity of selenium compounds and nanoselenium particles[C].Determination of noncancer chronic reference exposure levels batch 2B,2011.
[3] 黄冰霞,支添添,赵志刚,等.硒元素与人类健康[J].宜春学院学报,2019,41(9):95-101.
[4] 潘芸芸,姜竹茂,艾春梅,等.富硒乳制品的生产研发进展及前景分析[J].中国乳业,2020(8):89-92.
[5] 纪盛滨.新型有机硒的设计,合成及抗肿瘤作用机制研究[D].广州:暨南大学,2015.
[6] 杨善岩,李海龙,狄志鸿.硒元素生理功能及微生物富硒发酵研究现状[J].食品工业,2013(6):167-170.
[7] 刘军,张平.富硒健康白酒的研制[J].酿酒科技,2012(3):79-80,84.
[8] 李勤,谌永前,徐道贵,等.硒对根霉和酵母菌生长的影响[J].酿酒科技,2009(11):40-41,45.
[9] 刘昊,张宇靖,李婧祎,等.细菌富硒代谢及生物活性的研究进展[J].北京联合大学学报,2020,34(4):71-78.
[10] 王艳丽,张会敏,孟雅静,等.基于16S rDNA V4与V3-V4可变区高通量测序对浓香型白酒窖泥菌群组成的比较分析[J].现代食品科技,2020,36(6):147-154.
[11] 张会敏,孟雅静,王艳丽,等.新老窖池黄水的差异性及静置培养对其影响[J].食品科学,2020,41(2):215-222.
[12] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J]. Nat Methods,2010,7(5):335-336.
[13] ZHANG J,KOBERT K,FLOURI T,et al.PEAR:a fast and accurate Illumina Paired-End reAd mergeR[J].Bioinformatics,2014,30(5):614-620.
[14]ROGNES T,FLOURI T,NICHOLS B,et al.VSEARCH:a versatile open source tool for metagenomics[J].Peer J,2016,4:e2584.
[15] EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[16] KNIGHT R.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194.
[17] LOZUPONE C,KNIGHT R.UniFrac: a new phylogenetic method for comparing microbial communities[J]. Appl Environ Microbiol,2005,71(12):8228-8235.
[18] 樊俊,王瑞,胡红青,等.不同价态外源硒对土壤硒形态及酶活性、微生物数量的影响[J].水土保持学报,2015(5):137-141.
[19] 徐巧林,吴文良,赵桂慎,等.微生物硒代谢机制研究进展[J].微生物学通报,2017,44(1):207-216.
[20] 胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[21] 梅运军,向极钎,金文珍,等.富硒矿区真菌群落特征初步研究[J].生物技术,2017,27(1):53-57.
[22] 陈慧颖,李慧星,许彬,等.河南浓香型酒醅的真菌微生物菌群多样性及共变性[J].工业微生物,2021,51(2):36-45.
[23] 曾议霆,郭溪浪,周康,等.富硒乳酸菌的筛选及鉴定[J].食品科学,2015,36(3):178-182.
[24] SAINI K,TOMAR S K,SANGWAN V.Evaluation of Lactobacilli from human sources for uptake and accumulation of selenium[J]. Biological Trace Element Res,2014,160(3):433-436.
[25] 闫骁骧.富硒醋酸菌的筛选及其富硒特性研究[D].太原:山西大学,2015.
[26] 吴竞,王阳光,刘永杰,等.不同酵母菌种富硒能力比较与发酵条件优化[J].畜牧与兽医,2012,44(1):15-18.