黄酒含有氨基酸、低聚糖和微量元素等,营养丰富,是中国传统发酵食品的典型代表之一[1-2],其产地较广,品种较多,包括绍兴黄酒[3-4]、房县黄酒[5-6]、广东客家黄酒[7-8]等。黄酒中复杂的风味成分与传统酿造过程中各种微生物的代谢密切相关,其中微生物主要来源于酒曲,酒曲品质对酒的产率和品质影响极大,故有“曲是酒之骨”之称[9]。随着“健康中国2030”规划纲要的实施,作为传统养生食品的黄酒产业将迎来极好的机遇[10]。
红谷黄酒,作为河南南阳的特色黄酒,以红酒谷作为原料,酒曲作为发酵剂,经多种微生物发酵酿造而成。南阳红酒谷,又称红谷、红小米,谷粒琥珀色,是河南省南阳市濒临灭绝的特产农作物,其蛋白质与脂肪含量均高于糯米,富含多种维生素和营养物质,适合不同人群食用,属于营养滋补佳品[11]。红谷黄酒酿造过程中采用的酒曲主要有红曲、大曲、小曲三种,因其黄酒颜色晶莹透亮,口感绵甜醇香,备受南阳黄酒企业的推崇。2019年南阳因为红谷黄酒的发展,被评为世界美酒特色产区,中国九大黄酒产区之一[12]。目前,关于红谷酒曲微生物多样性研究的相关报道较少,严重制约了我省红谷黄酒产业的发展。
高通量测序技术为认识黄酒酿造微生物多样性提供了有利手段[13-14]。本研究采用Illumina MiSeq高通量测序技术对南阳红谷黄酒酿造用曲(红曲、大曲、小曲)中的微生物多样性进行分析,以期解析红谷黄酒中特殊风味感官特征产生的原因,并为后续对红谷黄酒的研究与开发提供理论依据,推动黄酒产业的发展。
1 材料与方法
1.1 材料与试剂
1.1.1 原料红曲(A):河南润之酒业有限公司;大曲(B)与小曲(C):邓州市光照酒业有限公司。
1.1.2 试剂
Taq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(5 U/μL):美国Thermo公司;E.Z.N.A.Soil DNA提取试剂盒:美国OMEGA公司;SanPrep柱式DNA胶回收试剂盒:生工生物工程(上海)股份有限公司;Qubit2.0 DNA检测试剂盒:美国Life公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Mastercycler聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;Pico-21台式离心机:美国Thermo Fisher公司;GL-88B漩涡混合器:其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:拓能达科技有限公司;DYY-6C型电泳仪:北京六一仪器厂;GelDoc-ItTS3凝胶成像系统:美国UVP公司;Illumina Miseq2500测序仪:美国Illumina公司。
1.3 方法
1.3.1 DNA的提取
酒曲中微生物总DNA的提取按照DNA提取试剂盒说明书中的方法和步骤进行。将提取的DNA置于-20 ℃冰箱中保存待用。
1.3.2 聚合酶链式反应及测序
采用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌的16S rDNA的V3-V4区域基因序列进行PCR扩增[15]。采用引物ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2-Rev(5'-GCTGCGTTCTTCATCGATGC-3')对真菌的ITS基因序列进行PCR扩增[16]。
PCR扩增体系:10×PCR buffer 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)0.1 mmol/L,DNA 10 ng,正向及反向引物各0.5 μmol/L,Taq DNA聚合酶0.05 U,用双蒸水(ddH2O)补充至50 μL。
PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,共计5个循环;然后进行94 ℃变性20 s,45 ℃退火20 s,65 ℃延伸30 s,共计20个循环;最后72 ℃延伸5 min。
采用琼脂糖凝胶电泳对PCR扩增产物进行检测,利用SanPrep柱式DNA胶回收试剂盒对DNA回收。利用Qubit 2.0 DNA检测试剂盒对回收的DNA进行精确定量,依托生工生物工程(上海)股份有限公司进行Illumina MiSeq高通量测序。
1.3.3 数据处理与分析
测序获取原始序列,将双末端序列融合成为一个方向的序列并进行质量控制(quality control,QC)[15]。采用1.2.3 Flash软件融合双末端序列,通过各样品的barcode使数据回归样品,并对各样品序列做质量控制。采用V0.20.4 Prinseq软件对序列阅读框的3'端进行质控,截掉碱基质量值<20的数据,提高后续序列融合比率;通过1.2.3 Flash软件融合双末端序列,使其形成一条序列;采用Prinseq V0.20.4软件去除各样品的引物序列、碱基长度<200 bp的序列、低复杂度序列和低质量序列;去除非靶区域序列及嵌合体,首先采用Mothur软件(1.30.1)的Pre.cluster模块校正测序错误,校正过程当中允许的最大错配为1/150。其次,采用软件Mothur内的Uchime功能模块,以Silva数据库中的序列作为模板,去除嵌合体及非靶区域序列。使用Usearch软件,对前述得到的优化序列按97%的相似度进行操作分类单元(operational taxonomic units,OTU)划分,计算样品中微生物Alpha多样性指数,构建香农指数曲线,并统计分析细菌和真菌群落信息。
2 结果与分析
2.1 红谷黄酒酒曲中细菌菌群多样性分析
2.1.1 序列的拼接
采用Illumina Miseq测序平台得到A、B、C样本对应的细菌原始序列分别为50 431条、64 293条、48 952条,其平均碱基长度分别为466.44 bp、466.54 bp、462.65 bp;经拼接、过滤,分别得到有效序列48 758条、62 575条、47 403条,其平均碱基长度分别为427.70 bp、427.38 bp、423.17 bp。
2.1.2 基于操作分类单元不同酒曲样品的聚类分析
基于OTU对3种红谷黄酒酒曲样本的细菌菌群进行聚类分析,绘制OTU在不同酒曲样本中分布的韦恩图[17],结果见图1。
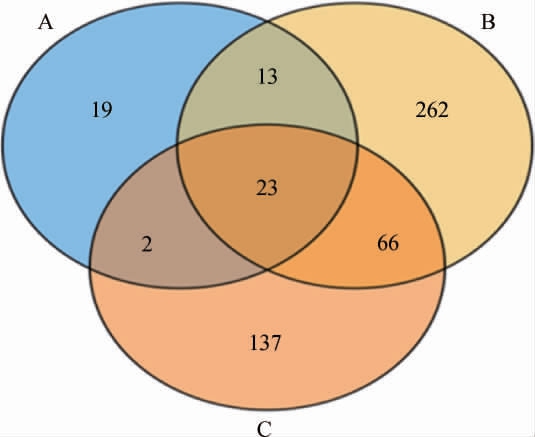
图1 不同酒曲样品中细菌菌群OTU分布韦恩图
Fig.1 Venn diagram of OTU distribution of bacterial community in different Jiuqu samples
由图1可知,红曲A、大曲B、小曲C样本中OTU数目分别为57个、364个、228个;A、B、C样本特有的OTU数目分别为19个、262个、137个;A与B样本共有的OTU数目为36个,A与C样本共有的OTU数目为25个,B与C样本共有的OTU数目为89个,A、B、C样本共有的OTU数目为23个。结果表明,大曲与小曲之间细菌菌群相似性较高,大曲和红曲间细菌菌群相似度较低。
2.1.3 Alpha多样性分析
香农(Shannon)指数、ACE指数、超1(Chaol)指数和辛普森(Simpson)指数是常用于描述微生物群落物种多样性的Alpha多样性指数,这4个多样性指数可以对群落物种组成的丰富度进行综合性的评价[18-19]。Chao1指数(或ACE指数)越大,表明群落的物种丰富度越高;Shannon指数越大,表明群落中物种多样性越高;Simpson指数越大,表明群落中物种多样性越低;覆盖率越大,表明样本中序列没有被测出的概率越低,若覆盖率>97%,则证明本次取样是合理的[20]。红谷黄酒不同酒曲中细菌菌群的Alpha多样性指数分析结果见表1。
表1 不同酒曲样品中细菌菌群的Alpha多样性指数分析结果
Table 1 Analysis results of Alpha diversity indexes of bacterial community in different Jiuqu samples
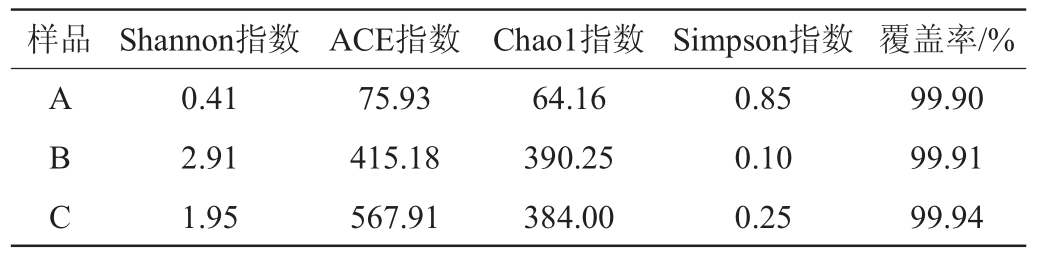
由表1可知,红曲A样本的Shannon指数、ACE指数、Chao1指数均最小,Simpson指数最大,证明其物种丰富度、多样性最低;大曲B样本的Shannon指数、Chao1指数最大,Simpson指数最小,表明大曲B物种丰富度、多样性最高;小曲C样本的细菌群落物种的丰富度和多样性则处于红曲A与大曲B之间。3个样品的覆盖率均>99%,说明测序结果能反映样品的真实情况。
为了比较样本的测序数据量不同时物种丰富度(香农指数)的大小和判断样本的测序数据量的合理性,以抽取的序列数目为横坐标,香农指数为纵坐标绘制稀疏性曲线[15],结果见图2。由图2可知,3个样品细菌菌群丰富度的大小为B>C>A,且随着抽取的序列数目的增加,香农指数基本稳定不变,曲线趋向平坦,说明测序数据量渐进合理。
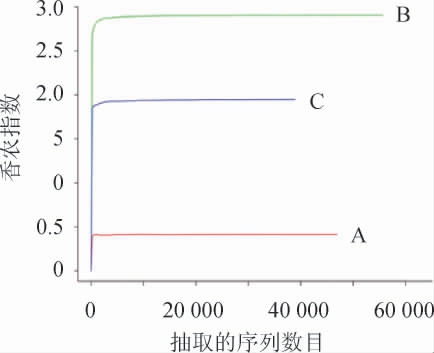
图2 不同酒曲样品细菌菌群的香农指数曲线
Fig.2 Shannon index curves of bacterial community in different Jiuqu samples
2.1.4 菌群结构分析
根据物种分类学分析结果,统计各样本细菌菌群在不同层级上的物种数量,结果见表2。
表2 不同酒曲样品细菌菌群在不同层级上物种数量的分析统计结果
Table 2 Analysis and statistical results of the number of species in different levels of bacterial community of different Jiuqu samples

由表2可知,红曲A样品在不同层级上的物种数量最少,小曲C样品次之,大曲B样品最多,即大曲中的细菌菌群结构最复杂,红曲中的细菌菌群结构最简单。在属水平上,基于高通量测序技术对红谷黄酒酒曲的细菌种类和相对丰度进行分析,根据相对丰度将样本中菌属分为优势菌属(相对丰度≥1.0%)和次要菌属(相对丰度<1.0%),且将次要菌属归类于其他(Others),其结果见表3。
表3 不同酒曲样品中细菌菌属及相对丰度分析结果
Table 3 Analysis results of bacterial genus and relative abundance in different Jiuqu samples
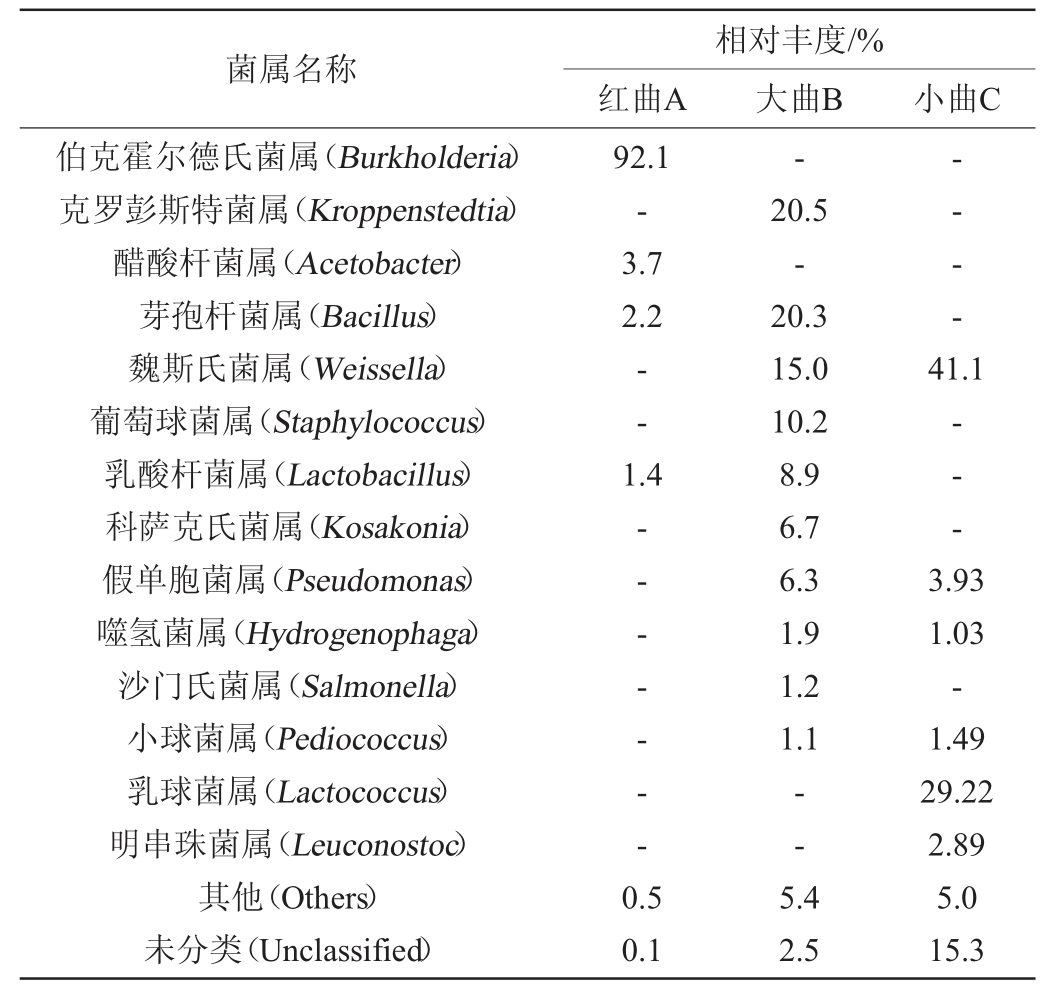
注:“-”代表未检出。下同。
由表3可知,红曲A样品中有优势细菌属4个,分别是Burkholderia、Acetobacter、Bacillus、Lactobacillus,相对丰度分别为92.10%、3.70%、2.20%、1.40%;小曲C样品中有优势细菌属6个,分别为Weissella、Lactococcus、Pseudomonas、Leuconostoc、Pediococcus、Hydrogenophaga,其中Weissella相对丰度最高,为41.1%;大曲B样品中有优势细菌属10个,分别为Kroppenstedtia、Bacillus、Weissella、Staphylococcus、Lactobacillus、Kosakonia、Pseudomonas、Hydrogenophaga、Salmonella、Pediococcus,其中Kroppenstedtia、Bacillus、Weissella、Staphylococcus相对丰度较高,分别为20.5%、20.3%、15.0%、10.2%。陈慧颖等[21]对浓香型白酒酒醅中微生物多样性研究发现,Kroppenstedtia为样品中的优势菌属;沈毅等[22]研究发现,Kroppenstedtia是酱香型郎酒高温大曲中的优势菌属;杜丹等[23]研究发现,Kroppenstedtia是谢村黄酒酒曲的优势菌属(相对丰度为41.6%);刘芸雅等[24]研究发现,绍兴黄酒麦曲中的主要优势细菌属为Bacillus、Lactobacillus、Lactococcus等。Bacillus是大多数酒曲中的优势菌属,可能由于其耐高温的特点[25]。上述优势细菌属与本研究的细菌属有部分重合。
使用核糖体数据库项目(ribosomal database project,RDP)classifier[26]方法得到各个层级上每个OTU对应的物种分类信息,基于属水平,通过物种丰度热图对各样本的细菌群落结构组分及样本间细菌群落结构组分的差异进行研究,结果见图3。图中显示平均相对丰度最高的前50种物种分类信息,剩余的物种分类合并成Other。
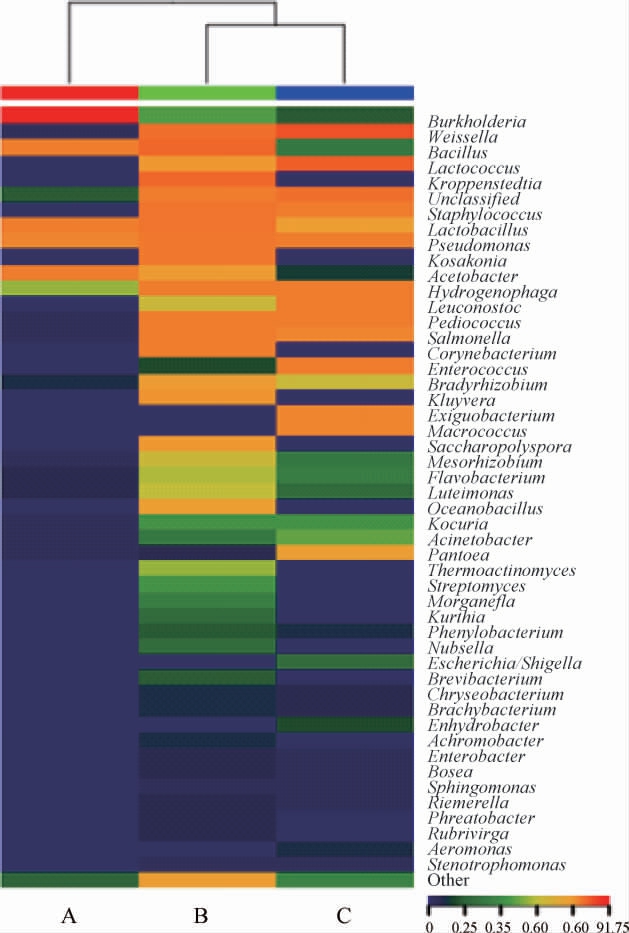
图3 基于属水平红谷黄酒酒曲样品细菌菌群相对丰度分析热图
Fig.3 Heat map of relative abundance of bacterial community in red-millet Huangjiu Jiuqu based on genus level
由图3可知,大曲B样品与小曲C样品距离较近,细菌菌群分布较相似。红曲A样品与大曲B样品、小曲C样品相比,差异细菌属主要是伯克霍尔德菌(Burkholderia);大曲B样品与红曲A样品、小曲C样品相比,差异细菌属主要是棒状杆菌属(Corynebacterium)、克吕沃尔菌属(Kluyvera)、糖多孢菌属(Saccharopolyspora)、大洋芽胞杆菌属(Oceanobacillus)、Kroppenstedtia、科萨克氏菌属(Kosakonia);小曲C样品与红曲A样品、大曲B样品相比,差异细菌属主要是微小杆菌属(Exiguobacterium)、巨球菌属(Macrococcus)、泛菌属(Pantoea)。大曲B样品中优势细菌种类最多,其次是小曲C样品,红曲A样品中优势细菌种类最少。未检测出酒曲样品中细菌菌群在种水平上的分类,可能是因为16SrDNA有很高的保守性,对亲缘关系较近的物种种属不容易分辨。
2.2 红谷黄酒酒曲中真菌菌群多样性分析
2.2.1 序列的拼接
采用Illumina Miseq测序平台得到A、B、C样本对应的真菌原始序列分别为57 458条、59 007条、58 267条,其平均碱基长度分别为274.84 bp、287.03 bp、195.57 bp;经拼接、过滤,分别得到有效序列57 342条、58 976条、58 039条,其平均碱基长度分别为230.47 bp、244.22 bp、152.84 bp。
2.2.2 基于操作分类单元不同酒曲样品的聚类分析
基于OTU对3种红谷黄酒酒曲样本的真菌进行聚类分析,OTU在不同酒曲样本中分布的韦恩图见图4。
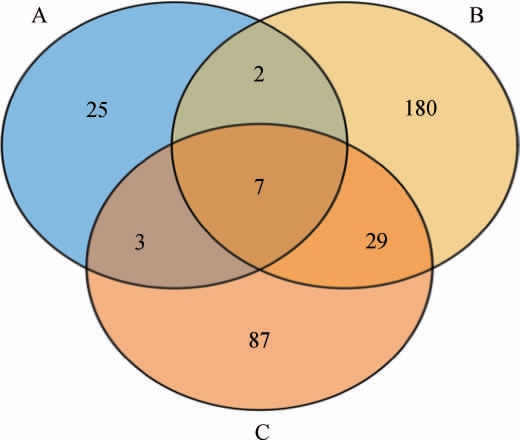
图4 不同酒曲样品中真菌菌群OTU分布韦恩图
Fig.4 Venn diagram of OTU distribution of fungal community in different Jiuqu samples
由图4可知,红曲A、大曲B、小曲C样本中OTU数目分别为37个、218个、126个;A、B、C样本特有的OTU数目分别为25个、180个、87个;A与B样本共有的OTU数目为9个、A与C样本共有的OTU数目为10个、B与C样本共有的OTU数目为36个、A、B、C样本共有的OTU数目为7个。结果表明,大曲与小曲之间真菌菌群相似性较高。
2.2.3 Alpha多样性分析
红谷黄酒不同酒曲中真菌菌群的Alpha多样性指数分析结果见表4。
表4 不同酒曲样品中真菌菌群的Alpha多样性指数分析结果
Table 4 Analysis results of Alpha diversity indexes of fungal community in different Jiuqu samples
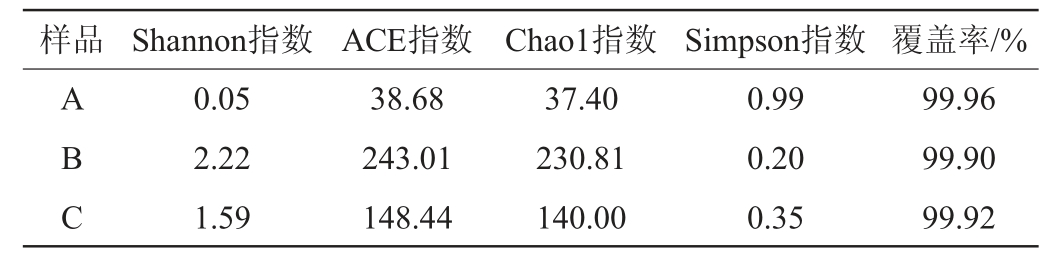
由表4可知,大曲B样本的Shannon指数、Chao1指数、ACE指数最大,Simpson指数最小,证明其群落物种丰富度、多样性最高;红曲A样本的Shannon指数、Chao1指数、ACE指数最小,Simpson指数最大,表明红曲A样本物种丰富度、多样性最低;小曲C样本的真菌群落物种多样性和丰富度则处于A样本与B样本之间。3个样本的覆盖率均>99%,说明测序结果能反映样本的真实情况。
不同酒曲样品真菌菌群的香农指数曲线见图5。由图5可知,3个样本真菌菌群丰富度的大小为B>C>A,且随着抽取的序列数目的增加,香农指数基本稳定不变,曲线趋向平坦,说明测序数据量渐进合理。
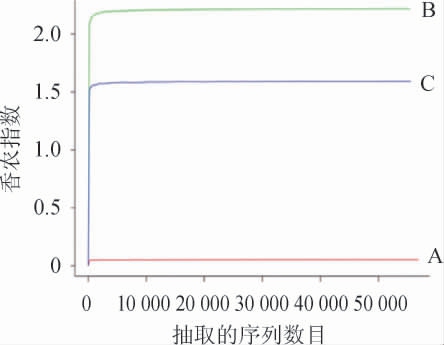
图5 不同酒曲样品真菌菌群的香农指数曲线
Fig.5 Shannon index curves of fungal community in different Jiuqu samples
2.2.4 菌群结构分析
根据物种分类学分析结果,统计各样本真菌菌群在不同层级上的物种数量,结果见表5。
由表5可知,红曲A样品在不同层级上的物种数量最少,小曲C样品次之,大曲B样品最多,即大曲B样品中的真菌菌群结构最复杂,红曲A样品中的真菌菌群结构最简单。基于种水平对红谷黄酒酒曲的真菌种类和相对丰度进行分析,根据相对丰度将样本中菌属分为优势菌属(相对丰度≥1.0%)和次要菌属(相对丰度<1.0%),且将次要菌属归类于其他(Others),其结果见表6。
表5 不同酒曲样品真菌菌群在不同层级上物种数量的分析统计结果
Table 5 Analysis and statistical results of the number of species in different levels of fungal community of different Jiuqu samples
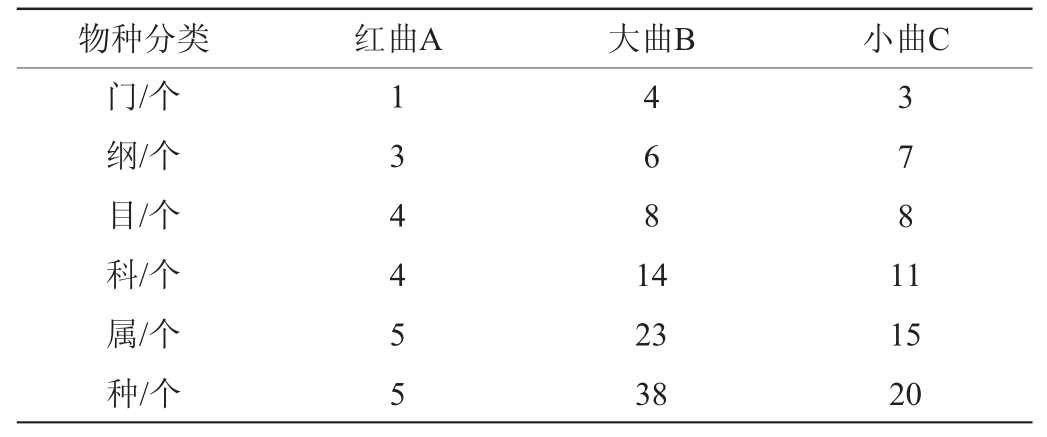
表6 不同酒曲样品中真菌菌种及相对丰度分析结果
Table 6 Analysis results of fungal genus and relative abundance in different Jiuqu samples
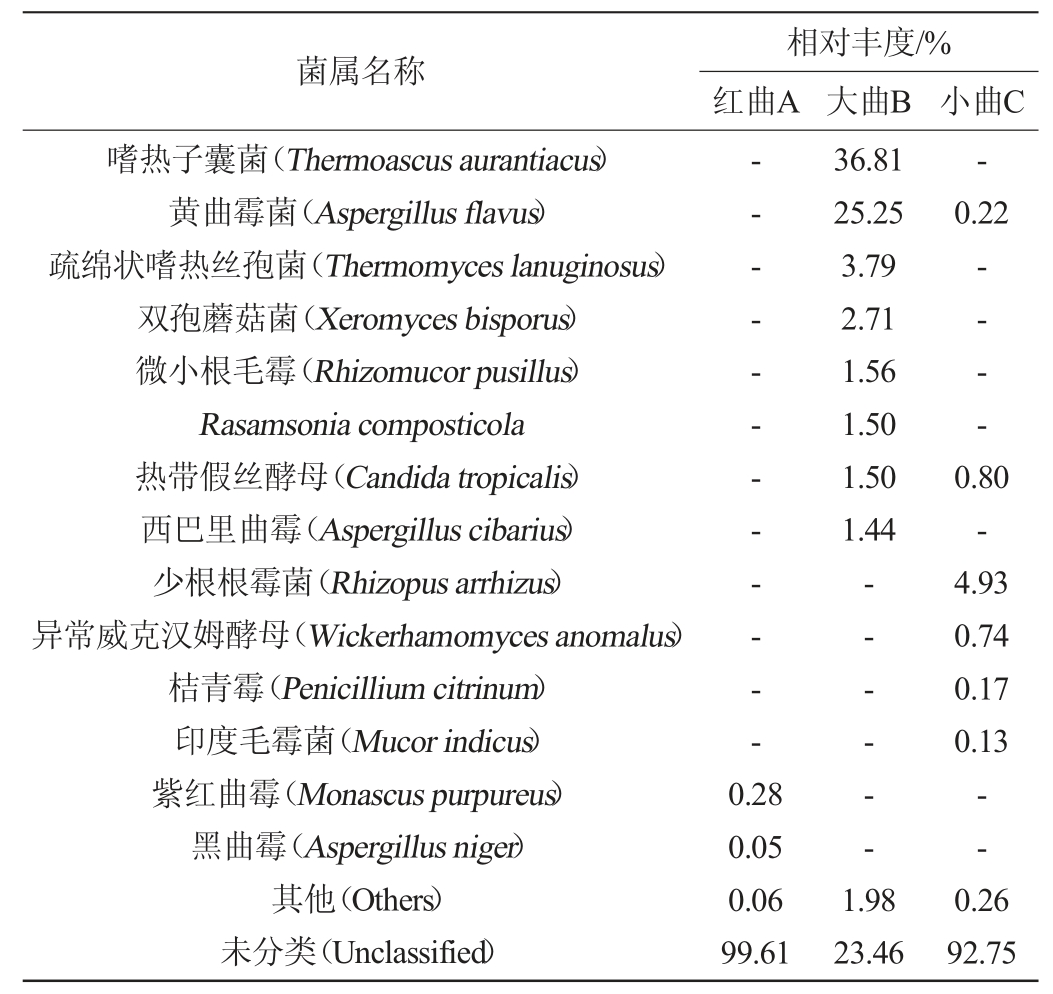
由表6可知,红曲A样品中有优势真菌种2个,分别为Monascus purpureus、Aspergillus niger;小曲C样品中有优势真菌种6个,分别为Rhizopus arhizus、Candida tropicalis、Wickerhamomyces anomalus、Aspergillus flavus、Penicillium citrinum、Mucor indicus,其中Rhizopus arhizus所占比例最大,为4.93%;大曲B样品中有优势真菌种8个,其中Thermoascus aurantiacus、Aspergillus flavus所占比例较大,相对丰度分别为36.81%、25.25%,其余依次为Thermomyceslanuginosus、Xeromycesbisporus、Rhizomucorpusillus、Rasamsonia composticola、Candida tropicalis、Aspergillus cibarius。杜贞娜等[27]研究发现,传统绍兴黄酒酿造过程中,子囊菌门(Ascomycota)占有绝对优势;陈亮亮等[28]从浙江古越龙山绍兴酒股份有限公司麦曲中筛选出一株Aspergillus niger与米曲霉苏-16混合制曲,混合熟曲的发酵性能优于单一菌种熟曲的发酵性能。红曲霉是一种药食两用丝状真菌,可以代谢多种酶类并能促进底物分解[29-30]。解文利等[31]利用紫红曲霉与银杏叶进行双向发酵可以提高银杏叶药汁总黄酮含量,并促进紫红曲霉生物量的生长。本研究发现在红谷黄酒酒曲中也存在上述几种霉菌。在黄酒酿造过程中,酒曲中含有的霉菌,例如毛霉、根霉、米曲霉以及少量的黑曲霉和青霉,这些真菌会产生大量的酶促使淀粉转化为糖,经过漫长的发酵过程后,这些糖类会部分残留下来,残留下来的糖主要是葡萄糖,还有少量的麦芽糖和糊精,它们共同赋予了酒体甜味和粘稠感[32]。
通过物种丰度热图对各样本的真菌群落结构及样本间真菌群落结构的差异进行研究,结果见图6。图6中显示平均相对丰度最高的前50种物种分类信息,剩余的物种分类合并成Other。
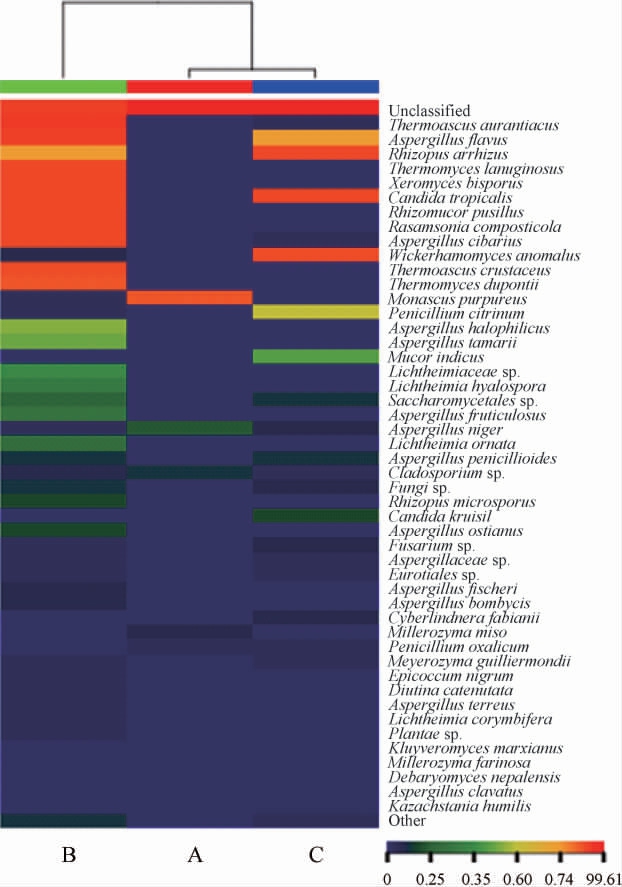
图6 基于种水平红谷黄酒酒曲样品真菌菌群相对丰度分析热图
Fig.6 Heat map of relative abundance of fungal community in red-millet Huangjiu Jiuqu based on species level
由图6可知,大曲B样品与小曲C样品的真菌菌群分布较相似。红曲A样品与大曲B样品、小曲C样品相比,差异真菌种主要是Monascus purpureus;大曲B样品与红曲A样品、小曲C样品相比,差异真菌种主要是Thermoascus aurantiacus、Thermomyces lanuginosus、Xeromyces bisporus、Rhizomucor pusillus、Rasamsonia composticola、Aspergillus cibarius、Thermomyces dupontii、Thermoascus crustaceus;小曲C样品与红曲A样品、大曲B样品样品相比,差异真菌种主要是Rhizopus arrhizus、Wickerhamomyces anomalus、Mucor indicus、Penicillium citrinum。大曲B样品中优势真菌种类最多,其次是小曲C样品,红曲A样品中优势真菌种类最少。3种酒曲真菌菌群中相对丰度差异较大,主要集中在子囊菌和霉菌,这可能是因为环境因子、制曲工艺以及原材料等对3种酿造用曲菌落结构差异的影响。
综上,3种酒曲样品的细菌菌群结构在各分类水平的数量分布均高于真菌菌群,进一步说明红谷黄酒酒曲中细菌菌群的多样性高于真菌菌群。
3 结论
利用Illumina MiSeq高通量测序技术对红谷黄酒酒曲(红曲、大曲、小曲)中的微生物多样性进行分析发现,大曲的微生物菌群物种多样性最高,红曲的最低,且两者间的微生物群落结构差异最大。红曲中优势细菌属为伯克霍尔德氏菌属(Burkholderia)、醋酸杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)等,优势真菌种为紫红曲霉(Monascus purpureus)、黑曲霉(Aspergillus niger)等;大曲中优势细菌属为克罗彭斯特菌属(Kroppenstedtia)、芽孢杆菌属、魏斯氏菌属(Weissella)、葡萄球菌属(Staphylococcus)等,优势真菌种为嗜热子囊菌(Thermoascus aurantiacus)、黄曲霉(Aspergillus flavus)、疏绵状嗜热丝孢菌(Thermomyces lanuginosus)等;小曲中优势细菌属为魏斯氏菌属、乳球菌属(Lactococcus)、假单胞菌属(Pseudomonas)等,优势真菌种为少根根霉菌(Rhizopus arhizus)、热带假丝酵母(Candida tropicalis)、异常威克汉姆酵母(Wickerhamomyces anomalus)等。该研究成果为进一步研究优化黄酒制曲工艺、提高酒曲质量指明了方向,具有重要的理论和实践意义。
[1] 周建弟,赖敏辉,应维茂,等.黄酒功能性成分与保健功能研究进展[J].酿酒,2021,48(5):24-29.
[2] 周梦洁.黄酒肽的分离纯化、结构鉴定及其降血糖活性研究[D].杭州:浙江大学,2021.
[3] 胡超凡.古法手酿绍兴黄酒发酵微生态及功效组分解析[D].杭州:浙江大学,2021.
[4] 周志立.绍兴黄酒生麦曲的微生物群落演替驱动力研究与制曲工艺优化[D].无锡:江南大学,2021.
[5] 夏军.膜分离除菌技术对房县黄酒风味物质的影响研究[D].武汉:湖北工业大学,2018.
[6] 朱正军,万端极,卢扬成,等.淋饭酒母在房县黄酒酿造生产中的应用[J].食品工业,2018,39(8):72-74.
[7]高云超,宫晓波,池建伟,等.广东客家黄酒主要糖类的HPLC-ELSD分析[J].农产品加工,2021(12):51-55,59.
[8] 赵文红.广东客家黄酒酿造体系中菌群及其对风味物质影响的研究[D].广州:华南农业大学,2018.
[9] 母应春,姜丽,苏伟.应用Illumina高通量测序技术分析3种酒曲中微生物多样性[J].食品科学,2019,40(14):115-122.
[10] 胡普信.健康中国背景下的养生黄酒的开发前景[C]//中国食品科学技术学会第十四届年会暨第九届中美食品业高层论坛论文摘要集.2017:706.
[11] 鞠乐,强学杰,牛银亭,等.南阳地区谷子产业现状及发展对策的研究与探讨[J].大麦与谷类科学,2017,34(3):45-47.
[12] 黄筱鹂.“世界美酒特色产区”获奖名单[J].酿酒科技,2019(11):82.
[13] 李俊锋.基于16S rRNA和宏基因组高通量测序的微生物多样性研究[D].北京:清华大学,2015.
[14] 杜贞娜,程斐,单之初,等.高通量测序技术及其在黄酒微生物多样性研究中的应用[J].中国酿造,2021,40(8):14-19.
[15] 李斌,闫志鹏,李慧星,等.基于高通量测序技术的浓香型和芝麻香型白酒酒曲细菌群落结构分析[J].中国酿造,2018,37(8):148-152.
[16] 李斌,胡俊杰,张兰兰,等.基于高通量测序浓香型和芝麻香型白酒酒曲真菌群落结构的分析[J].中国酿造,2019,38(10):96-99.
[17] 陈铭中,钟旭美,孔令开,等.生鲜香蕉和真空冷冻干燥香蕉粉的品质与挥发性组分的研究[J/OL].食品与发酵工业,2022:1-11.DOI:10.13995/j.cnki.11-1802/ts.029276.
[18] 李洁,崔霖芸,陈芳勇,等.凯里地区辣椒酸细菌群落多样性及其乳酸菌分离鉴定[J].中国酿造,2021,40(11):98-103.
[19] 庞春霞,李艺,虞任莹,等.基于Illumina Miseq技术比较不同地区传统发酵大豆制品细菌多样性[J].食品工业科技,2022,43(8):133-140.
[20] 孙哲,黄芷珊,刘幼强,等.酒饼叶对豉香型白酒酒饼细菌多样性影响研究[J].食品与发酵工业,2022,48(13):63-69.
[21] 陈慧颖,李慧星,许彬,等.高通量测序研究浓香型酒醅的细菌菌群多样性及共变性[J].工业微生物,2021,51(4):35-43.
[22] 沈毅,陈波,王西,等.酱香型郎酒高温大曲、酒醅和窖泥中细菌群落结构分析[J].中国酿造,2020,39(2):89-93.
[23] 杜丹,解修超,邓百万,等.谢村黄酒酒曲微生物多样性分析及产γ-氨基丁酸能力的初步研究[J].食品与发酵工业,2019,45(19):144-150.
[24] 刘芸雅,毛健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1):201-208.
[25] 杜丹,解修超,李新生,等.黄酒酒曲微生物及其代谢产物的研究进展[J].生物资源,2019,41(2):104-111.
[26] WANG Y,SHENG H F,HE Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of Illumina tags[J].Appl Environ Microbiol,2012,78(23):8264-8271.
[27] 杜贞娜,单之初,沈赤,等.传统绍兴黄酒酿造真菌群落与多样性发生机制[J].应用生态学报,2022,33(4):1118-1124.
[28] 陈亮亮,余培斌,谢广发,等.黄酒熟麦曲混菌制曲工艺研究[J].食品工业科技,2013,34(11):140-145.
[29] PATEL S.Functional food red yeast rice(RYR)for metabolic syndrome amelioration:A review on pros and cons[J].World J Microb Biot,2016,32(5):87.
[30] 代文婷,吴宏,郭安民,等.红曲霉在酿酒行业中的应用研究进展[J].食品与发酵工业,2018,44(1):280-284.
[31] 解文利,方月月,吴雨烔,等.紫红曲霉与银杏叶双向发酵研究[J].食品研究与开发,2020,41(22):174-182.
[32] 陈臣,刘洋,田怀香,等.黄酒微生物及其与风味形成关系的研究进展[J].食品安全质量检测学报,2019,10(15):4856-4863.