山西老陈醋具有酸、绵、香、甜、鲜五大风味特征,更有“天下第一醋”的美誉[1-2]。山西老陈醋中含有特征功能成分-川芎嗪(2,3,5,6-四甲基吡嗪)具有延缓人体细胞衰老、提高免疫力等保健作用[3-5]。近年来学者兴起对中国传统食醋的功能性成分研究。余鸣春[6]利用顶空固相微萃取(head space solid phase microextraction,HS-SPME)及气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)技术对镇江香醋中的川芎嗪进行了定性鉴定,利用反相高效液相色谱法(reversed phase high performance liquid chromatography,RP-HPLC)检测了香醋在不同生产阶段中的川芎嗪含量变化,结果显示川芎嗪含量最早在醋酸发酵阶段中被检测到,并有小幅增长,在陈放过程中大量积累,初步分析此阶段川芎嗪主要来源于美拉德反应。孙宗保等[7]研究表明,糯米糖化和酒精发酵过程中尚未生成川芎嗪,醋酸发酵过程中首次检测到川芎嗪,煎煮和陈放过程均有利于川芎嗪的增加。冯斌[8]研究表明,传统山西老陈醋的川芎嗪也是在醋酸阶段开始合成,但增长比较缓慢且不明显,到熏醅阶段,川芎嗪含量呈直线显著增加,熏醅结束后川芎嗪含量是熏醅前的40倍。芽孢杆菌在整个陈醋发酵过程中包括大曲制备、酒精发酵、醋酸发酵都可以被检测到,其主要起到产酶、产酸、产香和产抑菌物质等重要作用。关于高产乙偶姻基因工程菌的选育多集中在芽孢杆菌属[9-11],本实验室前期对100多株乳酸杆菌、醋酸杆菌、芽孢杆菌产乙偶姻能力进行比较,芽孢杆菌产乙偶姻能力普遍比乳酸杆菌、醋酸杆菌高。枯草芽孢杆菌是产川芎嗪重要前体物—乙偶姻的重要菌株,并且比乳酸杆菌、醋酸杆菌产乙偶姻的能力更强、更稳定。史改玲等[12]对分离自山西老陈醋醋醅中的芽孢杆菌进行产乙偶姻含量的测定,筛选出一株芽孢杆菌CP-1576,乙偶姻产量为1.15 mg/mL。张显[13]采用传统诱变方法对枯草芽孢杆菌(Bacillus subtilis)JNA3-10进行复合诱变,获得一株2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH)缺失型乙偶姻高产突变株JNA-UD-6,经发酵优化,最终发酵液中乙偶姻的含量达53.9 g/L。LI L等[14]通过优化发酵条件,改变2,3-丁二醇的转化策略,提高了地衣芽孢杆菌乙偶姻的产量。
在山西老陈醋发酵过程中,除芽孢杆菌外,醋酸杆菌和乳酸杆菌也是乙偶姻的重要产生菌群。吴林寰[15]对镇江香醋醋醅进行宏基因组测序,分析其微生物与主体风味物质的代谢关系,其中在乙偶姻代谢途径中主要的功能微生物有乳杆菌属、双歧杆菌属、芽孢杆菌属。FAVERI D D等[16]报道了一株汉森醋杆菌(Acetobacter hansenii)产乙偶姻量达到8.93 g/L。李雅茹等[17]对分离自传统发酵食品中的乳酸菌进行乙偶姻产量的测定,筛选出一株植物乳杆菌(Laobacillus plantarum)L7,乙偶姻产量为0.54 mg/mL。
目前,鲜有关于山西老陈醋优良菌株联合添加前体发酵强化川芎嗪的研究。本研究利用HPLC及GC-MS对川芎嗪及其前体物质进行测定,监测山西老陈醋醋酸发酵和熏醅过程中川芎嗪及其前体物质的变化,并对高产乙偶姻及川芎嗪菌株进行筛选及共培养,优选高产菌株组合,在醋醅模拟培养基中添加优良菌株组合联合底物及前体物质分析对乙偶姻和川芎嗪生成的影响。旨在为山西老陈醋醋酸发酵、熏醅阶段川芎嗪生成规律的揭示及强化工艺优化提供数据支持,对传统山西老陈醋工艺精髓挖掘、功能物质富集及采用现代生物技术提升具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌种
醋醅与熏醅样品选自山西省晋中市山西福源昌老陈醋有限公司醋酸阶段第0、1、3、5、7、9、10天(分别编号为C0、C1、C3、C5、C7、C9、C10)的醋醅和熏醅阶段第0、1、2、3、4、5天(分别编号为X0、X1、X2、X3、X4、X5)的熏醅作为本次试验的样品。样品均由无菌一次性塑封袋等量采取并封装于内,放置于-80 ℃冰箱保存用于后续分析。
表1 实验所用菌株名称及编号
Table 1 Name and number of strsain used in the experiments

续表

1.1.2 化学试剂
丙酮酸、川芎嗪标准品(均为色谱纯):天津市光复精细化工研究所;肌酸(分析纯):北京索莱宝科技有限公司;2,3-丁二醇、磷酸氢二铵(均为分析纯):武汉卡诺斯科技有限公司;丙酮酸、双乙酰(均为分析纯):天津金汇太亚化学试剂有限公司。
1.1.3 培养基
MRS培养基:牛肉膏1.0%,蛋白胨1.0%,吐温-80 0.1%,酵母膏0.5%,葡萄糖2.0%,柠檬酸三铵0.2%,磷酸氢二钾0.2%,乙酸钠0.2%,硫酸镁0.02%,硫酸锰0.005%,琼脂2.0%,pH 6.2~6.4,121 ℃高压灭菌15 min。
醋酸菌培养基:葡萄糖1.0%、酵母粉1.0%、蛋白胨0.3%、无水乙醇3.0%(V/V)(灭菌后加入)。
醋醅模拟培养基:取50 g山西老陈醋醋厂醋酸发酵第2天的醋醅,装入250 mL的锥形瓶中,用四层纱布封口,即为醋醅模拟培养基。
1.2 仪器与设备
Trace1300气相色谱仪:北京赛多利斯天平有限公司;ISQ质谱仪、HP-5-MS气相色谱柱(30 m×0.25 mm×0.25 mm)、U3000高效液相色谱仪、Venusil MP C18液相色谱柱(4.6 mm×150 mm,5 μm):赛默飞世尔科技公司;UV-9100紫外可见分光光度计:北京瑞利分析仪器公司;ZQPL-200立式全温振荡培养箱:天津市莱玻特瑞仪器设备有限公司。
1.3 方法
1.3.1 分析检测
(1)2,3-丁二醇的含量
采用气相色谱-质谱联用(GC-MS)法测定。
取1 g醋醅或熏醅样品于15 mL顶空进样瓶中,加入6 mL NaCl溶液(250 g/L)充分混匀后,0.22 μm微孔滤膜过滤上清液即可进样。
气相色谱条件:VF-5MS色谱柱(30m×0.25mm×0.25mm),流量1 mL/min,不分流进样。程序升温:起始温度40 ℃,保持3 min,然后以4 ℃/min的速度升至160 ℃,保持1 min,最后以10 ℃/min的速度升至270 ℃保持5 min。
质谱条件:电子电离(electronic ionization,EI)源,离子源温度230 ℃,四级杆温度150 ℃,电子能量70 eV,发射电流34.6 μA,倍增电压1 565 V,接口温度280 ℃,质量扫描范围41~500 amu。
定性定量方法:由保留指数、标准品、美国国家标准技术研究所(national institute of standards and technology,NIST)08谱库检索和人工图谱解析共同定性;采用峰面积归一化法进行定量。
(2)丙酮酸、乙偶姻和川芎嗪的含量
样品预处理:称取10 g醋醅,用90 mL超纯水浸泡3 h进行抽滤,抽滤完成后将滤液稀释到一定的浓度,12 000 r/min离心10 min,0.22 μm微孔滤膜过滤,取上清液分别对丙酮酸、乙偶姻和川芎嗪含量进行测定。
丙酮酸标准曲线制备:准确配制丙酮酸标准溶液,使用时稀释后过膜进样。测定丙酮酸标准品的保留时间,以保留时间定性,将不同浓度的丙酮酸标准液分别进样,采用峰面积外标法定量。标准曲线回归方程为y=17.072 5x+0.162 5,相关系数R2=0.999 8。
丙酮酸含量:采用高效液相色谱法(HPLC)测定,其色谱条件:流动相为pH=2.7的20 mmol/L NaH2PO4,进样量为20 μL,流速为0.8 mL/min,检测器检测波长210 nm,柱温为室温。
乙偶姻含量:采用肌酸比色法测定[18]。
川芎嗪标准曲线制备:准确称取5 mg川芎嗪标准品,制成0.5 mg/mL的标准储备液,稀释后过膜进样。测定川芎嗪标准品的保留时间,以保留时间定性,将不同浓度的川芎嗪标准液分别进样,采用峰面积外标法定量。标准曲线回归方程为y=589.53x+1.120 8,相关系数为R2=0.999 4。
川芎嗪含量:采用高效液相色谱法(HPLC)测定,其色谱条件:色谱柱为C18分离柱(4.6 mm×250 mm);流动相:含0.2 mmol/L磷酸二氢铵的52%甲醇水溶液;进样量20 μL;流动速度0.8 mL/min;紫外检测波长:297 nm;柱温:25 ℃。
1.3.2 高产乙偶姻、川芎嗪菌株的筛选
按3%(V/V)的接种量(菌体浓度为108 CFU/mL),将待筛选菌株分别接种于相应培养基中,其中芽孢杆菌和乳酸杆菌接种于MRS液体培养基中,37 ℃静置培养48 h;醋酸菌接种于醋酸菌培养基中,30℃、150r/min培养48h。发酵液12 000 r/min离心2 min取上清,分别测定发酵上清液中乙偶姻和川芎嗪的含量,筛选高产乙偶姻、川芎嗪菌株。
1.3.3 优良高产乙偶姻和川芎嗪菌株的相互作用研究
将筛选出的高产乙偶姻和川芎嗪的优良植物乳杆菌(Laobacillus plantarum)L7、短乳杆菌(Lactobacillus brevis)L728、莫海威芽孢杆菌(Bacillus mojavensis)B15、甲基营养型芽孢杆菌(Bacillus methylotrophicus)B6,菌体浓度均调整为108 CFU/mL,按照总接种量为3%(V/V)、等比例接入MRS液体培养基中,进行不同组合的共培养试验,37 ℃静置培养48 h后,按照1.3.1中的方法测定发酵上清液中乙偶姻的含量,探讨优良高产乙偶姻和川芎嗪菌株共培养对产乙偶姻的影响。
1.3.4 优良菌株组合联合添加前体物质强化乙偶姻、川芎嗪生成发酵试验
实验以空白醋醅为对照;在醋醅模拟培养基中添加强化菌株,菌体浓度为108 CFU/mL且总接种量为3%(V/V)、菌株组合:B6+B15(1∶1)和B6+B15+L7(1∶1∶1);在添加菌株组合的基础上添加18.75%质量浓度为20 g/L的前体添加液(丙酮酸、2,3-丁二醇、双乙酰、磷酸氢二铵)。37 ℃静置发酵5 d,进行强化乙偶姻、川芎嗪生成发酵试验,分别在第1、3、5天取样,测定醋醅模拟培养基中乙偶姻和川芎嗪的含量,探讨优良组合菌株联合前体添加强化乙偶姻、川芎嗪生成。
2 结果与分析
2.1 山西老陈醋醋酸发酵过程和熏醅过程中川芎嗪、底物及前体物质的变化
在醋酸发酵过程中,葡萄糖经糖酵解途径生成丙酮酸,丙酮酸在乙酰乳酸合成酶的催化下形成2-乙酰乳酸,2-乙酰乳酸在乙酰乳酸脱羧酶的催化下生成乙偶姻[15]。另外在有氧条件下,2-乙酰乳酸还可以氧化脱羧形成双乙酰,双乙酰在双乙酰还原酶的催化作用下生成乙偶姻。由图1可知,在醋酸发酵过程中,丙酮酸、2,3-丁二醇及乙偶姻含量均呈现上升趋势,在醋酸发酵第10天达到最大值,分别为0.88 g/100 g、0.88 mg/100 g和0.12 mg/g。川芎嗪含量在醋酸阶段变化不明显,积累量较少,主要是由乙偶姻与铵根离子或氨气通过非酶促化学反应生成[15],醋酸发酵末期其含量为1.19 μg/g。刘娜[19]对镇江香醋醋酸发酵过程中川芎嗪的生物合成途径进行研究,也证实了此结论,认为乙偶姻是川芎嗪合成的关键前体物质,且由生物酶作用催化形成。
山西老陈醋熏醅阶段温度一般在60~90 ℃,且温度越高美拉德反应速度越快,吡嗪类物质产生越快,温度每提高10 ℃,反应速度大约增加3~5倍[20-21]。丙酮酸含量在熏醅第1~2天仍保持增长趋势,在熏醅第2天峰值达到1.3 mg/100 g后呈下降趋势。2,3-丁二醇在整个熏醅过程中呈现下降趋势,在熏醅第5天其含量降低到0.33 mg/100 g。熏醅过程中水分散失,乙偶姻含量在熏醅前2天呈上升趋势,后续由于美拉德反应,其含量下降[19]。由图1可知,川芎嗪的生成主要在熏醅阶段,其中发生着复杂的化学合成、分解、缩合及美拉德反应等,并且川芎嗪的生成量随着熏醅温度的升高和熏醅时间的延长而增加,从熏醅第2天的6.78 μg/g急剧上升到熏醅第5天的43.52 μg/g。川芎嗪不仅是山西老陈醋的特征功能成分,并且具有咖啡、坚果等烘烤香气,联合熏醅过程中诸如糠醛类、吡嗪及其他杂环类化合物的生成和积累,赋予山西老陈醋相较其他醋种独特的熏香味[22-23]。
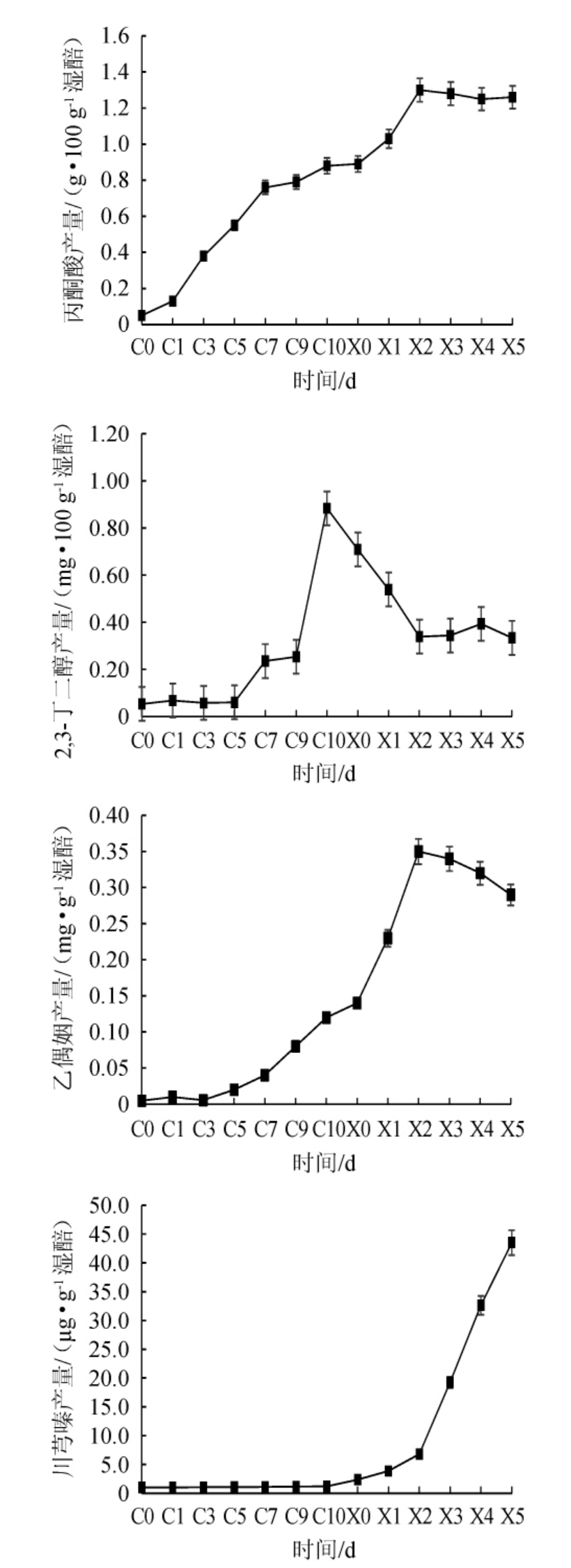
图1 山西老陈醋醋酸发酵及熏醅过程中川芎嗪及其前体物质的变化
Fig.1 Changes of ligustrazine and its precursors during acetic acid fermentation and fumigation of Shanxi aged vinegar
2.2 高产乙偶姻、川芎嗪菌株的筛选
乙偶姻具有典型奶香味[24],是一种重要的风味物质,国家已批准乙偶姻作为食品添加剂,通常应用于啤酒[25]、奶油[26]等生产。在食醋酿造过程中,通过微生物代谢可产生乙偶姻,其不仅为食醋提供了特殊风味,还是川芎嗪的重要前体物质[27]。筛选高产乙偶姻和川芎嗪的菌株对发酵食品的提质增香具有重要意义,一些学者对产乙偶姻的菌株进行了筛选工作,包括酵母菌、乳酸菌、醋酸菌和芽孢菌[22-23,28-29]。张显[13]采用传统诱变方法对枯草芽孢杆菌JNA 3-10进行复合诱变,获得一株2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH)缺失型乙偶姻高产突变株JNAUD-6,消耗150 g/L葡萄糖,可得到53.9 g/L的乙偶姻;LI L等[14]通过代谢工程和发酵控制,优化了地衣芽孢杆菌的发酵条件,提高了地衣芽孢杆菌乙偶姻的产量。杨铭等[30]对8株分离自内蒙古奶豆腐和西藏灵菇的乳酸菌进行产乙偶姻含量的测定,植物乳杆菌K25发酵乳中的乙偶姻质量浓度较高,为8.59 μg/mL。
对30株分离自山西老陈醋醋酸发酵阶段的醋酸杆菌、乳酸杆菌、芽孢杆菌进行产乙偶姻、川芎嗪能力的测定,结果见图2。由图2可知,芽孢杆菌产乙偶姻含量较高(0.45~2.08 mg/g),乳酸杆菌次之(0.97~1.50 mg/g),醋酸杆菌产乙偶姻含量最少(0.10~0.43 mg/g)。本研究自然筛选得到的菌株为山西老陈醋土著菌,具有其他来源菌株对发酵环境适应性无法比拟的优势特性,将来需通过菌种选育、发酵工艺优化等方法进一步提高其产乙偶姻能力。
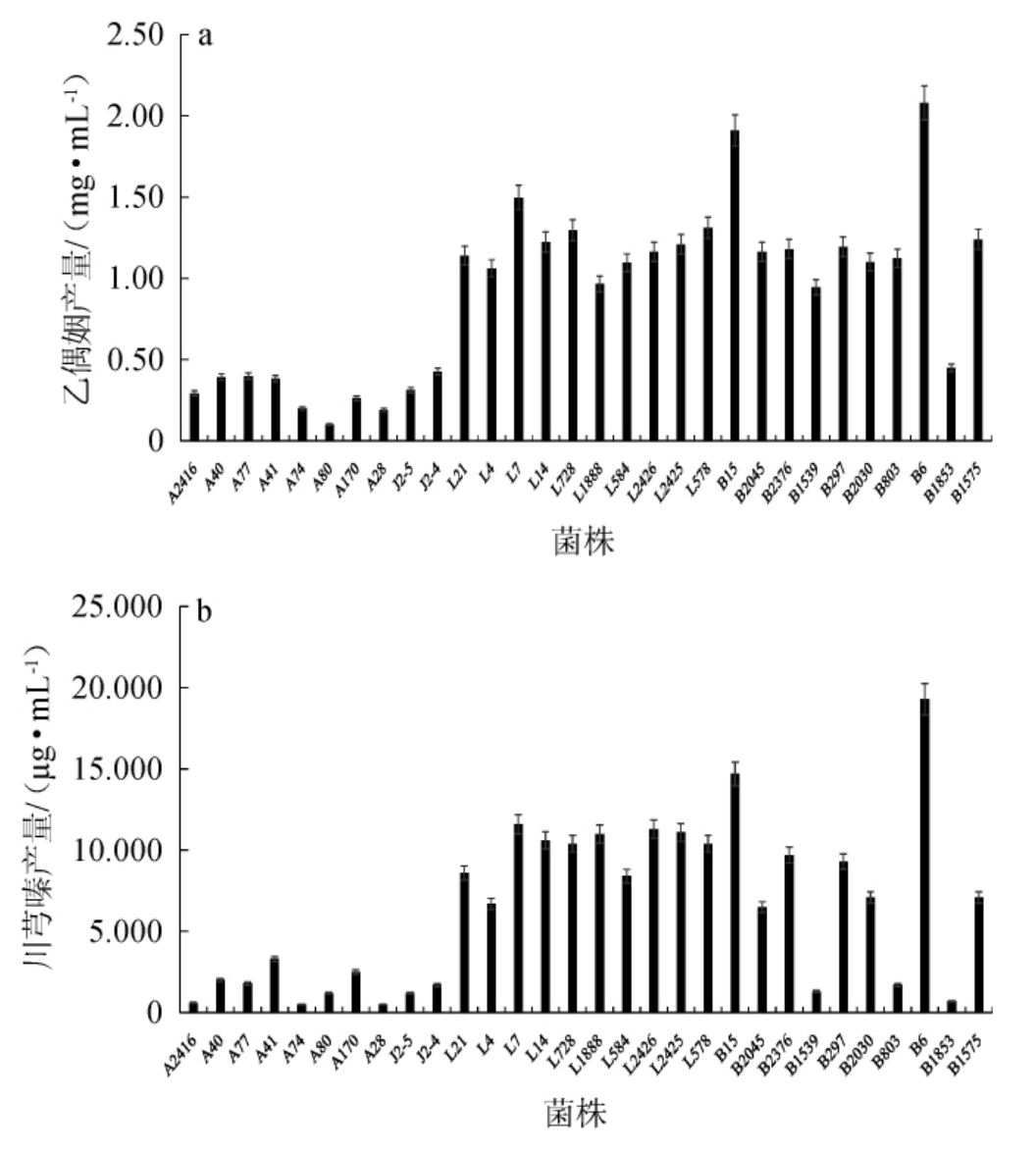
图2 山西老陈醋源芽孢杆菌、乳酸杆菌和醋酸杆菌产乙偶姻(a)和川芎嗪(b)能力测定结果
Fig.2 Determination results of acetoin (a) and ligustrazine (b)producing ability of Bacillus, Lactobacillus and Acetobacter isolated from Shanxi aged vinegar
其中,甲基营养型芽孢杆菌B6与莫海威芽孢杆菌B15产乙偶姻量高于其他芽孢杆菌菌株,乙偶姻产量分别达到2.08 mg/g和1.91 mg/g。植物乳杆菌L7产乙偶姻量高于其他乳酸菌菌株,其产量达到1.50 mg/g;除菌株L7外,短乳杆菌L728、L578和L14的乙偶姻产量也较高,分别为1.29 mg/g、1.31 mg/g和1.22 mg/g。基于实验室前期研究结果,菌株L728除产乙偶姻量较高外,其总酸、不挥发酸、氨基酸态氮产量也较高,因此后续试验选取菌株L728进行菌株共培养研究。相比于芽孢杆菌和乳酸杆菌,醋酸杆菌产乙偶姻能力较弱,巴氏醋杆菌A40、A77、A41以及汉氏醋杆菌J2-4产乙偶姻量均在0.40 mg/g左右。甲基营养型芽孢杆B6和莫海威芽孢杆菌B15产川芎嗪能力较强,其产川芎嗪量显著高于其他芽孢杆菌菌株,产量分别为19.30μg/mL和14.70 μg/mL。植物乳杆菌L7川芎嗪产量略高于其他乳酸杆菌菌株,为11.60 μg/mL。
2.3 山西老陈醋源高产乙偶姻芽孢杆菌和乳酸杆菌的纯培养与共培养
高产乙偶姻芽孢菌和乳酸菌纯培养和共培养体系乙偶姻产量见图3。由图3可知,菌株组合B6+B15乙偶姻合成量最高,达到3.16 mg/g。在总接种量一定的情况下,各菌株等比例组合,使得高产乙偶姻菌株B6和B15接种量减小,与菌株组合B6+B15相比,菌株组合B6+B15+L7、菌株组合L728+L7+B15、菌株组合L728+L7+B6+B15共培养体系中乙偶姻产量较低,分别为2.73 mg/g、1.84 mg/g、1.78 mg/g。
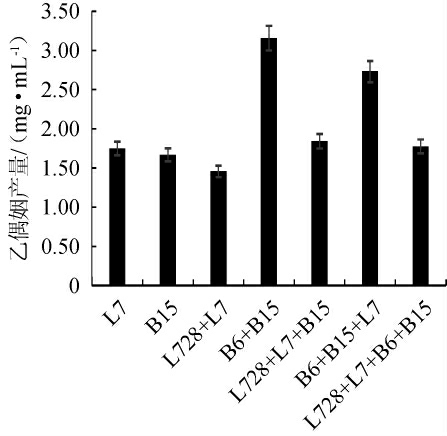
图3 菌株纯培养和共培养体系中乙偶姻产量
Fig.3 Acetoin production in pure culture and co-culture systems of strains
2.4 优良菌株组合联合添加底物及前体物质对乙偶姻、川芎嗪发酵的影响
由图4可知,随着发酵时间的延长,各组乙偶姻生成量均呈现下降趋势,川芎嗪则呈现上升趋势。发酵第5天时,各优良菌株组合联合添加前体、底物组合的乙偶姻产量都高于对照组。
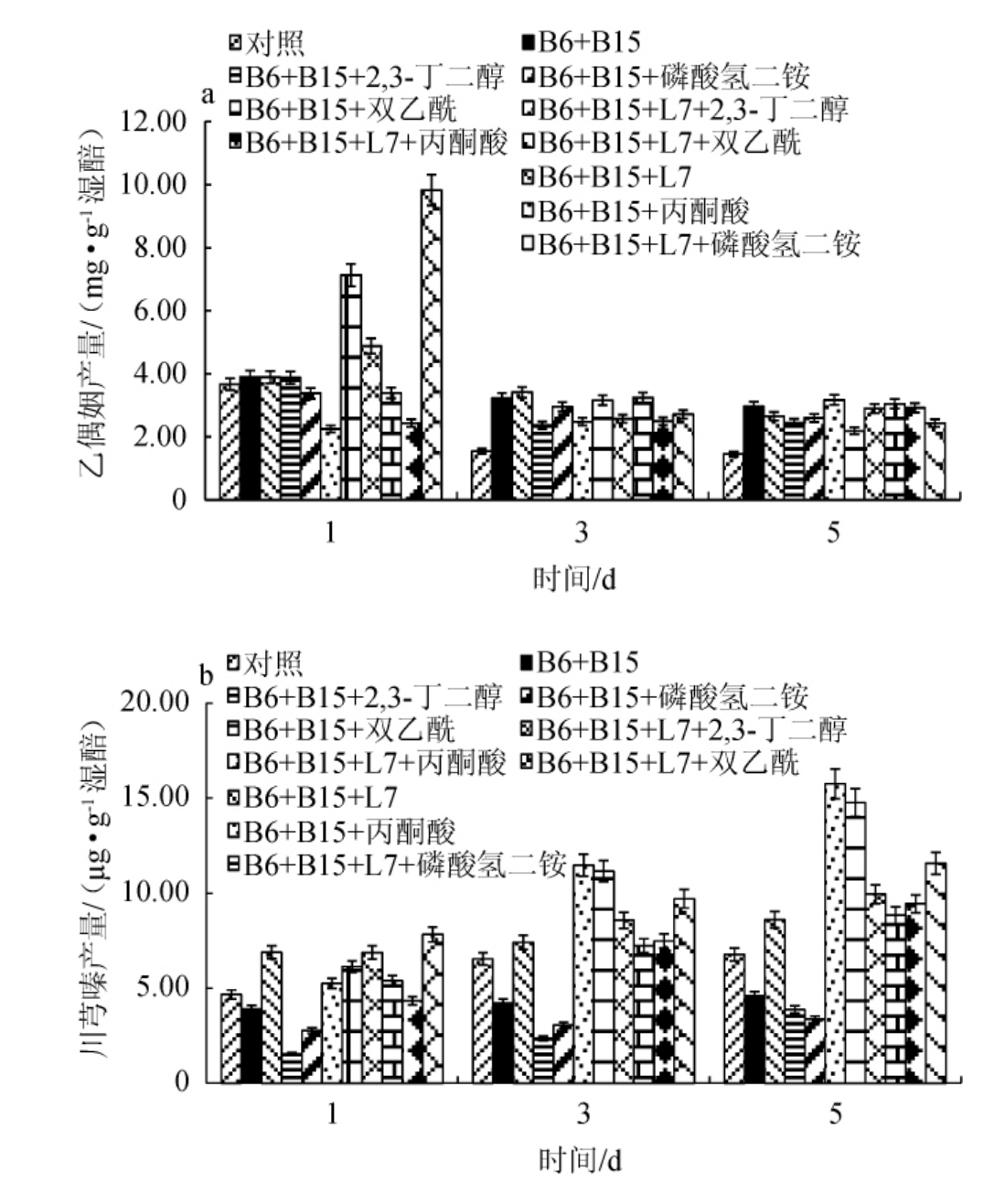
图4 醋醅模拟培养基中乙偶姻(a)和川芎嗪产量(b)测定结果
Fig.4 Determination results of acetoin (a) and ligustrazine (b) yield in vinegar fermented grains simulated medium
菌株B6+菌株B15+丙酮酸组合在发酵第5天乙偶姻的产量最高,为3.17 mg/g,丙酮酸可由丙酮酸脱羧酶与另一个分子活性醛共同作用形成乙偶姻,所以在添加丙酮酸后可促进乙偶姻的生成[19]。发酵第5天该组合川芎嗪产量为15.76 μg/g。
添加2,3-丁二醇的组合乙偶姻含量随着发酵天数的增加呈下降趋势。2,3-丁二醇与乙偶姻间存在着相互转化的可逆化学反应[19],在发酵初期,由于2,3-丁二醇的添加促使乙偶姻的生成量明显提高,随着发酵进行,乙偶姻进一步生成川芎嗪,模拟醋醅中的乙偶姻的产量下降。菌株B6+菌株B15+2,3-丁二醇、菌株B6+菌株B15+菌株L7+2,3-丁二醇组合川芎嗪产量分别为3.87 μg/g、9.94 μg/g。添加磷酸氢二铵底物的组合同样也呈现上述变化趋势。
在发酵过程中,微生物代谢可产生α-乙酰乳酸,经过一些列变化生成了双乙酰,最后在双乙酰还原酶的作用下催化双乙酰生成乙偶姻,该反应过程不可逆[26],故添加双乙酰的组合在发酵第1天乙偶姻含量明显高于其他组合,分别达到9.82 mg/g和7.13 mg/g,后续随着发酵进行,乙偶姻含量下降。在发酵第5天菌株B6+菌株B15+菌株L7+双乙酰、菌株B6+菌株B15+双乙酰组合的川芎嗪产量分别为11.57 μg/g、14.76 μg/g。
3 结论
本研究对山西老陈醋醋酸发酵和熏醅过程中川芎嗪及其底物、前体物质的生成进行了研究,并优选高产菌株配比组合进行川芎嗪生成强化。结果证明,在模拟醋醅培养基中添加优良菌株B6+B15联合前体物质丙酮酸,最终可使醋醅中川芎嗪的生成量达15.76 μg/g,比对照组提高132.79%。醋酸发酵过程中微生物群落结构复杂多样,本研究只分析了模拟醋醅中添加优良菌株组合联合底物及前体物质对乙偶姻、川芎嗪生成的影响,其中微生物相关代谢机理还需进一步进行原位醋酸发酵试验来具体研究。
[1] 张少飞.山西老陈醋中川芎嗪成分的分离纯化[D].太原:山西大学,2009.
[2] 温洪宇,王璐,杨依凡,等.发酵醋醅细菌菌株DX-2的分离、鉴定及生长特性研究[J].中国酿造,2012,31(9):75-78.
[3] 丁伟,魏莎莎,闫裕峰,等.山西老陈醋大曲制备过程中理化因子、微生物群落变化及风味形成规律[J].中国酿造,2022,41(5):52-59.
[4] 李弘文,李晓慧,赵文良,等.不同熏醅工艺条件对老陈醋中川芎嗪与丙烯酰胺含量的影响[J].中国酿造,2016,35(7):36-39.
[5] 许春青,李阳,魏莎莎,等.山西老陈醋源萎缩芽孢杆菌细菌素对病原菌群体感应的抑制研究[J].中国酿造,2022,41(4):46-53.
[6] 余鸣春.镇江恒顺香醋风味物质及川芎嗪的分析研究[D].无锡:江南大学,2006
[7] 孙宗保,赵杰文,邹小波,等.镇江香醋特征香气成分加工过程中的变化和形成机理分析[J].中国食品学报,2010,10(3):120-127
[8] 冯斌.富含川芎嗪复合型高活性保健醋研制[D].太原:山西大学,2012.
[9] 李秀鹏,杨套伟,徐美娟,等.过量表达枯草芽孢杆菌乙偶姻还原酶提高2,3-丁二醇产量[J].食品与生物技术学报,2016,35(3):252-257.
[10] 刘会灵,刘栓英,潘龙泽,等.转录调控因子ALsR表达强度对枯草芽孢杆菌合成乙偶姻和2,3-丁二醇的影响[J].应用与环境生物学报,2020,26(4):17-23.
[11] 程玲.产乙偶姻的海洋枯草芽孢杆菌的发酵性能研究[D].大连:大连理工大学,2015.
[12] 史改玲,许女,贾瑞娟,等.山西老陈醋源优良芽孢杆菌菌株的鉴定及筛选[J].中国酿造,2018,37(5):22-27.
[13] 张显.高产乙偶姻枯草芽孢杆菌的代谢工程改造[D].无锡:江南大学,2013.
[14] LI L,WEI X T,YU W P,et al.Enhancement of acetoin production from Bacillus licheniformis,by 2,3-butanediol conversion strategy:Metabolic engineering and fermentation control[J].Process Biochem,2017,57(6):35-42.
[15] 吴林寰.整合型元基因组序列分析平台构建及其在酿醋微生物群落功能研究中的应用[D].无锡:江南大学,2016.
[16] FAVERI D D,TORRE P,MOLINARI F,et al.Carbon material balances and bioenergetics of 2,3-butanediol bio-oxidation by Acetobacter hansenii[J].Enzyme Microb Tech,2003,33(5):708-719.
[17] 李雅茹,闫裕峰,陈旭峰,等.传统发酵食品中乳酸菌的分离鉴定、基因分型及优良菌株筛选[J].中国酿造,2019,38(4):89-94.
[18] 任潇,纪晓俊,孙世闻,等.肌酸比色法快速测定发酵液中3-羟基丁酮的含量[J].食品科技,2009,34(8):260-263.
[19] 刘娜.镇江香醋醋酸发酵过程川芎嗪前体的生物合成途径研究[D].无锡:江南大学,2016.
[20] 张茜,赵红年,李丽华,等.浅谈熏醅工艺[J].中国酿造,2013,32(12):125-127.
[21] 马玉敏,郎繁繁,闫裕峰.山西老陈醋熏醅工艺研究及发展现状[J].中国酿造,2020,39(1):17-20.
[22] 许女,张天震,樊玮鑫,等.山西老陈醋酿造过程中香气成分的动态变化[J].中国食品学报,2018,18(11):204-216.
[23] 李江涌,王如福,焦玉双.山西老陈醋熏酷前后香气成分的变化分析[J].中国酿造,2016,35(9):47-50.
[24] XIAO Z J,LU J R.Strategies for enhancing fermentative production of acetoin:A review[J].Biotechnol Adv,2014,32(2):492-503.
[25] JABLONSKI M,MÜNSTERMANN F,NORK J,et al.Capacitive fieldeffect biosensor applied for the detection of acetoin in alcoholic beverages and fermentation broths[J]. Physica Status Solidi(a),2021,218(13):2000765.
[26] 田延军.天然乳香香味剂3-羟基丁酮产生菌的构建及制备工艺的研究[D].无锡:江南大学,2016.
[27] 邱婷.产乙偶姻微生物群落的合成及其在传统食醋酿造过程的应用[D].无锡:江南大学,2019.
[28] HAO F,WU Q,XU Y.Precursor supply strategy for tetramethylpyrazine production by Bacillus subtilis on solid-state fermentation of wheat bran[J].Appl Biochem Biotechnol,2013,169:1346-1352.
[29] LI S B,LIU L M,CHEN J.Compartmentalizing metabolic pathway in Candida glabrata for acetoin production[J].Metab Eng,2015,28:1-7.
[30] 杨铭,郝晓娜,罗天淇,等.功能基因分析辅助筛选产双乙酰和乙偶姻乳酸菌[J].食品科学,2020,41(10):117-123.