酒自从出现就与人类的社会生活密不可分,世界卫生组织(world health organization,WHO)的研究报告显示,目前全球15岁以上的人群中约有31亿的饮酒者,占15岁以上总人口的57%,饮酒人群的人均年酒精消费量为15.1 L,人均日酒精消费量32.8 g[1]。目前,饮酒对人类健康的影响,尤其是低剂量饮酒对健康的影响,正逐渐受到社会各界的关注。
2型糖尿病(type 2 diabetes,T2DM)被认为是一种严重威胁人类健康的世界性公共卫生问题,很多环境和生活因素都被认为具有诱发、加重T2DM的风险[2-3],流行病学调查研究表明,饮酒和T2DM的发生、发展有一定的联系[4-6]。有研究结果显示,任何剂量的酒精摄入都会增加男性T2DM的患病风险;但对于女性在日酒精摄入量低于10 g的情况下反而可降低T2DM的患病风险,高于10 g则会增加患病风险[7],说明低剂量酒精摄入对T2DM的影响可能存在着性别差异。
为进一步了解低剂量酒精摄入对T2DM的影响是否存在性别差异及可能机制,本研究以人体日酒精摄入量10 g作为低剂量酒精摄入标准,对T2DM雌、雄小鼠连续灌胃30 d,对各组小鼠的糖脂代谢相关指标进行检测,并对小鼠胰腺组织病理学损伤和氧化应激水平进行分析,以期为进一步阐明低剂量饮酒对T2DM的影响提供参考。
1 材料与方法
1.1 材料与试剂
无特定病原体(specific pathogen free,SPF)级昆明小鼠:6~8周龄,体质量(20±2)g,购自于湖北省实验动物研究中心,饲养于SPF级实验动物房中,小鼠置于无病原专用鼠笼内,每天12 h光照和12 h黑暗,允许自由进食和饮水。动物饲养室内温度控制在20~25 ℃,室内相对湿度为50%~70%,保持室内安静,避免强光照。
基础饲料:湖北省实验动物研究中心;高脂高糖饲料:上海集奇生物科技有限公司;二甲双胍片(500 mg/片):浙江亚太药业股份有限公司;链脲佐菌素(streptozotocin,STZ)、2',7'-二氯荧光黄双乙酸盐(2',7'-dichlordihydrofluorescein diacetate,DCFH-DA)、硫代巴比妥酸(2-thiobarbituric acid,TBA):美国Sigma-Aldrich公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、还原型谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、胰岛素酶联免疫分析试剂盒:南京建成生物工程研究所;葡萄糖激酶(glucokinase,GK)活性、肝糖原检测试剂盒:上海侨杜生物科技有限公司;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒、干扰素γ(interferon-γ,INF-γ)检测试剂盒:美国eBioscience公司;胰岛素免疫组化试剂盒:南京烁朴生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
590血糖仪及试纸:江苏鱼跃医疗设备有限公司;ELx800酶标仪:美国Bio-Tek公司;Hide Chameleon V多功能荧光酶标仪:芬兰Hidex公司;5424R低温冷冻离心机:德国Eppendorf公司;DP73显微镜:日本Olympus公司。
1.3 方法
1.3.1 T2DM模型的构建[8-9]
首先采用基础饲料对小鼠进行一周适应性饲养。一周后,随机选取40只小鼠(雌雄各20只)全程采用基础饲料饲养,其他小鼠全程采用高脂高糖饲料进行饲养。采用STZ对高脂高糖饲料喂养小鼠进行处理,构建T2DM模型:小鼠经高脂高糖饲料喂养4周后,首次进行STZ(50 mg/kg)腹腔注射,注射前12 h小鼠禁食不禁水。随后每3天注射一次STZ,全过程小鼠共注射3次STZ,除每次注射前12 h进行禁食外,其他时段小鼠均自由进食进水。3次STZ注射完成一周后,对小鼠进行12 h禁食,随后采用尾静脉取血方式取血样,测定小鼠的空腹血糖(fasting blood glucose,FBG),以FBG>11.1 mol/L视为建模成功。随机选取建模成功的雌雄小鼠各60只进行后续实验。
1.3.2 实验动物分组及酒精暴露
将实验动物按表1分为10组进行相应的处理,以1个酒精单位,即10 g纯酒精/天,作为低剂量酒精摄入标准[7],对人群暴露剂量与小鼠暴露剂量进行等效换算[10],得出本实验中小鼠酒精的灌胃暴露剂量为0.033 mL/d。阳性对照组二甲双胍给药剂量为200 mg/(kg·d)[11],连续灌胃周期为30 d。
表1 实验小鼠分组与处理
Table 1 Grouping and treatment of mice
1.3.3 小鼠体质量增长量的测定
小鼠在酒精灌胃暴露第1天称体质量,记为初始体质量,在最后一次酒精灌胃暴露后,对小鼠进行禁食不禁水12 h后称体质量,记为终体质量,计算小鼠体质量增长量,其计算公式如下:
1.3.4 小鼠血清相关指标的测定
在最后一次酒精灌胃暴露后,对小鼠进行禁食不禁水12 h,随后对小鼠进行断尾取血,使用血糖仪检测小鼠FBG。最后一次酒精灌胃暴露后,对小鼠进行禁食不禁水12 h,所有小鼠均按2.00 g/kg剂量灌胃葡萄糖溶液,分别于葡萄糖灌胃后0 h、0.5 h、1.0 h和2.0 h对小鼠进行断尾取血测定血糖水平,计算血糖曲线下面积(area under the curve of blood glucose,AUC)[12]。参照试剂盒说明书测定小鼠血清中的TC、TG、LDL-C、HDL-C及胰岛素含量。
1.3.5 小鼠肝脏和胰腺组织样品的制备
最后一次酒精暴露结束24 h后,用颈椎脱臼法处死小鼠,取小鼠胰腺组织和肝组织。每组随机选择3只小鼠胰腺组织置于4%的多聚甲醛中进行固定,制作组织切片,其余胰腺组织及肝组织制备组织匀浆。将所取组织置于冷的磷酸盐缓冲液(phosphate buffered saline,PBS)(pH=7.5)中洗净,用吸水纸吸干水分,然后放至玻璃匀浆器中,加入冷的磷酸盐缓冲液制成10%的组织匀浆,然后在4℃下以10000r/min离心10 min,将上清分装置于-80 ℃冰箱待使用。
1.3.6 小鼠胰腺组织中胰岛损伤的观察及胰岛素表达情况
对小鼠胰腺组织进行石蜡包埋和切片后,进行苏木素-伊红(hematoxylin and eosin,H&E)染色[13],随后在显微镜下进行切片观察。按照试剂盒说明对小鼠胰腺组织进行胰岛素免疫组化(immunohistochemistry,HIS)染色,随后在显微镜下进行切片观察,对HIS染色切片随机选择5个阳性视野区域,使用IPP 6.0软件测定每张胰岛素HIS切片阳性区域显色深浅,以平均光密度(optical density,OD)值来衡量,并进行定量分析[14-15]。
1.3.7 小鼠肝脏组织及胰腺组织相关指标的测定
采用Lowry法测定组织匀浆中的蛋白质含量[16]。按照试剂盒说明书检测小鼠肝脏组织匀浆上清液中的GK活性及肝糖原含量。采用磷酸盐缓冲液将小鼠胰腺组织匀浆上清液稀释10倍,采用DCFH-DA法检测活性氧簇(reactive oxygen species,ROS)相对表达量,使用相对荧光强度进行衡量[17]。使用TBA法测定小鼠胰腺组织匀浆上清液中的丙二醛(malondialdehyde,MDA)含量[18]。按试剂盒说明书测定小鼠胰腺组织匀浆上清液中的GSH、TNF-α和INF-γ含量及SOD活性。
1.3.8 数据处理
采用SPSS 13.0分析数据,使用GraphPad Prism 8.0生成数据统计图,使用t检验分析差异性,P<0.05表示两组之间具有显著性差异。
2 结果与分析
2.1 雌雄小鼠糖脂代谢相关指标变化情况
雌、雄小鼠糖脂代谢相关指标的变化分别见表2和表3。
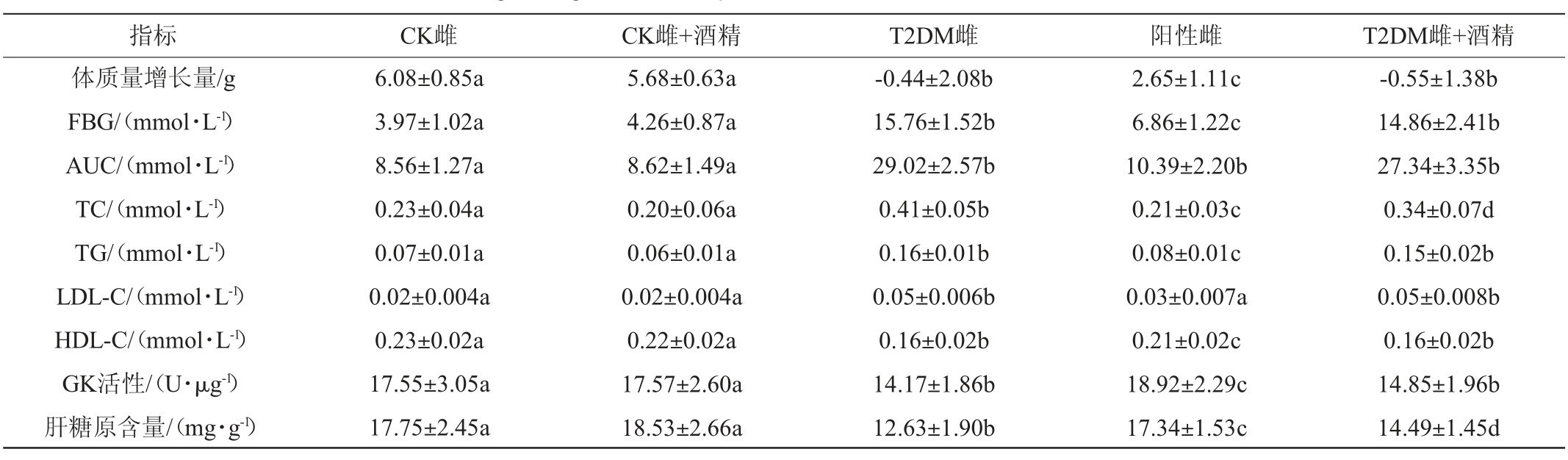
表2 雌性小鼠糖脂代谢相关指标的变化
Table 2 Changes of glucose and lipid metabolism related indexes in female mice
注:不同小写字母表示差异显著(P<0.05)。下同。
表3 雄性小鼠糖脂代谢相关指标的变化
Table 3 Changes of glucose and lipid metabolism related indexes in male mice
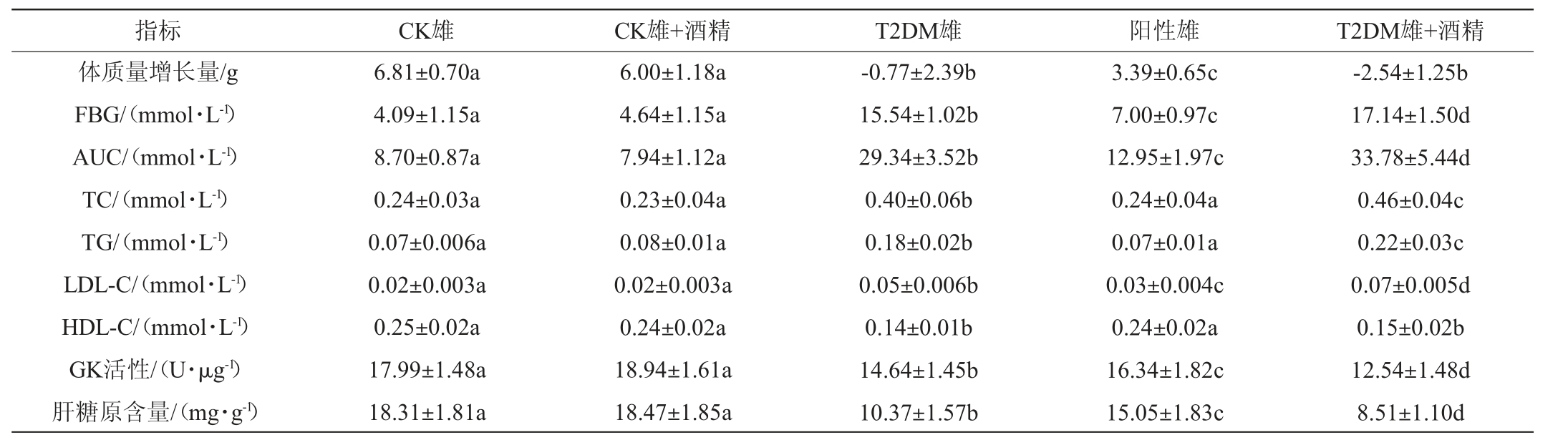
由表2及表3可知,与CK组小鼠相比,建模后T2DM雌、雄小鼠的FBG显著升高(P<0.05),GK活性、肝糖原含量和体质量增长量显著下降(P<0.05),TC、TG、LDL-C含量显著升高(P<0.05),而HDL-C含量显著下降(P<0.05),说明T2DM模型构建成功。与T2DM小鼠相比,阳性对照组小鼠相关指标改变情况得到了显著的缓解(P<0.05),FBG也已下降至建模标准以下,同时,阳性组雌性小鼠的TC、LDL-C和肝糖原含量、GK活性,以及阳性组雄性小鼠的TC、TG和HDL-C含量均已恢复至CK组水平。
连续30 d摄入低剂量酒精后,CK组小鼠并未出现显著性改变(P>0.05),但T2DM小鼠糖脂代谢相关指标的变化情况出现了差异。低剂量酒精摄入进一步加重了T2DM雄性小鼠糖脂代谢相关指标的紊乱情况;但对T2DM雌性小鼠影响较小,仅TC及肝糖原含量出现了一定程度的改变(P<0.05)。说明低剂量的酒精摄入可以加重T2DM雄性小鼠糖脂代谢紊乱情况,T2DM症状加剧。
2.2 小鼠胰腺组织的病理学观察及胰岛素表达情况
小鼠胰腺组织切片H&E染色结果见图1。
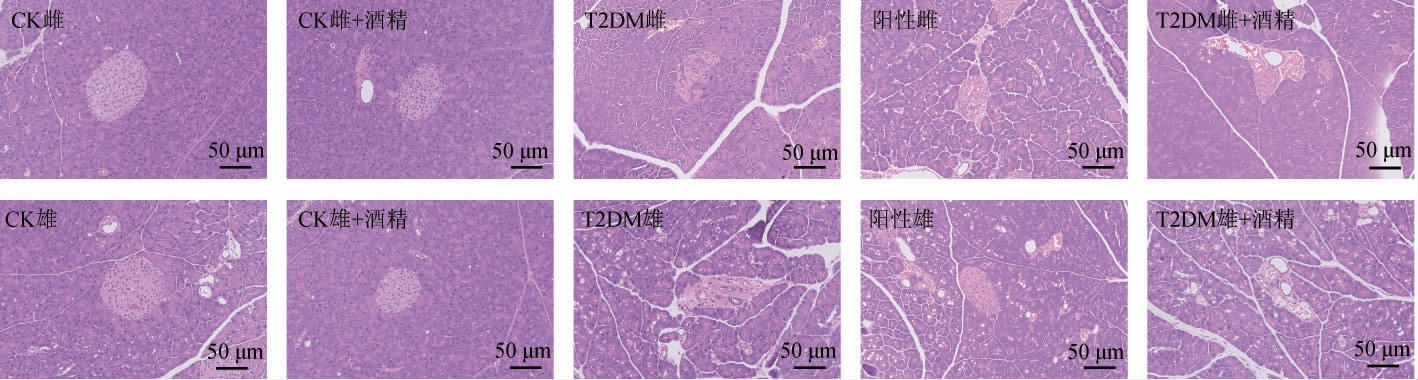
图1 小鼠胰腺组织病理学观察
Fig.1 Histopathological observation of pancreatic tissue of mice
由图1可知,CK组小鼠胰腺组织切片中胰岛的形状规则,呈圆形或椭圆形,胰岛边缘清晰,胰岛中细胞分布均匀,胰岛外周浆液性腺泡胞浆丰富,排列整齐。而T2DM小鼠胰岛出现了不同程度的萎缩,边缘不整,胰岛中央细胞稀疏、分布不均匀。阳性对照小鼠与T2DM小鼠相比,胰岛损伤有明显改善,但胰岛仍然存在一定萎缩和边缘不整的情况。低剂量酒精摄入后,CK组小鼠胰腺组织中的胰岛并未出现明显的病理学损伤,同时T2DM雌性小鼠胰岛损伤也未进一步加重,但T2DM雄性小鼠胰岛进一步萎缩,胰岛中央细胞更加稀疏。说明低剂量酒精摄入对T2DM雌性小鼠胰岛损伤并无影响,但进一步加重了T2DM雄性小鼠胰岛损伤。
对小鼠胰腺组织切片进行胰岛素HIS染色,结果见图2,小鼠胰岛素HIS染色的平均OD值及含量见图3。
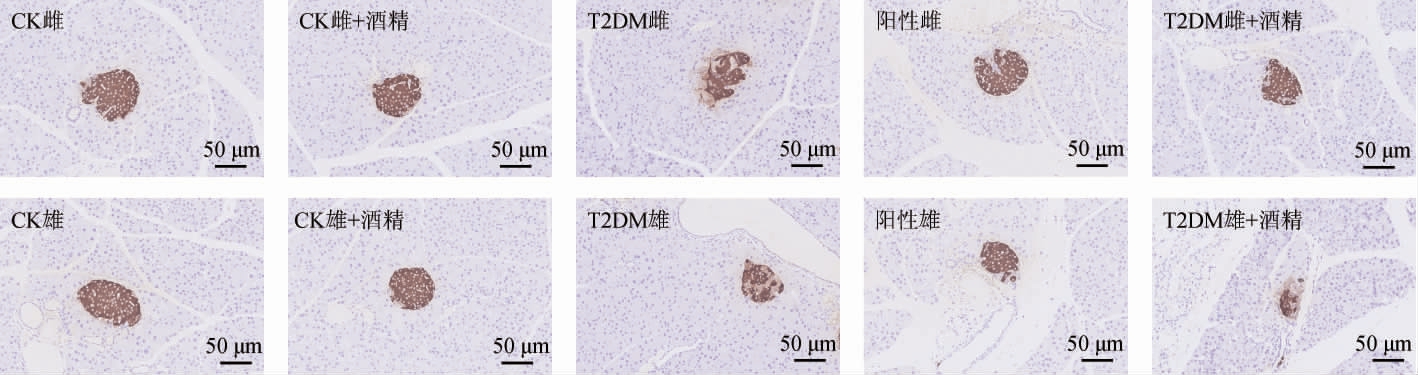
图2 小鼠胰腺组织的胰岛素免疫组化染色结果
Fig.2 Insulin immunohistochemical staining results of pancreatic tissue of mice
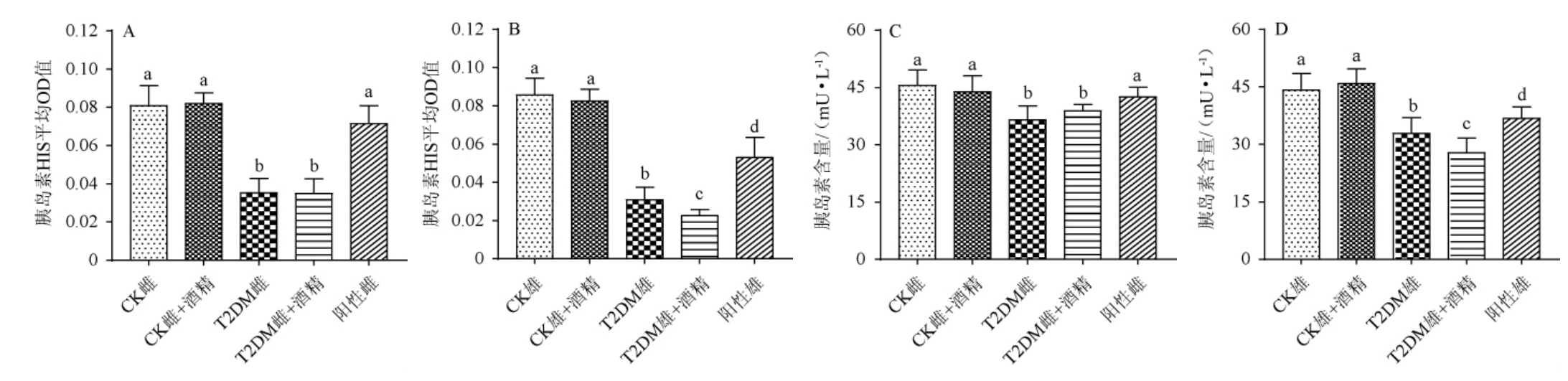
图3 小鼠胰岛素免疫组化染色的平均OD值及含量
Fig.3 Average OD value and content of insulin immunohistochemical staining of mice
由图2和图3可知,各组小鼠胰腺组织均有胰岛素的表达。与CK组相比,T2DM小鼠胰岛素HIS染色的平均OD值均显著下降(P<0.05),而与T2DM小鼠相比,阳性对照组小鼠胰岛素HIS染色的平均OD值显著升高(P<0.05),且阳性对照组雌性小鼠胰岛素HIS染色的平均OD值已恢复至CK组水平(P>0.05),但阳性对照雄性小鼠胰岛素HIS染色的平均OD值显著低于CK组(P<0.05)。同时,低剂量酒精的摄入并未显著改变CK组小鼠以及T2DM雌性小鼠胰岛素HIS染色的平均OD值(P>0.05),但是进一步的降低了T2DM雄性小鼠胰岛素HIS染色的平均OD值(P<0.05)。由图3可知,小鼠血液中胰岛素水平变化情况与胰腺组织切片胰岛素HIS染色的平均OD值变化情况类似。说明低剂量的酒精摄入对T2DM雌性小鼠胰腺组织和血液中胰岛素水平均无显著性影响,但能进一步降低T2DM雄性小鼠胰腺组织和血液中胰岛素的表达水平。
2.3 小鼠胰腺组织氧化应激水平变化情况
氧化应激是机体内氧化和抗氧化平衡紊乱导致的一种功能失调状态,是引起机体细胞损伤、死亡的重要机制之一,与T2DM的发生和发展有密切的联系[19-21]。细胞内ROS的过量积累会导致生物大分子的损伤[22-23],持续高水平的ROS会进一步促进炎症因子的产生,诱导炎症反应的发生[24-25]。小鼠胰腺组织氧化应激水平的变化见表4和表5。
表4 雌性小鼠胰腺组织氧化应激水平的变化
Table 4 Changes of oxidative stress level of pancreatic tissue of female mice
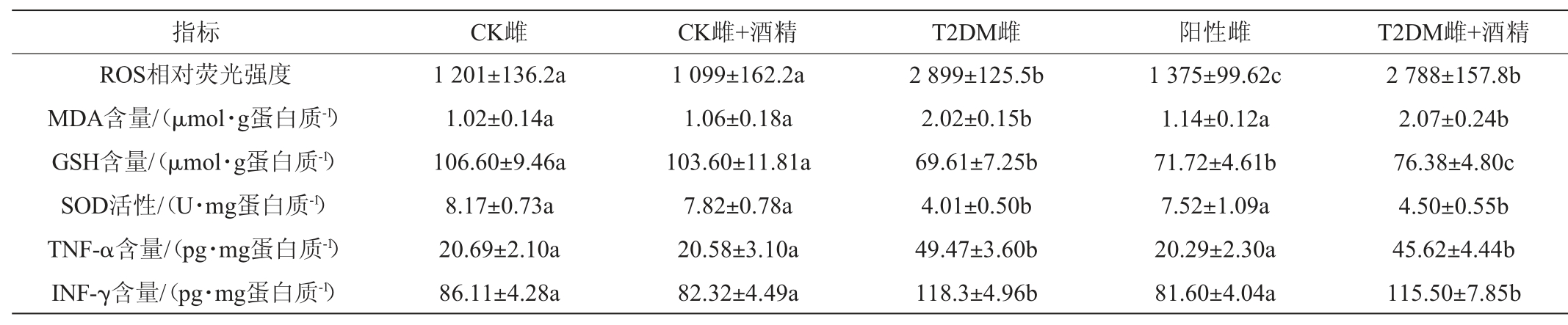
表5 雄性小鼠胰腺组织氧化应激水平的变化
Table 5 Changes of oxidative stress level of pancreatic tissue of male mice
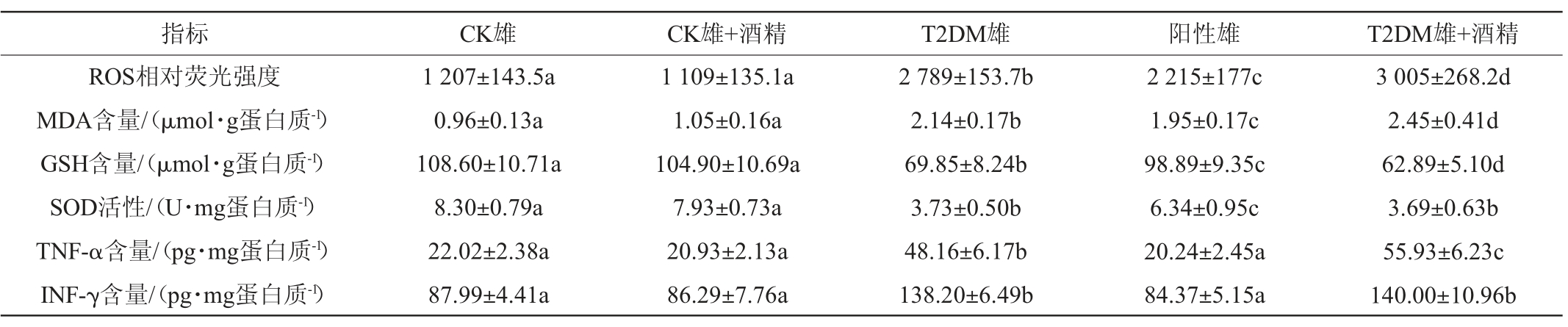
由表4及表5可知,与CK组相比,T2DM小鼠胰腺组织ROS表达量、脂质过氧化物MDA和炎症因子TNF-α、INF-γ的表达量均显著升高(P<0.05),而还原性氨基酸GSH含量和抗氧化酶SOD活性显著下降(P<0.05),说明T2DM小鼠胰腺组织氧化应激水平显著升高,部分炎症因子表达量也在增大。阳性对照组小鼠与T2DM小鼠相比,相关指标改变情况出现了显著性的缓解,阳性对照组雌性小鼠MDA、TNF-α、INF-γ表达量及SOD活性,以及阳性对照雄性小鼠TNF-α、INF-γ表达量均已恢复至CK组水平。
连续30 d摄入低剂量酒精后,CK组小鼠并未出现显著性改变(P>0.05),但T2DM小鼠氧化应激指标的变化情况出现了差异。低剂量酒精摄入后,T2DM雌性小鼠胰腺组织只有GSH水平出现了一定的上升(P<0.05),其他指标均未发生变化(P>0.05);而T2DM雄性小鼠胰腺组织ROS、MDA、TNF-α的表达量进一步升高(P>0.05),GSH表达量进一步下降(P>0.05)。说明低剂量酒精摄入进一步加剧了T2DM雄性小鼠胰腺组织氧化应激,对T2DM雌性小鼠胰腺组织氧化应激水平并未产生显著性的影响。
3 结论
采用链脲佐菌素(STZ)处理高脂高糖饲料喂养的小鼠构建T2DM模型,以灌胃200 mg/(kg·d)二甲双胍的T2DM小鼠为阳性对照,连续灌胃低剂量酒精(0.033 mL/d)30 d后,T2DM雄性小鼠的糖脂代谢紊乱情况及胰腺组织中胰岛损伤情况加重,胰岛素表达量降低,T2DM雄性小鼠胰腺组织氧化应激水平上调,但T2DM雌性小鼠未产生显著影响,推测胰腺组织氧化应激水平的差异性影响可能是低剂量酒精对不同性别T2DM小鼠产生差异影响的主要机制之一。后续研究中,可通过分析不同剂量酒精对T2DM雌雄小鼠氧化应激信号通路关键分子的作用,进一步揭示低剂量酒精对T2DM产生性别差异性影响的分子机制,为阐明低剂量饮酒对T2DM的影响提供参考。
[1] WORLD HEALTH ORGANIZATION.Global status report on alcohol and health 2018[M].Geneva:World Health Organization Press,2018:40-43.
[2] 孙元鹏,陈拥彬.2型糖尿病环境风险因素研究进展[J].湖北科技学院学报(医学版),2018,32(1):89-92.
[3] WU Y L,DING Y P,TANAKA Y,et al.Risk factors contributing to type 2 diabetes and recent advances in the treatment and prevention[J]. Int J Med Sci,2014,11(11):1185-1200.
[4] 李至韬,李玟,费宇,等.职业人群的糖尿病及糖尿病前期患病现状及影响因素分析[J].现代预防医学,2021,48(12):2161-2165.
[5] 李敏,祁志刚,顾云娟,等.糖尿病家族史和血脂异常对糖尿病患病风险的交互作用[J].中华疾病控制杂志,2021,25(3):300-305.
[6] KNOTT C,BELL S,BRITTON A.Alcohol consumption and the risk of type 2 diabetes: A systematic review and dose-response meta-analysis of more than 1.9 million individuals from 38 observational studies[J].Diabetes Care,2015,38(9):1804-1812.
[7] GRISWOLD M G,FULLMAN N,HAWLEY C.Alcohol use and burden for 195 countries and territories,1990-2016:a systematic analysis for the global burden of disease study 2016[J]. Lancet,2018,392(10152):1015-1035.
[8] 刘泽鑫,刘畅,钱和.锁掷酵母粉对糖尿病小鼠肝、肾的保护作用[J].中国酿造,2019,38(6):180-112.
[9] 常松林,高晓余,柳双凤,等.α-亚麻酸对高脂饮食和链脲佐菌素诱导Ⅱ型糖尿病模型小鼠的降血糖作用[J].中国食品学报,2021,21(10):86-94.
[10] 李才.人类疾病动物模型的复制[M].北京:人民卫生出版社,2018:60-62.
[11] 陈小敏,谭书明,黄颖,等.刺梨、桑叶、苦瓜饮料对糖尿病小鼠的降糖作用[J].中国酿造,2019,38(6):123-127.
[12] 陆敏涛,任廷远,杨建,等.花椒精油对链脲佐菌素诱导的糖尿病小鼠糖代谢的影响[J].食品科学,2020,42(9):115-122.
[13] 王生亚,薛洁,徐乃玉,等.青稞多糖对糖尿病模型小鼠的降血糖作用及机制研究[J].中国药房,2021,32(7):807-811.
[14] LIU X D,ZHANG Y C,YANG X.Vitamin E reduces the extent of mouse brain damage induced by combined exposure to formaldehyde and PM2.5[J].Ecotoxicol Environ Saf,2019,172:33-39.
[15] LIU X D,ZHANG Y C,LI J Q,et al.Cognitive deficits and decreased locomotor activity induced by single-walled carbon nanotubes and neuroprotective effects of ascorbic acid[J]. Int J Nanomedicine,2014,9:823-839.
[16] IKAWA M,SCHAPER T D,DOLLARD C A,et al.Utilization of Folin-Ciocalteu phenol reagent for the detection of certain nitrogen compounds[J].J Agr Food Chem,2003,51(7):1811-1815.
[17] 钟柏华,付超,刘旭东,等.单壁碳纳米管致昆明小鼠脑组织的氧化损伤[J].环境科学学报,2014,34(2):1-7.
[18] GE S Z,YAN B,HUANG J W,et al.Diisodecyl phthalate aggravates the formaldehyde-exposure-induced learning and memory impairment in mice[J].Food Chem Toxicol,2019,126:152-161.
[19] YARIBEYGI H,SATHYAPALAN T,ATKIN S L,et al.Molecular mechanisms linking oxidative stress and diabetes mellitus[J].Oxid Med Cell Longev,2020,2020:8609213.
[20] 韩晓瑜,李嘉斌,丁杰英,等.姜黄素对糖尿病肾病小鼠肾脏自噬及氧化应激的影响[J].中成药,2021,43(6):1598-1602.
[21] 李丽,梁丽清,庞珍莲,等.地菍粗多糖对STZ致糖尿病小鼠血糖、血脂及抗氧化作用的影响[J].中国老年学杂志,2021,41(10):2153-2156.
[22] DAS M,BABU K,REDDY N P,et al.Oxidative damage of plasma proteins and lipids in epidemic dropsy patients: Alterations in antioxidant status[J].Biochim Biophys Acta,2005,1722(2):209-217.
[23] GAŁAZYN-SIDORCZUK M,BRZÓSKA M M,JURCZUK M,et al.Oxidative damage to proteins and DNA in rats exposed to cadmium and/or ethanol[J].Chem Biol Interact,2009,180(1):31-38.
[24] BROWN D M,DONALDSON K,BORM P J,et al.Calcium and ROSmediated activation of transcription factors and TNF-alpha cytokine gene expression in macrophages exposed to ultrafine particles[J].Am J Physiol Lung Cell Mol Physiol,2004,286(2):L344-L353.
[25] SHANKAR E,VYKHOVANETS E V,VYKHOVANETS O V,et al.High-fat diet activates pro-inflammatory response in the prostate through association of Stat-3 and NF-κB[J].Prostate,2012,72(3):233-243.