高温大曲主要作为酱香型白酒生产的糖化发酵剂,由小麦经过粉碎拌水后压制成曲坯。由于采用生料制曲且在开放式环境中进行培菌发酵,来源于原料、水和环境的微生物在特定的温度和湿度控制下参与大曲微生物群落的组装和演替,从而形成高温大曲特有的微生物群系、酿酒酶系和香味前体物质[1]。不同地区和不同生产工艺的高温大曲中微生物群落结构存在差异,但其优势细菌属主要为芽孢杆菌属(Bacillus)、糖多孢菌属(Saccharopolyspora)、高温放线菌属(Thermoactinomyces)、泛菌属(Pantoea)、克罗彭施泰特氏菌属(Kroppenstedtia)和乳球菌属(Lactococcus)等。优势真菌主要为曲霉属(Aspergillus)、嗜热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces)[2]。环境温度较低时,霉菌大量繁殖,产生较高水平的蛋白酶。随着培菌的进行,环境温度升高,最高可达60~70 ℃,在此阶段,耐热细菌和嗜热真菌占据优势地位,发生复杂的反应生成大量代谢物[3]。
此前的研究多集中于制曲环境微生物和原料微生物,而忽略了制曲辅料微生物对大曲微生物群落的影响[4]。稻草由于其良好的保温性能,常作为曲块保温的材料在培菌过程中包裹曲块,减少曲块在培菌过程中的热量散失[5]。其次,稻草粘连性较强,起到了隔离曲块、提高对大曲微生物氧气供给的能力,同时,稻草良好的吸水和排潮性能对大曲水分含量也起到一定调节作用。稻草携带丰富的微生物,首次投入使用的新稻草中的微生物可以丰富大曲培菌初期微生物的种类,参与到初期复杂的菌群演替和代谢活动中;一轮发酵结束后,已使用一轮的稻草成为陈稻草,经过质量评价符合标准可重新用于新一轮的发酵,陈稻草中富集了大量培菌过程中的优势微生物,表现出与大曲微生物相似的群落特征,再度利用可以为新一轮制曲培菌过程接种所需的菌种[5]。目前,高温大曲实际生产过程中关于新稻草和陈稻草的选用仅依靠经验和粗略的感官评价,针对这两种稻草菌群差异的研究甚少。
本研究结合传统培养法和三代全长高通量测序技术对新稻草和陈稻草的微生物菌群进行全面分析,探究两者菌群结构和微生物代谢的差异,从微生物学的角度为制曲过程中稻草的选用提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
稻草样品:采集于中国四川某著名酱香型白酒酒企6号制曲车间,新稻草于常温条件下存放于辅料仓库;陈稻草采集于培菌仓,已经过一轮的高温培菌发酵(40 d),在不同位置取三份,相同条件下粉碎装于无菌袋,分别于4 ℃和-80 ℃保存用于后续微生物传统培养和测序分析。
1.1.2 化学试剂
土壤基因组试剂盒:美国Bio-Tek公司;Taq DNA聚合酶(5 U/μL):生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
平板计数琼脂(plate count agar,PCA)培养基、MRS培养基、孟加拉红氯霉素琼脂(rose bengal chloramphenicol agar,RBCA)培养基(氯霉素质量浓度为100 μg/mL):北京奥博星生物技术有限公司。
1.2 仪器与设备
DHP-9052生化培养箱:上海一恒科学仪器有限公司;LDZF-75L-I立式高压蒸汽灭菌器:上海申安医疗器械厂;DYY-6C电泳仪:北京六一生物科技有限公司;BG-gdsAUTO(130)凝胶成像系统:北京百晶生物技术有限公司;TGL-16B冷冻离心机:上海安亭有限责任公司。AG 223B1聚合酶链式反应(polymerase chain reaction,PCR)仪:德国EPPENDORF公司。
1.3 方法
1.3.1 传统培养法
取新稻草和陈稻草粉碎样品各5.0 g,用无菌生理盐水进行梯度稀释,选择合适稀释倍数的稀释液,每个稀释度3个平行。总好氧性细菌总数、耐热菌总数:采用PCA培养基分别在37 ℃和55 ℃条件下培养12~24 h[6];乳酸菌总数:采用MRS培养基加入终质量浓度为500μg/mL的纳他霉素于30℃条件下培养1~2 d[7];真菌总数:采用RBCA培养基于30 ℃条件下培养2~3 d[8];真菌为倾注培养,细菌均为涂布培养。
1.3.2 三代全长高通量测序分析
采用土壤基因组试剂盒提取稻草样品微生物基因组DNA,DNA质检合格后,以其为模板进行PCR扩增,使用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-ACCTTGTTACGACTT-3')对稻草样品中细菌的16S V5-V7区基因序列进行PCR扩增[9],使用引物内转录间隔区(internal transcribed spacer,ITS)1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和LR3(5'-CCGTGTTTCAAGACGGG-3')对稻草样品中真菌的ITS区基因序列进行PCR扩增[10],PCR扩增体系和条件参照ZHANG Y D等[11]的方法。采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测,将检验合格的PCR扩增产物送至上海派森诺生物技术有限公司进行Pacbio SMRT测序。
1.3.3 生信分析和数据处理
原始数据通过去引物、质量过滤、去噪、拼接和去嵌合体等步骤以100%相似度聚类产生特征序列扩增子序列变异体(amplicon sequence variants,ASV),基于核糖体数据库(ribosomal database project,RDP)网站下载的相应功能基因的seeds蛋白序列,对核酸序列中的插入和缺失错误进行纠正[12]。稻草细菌的16S rRNA基因在Greengenes数据库进行分类注释,而真菌ITS对比Unite 8数据库。使用QIIME2(2019.4)软件对微生物进行物种组成分析、Alpha多样性和Beta多样性分析,并以树图的形式绘制微生物分类等级树,通过Python线性判别分析效应量(linear discriminant analysis effect size,LEfSe)分析包将非参数的Kruskal-Wallis以及Wilcoxon秩和检验,使用PICRUSt 2软件预测样本功能丰度。利用R v4.1.1进行单因素方差分析(analysis of variance,ANOVA)和Duncan检验计算样品间的显著性(P<0.05)[13]。利用Prism 8和R studio v4.1.1进行数据可视化。
2 结果与分析
2.1 传统培养法菌落计数
使用不同培养基对新稻草和陈稻草中可培养微生物进行菌落计数,结果见图1。由图1可知,两种稻草的乳酸菌总数之间无显著性差异(P>0.05),陈稻草中的菌落总数、耐热菌数和真菌总数均显著高于新稻草(P<0.05)。这是由于铺于不同曲层之间的陈稻草附着了丰富的制曲培菌过程微生物,尤其是耐热的细菌和真菌,在培菌发酵阶段相较于新稻草可培养微生物数量更多。
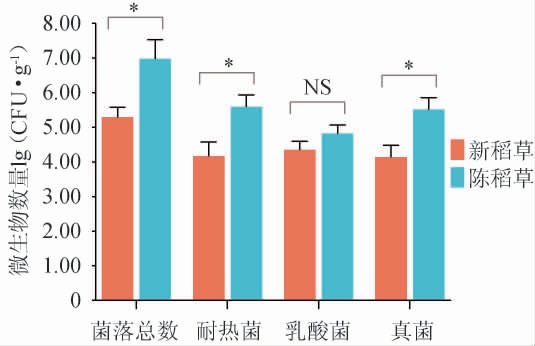
图1 新稻草和陈稻草中可培养微生物计数结果
Fig.1 Counts results of culturable microbiota in new and used straw
“*”表示差异显著(P<0.05),“NS”表示差异不显著(P>0.05)。
2.2 微生物物种组成分析
新稻草和陈稻草中微生物群落结构见图2。由图2a可知,在细菌门水平,新稻草样品中相对丰度最高的为变形菌门(Proteobacteria),平均相对丰度为65.59%,而陈稻草中相对丰度最高的是厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)相对丰度分别为50.95%和44.80%,总占比>95%,占据了绝对优势地位。由图2b可知,在真菌门水平,新稻草和陈稻草的组成结构相似,子囊菌门(Ascomycota)在所有稻草样品中的平均相对丰度均>70%,其中在新稻草中占比略高,平均相对丰度为89.64%。
三代全长测序技术极大提升了微生物属水平鉴定的准确度,由图2c可知,在细菌属水平上,由于新稻草的存放地点和陈稻草的取样位置等的差异,同一种稻草组内的样品平行性欠佳。总的来看,新稻草中泛菌属(Pantoea)(11.84%)和伯克霍尔德菌属(Burkholderia)(9.31%)的平均相对丰度明显高于陈稻草,而陈稻草中相对丰度最高的两个细菌属为芽孢杆菌属(Bacillus)(40.46%)和糖多孢菌属(Saccharopolyspora)(37.73%)。此外,陈稻草组内不同样品之间糖多孢菌(Saccharopolyspora)的相对丰度差异较大。泛菌属、甲基杆菌属(Methylobacterium)、孢囊杆菌属(Cystobacter)和螺旋体属(Spirosoma)在陈稻草中未检出,但在新稻草中均属于相对丰度前10的属。两组样品中葡萄球菌属(Staphylococcus)的平均相对丰度差异较小,均在6%左右。由图2d可知,在真菌属水平上,新稻草中的优势真菌属为曲霉属(Aspergillus)(21.33%)、变形闭囊鞘属(Chromocleista)(13.66%)和节担菌属(Wallemia)(1.18%),而陈稻草中Chromocleista相对丰度最高(59.42%),其次为节担菌属(6.49%)和曲霉属(4.03%)。
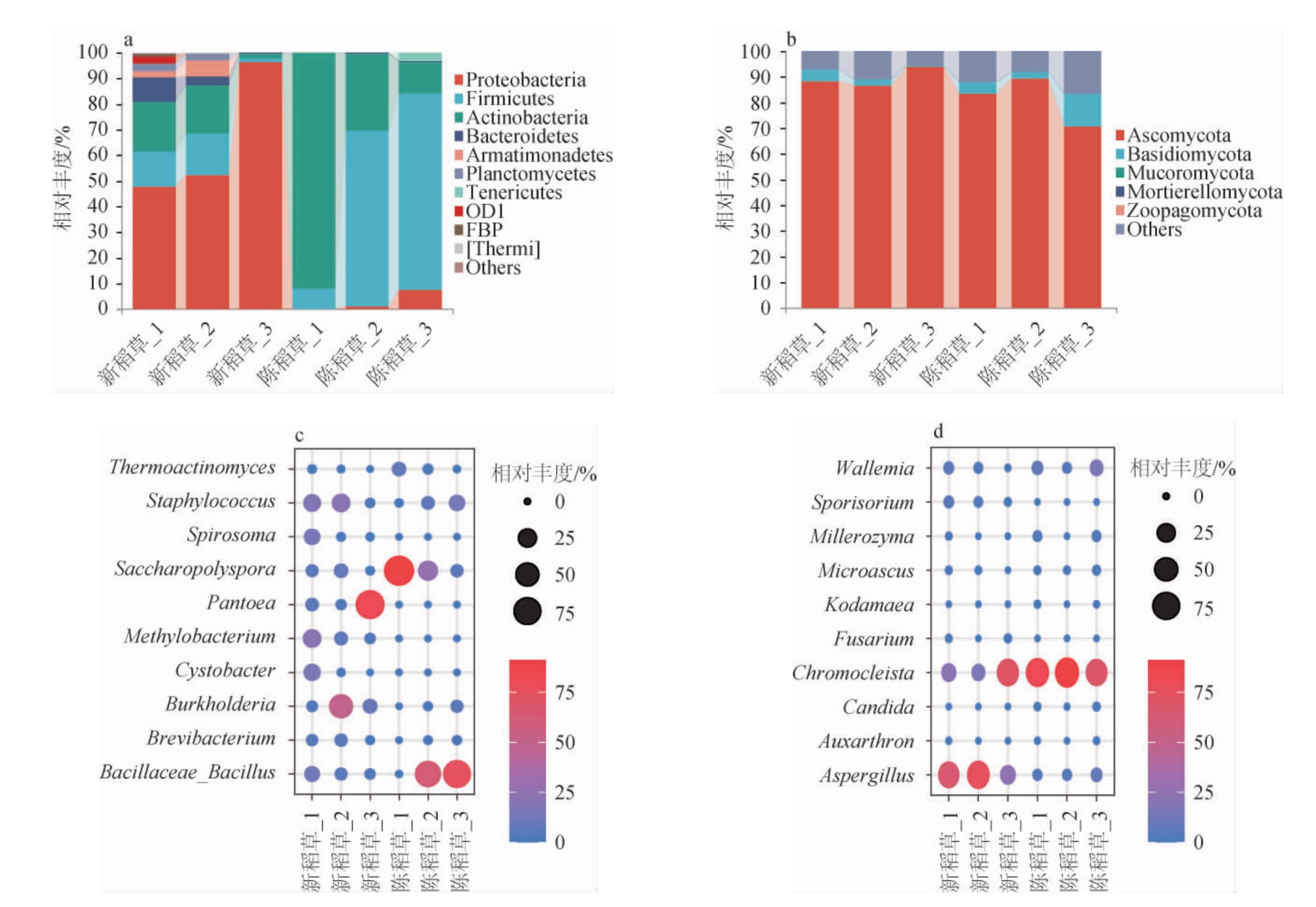
图2 新稻草和陈稻草在门(a,b)和属(c,d)水平的微生物群落结构
Fig.2 Microbial community structure of new and used straw at phylum (a,b) and genus (c,d) levels
综上,新、陈稻草中微生物在细菌门水平群落结构差异明显,而在真菌门水平则相似。两种稻草在细菌和真菌属水平皆差异明显,说明制曲辅料所用的新稻草和陈稻草菌群既具有一定的共性,也存在各自的特性。ZUO Q C等[14]的研究结果表明,芽孢杆菌属、糖多孢菌属和根瘤菌属(Rhizobium)是高温大曲中的优势菌属,这与陈稻草中的细菌菌群结果高度相似,说明陈稻草携带的微生物在培菌发酵的过程中,受到温度的调控和曲房环境微生物的影响,表现出了和大曲菌群相似的群落结构,体现了环境条件对不同来源微生物的塑造作用。DU H等[15]研究发现,泛菌属和曲霉属在酿造原料、车间工具和地面、新制成的大曲中的相对丰度明显高于成熟大曲。本研究中这两种菌属在新稻草中的占比远高于陈稻草,因此可以推测稻草、小麦等原辅料在生长过程中携带较丰富的泛菌属和曲霉属,在车间仓库长期于室温存放,但在高温培菌发酵阶段丰度有所降低。
2.3 微生物群落差异分析
为了更直观地反映不同稻草微生物菌群的分布特征,本研究采用层级树图配合饼图的形式展示样本的分类学全貌,结果见图3a和3b。就细菌而言,Δ-变形菌纲(Deltaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、Armatimonadia、纤维粘网菌纲(Cytophagia)主要分布在新稻草中,而芽孢杆菌纲(Bacilli)、放线菌纲(Actinobacteria)则在陈稻草中的分布占比更高。就真菌而言,各个分类学水平物种在不同样品组的分布差异明显,散囊菌纲(Eurotiomycetes)中的不同目水平物种在两组样品中分布差异较大。酵母纲(Saccharomycetes)和节担菌纲(Wallemiomycetes)主要在陈稻草中检出,而黑粉菌纲(Ustilaginomycetes)几乎全部存在于新稻草中。ZUO Q C等[14]研究发现,α-变形菌纲在高温大曲培菌初期相对丰度较高,约为15%,而在培菌结束时相对丰度降至1%~2%,在本研究中,α-变形菌纲在新稻草中的相对丰度约为17%。推测新稻草对高温大曲起到了接种α-变形菌纲的作用,而不同的稻草接种菌群有差异,这可能影响发酵初始阶段大曲菌群的结构。

图3 新稻草和陈稻草中微生物的分类等级树图及不同样品组微生物非度量多维尺度分析结果
Fig.3 Classification tree of microbiota in new and used straw and nonmetric multidimensional scaling analysis result of microbiota in different sample groups
a和c为细菌;b和d为真菌。图a和b中,最大的圈代表门水平,逐渐缩小的圈按照梯度依次代表纲、目、科、属,使用不同的颜色对不同分类学水平加以区分,通过圈内原点的面积来指示该圈所对应的分类单元的丰度。
此外,本研究基于Bray Curtis距离对测序获得的ASVs进行非度量多维尺度(nonmetric multidimensional scaling,NMDS)[16]分析以补充展示不同稻草细菌和真菌菌群组成的相似性和差异性,结果见图3c和3d。NMDS采用等级排序,近似认为两点之间的距离越近,表明两个样本中微生物群落的差异越小。由图3c和3d可知,细菌和真菌NMDS分析的应力值(Stress)分别为0.000 084 6和0.014 8,远小于0.2,因此分析结果可靠[17]。不同稻草组的样品呈现出明显的聚类,说明新稻草和陈稻草的细菌和真菌组成之间具有较大的差异。
2.4 物种差异与标志物种分析
采用LEfSe分析进一步分析导致两种稻草微生物群落差异的主要物种[18],结果见图4。分类学分枝图展示了样本群落中从门到属主要分类单元的分类等级关系,节点大小对应于该分类单元的平均相对丰度,空心节点代表组间差异不显著的分类单元,而其他颜色的节点则表明这些分类单元体现出显著的组间差异,且在该色所代表分组样本中丰度较高。由图4a可知,对于细菌,新稻草中不同分类学水平可作为生物标志物的共有1个门、3个纲、6个目、9个科和8个属,而陈稻草中仅有1个科和1个属可作为生物标志物。以属水平为主进行分析,四折叠球菌属(Quadrisphaera)、微杆菌属(Microbacterium)、螺状菌属(Spirosoma)、Mucilaginibacter、橙单胞菌属(Aurantimonas)、甲基杆菌属、鞘氨醇单胞菌属(Sphingomonas)和泛菌属在新稻草中的相对丰度均显著高于陈稻草(P<0.05),可作为新稻草样品组的生物标志物,仅糖多孢菌属在陈稻草中占比显著高于新稻草(P<0.05),可作为陈稻草的标志物。由图4c可知,对于真菌,曲霉属和孢堆黑粉菌属(Sporisorium)更多分布在新稻草中作为其生物标志真菌属,而变形闭囊鞘属、念珠菌属(Candida)、微囊菌属(Microascus)和节担菌属是陈稻草中的标志真菌属。同时,由图4b和4d可知,线性判别分析(linear discriminant analysis,LDA)对数得分值均>2,表明上述标志性物种在各样本组中具有特异性。LEfSe分析更直接地阐明了新、陈稻草微生物群落中的代表物种,这有助于进一步在不同分类水平对不同稻草样品组加以区分和辨别,从而表征不同稻草的微生物群落特征。
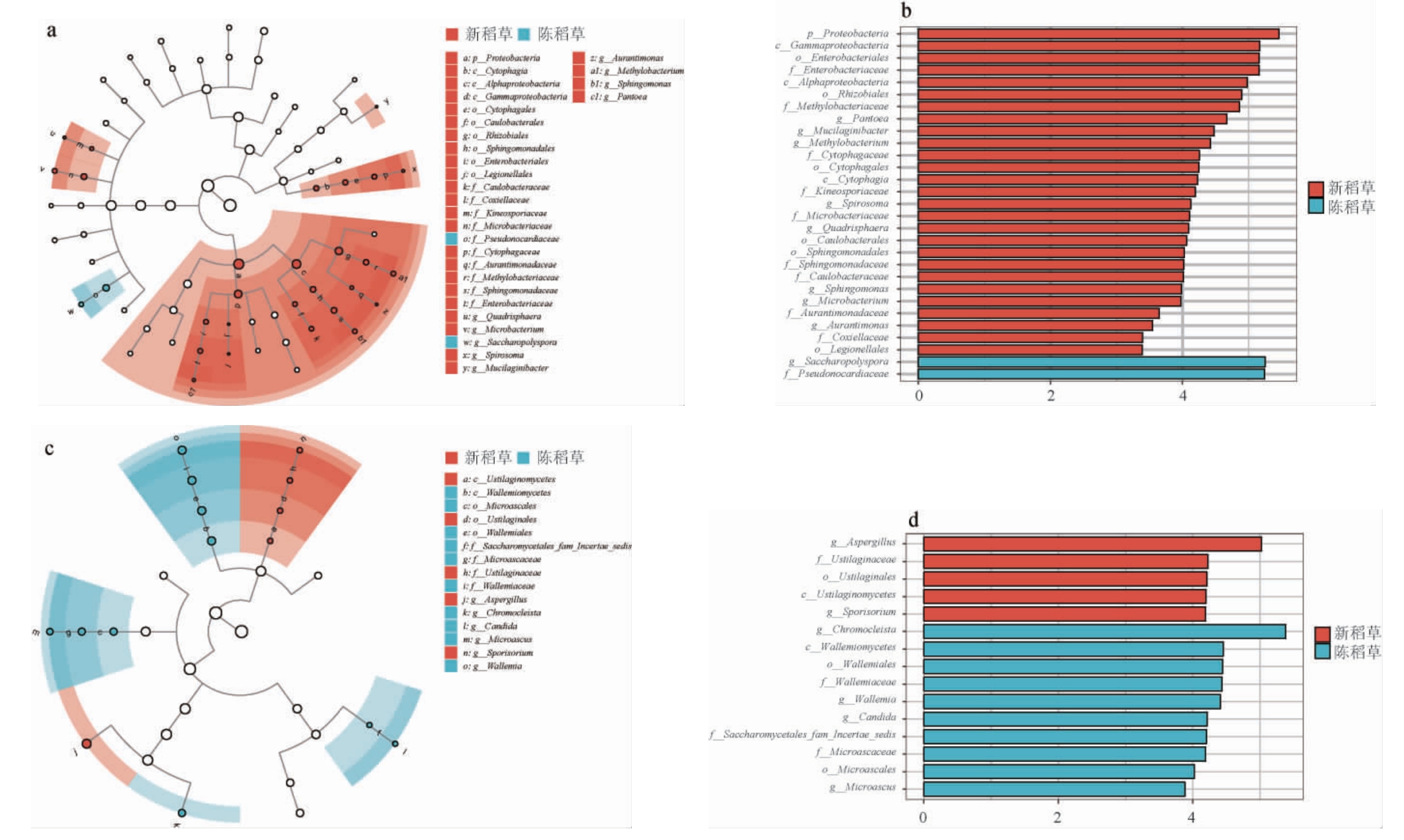
图4 新稻草和陈稻草中差异标志物的线性判别分析效应量结果
Fig.4 Linear discriminant analysis effect size results of differential markers in new and used straw
a:细菌分类学分支图;c:真菌分类学分支图;b:细菌LDA得分图;d:真菌LDA得分图。
对于在新鲜稻草中丰度较高的标志物种已经有相关研究报道,如MUANGHAM S等[19]从泰国水稻叶片分离出一株内生放线菌Quadrisphaera oryzae sp.Nov,这属于上述分析得到的新稻草中的生物标志物四折叠球菌属的一个种,耐高温性能较弱,因而在已经过一轮高温发酵的陈稻草中丰度较低;此外,ZHANG H X等[20]提出,白酒发酵过程中曲霉属由于无法很好适应发酵体系中温度的急剧升高而逐渐被淘汰,因而曲霉属在新鲜稻草中丰度更高。曲霉属是发酵过程中胞外酸性蛋白酶的主要生产者,但其活性普遍受到酸、高温等极端环境因素的抑制[21]。HU Y L等[22]研究发现,念珠菌属(Candida)在大曲培菌后期占主导地位,这也验证了本实验结果中念珠菌属在陈稻草中丰度高于新稻草,以及作为标志物种区分出陈稻草的可行性。
2.5 PICRUSt 2功能预测
使用PICRUSt 2软件对不同稻草组样品中的细菌和真菌的基因功能进行预测,结果发现,新稻草中细菌的总代谢通路丰度高于陈稻草,而真菌则情况相反。新、陈稻草的微生物功能代谢途径主要集中在物质合成和分解、前体代谢物的产生以及能量生成等方面。进一步地,将通路与物种进行关联,使用分层的样本代谢通路丰度表进行通路的物种组成分析[23]。本研究选取了代谢通路统计结果中差异倍数较大且在发酵过程中有重要作用的通路加以说明[24],结果见图5。由图5a、5b、5c可知,对于细菌,新稻草中的生物标志物肠杆菌科(Enterobacteriaceae)和泛菌属在L-色氨酸生物合成、L-精氨酸/腐胺/4-氨基丁酸降解和甲基乙二醛降解超级途径的占据绝对优势,进一步解释了发酵过程中菌群的差异会造成代谢路径的差异,从而影响大曲最终的品质。由图5d、5e、5f可知,对于真菌,陈稻草中的真菌标志物节担菌属在辛烷氧化、L-色氨酸降解为2-氨基-3-羧基粘康酸半醛和硝酸盐还原途径所占功能丰度明显高于新稻草。值得注意的是,新稻草中的细菌具有更强的L-色氨酸合成功能,而陈稻草中的真菌分解L-色氨酸功能更强,因此,预测不同稻草源微生物参与到大曲发酵过程中可能造成大曲中L-色氨酸含量的差异。一些真菌如曲霉属、青霉菌属、拟盘多毛孢属(Pestalotiopsis)和变形闭囊鞘属可以通过L-色氨酸和L-脯氨酸或从L-色氨酸和L-丙氨酸合成吲哚二酮哌嗪生物碱,这种物质具有抗毒素、抗氧化和杀虫活性[25],同时还具有调控菌群的功能,这是使用新稻草作为辅料的突出特点之一。
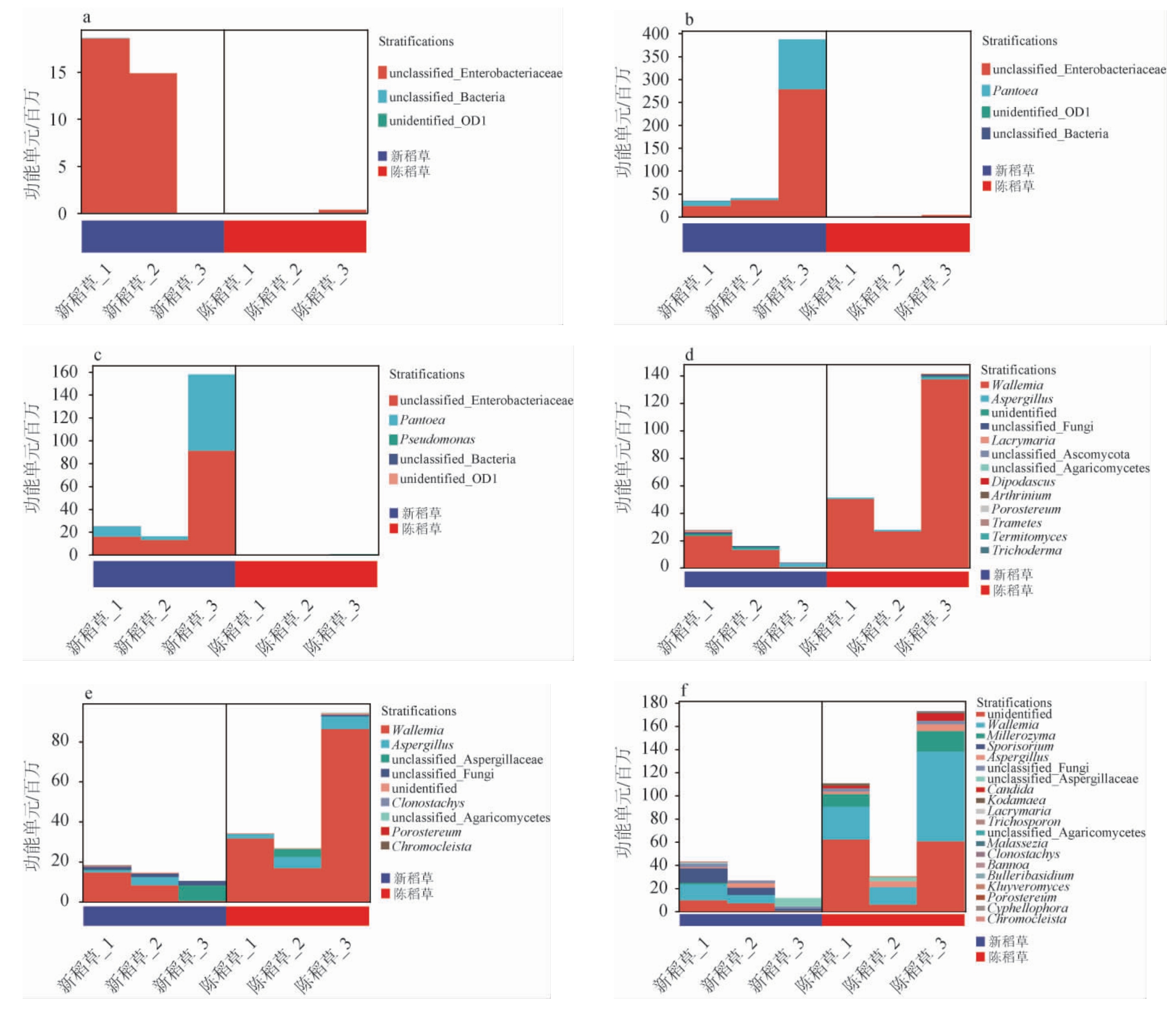
图5 涉及关键代谢途径的微生物群落组成
Fig.5 Microbial community composition involved in key metabolic pathways
3 结论
通过传统培养法和三代全长高通量测序分析发现,陈稻草样品中可培养的菌落总数、耐热菌和真菌数量显著高于新稻草(P<0.05),两种稻草的群落结构也存在明显差异,更突出地体现在细菌群落,新稻草中丰度占优势的细菌属为泛菌属和伯克霍尔德菌属,而陈稻草中为芽孢杆菌属和糖多孢菌属。物种差异分析表明,四折叠球菌属、微杆菌属、螺状菌属、Mucilaginibacter、橙单胞菌属、甲基杆菌属、鞘氨醇单胞菌属、泛菌属、曲霉属和Sporisorium是新稻草样品组的生物标志物,而糖多孢菌属、变形闭囊鞘属、念珠菌属、微囊菌属和节担菌属可作为陈稻草的标志物。微生物的组成差异导致代谢的差异,新稻草中的细菌在L-色氨酸生物合成、L-精氨酸/腐胺/4-氨基丁酸降解和甲基乙二醛降解所占功能丰度更高,而陈稻草中的真菌在辛烷氧化、L-色氨酸降解和硝酸盐还原途径发挥了更重要的作用,使用新稻草作为辅料其携带的菌群可以在发酵过程中提供更丰富的L-色氨酸进一步合成具有调控菌群功能的生物碱类物质。本研究丰富了人们对高温大曲制曲过程中不同稻草源微生物的认识,为稻草的选用和对大曲品质控制提供了一定的理论支撑。
[1] 张春林,杨亮,李喆,等.酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究[J].中国酿造,2021,40(11):31-36.
[2] 蒋倩儿,陈文浩,孙金沅,等.酱香型白酒大曲微生物研究进展[J].中国酿造,2021,40(12):1-5.
[3] 黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[4] ZHANG Y D,XU J G,DING F,et al.Multidimensional profiling indicates the shifts and functionality of wheat-origin microbiota during hightemperature Daqu incubation[J].Food Res Int,2022,156:111191.
[5] 王西,陈波,张亚东,等.高温大曲安曲投入老草的应用研究[J].酿酒科技,2020(12):88-91.
[6] PANG X N,HUANG X N,CHEN J Y,et al.Exploring the diversity and role of microbiota during material pretreatment of light-flavor Baijiu[J].Food Microbiol,2020,91:103514.
[7] HU Y N,HUANG X N,YANG B,ZHANG X,et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Biosci,2021,44:101395.
[8] 明红梅,周健,许德富,等.低温季节楼盘式制曲中大曲微生物变化趋势的初步研究[J].酿酒科技,2014(5):39-42.
[9] JENNIFER J M,ERIN L B,OLGA S,et al.Efficacy of a 3rd generation high-throughput sequencing platform for analyses of 16S rRNA genesfrom environmental samples[J].J Microbiol Meth,2013,95(2):175-181.
[10] SHI X L,ZHAO X H,REN J Y,et al.Influence of peanut,sorghum,and soil salinity on microbial community composition in interspecific interaction zone[J].Front Microbiol,2021,12:1-13.
[11] ZHANG Y D,SHEN Y,CHENG W,et al.Understanding the shifts of microbial community and metabolite profile from wheat to mature Daqu[J].Front Microbiol,2021,12:714726.
[12] 邓长阳,黎婷玉,刘文汇,等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造,2021,40(6):65-69.
[13] PATRÍCIA M O,MEREDITH C,TAMMI E,et al.Effects of Saccharomyces cerevisiae fermentation product on fecal microbiota populations of dogs subjected to exercise challenge[J].J Anim Sci,2020,98(4):63.
[14] ZUO Q C,HUANG Y G,GUO M.Evaluation of bacterial diversity during fermentation process: a comparison between handmade and machinemade high-temperature Daqu of Maotai-flavor liquor[J].Ann Microbiol Nlm,2020,70(1):57.
[15] DU H,WANG X S,ZHANG Y H,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,279:32-40.
[16] GUAN T W,YANG H,OU M Y,et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT-Food Sci Technol,2021,139:110544.
[17] 李登勇,黄钧,丁晓菲,等.酱香大曲间微生物群落结构时空特征的表征[J].食品工业科技,2018,39(23):139-145.
[18] 邓长阳,黎婷玉,刘文汇,等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造,2021,40(6):65-69.
[19] MUANGHAM S,LIPUN K,MATSUMOTO A,et al. Quadrisphaera oryzae sp.nov.,an endophytic actinomycete isolated from leaves of rice plant(Oryza sativa L.)[J].J Antibiot,2019,72:93-98.
[20] ZHANG H X,WANG L,WANG H Y,et al.Effects of initial temperature on microbial community succession rate and volatile flavors during Baijiu fermentation process[J].Food Res Int,2021,141:109887.
[21] HUANG Y G,WANG Y X,XU Y.Purification and characterisation of an acid protease from the Aspergillus hennebergii HX08 and its potential in traditional fermentation[J].J I Brewing,2017,123:432-441.
[22] HU Y L,DUN Y H,LI S A,et al.Changes in microbial community during fermentation of high-temperature Daqu used in the production of Chinese'Baiyunbian'liquor[J].J I Brewing,123(4):594-599.
[23] ZHAO T,ZHAN L B,ZHOU W,et al.The effects of erchen decoction on gut microbiota and lipid metabolism disorders in zucker diabetic fatty rats[J].Front Pharmacol,2021,12:647529.
[24] AN J J,WANG J Q,GUO L,et al.The impact of gut microbiome on metabolic disorders during catch-up growth in small-for-gestational-age[J].Front Endocrinol,2021,12:630526.
[25] MA Y M,LIANG X A,KONG Y,et al.Structural diversity and biological activities of indole diketopiperazine alkaloids from fungi[J].J Agr Food Chem,2016,64(35):6659-6671.