果皮蜡质存在于果实表面,是果实与周围环境的第一道屏障,在果实发育和贮藏阶段,具有防止果实水分散失、防止紫外线晒伤、防止病原微生物侵染和害虫啃食、防止果实开裂、防止果实营养流失、延长货架期、以及改善果实外观和内在品质性状的功能[1]。其主要由脂肪族化合物和次生代谢产物构成,前者包含烷烃、烯烃、初级醇、次级醇、脂肪酸、脂肪醛、酮;后者包含三萜类、甾醇和黄酮类[1]。目前果实蜡质的研究多集中于采收期和贮藏期果实蜡质组分分析及其功能的研究[2-3]。如TRIVEDI P等[4]研究发现,越橘果实的外观光泽与蜡质中三萜类组分比例的升高有关。CHU W J等[5]研究发现,去除蓝莓表面蜡质使其失水严重,果实外观亮蓝色变淡,口感和营养品质降低,果实抗氧化能力下降,货架期缩短。CHAI Y等[6]的研究结果表明,不同品种苹果贮藏期间蜡质组分烷烃与果实失水和营养品质保持密切相关。另外乙烯抑制剂1-甲基环丙烯(1-methylcyclopropene,1-MCP)在延缓低温贮藏新红星苹果蜡质总量增加的同时,延缓可滴定酸和果实硬度下降[7]。以上研究说明在采后及贮藏阶段,果实蜡质对于延缓品质劣变具有重要作用,但对于发育阶段果实蜡质与果实品质形成关系的研究却鲜见报道。
此研究以鸭梨和其芽变品种金坠梨为材料,与鸭梨相比,金坠梨果皮光滑且果点少[8]。据报道果实外观品质(颜色、质地、果点)受果实蜡质组分特征的影响[9]。另外有研究发现多酚是梨果实(尤其是果皮)中含量丰富的化合物[10]。因此选择这两种梨作为供试材料,是分析果实蜡质与果实营养指标总酚和黄酮含量关系的理想材料。通过分析盛花后60 d两种果实蜡质组分的差异,以及测定果实不同部位总酚和黄酮的含量,并对两者进行相关性和主成分分析(principal component analysis,PCA)。这一项研究将对进一步探究发育期果实蜡质在果实品质形成中发挥的重要作用奠定基础。
1 材料与方法
1.1 材料与试剂
金坠梨和鸭梨:产地为河北邯郸魏县东南温村;N-O-三甲基硅烷基三氟乙酰胺(分析纯):日本东京化成工业株式会社;正二十四烷标准品:美国AccuStandardTM公司;吡啶:北京索莱宝生物科技有限公司;氯仿和无水乙醇(均为分析纯):天津永大化学试剂公司;没食子酸标准品和芦丁标准品:加拿大BioBasicInc公司;福林酚(分析纯):北京酷来搏科技有限公司;硝酸铝(分析纯):上海埃彼化学试剂有限公司;氢氧化钠、亚硝酸钠、无水碳酸钠(均为分析纯):天津博迪化工股份有限公司;0.22 μm针筒微孔滤膜:北京酷莱搏有限责任公司;棕色样品瓶:美国安捷伦公司。
2021年6月6日于河北省魏县东南温村采集盛花后60 d的金坠梨和鸭梨,两种梨各自随机选取21个,分成3组,每组7个,分别进行果实总蜡质提取、测定前处理及气相色谱-质谱检测;另外随机选取20个分别取果皮、果肉和果心冻于液氮(-196 ℃),储存于超低温冰箱,用于果实不同部位总酚和黄酮含量的测定。
1.2 仪器与设备
RE-3000B型旋转蒸发器:上海亚荣生化仪器有限公司;RZK-S24水浴氮吹仪:北京亿阳润泽科技有限公司;Thermo DSQⅡ气相色谱-质谱(gas chromatograph mass spectrometer,GC-MS)分析仪(配有Xcalibur数据处理系统)、ThermoHeraeus Multifuge X1R离心机:美国塞默飞世尔科技有限公司;A11 basic分析研磨机:德国IKA公司;KS-100B旋钮超声波清洗器:昆山洁力美超声仪器有限公司;HH2恒温水浴锅:上海博讯实业有限公司;T6紫外可见光分光光度计:北京普析通用仪器有限公司。
1.3 方法
1.3.1 果实总蜡质提取和GC-MS检测
参考文献[11]的方法,从两种梨中各挑选21个无明显机械和病害损伤的果型端正的果实,平均分成3组进行总蜡质提取。每个果实连续进入两个盛放相同体积氯仿且规格一致的容器,各自浸泡1 min。分别将每种梨两次提取液(每一组)混合,并加入200 μL 1 μg/μL正二十四烷标准品作内标。将混合液旋蒸至少量并存放于棕色样品瓶中,在40 ℃水浴条件下,由氮吹仪吹干,并密封存放于超低温冰箱用于蜡质组分分析和含量测定。总蜡质提取前测量每个果实横径、纵径和高度,用于估算果实浸泡表面积。
蜡质测定前处理参考文献[11]的方法。在干燥后的蜡质样品中加入400 μL N-O-三甲基硅烷基三氟乙酰胺并在70 ℃条件下衍生化40 min。40 ℃条件下,用缓慢的氮气(N2)流将反应液中多余硅烷化试剂吹干,加入2.5 mL氯仿定容,使用孔径为0.22 μm针筒微孔滤膜过滤至1.5 mL顶空进样瓶中,准备上机测定。
蜡质组分测定参考文献[11]的方法,由Thermo DSQⅡ气相色谱-质谱联用仪完成。DB-1毛细管柱(30 m×0.25 mm×0.25μm)用于组分分离,氦气(He)作为载气,流速为1mL/min。气相程序设置:初始温度70 ℃保持1 min,以10 ℃/min升温至200 ℃,再以4 ℃/min升温至300 ℃并保持20 min。分流比10∶1,进样量为1.5 μL。质谱程序设置:进样口温度250 ℃,传输线温度250 ℃,离子源温度230 ℃,电子电离(electron ionization,EI)源70 eV,质谱扫描范围为50~650 m/z。蜡质组分鉴定参考质谱库美国国家标准技术研究所(national institute of standards and technology,NIST)09,根据内标法计算蜡质组分含量,含量表示为μg/cm2。
1.3.2 果实不同部位总酚含量测定
参考文献[12]的方法。分别称取果皮、果肉和果心冻样0.3 g、0.5 g和0.3 g,加入5 mL体积分数60%的乙醇,室温超声30 min得到粗提液,10 000 r/min、4 ℃离心10 min,吸取上清液备用。取1.5 mL待测上清液,加入1 mL福林酚并振荡摇匀,再加入2 mL 12 g/100mL Na2CO3,体积分数60%的乙醇定容至25 mL,避光反应2 h,用没食子酸制作标准曲线,测定反应液波长765 nm处的吸光度值。总酚计算公式如下:
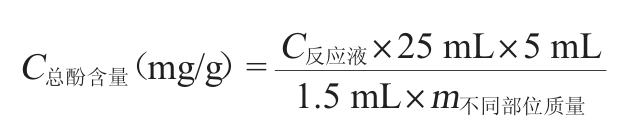
C反应液(mg/mL)由标准曲线得出。
1.3.3 果实不同部位黄酮含量测定
黄酮测定参考文献[12]的方法,按照“1.3.2”方法制备粗提液。取2 mL待测上清液,加入3 mL体积分数60%的乙醇并混匀,依次分别加入0.3 mL 5 g/100 mL NaNO2、和10 g/100 mL Al(NO3)3,两步均混匀并静置6 min,再加入4 mL 4 g/100 mL NaOH静置12 min,最后加入0.4 mL体积分数60%的乙醇(定容至10 mL)。用芦丁制作标准曲线,测定波长510 nm处反应液的吸光度值。黄酮计算公式同上。
1.3.4 数据处理
所有试验均包含3个重复,数据表示为“平均值±标准误差”。单因素方差分析用于数据间差异分析,多重比较采用LSD和Duncan两种方法,其中不同字母代表数据间差异显著(P<0.05)。单因素方差分析和相关性分析利用软件IBM statistics SPSS 22,主成分分析使用软件Origin2017。
2 结果与分析
2.1 盛花后60天,金坠梨和鸭梨果实蜡质组分比例、含量及分布
盛花后60天,两种梨果实中共鉴定出25种蜡质组分,分别属于烷烃、脂肪醇、脂肪醛和三萜类,除以上4种分类,总蜡质中还含有极少量其他未鉴定组分,在金坠梨中的比例依次为5.21%、15.75%、22.00%、54.84%、2.20%,而在鸭梨中依次为5.23%、13.36%、18.86%、59.51%、3.04%(图1)。两种梨中三萜类含量>脂肪醛(或脂肪醇)含量>烷烃含量。其中烷烃、脂肪醇、脂肪醛总和为脂肪族蜡质,且金坠梨中三萜类、脂肪族蜡质和总蜡质等的含量均低于鸭梨中的含量(表1)。
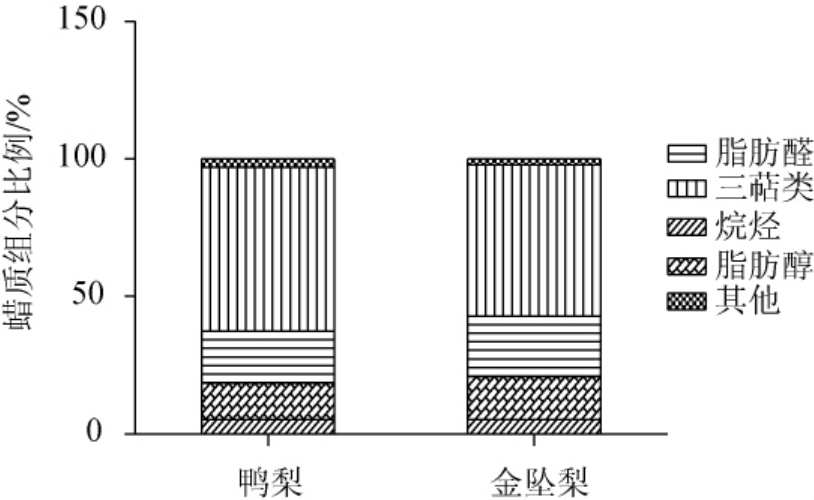
图1 盛花后60 d金坠梨和鸭梨果实蜡质组分比例
Fig. 1 Proportion of waxy components in fruits of 'jinzhui' and 'yali'pears after flowering for 60 d
表1 盛花后60 d金坠梨和鸭梨果实蜡质组分含量差异
Table 1 Difference of wax components in fruits of 'jinzhui' and 'yali' pears after flowering for 60 d
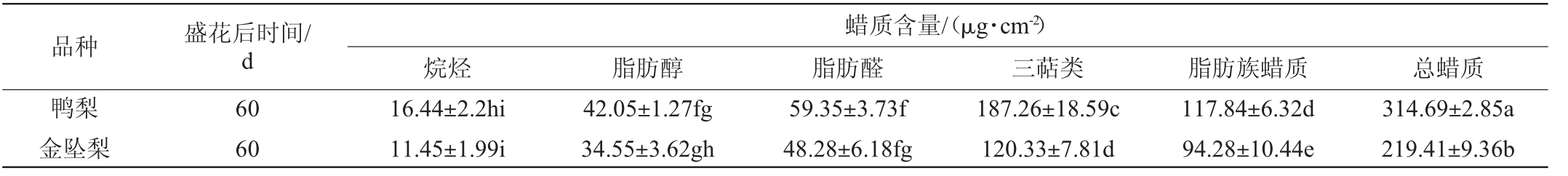
注:同列间不同小写字母表示差异显著(P<0.05)。
对各种梨果实蜡质组成的研究得出成熟‘红香酥’梨、发育和成熟‘苹果梨’及35个梨品种果实蜡质均以三萜、烷烃和脂肪醇为主[13-16]。分析其他果实品种蜡质组成发现9种蓝莓[17]、不同采收期的两种桃(‘October Sun’和‘Jesca’)[18]和4种苹果(‘Prima’、‘Florina’、‘乔纳金’和‘红元帅’)[19-20]均以三萜、奇数碳烷烃(C23和C25)和脂肪醇为主。综上说明品种、发育阶段、生长环境均对果实蜡组分产生影响,但果实蜡质却是三萜的重要来源,优化提取工艺从果实蜡质中获得更高含量的三萜类物质,应用于功能食品、保健品和药品开发及抗衰老和抗氧化化妆品的研发是很有前景的。
两种梨果实蜡质分布相似,包含碳链长度C22-C29烷烃、C22-C30脂肪醇、C28-C34脂肪醛和7种三萜类物质(图2)。其中C29烷 烃、C28 醇、C32 醛、C34 醛 和Urs-12-en-28-al,3-(acety loxy)-,(3β)-为主要成分,金坠梨中它们的含量依次为(8.42±1.38)μg/cm2、(16.00±1.98)μg/cm2、(27.00±4.52)μg/cm2、(8.06±1.61)μg/cm2、(86.70±16.08)μg/cm2;而鸭梨中它们的含量依次为(12.48±1.79)μg/cm2、(20.35±0.92)μg/cm2、(34.34±2.92)μg/cm2、(11.89±1.17)μg/cm2、(138.57±14.77)μg/cm2,其中金坠梨中以上主要蜡质组分的含量均低于鸭梨中它们的含量(图2)。
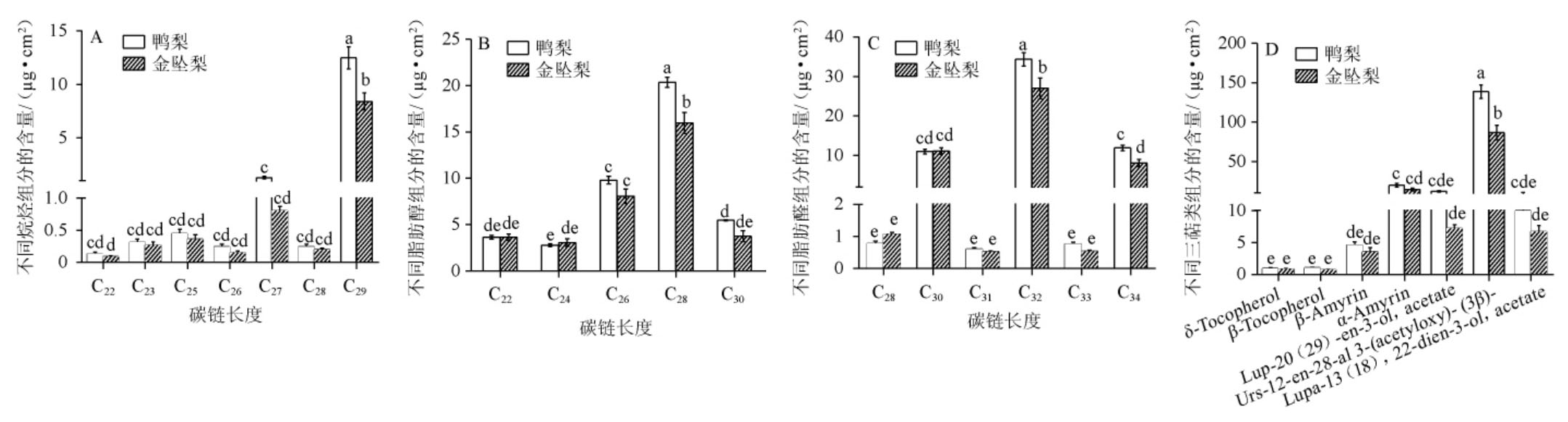
图2 盛花后60 d金坠梨和鸭梨果实烷烃(A)、脂肪醇(B)、脂肪醛和三萜类(C)蜡质组分分布
Fig. 2 Distribution of wax components alkanes (A),fatty alcohols (B),aliphatic aldehydes and triterpenes (C) in fruits of 'jinzhui' and 'yali'pears after flowering for 60 d
不同小写字母表示差异显著(P<0.05)。下同。
前期研究发现C29烷烃、C22醇、C32醛、C34醛和两种三萜(β-amyrin、Urs-12-en-28-al,3-(acetyloxy)-,(3β)-)是‘红香酥梨’果实蜡质主要成分[13],这与本次研究两种梨的蜡质分布相似。在研究湿度及低温对贮藏‘库尔勒香梨’、‘雪花梨’和‘玉露香梨’蜡质组分的影响发现,C29烷烃、C31烷烃、C22-C30醇(偶数碳)、C16醛、C18醛和C28醛是3种梨蜡质的主要成分[21-22]。另外在研究其他果实蜡质组分分布时发现:4种北欧越橘品种以及‘粉红女士’苹果蜡质组分均以C29烷烃、C31烷烃、C18醛、C24醛-C28醛(偶数碳)、α-amyrin、β-amyrin为主要成分[23-24]。以上研究表明,不同品种梨果实蜡质组分分布呈相似规律,表现为烷烃以奇数碳组分为主要成分,而脂肪醇和脂肪醛均以偶数碳组分为主要成分。
2.2 盛花后60 d,金坠梨和鸭梨果实不同部位总酚和黄酮含量
由图3A可知,金坠梨果皮、果肉、果心的总酚含量分别为1.97 mg/g、0.74 mg/g、3.14 mg/g;鸭梨果皮、果肉、果心的总酚含量分别为2.57 mg/g、0.62 mg/g、2.74 mg/g。金坠梨果心总酚含量显著高于鸭梨(P<0.05),果皮总酚含量显著低于鸭梨(P<0.05),果肉总酚含量稍高于鸭梨但差异不显著(P>0.05)。
由图3B可知,金坠梨果皮、果肉、果心的黄酮含量分别为1.92 mg/g、0.80 mg/g、8.97 mg/g;鸭梨果皮、果肉、果心的黄酮含量分别为2.43 mg/g、0.61 mg/g、10.41 mg/g。金坠梨果心黄酮含量显著低于鸭梨(P<0.05),金坠梨果皮黄酮稍低于鸭梨但无明显差异(P>0.05),金坠梨果肉黄酮稍高于鸭梨但无明显差异(P>0.05)。
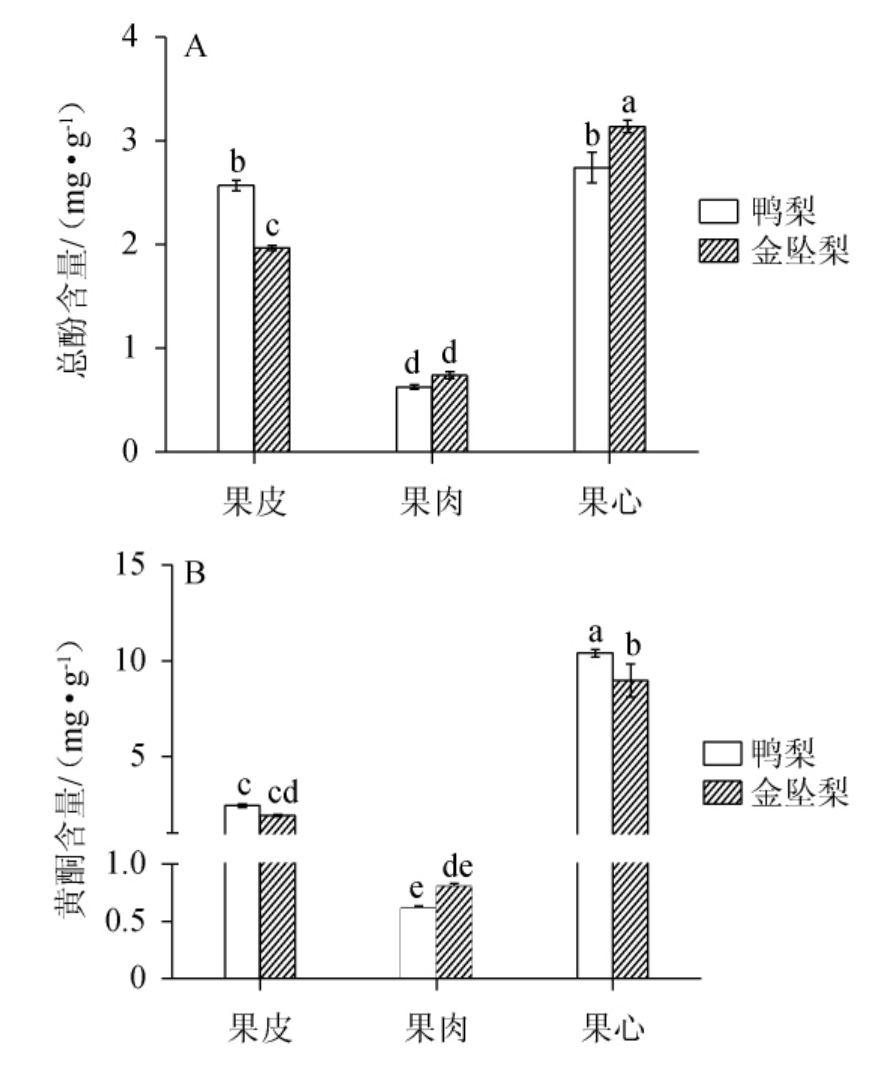
图3 盛花后60 d金坠梨和鸭梨果实不同部位总酚(A)和黄酮(B)含量
Fig. 3 Contents of total phenols (A) and flavonoids (B) in different parts of 'jinzhui' and 'yali' pears after flowering for 60 d
研究采收期5个梨品种(‘圆黄梨’、‘红香酥梨’、‘玉露香梨’、‘黄冠梨’、‘雪花梨’)发现果皮总酚和黄酮含量高于果肉和果心中它们的含量[12]。这与本研究结果部分相似,其中差异可能与梨品种、产地、发育和贮藏条件有关,蒙秋霞等[25]的研究表明‘玉露香梨’果皮中黄酮含量受产地因素影响较大。
2.3 盛花后60 d,金坠梨和鸭梨果实蜡质组分与果实总酚和黄酮含量的PCA和相关性分析
将两种梨6种蜡质分类的含量和果皮、果肉和果心中总酚和黄酮含量共12个因子做PCA(图4)。提取的主成分PC1和PC2方差贡献率分别为79.9%和12.9%。
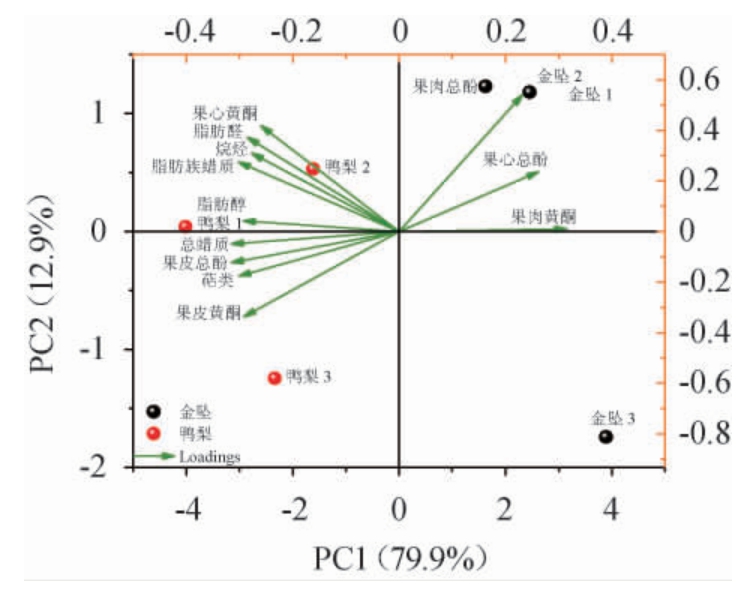
图4 盛花后60 d金坠梨和鸭梨果实中蜡质组分与果实不同部位营养指标的主成分分析
Fig. 4 Principal component analysis of wax components in 'jinzhui'and 'yali' pears fruit and nutritional indexes of different parts of fruits after flowering for 60 d
由图4可知,蜡质组分脂肪醛、烷烃、脂肪族蜡质和果心黄酮均在PC1负半轴和PC2正半轴上有载荷,说明这三种蜡质组分代表两种梨果心营养指标的特征,且它们的含量与果心黄酮含量正相关(P<0.05)(表2);而脂肪醇、总蜡质、三萜类和果皮总酚、果皮黄酮均在PC1负半轴上有载荷,说明这三种组分代表两种梨果皮营养指标的特征,且它们的含量与果皮总酚和果皮黄酮含量正相关(P<0.05)(表2)。
表2 盛花后60 d金坠梨和鸭梨果实中蜡质组分与果实不同部位总酚和黄酮含量的相关性分析
Table 2 Correlation analysis between wax components in 'jinzhui'and 'yali' pears and the contents of total phenols and flavonoids of different parts of fruits after flowering for 60 d
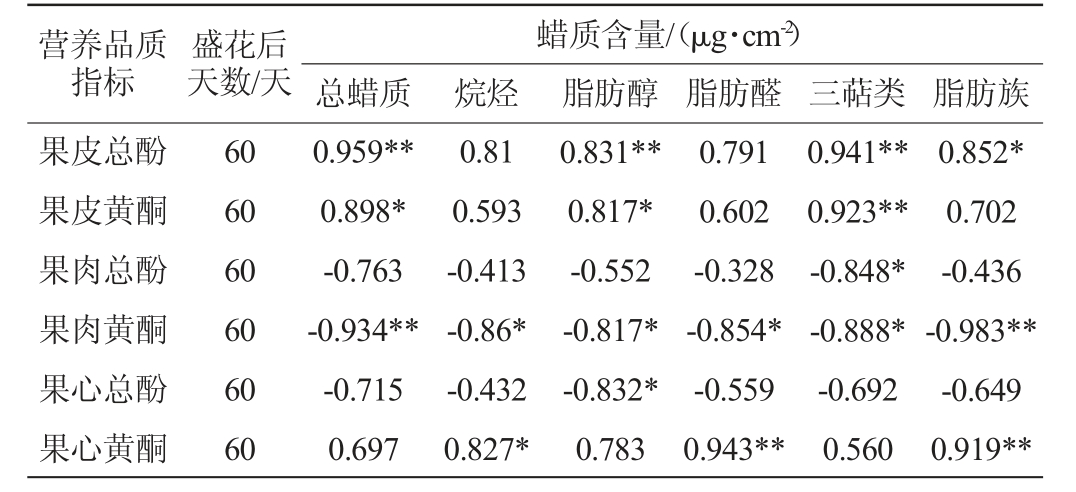
注:“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)。
根据品种与12种因子的关系,主成分PC1将两种梨分成两组。其中金坠梨组合金坠1、金坠2、金坠3位于PC1正半轴,鸭梨组合鸭梨1、鸭梨2、鸭梨3位于PC1负半轴。这种差异表现为金坠梨和鸭梨在蜡质组分三萜类、总蜡质和脂肪族含量,以及营养指标果皮总酚、果皮黄酮和果心黄酮含量上的差别。
3 结论
盛花后60 d,与鸭梨相比,金坠梨果皮光滑无果点,且果皮总酚、果皮黄酮及果心黄酮含量呈下降趋势,这可能与果实蜡质中总蜡质、三萜类、脂肪族类蜡质及它们的主要组分C29烷烃、C28醇、C32醛、C34醛和Urs-12-en-28-al 3-(acetyloxy)-(3β)-含量的降低有关。此研究对进一步探究发育期果实蜡质对果实品质营养指标的影响,及开发改变果实蜡质组分达到促进果实营养品质形成的生长调节剂等实用技术奠定理论基础。
[1] TRIVEDI P,NGUYEN N,HYKKERUD A L,et al.Developmental and environmental regulation of cuticular wax biosynthesis in fleshy fruits[J].Front Plant Sci,2019,10:431.
[2] SHAHEENUZZAMN M,SHI S D,SOHAIL K,et al.Regulation of cuticular wax biosynthesis in plants under abiotic stress[J]. Plant Biotechnol Rep,2021,15:1-12.
[3] DIMOPOULOS N,TINDJAU R,WONG D C,et al.Drought stress modulates cuticular wax composition of the grape berry[J].J Exp Bot,2020,71(10):3126-3141.
[4] TRIVEDI P,NGUYEN N,KLAVINS L,et al.Analysis of composition,morphology,and biosynthesis of cuticular wax in wild type bilberry(Vaccinium myrtillus L.) and its glossy mutant[J]. Food Chem,2021,354:129517.
[5] CHU W J,GAO H Y,CHEN H J,et al.Effects of cuticular wax on the postharvest quality of blueberry fruit[J].Food Chem,2018,239:68-74.
[6] CHAI Y,LI A,WAI S C,et al.Cuticular wax composition changes of 10 apple cultivars during postharvest storage[J].Food Chem,2020,324:126903.
[7] LI F J,MIN D D,REN C T,et al.Ethylene altered fruit cuticular wax,the expression of cuticular wax synthesis-related genes and fruit quality during cold storage of apple(Malus domestica Borkh.c.v.Starkrimson)fruit[J].Postharvest Biol Tec,2019,149:58-65.
[8] HENG W,HUANG H N,LI F,et al.Comparative analysis of the structure,suberin and wax composition and key gene expression in the epidermis of'Dangshansuli'pear and its russet mutant[J].Acta Physiol Plant,2017,39:1-13.
[9] 孙莉琼,郝雯菁,唐晓清,等.UPLC-MS/MS研究36个梨品种成熟果实中的特征性多酚和三萜酸类物质[J].食品科学,2020,41(22):206-214.
[10] 田淑芬,陶荣宗,高献亭.金坠梨在天津地区的试种表现[J].天津农业科学,1999(3):32-35.
[11] WANG J Q,HAO H H,LIU R S,et al.Comparative analysis of surface wax in mature fruits between Satsuma mandarin (Citrus unshiu) and'Newhall'navel orange (Citrus sinensis) from the perspective of crystal morphology,chemical composition and key gene expression[J]. Food Chem,2014,153:177-185.
[12] 安景舒,关晔晴,程玉豆,等.5个梨品种果实不同部位的总酚、黄酮含量及其抗氧化能力分析[J].保鲜与加工,2020,20(3):162-166.
[13] LI D,CHENG Y D,GUAN J F.Effects of 1-methylcyclopropene on surface wax and related gene expression in cold-stored 'Hongxiangsu'pears[J].J Sci Food Agr,2019,99(5):2438-2446.
[14] LI Y C,YIN Y,CHEN S J,et al.Chemical composition of cuticular waxes during fruit development of Pingguoli pear and their potential role on early events of Alternaria alternata infection[J]. Funct Plant Biol,2013,41(3):313-320.
[15] WU X,YIN H,SHI Z B,et al.Chemical composition and crystal morphology of epicuticular wax in mature fruits of 35 pear(Pyrus spp.)cultivars[J].Front Plant Sci,2018,9:679.
[16] YIN Y,BI Y,CHEN S J,et al.Chemical composition and antifungal activity of cuticular wax isolated from Asian pear fruit (cv.Pingguoli)[J].Sci Hortic,2011,129(4):577-582.
[17] CHU W J,GAO H Y,CAO S F,et al.Composition and morphology of cuticular wax in blueberry(Vaccinium spp.)fruits[J].Food Chem,2017,219:436-442.
[18] BELGE B,LLOVERA M,COMABELLA E,et al.Fruit cuticle composition of a melting and a nonmelting peach cultivar[J].J Agr Food Chem,2014,62:3488-3495.
[19] LEIDE J,DE SOUZA A X,PAPP I,et al.Specific characteristics of the apple fruit cuticle:investigation of early and late season cultivars'Prima'and'Florina' (Malus domestica Borkh.)[J].Sci Hortic,2018,229:137-147.
[20] YANG Y Q,ZHOU B,ZHANG J,et al.Relationships between cuticular waxes and skin greasiness of apples during storage[J].Postharvest Biol Tec,2017,131:55-67.
[21] WANG Y,MAO H J,LV Y H,et al.Comparative analysis of total wax content,chemical composition and crystal morphology of cuticular wax in Korla pear under different relative humidity of storage[J].Food Chem,2021,339:128097.
[22] WU X,YIN H,CHEN Y Y,et al.Chemical composition,crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J].Postharvest Biol Tec,2017,132:71-80.
[23] KLEIN B,FALK R B,THEWES F R,et al.Dynamic controlled atmosphere:Effects on the chemical composition of cuticular wax of'Cripps Pink'apples after long-term storage[J].Postharvest Biol Tec,2020,164:111170.
[24] TRIVEDI P,KARPPINEN K,KLAVINS L,et al.Compositional and morphological analyses of wax in northern wild berry species[J]. Food Chem,2019,295:441-448.
[25] 蒙秋霞,张丽珍,李阳,等.不同产地‘玉露香’梨品质及香气物质分析[J].中国果树,2020(3):28-33.