黄曲霉毒素(aflatoxins,AFs)是由黄曲霉、寄生曲霉等某些霉菌菌株在特定条件下产生的一类有毒性代谢产物[1],常见于玉米、花生、大米和小麦等谷物及其副产品中。黄曲霉素包括黄曲霉毒素B1(AFB1)、AFB2、AFG1、AFG2、AFM1和AFM2等二十余种结构类似物,其中AFB1是迄今为止发现的性质最稳定、毒性最强的真菌毒素,世界卫生组织把其定为IA类致癌物质[2-3]。黄曲霉毒素严重危害人体和动物的健康安全,进入人体后会被细胞色素P450酶代谢形成活性中间体,与肝细胞相互作用引起肝癌[4],对免疫力也会产生不良影响[5]。奶牛摄入黄曲霉素会导致其采食量下降,免疫力降低,内脏器官受损甚至癌变,产奶量减少;且饲喂黄曲霉毒素时间越长,危害越大[6]。同样,黄曲霉毒素也严重影响鸡鸭等禽类的健康和生产性能[7]。因此,探寻有效的方法来消除食品及饲料中黄曲霉毒素污染,降低黄曲霉毒素对畜禽和人类的威胁是个亟待解决的问题。
作为黄曲霉毒素中毒性最强、危害最大的一种毒素,AFB1的脱除方法主要包括物理、化学和生物脱除等三种方式。其中物理脱除法主要是通过高温加热和紫外照射等方式破坏AFB1的结构,或通过吸附剂将AFB1吸附从而达到去除的效果[8-10]。化学脱除法主要是通过强氧化剂或碱处理法来破坏某些化学键从而达到脱毒目的[11-12]。AFB1耐温性强,在268 ℃以上高温条件下才能被大量热解[13];且其在pH值中性条件下稳定,在pH 1.0~3.0的强酸性溶液中也只有极少量分解,但在pH 9.0~10.0的强碱溶液中能够快速分解并生成没有毒性的盐。但是,这个反应是可逆的,一旦遇到酸性条件,其毒性便会恢复[14]。因此普通的物理和化学方法难以将其彻底脱除,而且反应条件严格、成本高,同时会破坏饲料的风味和营养成分,造成适口性的降低,也可能引入其他有毒物质而危害畜禽的健康[15]。生物脱除法则是利用微生物或其产生的酶类来解毒,其反应条件温和,降解效率高,不会产生对人和动物有害的物质,甚至有的益生菌还能对饲料的营养价值有一定的提升,因此已成为当前最有前景及最具应用价值的黄曲霉毒素脱毒方法之一[16-17]。
尽管黄曲霉毒素种类繁多,但是它们均是二氢呋喃香豆素的衍生物,该类分子主要是由双呋喃环和氧杂萘邻酮(香豆素)组成,两者是其基本毒性结构[18-19]。就AFB1高效降解菌的分离而言,针对黄曲霉素分子中所含有的香豆素结构而设计出的香豆素筛选模型成本低廉,安全无毒,已得到较广泛应用,如孙粮等[20]利用香豆素为唯一碳源从奶牛粪便中筛选到了1株地衣芽孢杆菌(Bacillus licheniformis),对质量浓度为100 μg/L的AFB1的降解率达到91.86%;王威等[21]利用此方法从腐烂朽木中筛选到1株克雷伯氏菌(Klebsiella sp.),对质量浓度为2.5 μg/mL的AFB1降解率为71.91%;王明清等[22]也以香豆素为唯一碳源从土壤中筛选到了1株能降解AFB1的贝莱斯芽孢杆菌(Bacillus velezensis),对质量浓度为100 μg/L的AFB1降解率为90.6%。
传统酿造食品主要由多种微生物共酵而来,传统发酵工艺历经了长久的生产实践检验,食品发酵过程中微生物交替繁衍,蕴含着种类繁多、代谢类型多样的微生物,它们也是公认安全(general recognized as safe,GRAS)成分。本研究拟采用香豆素富集培养法从酒醅、大曲、榨菜、酸豆角等样品中分离筛选可利用香豆素菌株;采用高效液相色谱(high performance liquid chroma-tography,HPLC)法复筛高效降解AFB1的优良菌株,并采用单因素试验及正交试验优化其发酵条件,以期应用到食品或饲料工业中去降低黄曲霉素危害,减少经济损失。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
大曲样品1份、不同发酵天数的酒醅样品12份:黄鹤楼酒厂;大曲样品1份:湖北襄阳石花酒厂;榨菜样品、酸豆角样品各1份:武汉市东西湖区常青花园菜市场;共计16份样品。
1.1.2 化学试剂
香豆素(分析纯):上海山浦化工有限公司;AFB1标准品(纯度99.8%):以色列Fermentek公司;甲醇(色谱纯)、二氯甲烷(分析纯):国药集团化学试剂有限公司;菌体裂解液:宝生物工程有限公司。
1.1.3 培养基
LB液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,蒸馏水1 000 mL,pH 7.0。121 ℃高压蒸汽灭菌20 min。
初筛液体培养基:KH2PO40.25g/L,MgSO4·7H2O 0.25g/L,KNO3 0.5 g/L,(NH4)2SO4 0.5 g/L,CaCl2·2H2O 0.005 g/L,FeCl3·6H2O 0.003 g/L,pH 7.0,蒸馏水1 000 mL[23]。121 ℃高压蒸汽灭菌20 min后,每100 mL培养基中加入经细菌过滤器滤过的质量浓度为100 mg/mL的香豆素液1 mL,在培养基中终质量浓度为1 g/L[18]。
初筛固体培养基:初筛液体培养基中添加琼脂粉18g/L。
发酵培养基:蛋白胨10 g/L,牛肉膏3 g/L,NaCl 8.5 g/L,KH2PO4 1 g/L,葡萄糖1 g/L,蒸馏水1 000 mL,pH 6.5。121 ℃高压蒸汽灭菌20 min[18]。
1.2 仪器与设备
SPX-3008SH-II生化培养箱:上海知楚仪器有限公司;ZQLY300F振荡培养箱:上海新苗医疗器械制造有限公司;SW-CJ-IBM超净工作台:苏州安泰空气有限公司;5417R台式高速冷冻离心机:德国Eppendorf公司;T-GRADIENT聚合酶联式反应(polymerase chain reaction,PCR)仪:德国Biometra公司;DYY-6C电泳仪:北京六一仪器厂;GBoXHR-E-M凝胶成像系统:英国Syngene公司;Agilent 1260 Ⅱ高效液相色谱仪:美国安捷伦公司。
1.3 方法
1.3.1 AFB1降解菌的筛选
(1)初筛
取10 g样品,将其加入至100 mL无菌水中,振荡摇匀,吸取样品稀释液按10%接种量接种于LB液体培养基中,37 ℃、200 r/min振荡培养24 h,得到微生物富集液。取微生物富集液以10%接种量转接至以香豆素为唯一碳源的初筛液体培养基,37 ℃、200 r/min振荡培养3 d,再以10%接种量转接至新的初筛液体培养基中,共转接3次,待培养基变浑浊,涂布在香豆素固体筛选培养基上,置于37 ℃培养箱中培养。观察细菌生长情况,选取生长良好的单菌株,连续3次划线于初筛培养基上,纯化后保存初筛菌株。
(2)复筛
将纯化的筛选菌株单菌落接种于发酵培养基,37 ℃、200 r/min振荡培养24 h,从中取975 μL菌液加入10 mL细菌培养瓶,再加入100 μg/mL AFB1标准溶液25 μL,发酵液中AFB1终质量浓度为2.5 μg/mL,混匀,37 ℃、200 r/min避光孵育72 h,离心取上清液用二氯甲烷进行等体积萃取2次,将萃取液置于氮吹仪中吹干,加入1 mL甲醇,超声处理,复溶后经0.22 μm滤膜过滤至色谱瓶中,置于4 ℃冰箱保存备用,检测AFB1含量,计算降解率,复筛高效AFB1降解菌。
1.3.2 AFB1的检测
采用HPLC法检测AFB1含量,色谱条件为:C18色谱柱(4.6 mm×15 cm×5 μm),进样量20 μL,流动相为甲醇∶水=6∶4(V/V),等度洗脱,流速0.7 mL/min,检测波长365 nm[13]。
AFB1标准曲线的绘制:准确移取100 μg/mL的AFB1标准溶液适量,加色谱级甲醇将其稀释成质量浓度分别为0.1 μg/mL、0.5 μg/mL、1.0 μg/mL、1.5 μg/mL、2.0 μg/mL、2.5 μg/mL的AFB1标准溶液。按照上述色谱条件进行HPLC进样,将峰面积(y)作为纵坐标,AFB1标准溶液质量浓度(x)为横坐标,绘制AFB1标准曲线,得到标准曲线回归方程为y=105.38x-4.899 8,相关系数为R2=0.997 7,根据此回归方程计算样品中AFB1含量,并计算AFB1降解率,其计算公式如下:
1.3.3 筛选菌株的鉴定
(1)形态学观察
将AFB1降解率最高的菌株在LB固体培养基平板上划线,37 ℃条件下培养48 h,根据《伯杰细菌鉴定手册》进行菌落及细胞观察。观察菌落颜色及单菌落形态;并挑取少量菌作革兰氏染色和芽孢染色,显微观察细胞和芽孢形态及染色结果。
(2)分子生物学鉴定
采用菌体裂解液裂解菌体,释放其基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGGCTACC TTGTTACGACTT-3')扩增16S rDNA基因。PCR 扩增体系(50 μL):菌株DNA模板5 μL,上下游引物27 F与1492R各2 μL,Taq DNA聚合酶25 μL,双蒸水(ddH2O)16 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性45 s,60 ℃退火45 s,72 ℃延伸90 s,25个循环;72 ℃再延伸5 min。聚合酶链式反应结束后,取PCR产物上样于0.8%琼脂糖凝胶,120 V电泳30 min后经凝胶成像系统检测基因扩增结果。将阳性PCR反应液送至上海生工生物有限公司测序。
测序后的16S rDNA基因序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源搜索比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 菌株对AFB1脱毒方式的探究
取2份振荡培养至12 h的等体积菌株发酵菌液,培养温度为37 ℃、转速为200 r/min。一份经121 ℃高压灭菌20 min进行灭活处理后,于4 ℃、8 000 r/min条件下离心10 min,弃去上清,收集菌体。将菌体复溶于同体积的发酵培养基中;另一份不做任何处理。二者分别装于3个培养瓶中,设3重复,加入AFB1标准溶液使AFB1终质量浓度为2.5 μg/mL。以不加菌液但AFB1终浓度相同的发酵液体培养基作为空白对照。在37 ℃、200 r/min条件下避光培养72 h,按照1.3.1的方法萃取上清液中AFB1进行HPLC分析。
1.3.5 菌株降解AFB1发酵条件优化
(1)单因素试验
筛选菌株活化后挑一环菌于LB液体培养基中,在37 ℃、200 r/min条件下培养12 h,得到种子液,将种子液按5%接种量接种至AFB1质量浓度为2.5 μg/mL的发酵培养基中摇床培养,培养基初始pH为6.5,37 ℃、200 r/min摇床培养72 h。在此基础上固定摇床转速为200 r/min,分别考察接种量(4%、5%、6%、7%、8%)、培养基初始pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5)、培养温度(25 ℃、28 ℃、31 ℃、34 ℃、37 ℃)、培养时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h)、AFB1质量浓度(2.5 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL)对筛选菌株降解AFB1的影响。发酵结束后将发酵液8 000 r/min离心10 min,取上清液经1.3.1中方法进行萃取、氮吹、复溶、过滤等处理后,采用HPLC法检测AFB1含量,另外取等量AFB1标准品溶液加入等量无菌发酵培养基中作为空白对照。
(2)正交试验
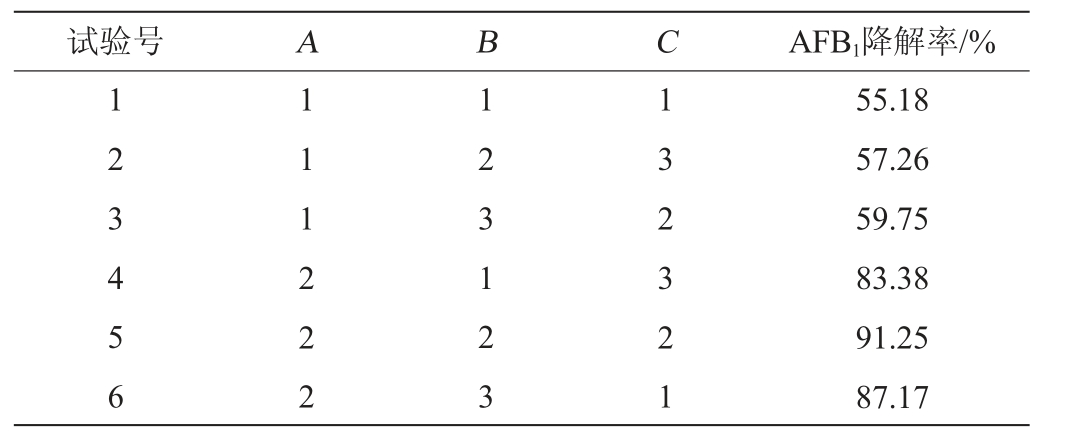
在单因素试验的基础上,固定AFB1质量浓度为2.5μg/mL,初始pH值为7.2,选取培养温度(A)、培养时间(B)、接种量(C)为影响因素,以AFB1降解率为评价指标,进行3因素3水平正交试验。正交试验因素与水平见表1。
表1 发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization

2 结果与分析
2.1 AFB1降解菌株初筛
本研究利用香豆素筛选模型从酒醅、大曲、榨菜及酸豆角共16份样品中共筛选到23株能够以香豆素为唯一碳源生长的菌株,根据取样天数及样品类型分别编号为HB021~HB026、HB324~HB326、HB721~HB722、HBH2、SQ1~SQ8、SQ9~SQ12。其中黄鹤楼酒厂二茬酒醅发酵第0天6株,第3天3株,第7天2株,大曲中1株,石花酒厂大曲中11株。
2.2 AFB1降解菌株复筛
经香豆素富集培养法初筛得到的23株菌,通过AFB1降解试验复筛,结果见图1。由图1可知,这23株菌都具有降解AFB1的能力,其中湖北武汉黄鹤楼酒厂酒醅中分离到的菌株HB022降解能力最强,AFB1降解率达到86.22%,同样分离自黄鹤楼酒醅中的菌株HB721 AFB1降解能力次之,AFB1降解率为77.70%,此外分离自湖北襄阳石花酒厂大曲的菌株SQ9 AFB1降解率也较高,达到77.27%。结合菌株对AFB1的降解稳定性情况,本研究选择AFB1降解率最高的菌株HB022作进一步研究。
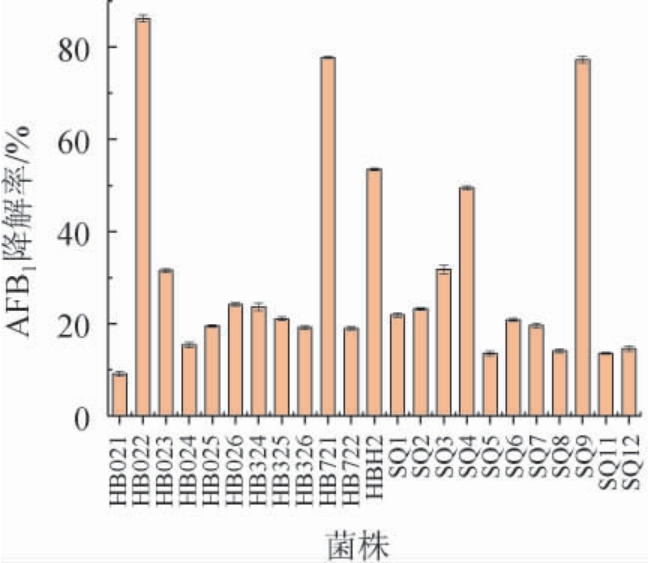
图1 AFB1降解菌株的复筛结果
Fig. 1 Secondary screening results of AFB1 degrading strains
2.3 菌株HB022的鉴定结果
2.3.1 形态学观察
由图2a可知,菌株HB022在营养琼脂培养基上的菌落为白色、边缘不整齐、表面粗糙皱褶,中心有轻微隆起;由图2b可知,显微镜下细胞为杆状,革兰氏染色呈紫色;由图2c可知,具有芽孢,呈椭圆形。综上,菌株HB022是革兰氏阳性芽孢杆菌。
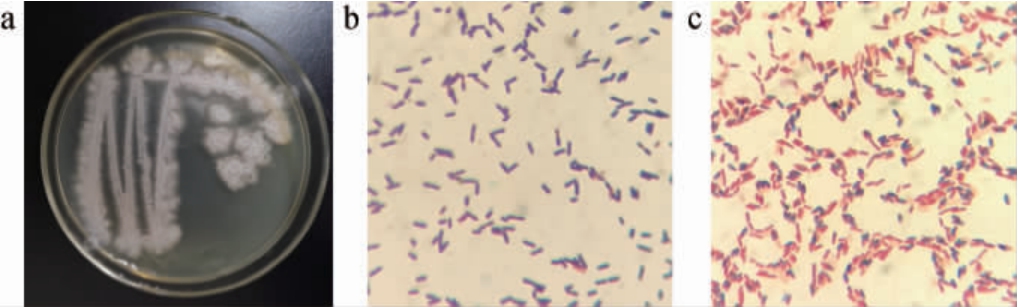
图2 菌株HB022的菌落(a)、细胞(b)及芽孢(c)形态
Fig. 2 Colony (a),cell (b) and spore (c) morphology of strain HB022
2.3.2 分子生物鉴定
测序后,在NCBI数据库中进行BLAST序列比对,下载与菌株HB022同源性较高的菌株序列,采用MEGA 7.0构建系统发育树,结果见图3。由图3可知,菌株HB022与地衣芽孢杆菌TS08和KW55P属于同一分支,结合菌株HB022的形态学特征,最终鉴定菌株HB022为地衣芽孢杆菌(Bacillus licheniformis)。
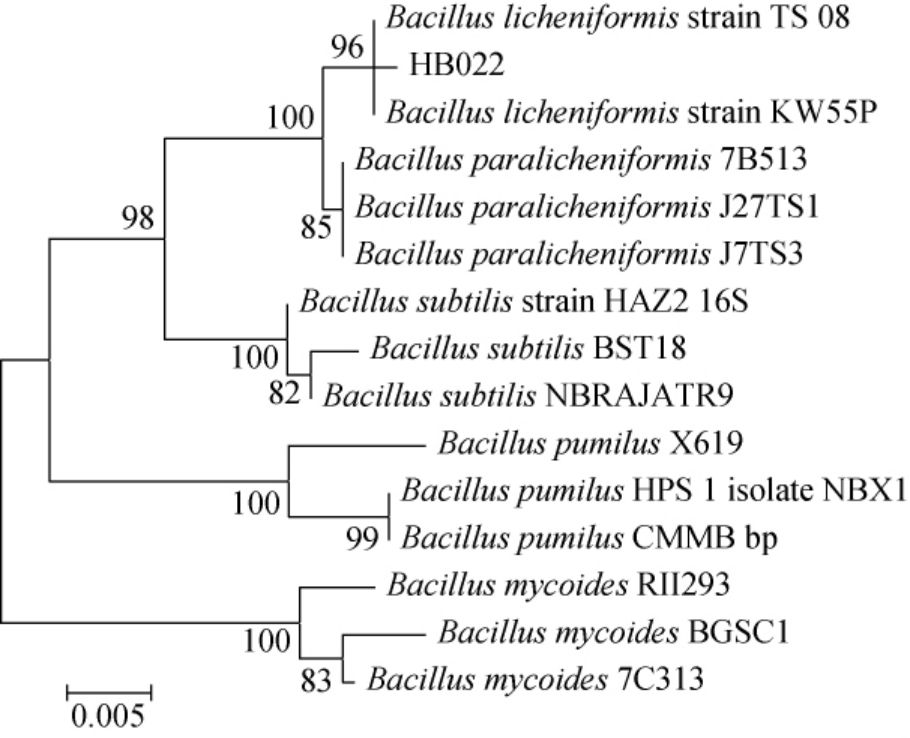
图3 基于16S rDNA基因序列菌株HB022的系统发育树
Fig. 3 Phylogenetic tree of strain HB022 based on 16S rDNA gene sequences
2.4 菌株HB022对AFB1脱毒方式的探究
迄今为止,研究发现微生物对AFB1的脱毒作用主要分为菌体细胞壁吸附和菌株代谢分解转化这2种方式[24]。某些芽孢杆菌属(Bacillus sp.)、镰刀菌(Fusarium sp.)等对AFB1也有一定的吸附作用[25],但大多数微生物对AFB1的吸附是非特异性的,且有可逆性,不能从根本上去除毒性[26]。为了探究菌株HB022对AFB1的脱毒机理,将菌株HB022培养至24h的菌液采用灭菌处理后,其AFB1降解率仅有26.48%,而未经灭菌处理的菌液的AFB1降解率则达到78.93%,这充分说明菌株HB022对AFB1的去除主要是通过生物降解作用而非菌体吸附作用来完成的。
2.5 菌株HB022降解AFB1发酵条件优化单因素试验
2.5.1 发酵时间对菌株HB022降解AFB1的影响
由图4可知,随着发酵时间的延长,菌株HB022对AFB1的降解率在持续增长,其降解率在0~24 h提升较为缓慢,在发酵时间24~48 h,降解率随之提升迅速,在48 h后又趋于缓慢,分析可能是由于营养物质的消耗、有毒代谢产物的积累及pH的变化导致菌株HB022的生长和降解酶的活性受到影响。在72 h时,AFB1降解率达到84.61%,发酵时间>72之后,AFB1降解率趋于平稳,因此,最适培养时间为72 h。
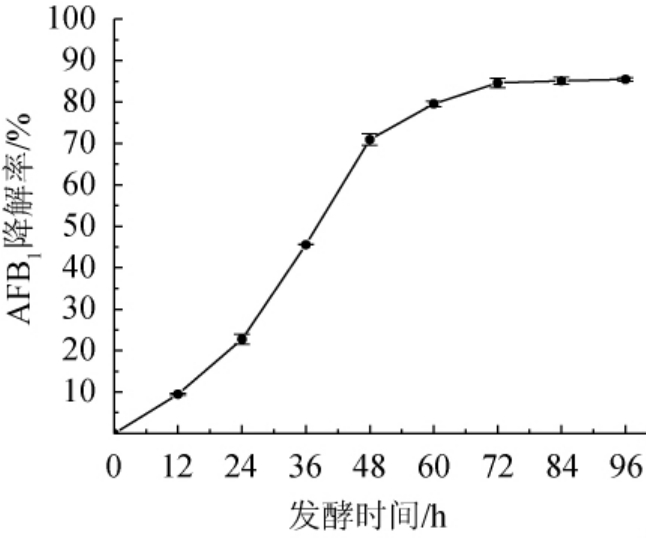
图4 发酵时间对菌株HB022降解AFB1的影响
Fig. 4 Effect of fermentation time on AFB1 degradation by strain HB022
2.5.2 接种量对菌株HB022降解AFB1的影响
由图5可知,菌株HB022在接种量为4%~5%时,AFB1降解率呈上升趋势并在5%接种量时达到最大,为82.38%。当接种量继续升高,AFB1的降解率则呈下降趋势,接种量太大,在发酵初期加速了营养物质和溶氧的消耗,随着发酵的进行,便不足以提供菌株发酵的营养需求,从而导致接种量为8%时的AFB1降解率只有76.04%。因此,最适接种量为5%。
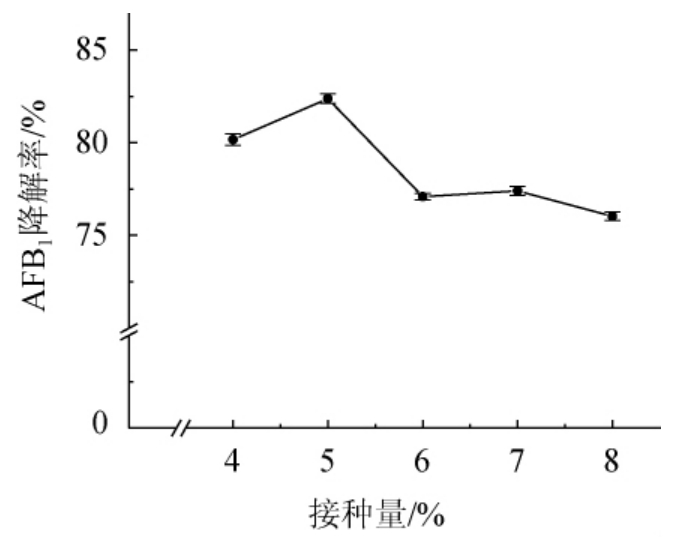
图5 接种量对菌株HB022降解AFB1的影响
Fig. 5 Effect of inoculum on AFB1 degradation by strain HB022
2.5.3 发酵温度对菌株HB022降解AFB1的影响
由图6可知,发酵温度在28~34 ℃时菌株HB022对AFB1的降解率较低,降解率在55%~70%之间,而在37 ℃时降解率达到最高,为85.24%,说明其最适发酵温度为37 ℃。随着发酵温度升高达到40 ℃,其AFB1降解率则又下降到只有51.7%。分析其原因可能是发酵温度已超过其菌体最适生长温度或降解酶催化最适温度,从而影响了菌体的增殖或AFB1降解酶的酶活。因此,最适发酵温度为37 ℃。
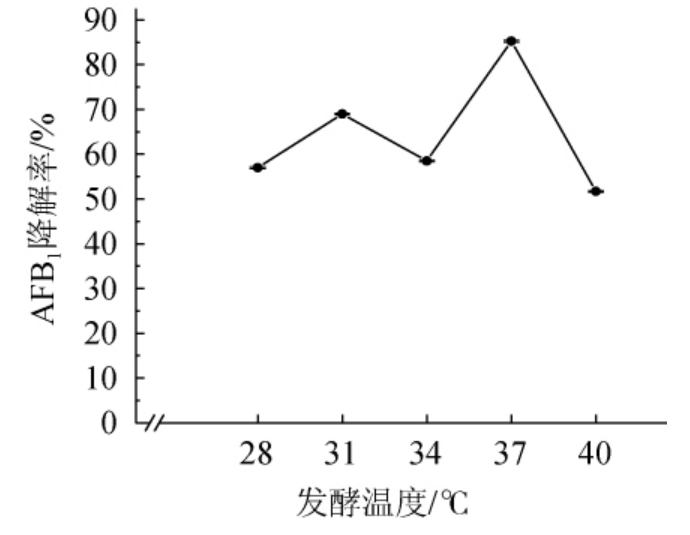
图6 发酵温度对菌株HB022降解AFB1的影响
Fig. 6 Effect of fermentation temperature on AFB1 degradation by strain HB022
2.5.4 初始pH值对菌株HB022降解AFB1的影响
AFB1在初始pH 9.0~10.0的强碱溶液中自身能够快速分解且反应可逆,另外参考相关文献的研究方法,对pH值的研究只进行到pH 8.5[14]。由图7可知,发酵培养基初始pH值在5.0~6.5之间时对菌株HB022降解AFB1的影响较小,降解率均在70%~75%之间,但当pH值>6.5之后,随着pH的升高降解率也随之升高,并在pH为8.5时,降解率达到90.28%。综合考虑到AFB1在高于pH 9.0条件下碱性越强自身分解越大[27],以及地衣芽孢杆菌菌体适宜生长pH值,避免pH过高对降解酶的活性造成影响[28-29],因此,最适初始pH值为7.2。
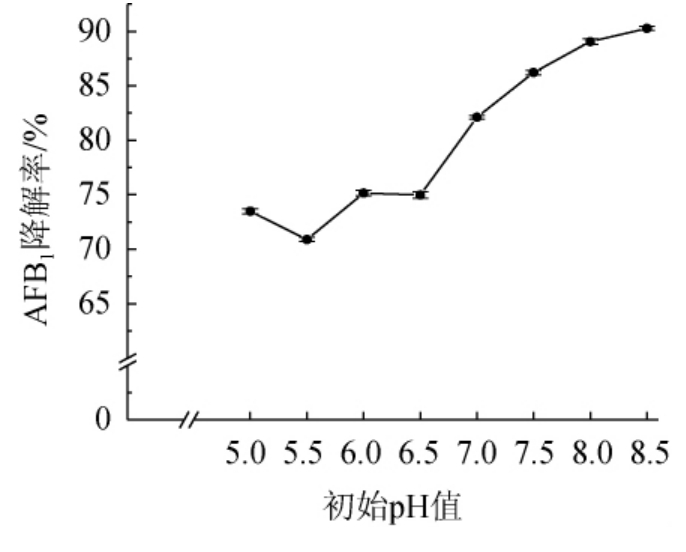
图7 培养基初始pH值对菌株HB022降解AFB1的影响
Fig. 7 Effect of medium initial pH on AFB1 degradation by strain HB022
2.5.5 AFB1质量浓度对菌株HB022降解AFB1的影响
为了探究菌株HB022对高浓度AFB1的降解能力,在2.5 μg/mL的基础上提升培养基中AFB1的质量浓度后进行发酵,结果见图8。由图8可知,当AFB1质量浓度为2.5 μg/mL时,AFB1降解率最高,达到83.46%,在质量浓度为25 μg/mL时,AFB1降解率为75.30%,但整体波动不大,说明菌株HB022对于高浓度的黄曲霉毒素也具有良好的降解能力,说明其对黄曲霉毒素污染较为严重的饲料原料的脱毒中具有很大的应用潜力。因此,最适AFB1质量浓度为2.5 μg/mL。
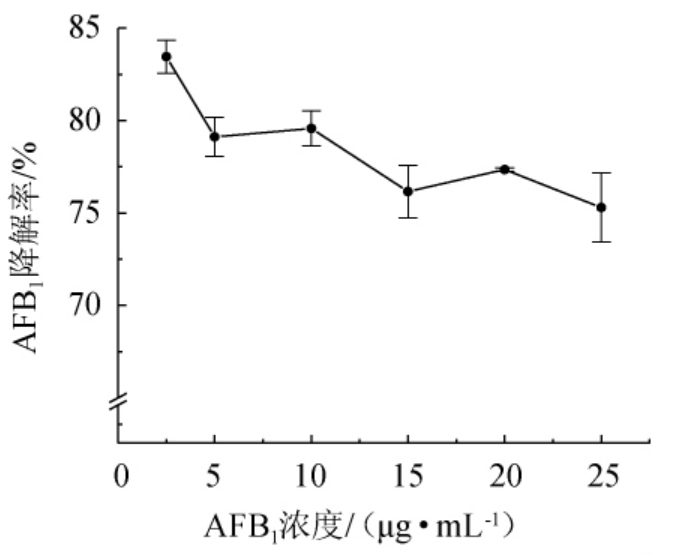
图8 不同质量浓度AFB1对菌株HB022降解AFB1的影响
Fig. 8 Effect of different AFB1 concentration on AFB1 degradation by strain HB022
2.6 菌株HB022降解AFB1发酵条件优化正交试验
在单因素试验的基础上,固定发酵培养基初始pH为7.2,选取发酵温度(A)、发酵时间(B)、接种量(C)为影响因素,以质量浓度为2.5 μg/mL的AFB1降解率为评价指标,进行3因素3水平正交试验,正交试验结果与分析见表2。
表2 发酵条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization
续表
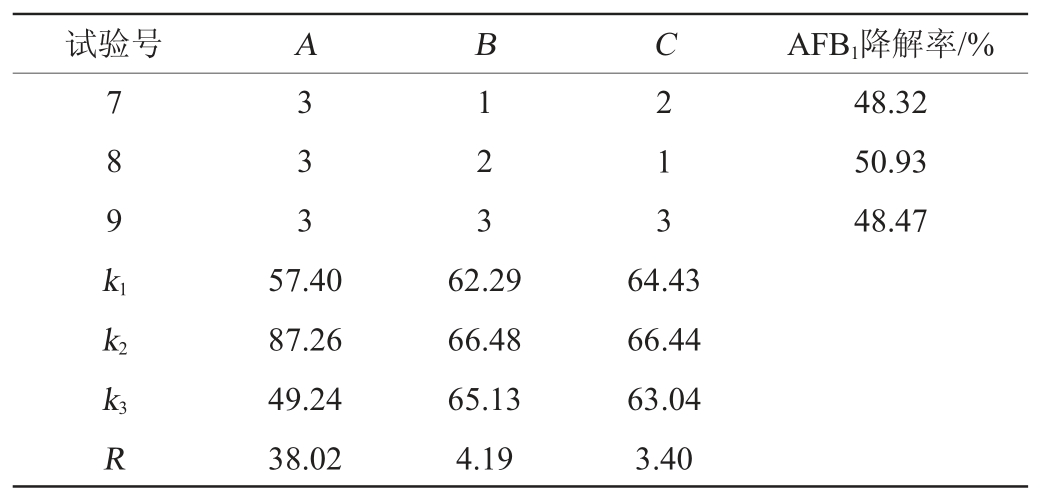
由表2可知,3个因素对菌株AFB1降解率的影响能力排序为A>B>C,即发酵温度>发酵时间>接种量。正交试验最优发酵条件组合为A2B2C2,即发酵温度37 ℃、发酵时间72 h,接种量5%。在此条件下进行5次平行验证试验,AFB1降解率平均值为91.13%。
3 结论
本研究利用香豆素筛选模型,从白酒大曲与酒醅,以及榨菜、酸豆角等不同传统酿造食品中进行了降解菌的初步筛选,获得了23株生长良好的菌株。经多轮复筛发现菌株HB022具高效降解AFB1的能力,降解率达86.22%。结合形态观察与16S rDNA系统发育树分析结果,鉴定菌株HB022为地衣芽孢杆菌(Bacillus licheniformis)。通过单因素试验及正交试验对该菌发酵条件进行优化,结果显示在发酵培养基初始pH 7.2情况下,菌株HB022降解AFB1的最优发酵条件是发酵温度37 ℃、接种量5%、发酵时间72 h。在此优化条件下,菌株HB022对质量浓度为2.5 μg/mL的AFB1降解率达到91.13%。综合来看,该菌有着一定的应用潜力,也为传统酿造微生物应用于食品、饲料或中药材等生产领域的脱毒应用提供了佐证,丰富了AFB1降解菌种资源库。后续将继续开展其作为益生菌剂改善花生粕等饲料原料品质的相关研究。
[1] 孙标,白禄宏,韩立虎,等.产黄曲霉毒素生物降解酶枯草芽孢杆菌菌株的筛选及发酵工研究[J].饲料工业,2020,41(10):30-37.
[2] 李超波,李文明,杨文华,等.黄曲霉毒素B1降解菌的分离鉴定及其降解特性[J].微生物学报,2012,52(9):1129-1136.
[3] 李超波.黄曲霉毒素B1降解菌的分离鉴定及其降解特性[D].南昌:南昌大学,2012.
[4] 谢慧,高蕾,赵丹丹,等.生物法降解黄曲霉毒素B1的研究进展[J].食品与发酵工业,2020,46(24):249-256.
[5] 范云燕,欧嵩凤.中国食用植物油中黄曲霉毒素B1污染现状及风险评估研究进展[J].职业与健康,2020,36(5):701-705.
[6] 季凤杰.奶牛养殖业中黄曲霉素污染和预防控制[J].当代畜牧,2016,33(14):81.
[7] 梁子龙,郭艳,刘文超.黄曲霉毒素B1对肉鸡器官功能的危害及生物活性物质的保护作用[J].当代畜牧,2021(8):23-25.
[8] SAKUDO A,TOYOKAWA Y,MISAWA T,et al.Degradation anddetoxification of aflatoxin B1,using nitrogen gas plasma generated by a static induction thyristor as a pulsed power supply[J].Food Control,2017,73:619-626.
[9] 李玉鹏,王世清,肖军霞,等.低温射频等离子体降解农产品中黄曲霉毒素B1效果的研究[J].粮油食品科技,2014,22(5):54-57.
[10] SHI H,COOPER B R,STROSHINE R L,et al.Structures of degradation products and degradation pathways of aflatoxin B1 by high voltage atmospheric cold plasma (HVACP) treatment[J]. J Agr Food Chem,2017,65(30):6222-6230.
[11] 周建新,吴萌萌,包月红,等.臭氧处理稻谷降解黄曲霉毒素B1的工艺条件优化[J].粮食储藏,2014,43(4):17-21.
[12] 罗小虎,王韧,王莉,等.臭氧降解玉米中黄曲霉毒素B1效果及降解动力学研究[J].食品科学,2015,36(15):45-49.
[13] 田尔诺.黄曲霉毒素B1降解酶及其降解机制研究[D].武汉:湖北工业大学,2018.
[14] 张禹,王海荣.饲料中黄曲霉毒素的危害及脱毒方法进展[J].饲料研究,2021,44(8):157-160.
[15] 蔡俊,田尔诺,邵帅,等.黄曲霉毒素B1生物脱毒的研究进展[J].微生物学通报,2017,44(3):726-731.
[16] 赵春霞,王轶,吕育财,等.黄曲霉毒素的生物降解研究进展[J].湖北农业科学,2016,55(20):5172-5176.
[17] 乔宏兴,姜亚乐,王永芬,等.黄曲霉毒素的危害及其脱毒方法研究进展[J].动物医学进展,2017,38(1):89-93.
[18] 关心,何剑斌,董双,等.黄曲霉毒素B1高效降解菌株的筛选鉴定及其降解[J].华中农业大学学报,2016,35(2):90-96.
[19] TRIPATHI S,MISHRA H N.Studies on the efficacy of physical,chemical and biological aflatoxin B1 detoxification approaches in red chilli powder[J].Int J Food Safety Nutr Public Health,2009,2(1):69-77.
[20] 孙粮,赵仁勇.黄曲霉毒素B1降解菌的筛选鉴定[J].河南工业大学学报(自然科学版),2019,40(3):44-49.
[21] 王威,谢岩黎.黄曲霉毒素B1降解菌的筛选及鉴定[J].食品工业科技,2018,39(17):118-121,127.
[22] 王明清,张初署,于丽娜,等.一株黄曲霉毒素B1降解菌的筛选及鉴定[J].食品工业科技,2019,40(1):105-109.
[23] HORMISCH D,BROST I,KOHRING G W,et al.Mycobacterium fluoranthenivorans sp.nov.,a fluoranthene and aflatoxin B1 degrading bacterium from contaminated soil of a former coal gas plant[J]. Syst Appl Microbiol,2004,27(6):653-660.
[24] GUAN Y,CHEN J,NEPOVIMOVA E,et al.Aflatoxin detoxification using microorganisms and enzymes[J].Toxins,2021,13(46):1-17.
[25] WANG J Q,OGATA M,HIRAI H,et al.Detoxification of aflatoxin B1 by manganese peroxidase from the white-rot fungus Phanerochaete sordida YK-624[J].FEMS Microbiol Lett,2010,314(2):164-169.
[26] 赵萌,高婧,褚华硕,等.黄曲霉毒素B1的分子致毒机理及其微生物脱毒研究进展[J].食品科学,2019,40(11):235-245.
[27] 蔡俊,田尔诺,邵帅,等.黄曲霉毒素B1生物脱毒的研究进展[J].微生物学通报,2017,44(3):726-731.
[28] 胡爽,詹发强,包慧芳,等.饲用地衣芽孢杆菌TS-Ⅱ菌株发酵培养基及发酵条件优化[J].新疆农业科学,2009,46(6):1245-1251.
[29] 刘莹,孙荣丹,杨翔华,等.地衣芽孢杆菌LNPU-1发酵条件研究及培养基优化[J].食品科技,2006(8):28-31.