枸杞(Lycium barbarum)是茄科、枸杞属植物,富含多糖、类胡萝卜素、多酚、生物碱等生物活性成分,为我国传统的药食同源水果,性甘味平,具有滋补肝肾、益精明目等功效[1]。乳酸菌是一类利用碳水化合物发酵产生乳酸等风味物质的革兰氏阳性细菌,广泛存在于泡菜、酵素等发酵食品中[2-3]。枸杞原浆经乳酸菌发酵可以丰富产品的风味,同时乳酸菌发酵带来的益生作用也提高了产品的保健价值[4]。枸杞发酵常用的乳酸菌菌种有植物乳植杆菌(Lac-tiplantibacillus plantarum)、发酵粘液乳杆菌(Limosilactobacillus fermentun)和瑞士乳杆菌(Lactobacillus helveticus)等[5-7],发酵过程可以产生乳酸等有机酸以及乙偶姻、2,3-丁二醇等风味物质[8-9],并且多种乳酸菌共同发酵,往往比单一菌株发酵的产品具有更加丰富、协调的风味[10-11]。
发酵过程乳酸菌的活菌数是分析与控制发酵过程的重要指标[12]。传统的培养法是微生物检测的“金标准”,但其存在操作繁琐、检测周期长、易受杂菌干扰,难以检测“活的非可培养状态(viable but non-culturable,VBNC)”微生物的缺点,导致漏检现象的发生[13-14]。此外,乳酸菌种类众多,但常用的乳杆菌属在菌落形态、显微镜下形状以及代谢特征等方面非常接近,常规的平板计数和显微镜计数等方法并不能有效地区分不同种属的乳杆菌。目前较为常用的宏基因组高通量测序等方法[15-19],由于检测周期长、测序分析费用高等,不适合发酵过程乳酸菌的快速检测。荧光定量聚合酶链式反应(fluorescent quantitative-polymerase chain reaction,fqPCR)是一种在脱氧核糖核酸(deoxyribonucleic acid,DNA)扩增反应中,以荧光强度表示每次PCR循环后产物总量的方法,具有特异性强、灵敏度高、重复性好等优点,可实现特征序列的快速分析检测[20]。利用该方法能够简便、快速地对多种发酵产品中的乳酸菌进行准确定量,如发酵乳中的植物乳植杆菌(L.plantarum)[21],发酵物料中的嗜酸乳杆菌(Lactobacillus acidophilus)[22],发酵面团中的旧金山乳杆菌(Lactobacillus sanfranciscensis)[23],以及葡萄酒中的乳酸菌[24]。但是,由于乳酸菌发酵过程酸度逐渐增加,容易导致微生物细胞膜的损伤甚至死亡,会影响微生物浓度与多样性检测的准确性[25-27]。细胞死亡后DNA分子能保留较长时间,常规的fqPCR技术,容易受到样品中的“死亡微生物”的影响,易造成假阳性结果。叠氮溴化丙锭(propidiummonoazide,PMA)是一种光反应的DNA结合染料,可被活的微生物完整的细胞膜阻止在外,但能渗入膜损伤细胞并插入双链DNA内,与DNA反应生成稳定的共价交联沉淀物,可抑制后续DNA扩增,从而排除死亡微生物的干扰,准确定量活细菌[14,28]。韩之皓等[29]采用PMA处理结合fqPCR方法建立了一种准确检测发酵乳品中L.plantarum活菌数的方法,减少了死亡微生物的干扰。利用该方法还可以分析检测山西老陈醋发酵过程不同种属乳酸菌的活菌数,可以对发酵过程乳酸菌的浓度变化进行监测[30]。
本研究以枸杞果汁为原料,植物乳植杆菌、发酵粘液乳杆菌和瑞士乳杆菌为混合菌种进行发酵。为实现枸杞果汁发酵过程中主要乳酸菌的快速检测,对可修复乳酸菌细胞膜损伤的修复液的组成及修复温度进行优化,以期使亚致死性损伤的乳酸菌细胞进行修复,提高方法的准确性,并分别针对植物乳植杆菌、发酵粘液乳杆菌和瑞士乳杆菌设计特异性引物,利用PMA-fqPCR方法,实时定量检测枸杞果汁发酵过程中不同乳酸菌活菌数,建立枸杞果汁发酵过程主要乳酸菌的实时定量检测方法。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
宁夏中宁枸杞原浆:宁夏中宁枸杞产业创新研究院。植物乳植杆菌(Lactiplantibacillus plantarum)AF1-9、发酵粘液乳杆菌(Limosilactobacillus fermentum)AF4-5、瑞士乳杆菌(Lactobacillus helveticus)AF1-5:保存于天津科技大学微生物菌种保藏管理中心。pMD-18T载体、大肠杆菌(Escherichia coli)DH5α感受态细胞:大连宝生物工程有限公司。
1.1.2 引物
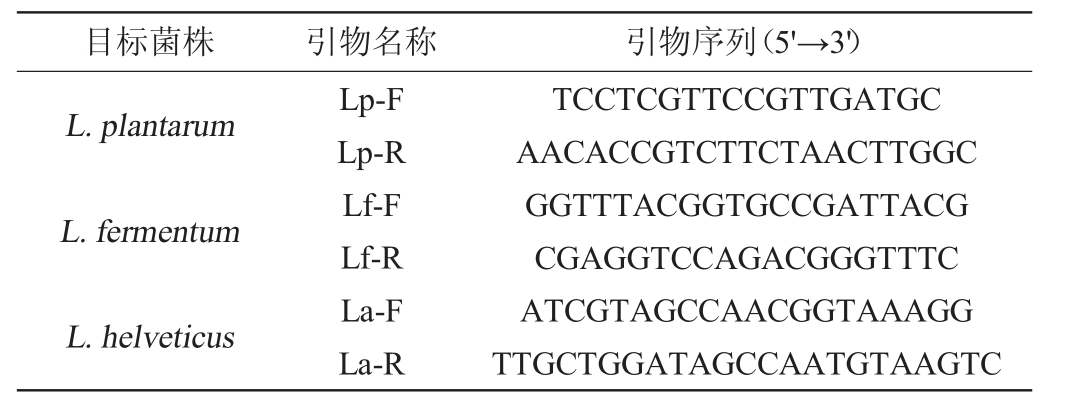
利用DNAMAN软件(V 8.0)分别比对分析美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中L.plantarum WCFS1、L.fermentum IFO 3956、L.helveticus CNRZ32的乳酸脱氢酶基因序列,设计特异性引物,见表1。
表1 本研究所用的引物
Table 1 Primers used in the study
1.1.3 化学试剂
磷酸盐缓冲液(phosphate buffered saline,PBS)、叠氮溴化丙锭(PMA):北京索莱宝科技有限公司;质粒提取试剂盒、胶回收试剂盒、细菌基因组DNA提取试剂盒:TIANGEN生化科技(北京)有限公司;高效感受态细胞制备试剂盒:上海捷瑞生物工程有限公司;Taq DNA聚合酶、10×PCR Buffer、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP):大连宝生物公司。
1.1.4 培养基
MRS液体培养基:葡萄糖2%,蛋白胨1%,牛肉提取物1%,酵母提取物0.5%,无水乙酸钠0.5%,吐温80 0.1%,柠檬酸铵0.2%,磷酸氢二钾0.2%,硫酸镁0.058%,硫酸锰0.025%,调节pH为6.2~6.8,115 ℃灭菌20 min。
减量肉汤培养基:蛋白胨1 g/L,牛肉浸出粉0.3 g/L,氯化钠0.5 g/L,115 ℃灭菌20 min。
1.2 仪器与设备
SW-CJ-1FD超净工作台:苏州安泰空气技术有限公司;ZHWY-2102恒温培养振荡器:上海智城分析仪器制造有限公司;UVmini-1240紫外可见分光光度计:日本岛津公司;TMTime PCR System荧光定量PCR仪:美国Applied Biosystems公司;Mastercycler基因扩增仪、D30微量核酸蛋白浓度测定仪:德国Eppendorf公司。
1.3 方法
1.3.1 种子液的制备
分别将乳酸菌AF1-9、AF4-5、AF1-5斜面培养物在MRS液体培养基中活化培养,37 ℃静置培养12 h,OD600nm值≈0.8时,以1%(V/V)的接种量接入MRS液体培养基,37 ℃静置培养24 h,连续培养2次作为种子液。
1.3.2 枸杞果汁的发酵
将活化后的乳酸菌AF1-9、AF4-5、AF1-5种子液在MRS液体培养基中37 ℃静置培养24 h,将3株乳酸菌的种子液分别以1%(V/V)的接种量接入枸杞原浆中,37 ℃静置培养,每12 h振荡混匀10 min,即得枸杞汁发酵果汁。
1.3.3 亚致死乳酸菌修复条件的优化
亚致死乳酸菌修复液成分:减量肉汤培养基+外源物。外源物包括:吐温80(0.05%、0.1%、0.15%)、丙酮酸钠(0.05%、0.09%、0.13%)、过氧化氢酶(0.01%、0.04%、0.07%)、MgCl2(1 mmol/L、3 mmol/L、5 mmol/L)、Na2HPO4(0.05 mmol/L、1mmol/L、2mmol/L)、MnCl2(1mmol/L、2mmol/L、4 mmol/L)、FeCl2(1 mmol/L、2 mmol/L、4 mmol/L)。
亚致死乳酸菌修复液组成的确定:乳酸菌种子液于6 000 r/min离心3 min后弃上清,沉淀用等体积无菌PBS缓冲液重悬,放入55 ℃的水浴锅,水浴5 min,得到损伤菌,于6 000 r/min离心3 min后弃上清,沉淀用等量的修复液溶解,于37 ℃静置培养15 min后进行PMA-fqPCR分析,统计结果并分析,每组实验平行3次,确定最适的修复液组成。
亚致死乳酸菌修复温度的确定:取适量损伤菌菌液于6 000 r/min离心3 min后弃上清,添加修复液(吐温80 0.1 g/L、丙酮酸钠0.09 g/L、过氧化氢酶0.04 g/L、MgCl2 3 mmol/L、Na2HPO4 1 mmol/L、MnCl2 2 mmol/L、FeCl2 2 mmol/L)后分别置于不同温度(37 ℃、32 ℃、27 ℃、22 ℃)下,静置培养15 min后进行PMA-fqPCR分析,统计结果并分析,每组实验平行3次,得到最适修复温度。
1.3.4 PMA-fqPCR检测枸杞果汁发酵过程乳酸菌数量
质粒DNA标准曲线的建立:分别采用细菌基因组DNA提取试剂盒提取菌株L.helveticus(AF1-5)、L.plantarum(AF1-9)、L.fermentum(AF4-5)的基因组DNA。如表1所示,分别以Lh-f和Lh-r为引物,L.helveticus的基因组DNA为模板,扩增特异性基因片段;以Lp-f和Lp-r为引物,L.plantarum的基因组DNA为模板,扩增特异性基因片段;以Lf-f和Lf-r为引物,L.fermentum的基因组DNA为模板,扩增特异性基因片段。PCR扩增体系及条件参照本实验室方法进行[30]。将特异性基因片段连接到pMD-18T载体后转入大肠杆菌DH5α感受态细胞中,筛选阳性克隆菌落,经过PCR及测序后提取质粒DNA获得质粒标准品,测定质粒标准品DNA的浓度并换算成基因拷贝数,标准品浓度的计算公式如下:
其中:c标为质粒标准品浓度,拷贝数/μL;OD260nm值为由核酸浓度测定仪3次测定的平均值;A为换算系数0.05,即1个单位的OD260nm值=0.05 μg/(μLDNA);N为稀释倍数;6.02×1023为阿佛加德罗常数。
将获得的质粒标准品进行10倍梯度稀释至1×1010~1×106拷贝数/μL的5个梯度,作为标准模板溶液进行荧光定量PCR反应,以质粒标准品浓度的对数(Y)作为纵坐标,以荧光定量PCR的循环阈值(cycle threshold,Ct)(即每个反应管内的荧光信号达到设定的阈值时所经历的循环数)为横坐标(X),绘制质粒DNA浓度标准曲线。
fqPCR扩增体系(20 μL)[30]:质粒模板2 μL,荧光定量PCR上、下游引物(如表1所示)各0.4 μL,SYBR Green Master Mix 10 μL,加双蒸水(ddH2O)至20 μL。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,40个循环;生成熔解曲线步骤为:95 ℃反应15 s,60 ℃反应60 s,95 ℃反应15 s。根据荧光值的变化规律,系统将自动生成扩增曲线和熔解曲线,得到每个样品的Ct值。
枸杞果汁发酵过程中乳酸菌的PMA-fqPCR检测:取枸杞发酵液5 mL,在4 ℃、6 000 r/min离心10 min,收集菌体,弃上清。菌体沉淀用等体积的修复液重悬,在27 ℃静置培养15 min后4 ℃、6 000 r/min离心10 min,收集菌体。菌体沉淀用无菌PBS缓冲液重悬,加入叠氮溴化丙锭(PMA)至终质量浓度为30 μg/mL,PMA与菌液充分混匀后在室温条件下避光反应10 min,之后将样品置于冰上(避免过热),在距离样品20 cm处利用500 W的卤素灯曝光20 min,曝光期间每隔5 min进行充分混匀。曝光交联后菌体用无菌PBS缓冲液洗涤,然后在4 ℃、6 000 r/min离心10 min,收集菌体,提取DNA进行fqPCR实验[30]。根据标准品质粒标准曲线回归方程计算枸杞果汁发酵过程中的乳酸菌浓度。
1.3.5 分析检测
总糖的测定按照GB/T 5099.7—2016《食品安全国家标准食品中还原糖的测定》。总酸的测定按照GB/T 12456—2021《食品中总酸的测定》。
样品中乳酸菌总数的测定:将样品梯度稀释,吸取0.1 mL稀释液涂布于MRS培养基平板,正向放置30 min待液体被固体培养基吸收完全,37 ℃培养箱倒置培养24 h。选择菌落数在30~300之间的平板进行乳酸菌计数[31]。
2 结果与分析
2.1 PMA-fqPCR方法优化
2.1.1 引物特异性验证
分别以L.helveticus AF1-1、L.plantarum AF1-9、L.fermentum AF4-5的基因组为模板进行PCR扩增,验证引物特异性。由图1可知,根据L.helveticus、L.plantarum、L.fermentum中乳酸脱氢酶基因设计的特异性引物相互之间不存在干扰,具有较好的特异性。
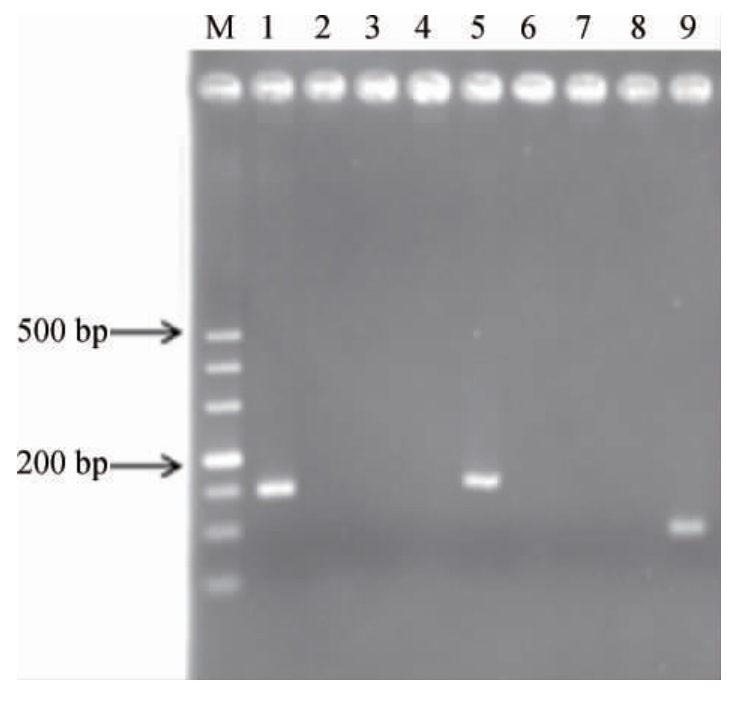
图1 引物特异性验证结果
Fig. 1 Verification results of the primers specificity
M:DL500 DNA Marker;1~3为采用引物Lh-f和Lh-r分别扩增瑞士乳杆菌AF1-1、植物乳植杆菌基因组AF1-9、发酵粘液乳杆菌AF4~5基因组中目的片段;4~6为采用引物Lp-f和Lp-r分别扩增瑞士乳杆菌AF1-1、植物乳植杆菌基因组AF1-9、发酵粘液乳杆菌AF4-5基因组中目的片段;7~9为采用引物Lf-f和Lf-r分别扩增瑞士乳杆菌AF1-1、植物乳植杆菌基因组AF1-9、发酵粘液乳杆菌AF4-5基因组中目的片段。
2.1.2 标准曲线回归方程的建立
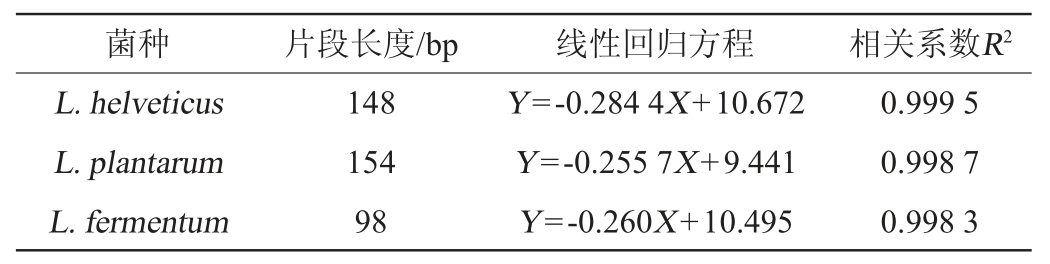
根据1.3.4所述实验方法进行fqPCR定量检测,每个浓度3个平行检测,取平均Ct值,分别建立不同菌株活菌数对数值lg(CFU/mL)与Ct值的标准曲线回归方程,结果见表2。由表2可知,所建立的标准曲线回归方程的线性相关系数达到0.99以上,均符合实时荧光定量PCR的定量要求,可对待检测样品浓度进行精确定量。
表2 不同菌株活菌数标准曲线回归方程
Table 2 Standard curves regression equation of viable bacterial counts of different strains
2.1.3 亚致死乳酸菌修复条件的优化
乳酸菌是一类重要的微生物,在食品工业上常用作发酵剂及益生菌制品[4]。果汁发酵通常具有较高的糖度,发酵过程乳酸菌会代谢产生乳酸等有机酸导致pH降低,而高渗和高酸等条件会造成部分乳酸菌细胞膜和细胞壳损伤,形成亚致死状态,影响了PMA-fqPCR方法的准确性[14]。通常情况下,亚致死乳酸菌的细胞膜损伤转变是可逆的,合适的修复条件有助于亚致死乳酸菌的修复,有机物质和矿化处理都有助于乳酸菌细胞膜和细胞壳的损伤修复。因此,在进行PMA-fqPCR时进行细胞修复,可以提高分析结果的准确性。本研究在减量肉汤培养基的基础上分别添加了吐温80、丙酮酸钠、过氧化氢酶、MgCl2、Na2HPO4、MnCl2、FeCl2等有机物和盐类[22-23],同时考察温度对乳酸菌修复效果的影响,结果见表3。
表3 乳酸菌修复条件的优化
Table 3 Optimization of the repair conditions of lactic acid bacteria
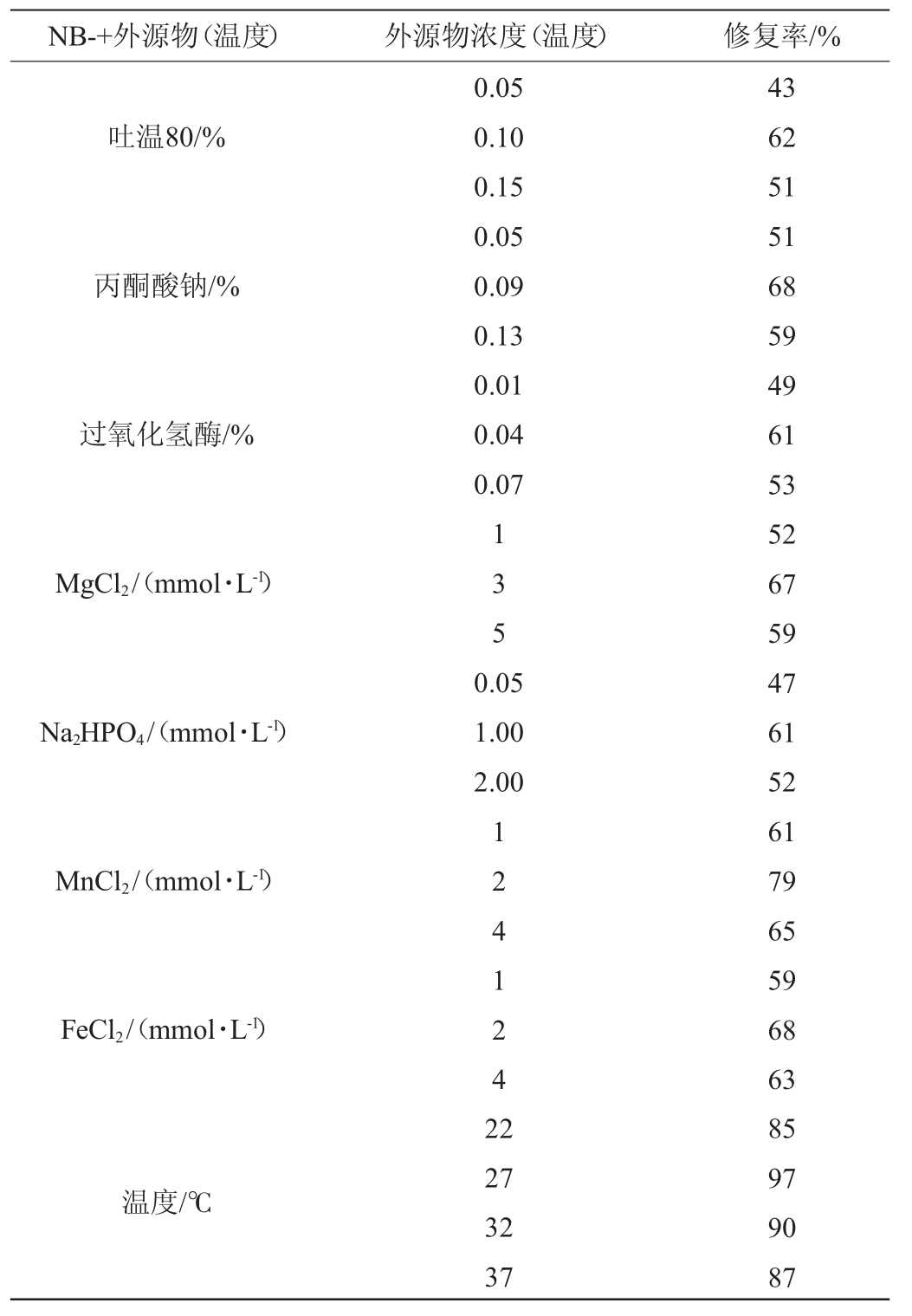
由表3可知,试验菌株分别在减量肉汤培养基添加吐温80的浓度分别为0.05%、0.10%、0.15%时,乳酸菌的修复率呈先升高后下降的趋势,吐温80的浓度为0.10%时,修复率达到最大值,为62%;减量肉汤培养基添加丙酮酸钠的浓度分别为0.05%、0.09%、0.13%时,乳酸菌的修复率呈先升高后下降的趋势,当丙酮酸钠的浓度为0.09%时,修复率达到最大值,为68%;减量肉汤培养基添加过氧化氢酶的浓度为0.01%、0.04%、0.07%时,乳酸菌的修复率呈先升高后下降的趋势,当过氧化氢酶的浓度为0.04%时,修复率达到最大值,为61%;减量肉汤培养基添加MgCl2浓度为1 mmol/L、3 mmol/L、5 mmol/L时,乳酸菌的修复率呈先升高后下降的趋势,当MgCl2的浓度为3 mmol/L时,修复率达到最大值,为67%;减量肉汤培养基添加Na2HPO4浓度为0.05 mmol/L、1.00 mmol/L、2.00 mmol/L时,乳酸菌的修复率呈先升高后下降的趋势,当Na2HPO4的浓度为1.00 mmol/L时,修复率达到最大值,为61%;减量肉汤培养基添加MnCl2浓度为1 mmol/L、2 mmol/L、4 mmol/L时,乳酸菌的修复率呈先升高后下降的趋势,当MnCl2的浓度为2 mmol/L时,修复率达到最大值,为79%;减量肉汤培养基添加FeCl2浓度为1 mmol/L、2 mmol/L、4 mmol/L时,乳酸菌的修复率呈先升高后下降的趋势,当FeCl2的浓度为2 mmol/L时,修复率达到最大值,为68%;因此,确定最适的乳酸菌修复液组成为吐温80 0.10%、丙酮酸钠0.09%、过氧化氢酶0.04%、MgCl2 3 mmol/L、Na2HPO4 1.00 mmol/L、MnCl2 2 mmol/L和FeCl2 2 mmol/L;当温度在22~27 ℃时乳酸菌的修复率呈先升高的趋势,当温度为27 ℃时,乳酸菌修复率达到最大值97%,当温度>27 ℃后,乳酸菌的修复率逐渐下降,因此,确定最佳修复温度为27 ℃。
2.2 枸杞果汁发酵过程主要乳酸菌的实时检测
利用植物乳植杆菌AF1-9、发酵粘液乳杆菌AF4-5和瑞士乳杆菌AF1-5进行枸杞果汁发酵,枸杞果汁发酵过程中总糖、总酸及活菌数的变化见图2。
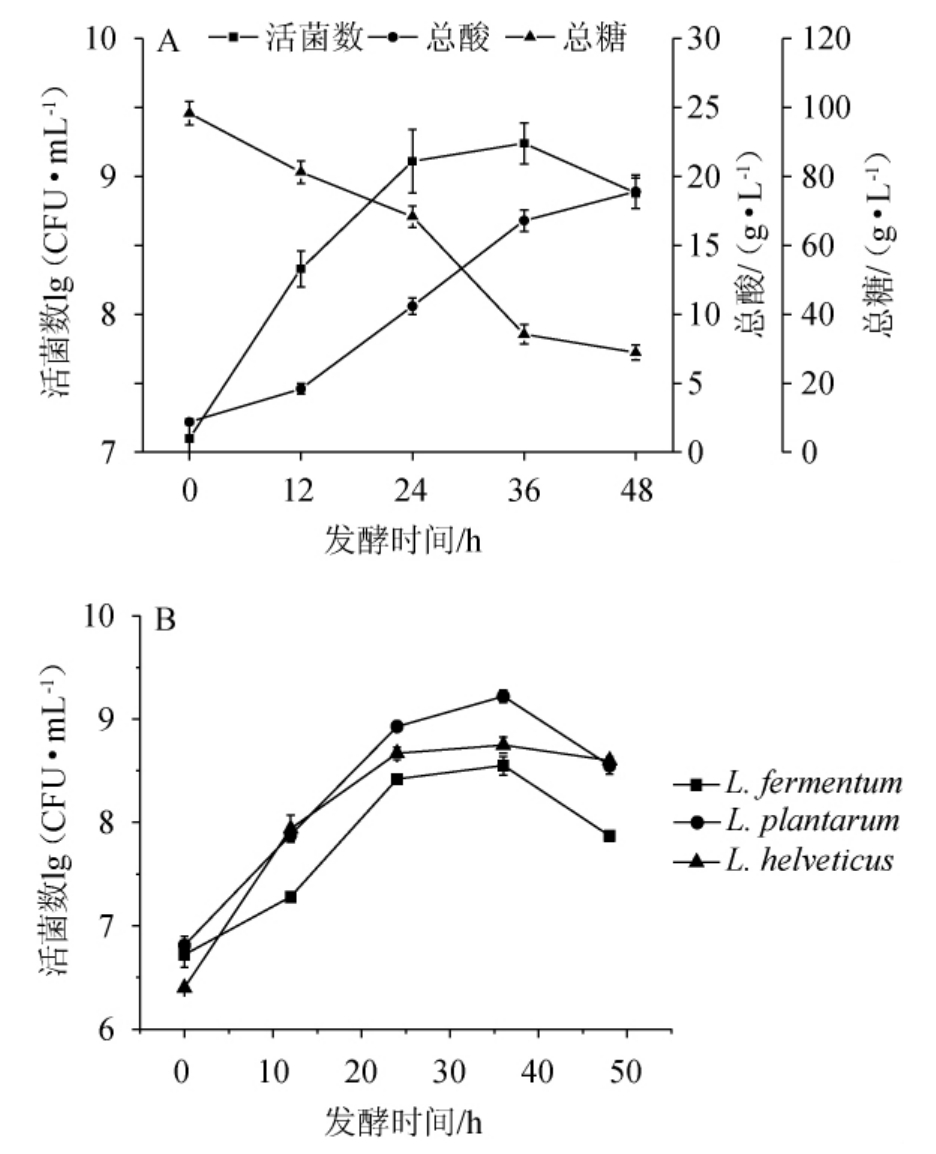
图2 枸杞果汁发酵过程中总糖含量、总酸含量、微生物平板计数(A)及PMA-fqPCR计数(B)变化
Fig. 2 Changes of total sugars contents,total acid contents,microbial plate counts (A) and PMA-fqPCR counts during wolfberry juice fermentation (B)
由图2(A)可知,枸杞果汁发酵过程总糖含量快速降低,酸度和活菌数快速增加,说明乳酸菌快速生长,代谢糖类产生了乳酸等有机酸,发酵最终总酸含量为18.9 g/L,总糖含量为28.9 g/L,平板计数法检测的总活菌数为7.94×108 CFU/mL。该研究结果与他人结果一致[3-4,6]。由图2(B)可知,随着发酵时间的延长,采用PMA-fqPCR方法检测的植物乳植杆菌AF1-9、发酵粘液乳杆菌AF4-5和瑞士乳杆菌AF1-5的活菌数逐渐增加,其中植物乳植杆菌AF1-9生长最快,当发酵时间为36 h时,活菌数达到最高值,发酵时间>36 h时,活菌数下降。发酵结束时,发酵粘液乳杆菌AF4-5、植物乳植杆菌AF1-9和瑞士乳杆菌AF1-5总活菌数分别为7.41×107 CFU/mL、3.55×108 CFU/mL和3.98×108 CFU/mL。与平板计数法相比(图2A),采用PMA-fqPCR方法(图2B)菌体总浓度略高,可能是由于部分乳酸菌在修复培养的时候进行繁殖导致的。因此,PMA-fqPCR方法能够实时监测发酵过程植物乳植杆菌、发酵粘液乳杆菌和瑞士乳杆菌的菌体浓度,有助于今后发酵工艺的优化与产品品质的控制。
3 结论
采用复合乳酸菌(植物乳植杆菌、发酵粘液乳杆菌、瑞士乳杆菌(1∶1∶1,V/V))进行枸杞果汁发酵,最优的乳酸菌亚致死修复液的组成为:蛋白胨1 g/L,牛肉浸出粉0.3 g/L,氯化钠0.5 g/L;吐温80 0.1 g/L、丙酮酸钠0.09 g/L、过氧化氢酶0.04 g/L、MgCl2 3 mmol/L、Na2HPO4 1 mmol/L、MnCl2 2 mmol/L、FeCl2 2 mmol/L。在27 ℃静置培养15 min,乳酸菌亚致死细胞修复率达到97%。设计分别针对植物乳植杆菌、发酵粘液乳杆菌和瑞士乳杆菌的特异性引物,利用PMA-fqPCR方法,实现了发酵过程不同乳酸菌的实时荧光定量检测,为今后复合乳酸菌发酵过程中的微生物的动态在线监测提供了参考方法。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:249.
[2] 陈彦辉,董建方,朱银龙,等.乳酸菌发酵改良枸杞酒风味工艺研究[J].酿酒科技,2021(11):45-52.
[3] 黄宁馨,鲁群,丁士勇,等.复合乳酸菌发酵过程中枸杞果汁品质及抗氧化活性变化[J].华中农业大学学报,2021,40(6):186-194.
[4] 马晓娟,谢有发,余银芳,等.发酵枸杞原浆中多糖、活菌数的变化规律[J].食品安全导刊,2019(28):62-65.
[5] 胡金丽,高庆超,扎西巴藏,等.黑果枸杞酵素中乳酸菌和酵母菌的分离鉴定和安全性评价[J].食品安全质量检测学报,2021,12(20):8207-8213.
[6] 李旭阳,刘慧燕,潘琳,等.宁夏自然发酵泡菜中乳酸菌的分离鉴定及其在枸杞汁发酵中的应用[J].食品工业科技,2021,42(23):126-134.
[7] HASSAN M U,NAYAB H,SHAFIQUE F,et al.Probiotic properties of Lactobacillus helveticus and Lactobacillus plantarum isolated from traditional Pakistani yoghurt[J].Biomed Res Int,2020:8889198.
[8] 俞本杰.发酵乳中增香乳酸菌的筛选及其产香机制研究[D].上海:上海应用技术大学,2020.
[9] KANDASAMY V,LIU J M,DANTOFT S H,et al.Synthesis of(3R)-acetoin and 2,3-butanediol isomers by metabolically engineered Lactococcus lactis[J].Sci Rep,2016,6:36769.
[10] 黄宁馨.复合乳酸菌发酵枸杞汁的工艺优化及其营养品质变化研究[D].武汉:华中农业大学,2021.
[11] LEE J J,CHOI Y J,LEE M J,et al.Effects of combining two lactic acid bacteria as a starter culture on model kimchi fermentation[J].Food Res Int,2020,136:109591.
[12] 刘艳容,舒永红,杨佳玮,等.食品中乳酸菌定量检测方法研究进展[J].食品工业科技,2020,41(12):358-365.
[13] GUO L Z,WAN K,ZHU J W,et al.Detection and distribution of VBNC/viable pathogenic bacteria in full-scale drinking water treatment plants[J].J Hazard Mater,2021,406:124335.
[14] 肖莉莉,张昭寰,娄阳,等.叠氮溴化丙锭(PMA)在食源性致病菌检测中的应用[J].中国食品学报,2016,16(6):187-194.
[15] 夏梦雷,杨帆,陆锴,等.高通量测序技术在传统发酵食品微生物群落中的应用研究[J].中国酿造,2021,40(5):1-7.
[16] HE G Q,LIU T J,SADIQ F A,et al.Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J].J Zhejiang U Sci B,2017,18(4):289-302.
[17] SARDARO M L S,PERIN L M,BANCALARI E,et al.Advancement in LH-PCR methodology for multiple microbial species detections in fermented foods[J].Food Microbiol,2018,74:113-119.
[18] XIE M X,WU J R,AN F Y,et al.An integrated metagenomic/metaproteomic investigation of microbiota in dajiang-meju,a traditional fermented soybean product in Northeast China[J].Food Res Int,2019,115:414-424.
[19] WANG J,WANG R,XIAO Q,et al.Analysis of bacterial diversity during fermentation of Chinese traditional fermented chopped pepper[J].Lett Appl Microbiol,2019,69(5):346-352.
[20] KUBISTA M,ANDRADE J M,BENGTSSON M,et al.The real-time polymerase chain reaction[J].Mol Aspects Med,2006,27(2-3):95-125.
[21] 斯日古冷,包秋华,张家超,等.应用RT-PCR技术定量检测发酵乳中Lactobacillus plantarum活菌数[J].食品科技,2011,36(7):270-275.
[22] 郭子好,方华,夏志生,等.应用RT-PCR技术定量检测发酵物料中嗜酸乳杆菌菌体数[J].饲料研究,2014(23):79-82.
[23] MICHEL E,MONFORT C,DEFFRASNES M,et al.Characterization of relative abundance of lactic acid bacteria species in French organic sourdough by cultural,qPCR and MiSeq high-throughput sequencing methods[J].Int J Food Microbiol,2016,239:35-43.
[24] KÁNTOR A,KLUZ M,PUCHALSKI C,et al.Identification of lactic acid bacteria isolated from wine using real-time PCR[J].J Environ Sci Heal B,2016,51(1):52-56.
[25] 宋金丽,索标,王娜,等.食品中的亚致死致病菌修复及检测技术研究进展[J].食品安全质量检测学报,2013,4(3):841-846.
[26] RITZ M,PILET M F,JUGIAU F,et al.Inactivation of Salmonella typhimurium and Listeria monocytogenes using high-pressure treatments:destruction or sublethal stress[J]. Lett Appl Microbiol,2006,42(4):357-362.
[27] HOEFEL D,GROOBY W L,MONIS P T,et al.Enumeration of waterborne bacteria using viability assays and flow cytometry: a comparison to culture-based techniques[J]. J Microbiol Meth,2003,55(3): 585-597.
[28] 陶怡君,谌志筠,何秋水.叠氮溴化丙锭结合qPCR检测与区分活菌和死菌的研究进展[J].微生物学免疫学进展,2020,48(6):63-68.
[29] 韩之皓,郭帅,黄天,等.叠氮溴化丙锭结合实时荧光定量PCR技术检测发酵乳中植物乳杆菌P-8活菌数[J].食品与发酵工业,2019,45(1):183-189.
[30] 曹珊.山西老陈醋醋酸发酵阶段乳酸菌乳酸合成代谢分析[D].天津:天津科技大学,2018.
[31] 郑宇,牛纪伟,张祥龙,等.传统食醋中潜在污染微生物的分离鉴定[J].现代食品科技,2016(11):334-339.