高粱(Sorghum bicolor L.)为禾本科一年生草本植物,俗称蜀黍、芦稷、芦粟等[1],不仅产量高,而且具有独特的耐盐碱、耐涝、耐旱等抗逆性[2-3]。高粱营养价值丰富,富含蛋白质[4-6]、碳水化合物[7]、膳食纤维[8]、矿物元素[9]等营养成分,是我国酿酒产业的主要原料,在我国已有大面积人工种植。为提高高粱产量,农药在其生长过程中被广泛应用于病、虫、草害等防治,然而因存在农药的不合理使用,故高粱中存在农药污染风险。因此,建立高粱中农药残留量的快速检测方法,对于保证高粱的质量安全具有重要作用。
目前,农药提取常见的方法有加速溶剂萃取、超声提取、固相萃取及QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)方法[10]。如今QuEChERS 方法从最初用于蔬菜水果中农药残留检测的净化提取过程,已发展成为一套根据样品基质不同而灵活改变的系列多农药残留前处理方法。其应用已延伸到畜产品、茶叶、烟草、粮谷等众多领域[11]。本研究采用优化的QuEChERS 法进行简单而有效的样品预处理,结合气相色谱-三重四极杆串联质谱(gas chromatography-triple quadrupole tandem mass spectrometry,GC-MS/MS)技术的多反应监测(multiple reaction monitoring,MRM)采集方式,不仅可以减少基质干扰对农药的测定,同时也降低了检出限,为建立高效的高粱多农残检测技术提供参考,同时也可以提高日常食品安全监管工作的效率,为高粱中农药残留的分析检测提供了一种简单、快速、可靠的分析方法。
1 材料与方法
1.1 材料与试剂
高粱样品(锦杂100、辽杂11、两糯1号、红塔2号、辽杂12、新丰218、睿糯2号、辽杂13、冀粱2号、睿糯7号、辽甜3号、精品红星2号、超级糯1号、矮抗铁杆16号、矮抗12号、晋糯1号、晋糯5号、晋糯12号):均为市售,随机选取颗粒饱满无霉变的高粱粉碎后装入洁净的盛样容器内备用。
正己烷(色谱纯):美国Fisher公司;乙腈(色谱纯):美国TIDE公司;二氯甲烷(色谱纯)、甲苯(优级纯):德国Merck公司;WondaPak QuEChERS提取盐试剂包Ⅱ(5 g无水MgSO4,2.5 g醋酸钠),WondaPak QuEChERS 净化管Ⅰ(100 mg 乙二胺-N-丙基硅烷(primary secondary amine,PSA),800 mg MgSO4)、WondaPak QuEChERS净化管Ⅱ(100 mg PSA,20 mg 石墨化碳黑(graphitized carbon black,GCB),900 mg MgSO4)、WondaPak QuEChERS净化管Ⅲ(450 mg PSA,450 mg C18,1 000 mg MgSO4)、WondaPak QuEChERS净化管Ⅳ(400mgPSA,400mgC18,200 mgGCB,1 200 mg MgSO4):美国Agilent公司;0.22 μm有机相微孔滤膜:天津博纳艾杰尔科技有限公司;环氧七氯(1 000 μg/mL,1.2 mL):坛墨质检科技股份有限公司;农药(甲胺磷、敌敌畏、杀虫脒、甲拌磷、甲基乙拌磷、五氯硝基苯、二嗪磷、地虫硫磷、乙嘧硫磷、除线磷、三唑磷、伏杀硫磷、皮蝇磷、甲基立枯磷、甲基对硫磷、灭菌磷、灭线磷、倍硫磷、三唑磷、乙拌磷、α-六六六、β-六六六、毒死蜱、四氯硝基苯、γ-六六六、δ-六六六、杀螟腈、甲基毒死蜱、毒虫畏、丙溴磷、p,p'-滴滴涕、o,p'-滴滴涕、伐灭磷、噻嗪酮、p,p'-滴滴伊、p,p'-滴滴滴、三硫磷、啶虫脒、嗪草酮、甲氰菊酯、三唑酮、狄氏剂、艾氏剂、异狄氏剂、联苯菊酯)标准品(纯度均≥98.0%):德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
TQ8050气相色谱-三重四极杆串联质谱(GC-MS/MS)仪(配AOC-20i+s自动进样器):日本岛津公司;JE703梅特勒分析天平:瑞士梅特勒公司;SPEX液氮冷冻研磨仪:德国莱特公司;AH-30全自动均质器:睿科集团股份有限公司;Eppendorf 5427 台式高速冷冻离心机:北京仪信网通科技有限公司;Vap Basic旋转蒸发仪:郑州旋转蒸发仪有限公司;XT-NS2定量氮吹浓缩仪:上海新拓分析仪器科技有限公司。
1.3 方法
1.3.1 标准储备液的配制
环氧七氯内标溶液的配制:准确量取环氧七氯标准品(1000μg/mL)100μL于10mL容量瓶中,用正己烷定容,即得质量浓度为10 μg/mL环氧七氯储备液,于2~4 ℃冷藏保存。
45种混合农药标准储备液的配制:分别称取10 mg农药标准品于100 mL容量瓶中,用正己烷定容,即得质量浓度为100 μg/mL混合农药A液,取1 mL混合农药A液于10 mL容量瓶中,用正己烷定容,即得质量浓度10 μg/mL混合农药标准储备液,于2~4 ℃冷藏保存。
1.3.2 样品的制备
称取10.0 g(精确至0.001 g)高粱粉末样品于50 mL离心管中,加入12 mL超纯水,旋涡混匀,静置30 min后加入10 mL乙腈-乙酸乙酯(1∶1,V/V)溶液混匀,加入WondaPak QuEChERS提取盐试剂包Ⅱ均质20 min;6 000 r/min离心10 min;取上清液6 mL于WondaPak QuEChERS 净化管Ⅲ中,立即涡旋5 min后,6 000 r/min离心5 min;取上清液3 mL,40 ℃氮吹浓缩至近干,加入0.1 mL质量浓度为10 μg/mL的环氧七氯内标溶液,用乙酸乙酯定容至1 mL,过0.22 μm有机相微孔滤膜,供GC-MS/MS分析。
1.3.3 仪器条件
气相色谱条件:DB-5 MS毛细管柱(30 m×0.25 mm×0.25 μm);进样模式为不分流;溶剂延迟时间3 min;色谱柱温度为初始温度90 ℃,保持1 min,以20 ℃/min的速率升温至180 ℃,保持2 min,再以15 ℃/min的速率升温至280 ℃,保持8 min;柱流量为1.15 mL/min;载气为氦气(He),纯度≥99.999%;进样口温度280 ℃;进样量1 μL。
质谱条件:电离方式为电子电离(electronion ionization,EI)源;接口温度285 ℃;电子能量70 eV;离子源温度290 ℃;检测器电压(相对于调谐结果)0.5 kV;扫描模式:多反应监测(multiple reaction monitoring,MRM),具体参数见表1;优化条件下的环氧七氯(内标)及45种混合农药标准品的总离子流色谱图见图1。
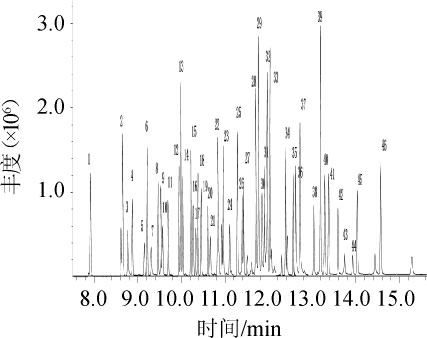
图1 环氧七氯及45种混合农药标准品的总离子流色谱图
Fig.1 Total ion flow chromatogram of heptachlor epoxide and 45 mixed pesticide standards
表1 环氧七氯及45种农药组分的CAS号及MRM参数
Table 1 CAS numbers and MRM parameters of heptachlor epoxide and 45 pesticide components

续表

2 结果与分析
2.1 QuEChERS前处理提取溶剂的选择
农药种类繁多,根据不同农药的性质选择不同提取溶剂对分析结果的准确性至关重要。因一些样品成分复杂,用单一溶剂提取样品中农药残留效果不佳,需要几种溶剂混合提取才能满足农药分析。本试验分别对农药常用提取溶剂,二氯甲烷、乙腈、乙腈-乙酸乙酯(1∶1,V/V)等溶剂提取效果进行考察。以乙腈、二氯甲烷、乙腈-乙酸乙酯(1∶1,V/V)分别作为QuEChERS法萃取溶剂时。实验结果表明,用乙腈-乙酸乙酯(1∶1,V/V)作为提取溶剂时目标农药回收率最高,其45种农药回收率为81.91%~111.93%;而使用单一溶剂乙腈和二氯甲烷作为提取溶剂时,其45种农药回收率为67.91%~86.93%,目标农药回收率相对偏低。研究表明二氯甲烷毒性相对较大,长期接触不利于实验人员的健康[12-14];单一溶剂乙腈提取效果没有混合溶剂乙腈-乙酸乙酯(1∶1,V/V)提取效果好,所以选择乙腈-乙酸乙酯(1∶1,V/V)作为QuEChERS法的提取溶剂。
2.2 QuEChERS法中净化剂的筛选
QuEChERS方法中常用到的净化材料有乙二胺-N-丙基甲硅烷(PSA)、十八烷基硅烷键合硅胶(C18)、石墨化碳黑(GCB)、无水MgSO4等[15]。净化剂对样品的净化效果对检测结果的准确性影响较大,本试验分别考察净化管Ⅰ、净化管Ⅱ、净化管Ⅲ和净化管Ⅳ四种净化试剂盒的净化效果。实验结果表明,净化管Ⅲ净化后效果最佳,其45种农药回收率为83.45%~112.80%;净化管Ⅰ的农药回收率为67.87%~89.77%;净化管Ⅱ的农药回收率为77.34%~90.55%;净化管Ⅳ的农药回收率为81.65%~96.78%;因此,本试验选择净化管Ⅲ作为净化剂。净化管Ⅲ中所含净化剂PSA能有效去除高粱样品提取液有机酸、少量色素和糖类等杂质[16];C18能有效吸附高粱样品提取液长链脂类化合物,甾醇以及其他非极性杂质等;无水MgSO4主要是吸附样品中多余的水分。在选择净化剂时应根据不同样品的组分差异选择合适的净化剂,同时应尽量避免净化剂吸附待测组分[17-18]。
2.3 QuEChERS法提取液净化体积的筛选
WondaPak QuEChERS 净化管Ⅲ(450 mg PSA,450 mg C18,1 000 mg MgSO4)中固定量的净化剂对不同体积高粱样品提取液的净化效果不同,分别考察比较6 mL、8 mL、10 mL高粱样品提取液在WondaPak QuEChERS净化管Ⅲ的净化效果,样品提取液在不同净化体积6 mL、8 mL、10 mL的回收率分别为70.92%~89.65%、88.11%~108.98%、79.88%~91.98%,由实验结果可知,在固定量净化剂下随着净化液体积的增加净化后颜色较深,虽能保住净化后各种农药的净化效果,但是对检测仪器的离子源及色谱柱污染较大。因此,本试验选择吸取8 mL提取液进行净化,既能保证净化效果,又对检测仪器污染较小。
2.4 方法验证
2.4.1 高粱中45种农药的线性关系及方法检出限
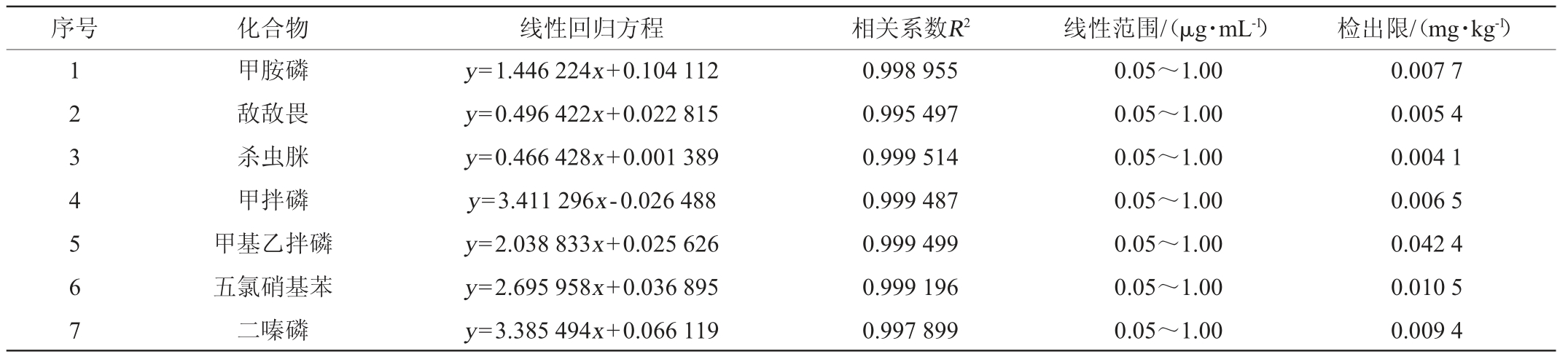
为消除基质影响,将质量浓度10 μg/mL混合农药标准储备液用按1.3.2方法处理后的阴性高粱提取液稀释至质量浓度为0.05 μg/mL、0.10 μg/mL、0.20 μg/mL、0.50 μg/mL和1.00 μg/mL系列标准工作液,其中分别含内标环氧七氯1 μg/mL。以目标物(农药)的质量浓度与内标物环氧七氯质量浓度的比值和对应目标物(农药)峰面积与内标物环氧七氯峰面积的比值绘制标准曲线,峰面积比为y轴,浓度比为x轴[19-20]。以空白基质产生的3倍信噪比(S/N=3)计算检出限[21-26]。由表2可知,45种农药在质量浓度0.05~1.00 μg/mL范围内线性关系良好,相关系数R2均>0.995,检出限在0.001 2~0.042 4 mg/kg。
表2 45种农药的线性回归方程及检出限
Table 2 Linear regression equations and detection limits of 45 pesticides
续表

2.4.2 加标回收率与精密度试验结果
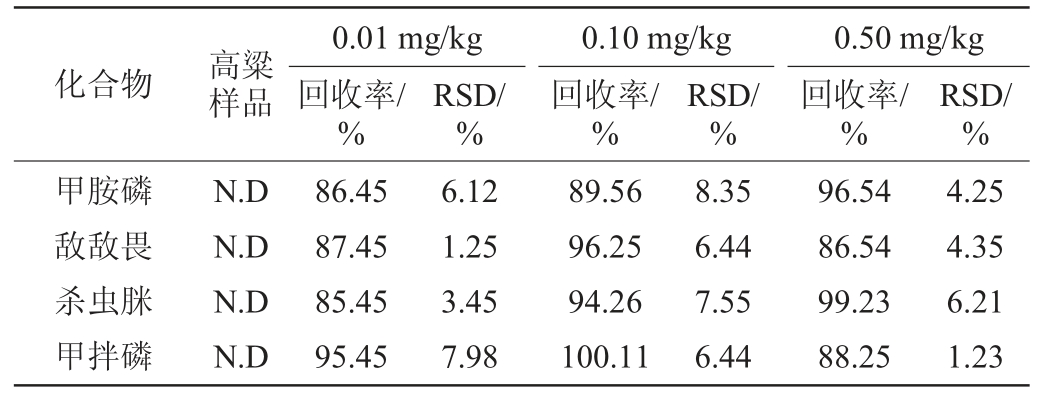
选取阴性高粱样品进行加标回收试验,分别添加0.01 mg/kg、0.10 mg/kg和0.50 mg/kg的3个水平浓度,每个添加水平做6次重复试验,计算其加标回收率、相对标准偏差(relative standard deviation,RSD)。由表3可知,阴性高粱样品中45种农药的3水平加标回收率为76.32%~108.45%,精密度实验结果的RSD为0.12%~10.95%,均满足农药残留痕量分析要求。
表3 精密度及加标回收率试验结果
Table 3 Results of precision and standard recovery rate tests
续表

注:“N.D”表示未检出。
2.5 实际样品的检测
利用该实验所建立的方法对市售18种高粱样品中45种农药残留进行检测,结果见表4。由表4可知,根据GB 2763—2021《食品安全国家标准食品中农药最大残留限量》中规定农药最大残留限量(maximum residue limit,MRLs)对高粱检测结果进行判定,在所检测的45种农药残留中,虽有10种农药残留分别在18种高粱品种中检出呈阳性,其中毒虫畏、狄氏剂分别在睿糯7号、精品红星2号检测结果超过GB 2763—2021规定农药最大残留限量(MRLs)值,其检测结果分别0.025 mg/kg、0.035 mg/kg。其余检测结果呈阳性的农药中有2项未有最大残留限量(MRLs)规定的农药不作判定;剩余6种农药检测呈阳性农药均未超过相关规定的农药最大残留限量值。
表4 高粱样品中45种农药的检测结果
Table 4 Determination results of 45 pesticides in sorghum samples
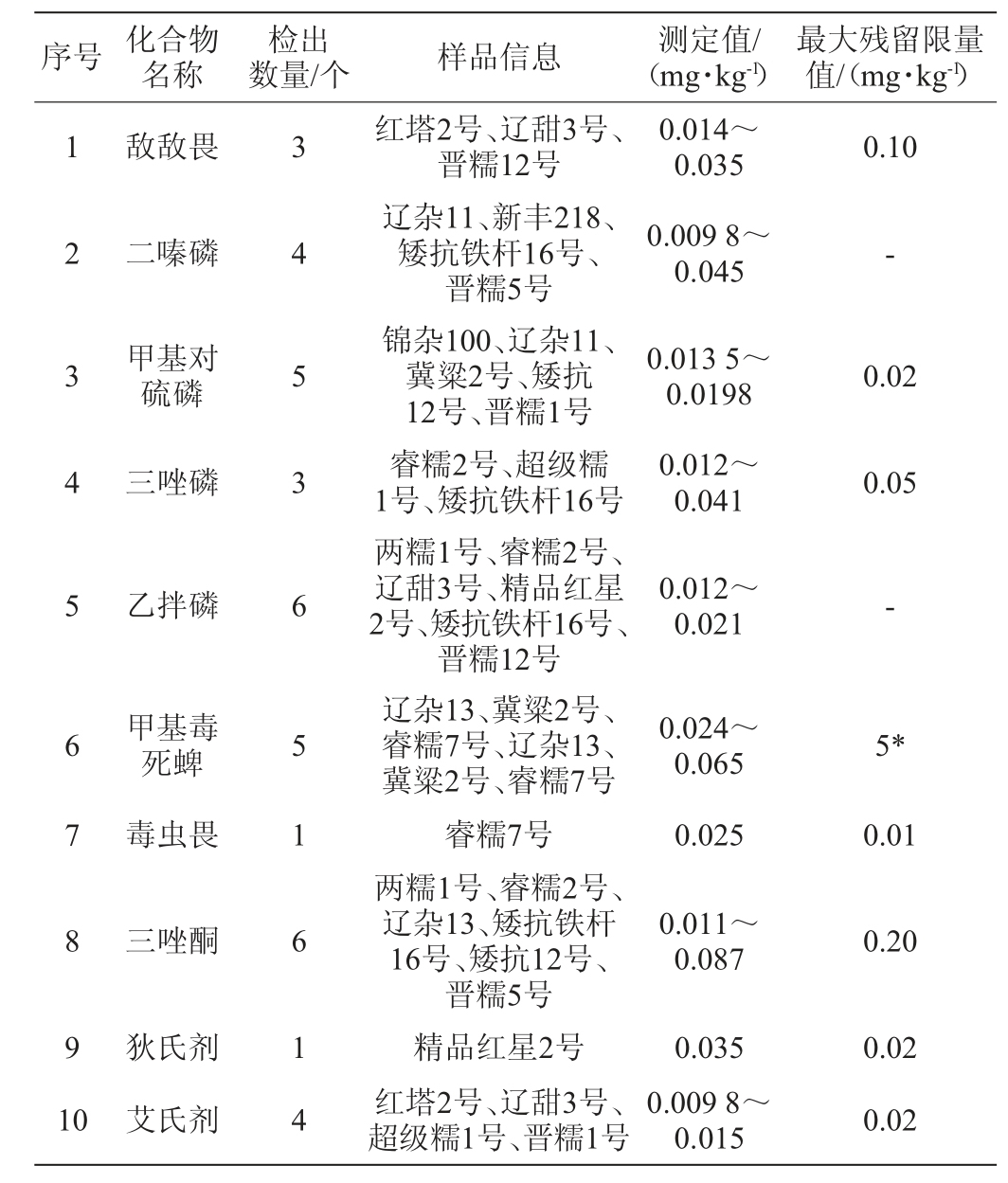
注:“*”该限量为临时限量,“-”表示未有MRLs规定。
3 结论
本实验以高粱为研究对象,通过对试验条件的选择和优化,建立最优QuEChERS方法快速检测高粱中45种农药残留的分析检测方法,该方法前处理操作简单,重复性好,灵敏度高,在0.01 mg/kg、0.1 mg/kg和0.50 mg/kg的加标浓度下,高粱样品中45种农药的平均为回收率为76.32%~108.45%,相对标准偏差(RSD)为0.12%~10.95%,检出限在0.001 2~0.042 4 mg/kg,完全满足日常的农药残留痕量分析工作。本研究采用建立的最优QuEChERS前处理结合气相色谱三重四极杆串联质谱法同时检测市售18种不同品种高粱中农药残留。实验表明,串联质谱的检测方法能够避免杂质的干扰,尤其是分析高粱等复杂样品时,能有效地消除基质干扰,减少假阳性的检出率,同时能提高分析的选择性和检测灵敏度,简化样品前处理过程,降低分析成本。
[1]卢君,唐平,王凡,等.一种评价酱香型白酒酿造过程高粱蒸煮程度的技术研究[J].中国酿造,2021,40(3):73-78.
[2]柳发财,孙志强.不同品种饲草高粱的综合表现及营养价值评价[J].畜牧与饲料科学,2019,40(10):55-58.
[3]LEE S,ZARGAR O,REISER C,et al.Time-dependent mechanical behavior of sweet sorghum stems[J].J Mech Behav Biomed Mater,2020,106(5):103731.
[4]NAVEEN A,PRASHAD M S,NITNAVARE R B,et al.Morpho-physiological traits and leaf surface chemicals as markers conferring resistance to sorghum shoot fly(Atherigona soccata Rondani)[J].Field Crop Res,2020,26(5):1546-1552.
[5]冯涛,唐海洋,杨文祥,等.甜高粱凋萎青贮和混合青贮对发酵品质及营养成分保存效果的影响[J].南京农业大学学报,2019,42(2):352-357.
[6]寇兴凯,徐同成,宗爱珍,等.高粱的营养价值以及应用现状[J].安徽农业科学,2015,43(21):271-273.
[7]易翠平,李艳,姚辰,等.发芽白高粱的工艺优化及主要营养成分分析[J].中国粮油学报,2015,30(6):27-31,42.
[8]AGHA Y,KOWASH M,HUSSEIN I,et al.Fluoride concentration of commercially available infant formulae in the United Arab Emirates[J].Eur Arch Paediatr Dent,2021,15(6):457-466.
[9]LOPEZ C,ADELFIO A,WALL A M,et al.Human milk and infant formulae:Peptide differences and the opportunity to address the functional gap[J].Curr Res Food Sci,2020,26(15):689-696.
[10]黄小兰,周祥德,何旭峰,等.QuEChERS结合气相色谱-三重四极杆串联质谱法快速测定地参中63种农药残留[J].中国酿造,2021,40(3):170-176.
[11]阳曦,陈慧斐,向世杰,等.QuEChERS-气相色谱-串联质谱法测定结球甘蓝中甲基毒死蜱农药残留不确定度评估[J].食品安全质量检测学报,2021,12(3):1136-1141.
[12]刘建平,骆洪,连海飞,等.QuEChERS法萃取-气相色谱-三重四级杆串联质谱法检测大葱等鳞茎类蔬菜中6种杀菌剂的分析方法[J].分析仪器,2020(6):40-45.
[13]司露露,梁杨琳,李湧,等.QuEChERS-气相色谱串联质谱法快速测定供港蔬菜中118种农药残留[J].化学研究与应用,2020,32(11):2034-2043.
[14]李燕妹.QuEChERS-气相色谱-三重四极杆质谱法测定蜂蜜中15种农药残留[J].食品安全质量检测学报,2020,11(20):7466-7471.
[15]傅群,曾远,李华勇,等.QuEChERS-气质法测定蔬菜水果中的甲基异柳磷含量[J].食品工业,2020,41(9):318-320.
[16]毕思远,曹涛,朱志强,等.QuEChERS-气相色谱-串联质谱法测定葡萄等浆果中7种酰胺类杀菌剂残留量[J].理化检验(化学分册),2020,56(9):955-959.
[17]赵馨.QuEChERS方法在HPLC测定高粱中灭蝇胺残留量的应用研究[J].福建农业科技,2020(8):7-12.
[18]叶学敏.新型QuEChERS方法在果蔬农残分析中的应用研究[D].杭州:浙江工业大学,2020.
[19]郑坤明,陈冬花,徐佳,等.QuEChERS-高效液相色谱-串联质谱法测定豇豆中吡蚜酮残留和消解动态[J].农药学学报,2020,22(6):1104-1108.
[20]李志,焦彦朝,王兴宁,等.气相色谱-质谱联用法测定茶叶中21种农药残留[J].中国酿造,2019,38(3):181-186.
[21]刘沛明.气相色谱法测定水产品中氯氰菊酯、氰戊菊酯和溴氰菊酯[J].分析仪器,2020(5):23-26.
[22]傅群,曾远,李华勇,等.QuEChERS-气质法测定蔬菜水果中的甲基异柳磷含量[J].食品工业,2020,41(9):318-320.
[23]李洁,梁艺馨,王兴宁,等.全自动QuEChERS样品制备系统-同位素稀释-气相色谱-串联质谱法测定水果蔬菜中的三苯锡残留[J].食品科技,2020,45(9):321-325.
[24]刘志荣,张明童,谢楠,等.改进QuEChERS-超高效液相色谱-串联质谱法同时测定甘草中86种农药残留[J].质谱学报,2020,41(6):624-636.
[25]赵馨.QuEChERS方法在HPLC测定豇豆中灭蝇胺残留量的应用研究[J].福建农业科技,2020(8):7-12.
[26]李志,冉茂乾,张馨允,等.QuEChERS-GC-MS/MS法同时测定刺梨中15种有机氯农药残留[J].中国酿造,2020,39(3):166-171.