传统米酒是以糯米为主要发酵原料,添加酒曲酿造而成。米酒酒曲中的酵母主要包括酿酒酵母(Saccharomyces cerevisiae)、异常威克汉姆酵母(Wickerhamomyces anomalus)[1]和扣囊覆膜酵母(Saccharomyces fibuligera)[2]等,其作为发酵米酒的主要微生物,对米酒风味特征的影响一直是米酒酿造的研究热点[3-6]。高级醇作为酒精饮料的主要风味之一,对于米酒的风味具有重要贡献。米酒中的高级醇主要由异丁醇、异戊醇和β-苯乙醇组成。高级醇[7]是导致酒精饮料“上头”的关键物质。其中,β-苯乙醇[8]、异戊醇[9]和异丁醇是影响醉酒速率的关键化合物[10]。通过传统固态方法酿造出的米酒高级醇含量通常在245~498 mg/L之间,而啤酒的高级醇含量通常在55~94 mg/L之间[11],与口味清爽的啤酒相比,米酒的高级醇含量过高会使酒体呈现苦味等不良风味[12],且具有较强的致醉性。在实验室中采用液态发酵的方法有助于降低米酒中高级醇的含量,具有非常重要的现实意义。
米酒发酵过程中的主要酵母菌S.cerevisiae、W.anomalus和S.fibuligera都具有产生高级醇的能力[13]。徐银等[14]在小曲酒固态发酵中添加W.anomalus提高了其乙酸乙酯产量,降低了杂醇含量。S.fibuligera的主要代谢产物包括β-苯乙醇、乙酸苯乙酯等,对风味物质的形成有一定的作用[15]。白梦洋等[16]将W.anomalus和S.cerevisiae混合发酵,与纯发酵相比,混合发酵产生了更高浓度、更多种类的风味物质。酵母菌混合发酵可提高果酒的酯类和风味物质含量。
在米酒发酵中,酵母接种量、后发酵温度和后发酵时间是影响米酒质量的关键因素。曾朝珍等[17]研究发现,高级醇含量会随着接种量的提高而升高;温度影响发酵过程中细胞质膜的流动性、酶的活性及物质的溶解度等,在酿酒工艺中低温发酵(10~16 ℃)是常见的发酵方式[18],由于酵母的最适生长温度是25~30 ℃,而在10~16 ℃发酵则有可能导致其生长缓慢与阻滞。张洋洋等[19]研究发现,醇、酯、醛、酸类等风味化合物随糙米酒酿发酵时间增加种类先增后趋于稳定,可能是由于后期低温环境有利于减少醛酮类物质的产生,可通过延长后期低温发酵时间改善米酒质量。
本研究以异常威克汉姆酵母(Wickerhamomyces anomalus)、扣囊复膜酵母(Saccharomyces fibuligera)和酿酒酵母(Saccharomyces cerevisiae)为发酵菌株,采用液态发酵的方式对米酒进行发酵,对其发酵的米酒的挥发性风味物质及感官品质进行分析,并以感官评分和高级醇含量为考察指标,采用单因素试验及响应面试验对其发酵条件进行优化,以期降低米酒中的高级醇含量并提高品质,为米酒酿造的产业升级提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
糯米:市售;异常威克汉姆酵母(Wickerhamomyces anomalus)LL-7、扣囊复膜酵母(Saccharomyces fibuligera)3-1[20]:本实验室分离保存;酿酒酵母(Saccharomyces cerevisiae)H1:某酵母股份有限公司。
1.1.2 试剂
叔戊醇(纯度99%):上海麦克林生化科技有限公司;乙酸戊酯、2-乙基丁酸(纯度均为99.5%):成都艾科达化学试剂有限公司;乙酸乙酯、正丙醇、异戊醇、异丁醇、β-苯乙醇、乙酸(纯度均为99.5%):阿拉丁试剂(上海)有限公司;耐高温α-淀粉酶(酶活30 000 U/g):夏盛(北京)生物科技开发有限公司;糖化酶(酶活100 000 U/g)、蛋白胨、酵母膏(均为生化试剂):安琪酵母股份有限公司;葡萄糖、乳酸、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):天津科密欧化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,蒸馏水1 000 mL;YPD固体培养基:在YPD基础上添加2%琼脂粉。115 ℃高压蒸汽灭菌25 min。
1.2 仪器与设备
UV-5900PC紫外可见分光光度计:上海元析仪器有限公司;7890A气相色谱仪、J&WCP-Wax 57 CB色谱柱(50 m×0.25 mm,0.2 μm):美国安捷伦科技有限公司;DNP-9082恒温培养箱:上海精宏实验设备有限公司;EUG12PY-DEUG超纯水机:上海阳沦精密设备科技有限公司。
1.3 方法
1.3.1 种子液的制备
对实验室保藏的W.anomalus LL-7、S.fibuligera 3-1、S.cerevisiaeH1于YPD固体培养基活化,挑取单菌落到10 mL YPD培养基中,恒温30 ℃,170 r/min摇床培养24 h,得到一级种子液。再取1 mL一级种子液到装液量为100 mL/250 mL的YPD液体培养基中恒温30 ℃、170 r/min摇床培养24 h,得到二级种子液,菌落数为3.76×106 CFU/mL。
1.3.2 米酒的制备
称取一定量的糯米,研磨成粉,过40目的筛。将糯米粉和水以料液比1∶3(g∶mL)混合,于65~90 ℃升温时水浴加热30 min糊化,90 ℃时加入耐高温α-淀粉酶(20 U/g),并保温90 min。冷却后加入糖化酶(150 U/g),65 ℃保温糖化30 min。整个过程中需要不断搅拌,糖化冷却后即为糯米糖化液,初始糖度为160 g/L,pH值为6.0。将二级种子液按5%的体积比接种糯米糖化液,摇匀后放入28 ℃静置培养2 d进行前发酵,20 ℃静置培养3 d进行后发酵,得到米酒。
1.3.3 酵母菌混合发酵米酒试验设计
在米酒制备工艺的基础上,考察不同菌种混合发酵对米酒品质的影响。将不同菌株的二级种子液以5%接种量(V/V)发酵制备米酒,混合发酵米酒菌株添加比例的试验方案设计见表1。
表1 酵母菌混合发酵米酒菌株添加比例的试验设计方案
Table 1 Experimental design scheme of strain addition ratio of rice wine by mixed yeast fermentation

1.3.4 米酒发酵工艺优化
(1)单因素试验
以高级醇含量和感官评分为考察指标,分别考察菌株接种量(2×106 CFU/mL、3×106 CFU/mL、4×106 CFU/mL、5×106 CFU/mL、6×106 CFU/mL)、后发酵温度(16 ℃、18 ℃、20 ℃、22 ℃、24 ℃)、后发酵时间(1 d、2 d、3 d、4 d、5 d)对发酵效果的影响。
(2)响应面试验
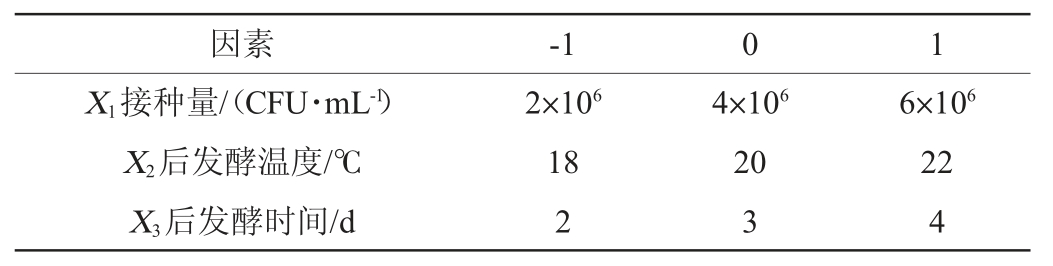
在单因素试验的基础上,进一步研究接种量(X1)、后发酵温度(X2)、后发酵时间(X3)对高级醇含量(Y1)和感官评分(Y2)的影响,采用响应面试验对米酒发酵工艺进行优化,Box-Behnken试验设计因素及水平见表2。
表2 米酒发酵工艺优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design for rice wine fermentation process optimization
1.3.5 分析检测
总酸含量的测定:参照GB/T 13662—2018《黄酒》[21];还原糖含量的测定[22]:采用DNS法。
乙醇含量及高级醇(正丙醇、异戊醇、异丁醇和β-苯乙醇)含量的测定[23]:采用气相色谱法。
标准品的配制:将10 mL乙酸乙酯、正丙醇、异戊醇、异丁醇、β-苯乙醇、乙酸试剂添加到10 mL容量瓶中,并添加0.2 mL内标混合液(叔戊醇质量浓度324.71 mg/L、乙酸戊酯质量浓度352.94 mg/L、2-乙基丁酸质量浓度374.12 mg/L)。
样品前处理:取发酵液和蒸馏水各100 mL于500 mL蒸馏瓶中蒸馏,收集前100 mL蒸出液,蒸馏液用0.45 μm水系膜过膜处理,取10 mL蒸馏液,添加溶液质量浓度分别为叔戊醇324.71 mg/L、乙酸戊酯352.94 mg/L、2-乙基丁酸374.12 mg/L的混合溶液20 μL/mL作内标物,混合均匀,采用气相色谱仪测定。
气相色谱条件:色谱柱为DB-FFAP(60 m×0.25 mm×0.25 μm);载气为氮气(N2);仪器参数为:进样量1 μL,分流比10∶1,氢气(H2)流速为30 mL/min,空气流速为400 mL/min,N2流速为1mL/min,进样口温度220℃,检测器温度为200℃,初始温度为60 ℃,维持5 min,以10 ℃/min的上升速率升至160 ℃,维持5 min,总运行时间20 min。
定性定量方法:根据标准品在色谱图上的保留时间进行定性,根据内标法进行定量。
1.3.6 感官评价
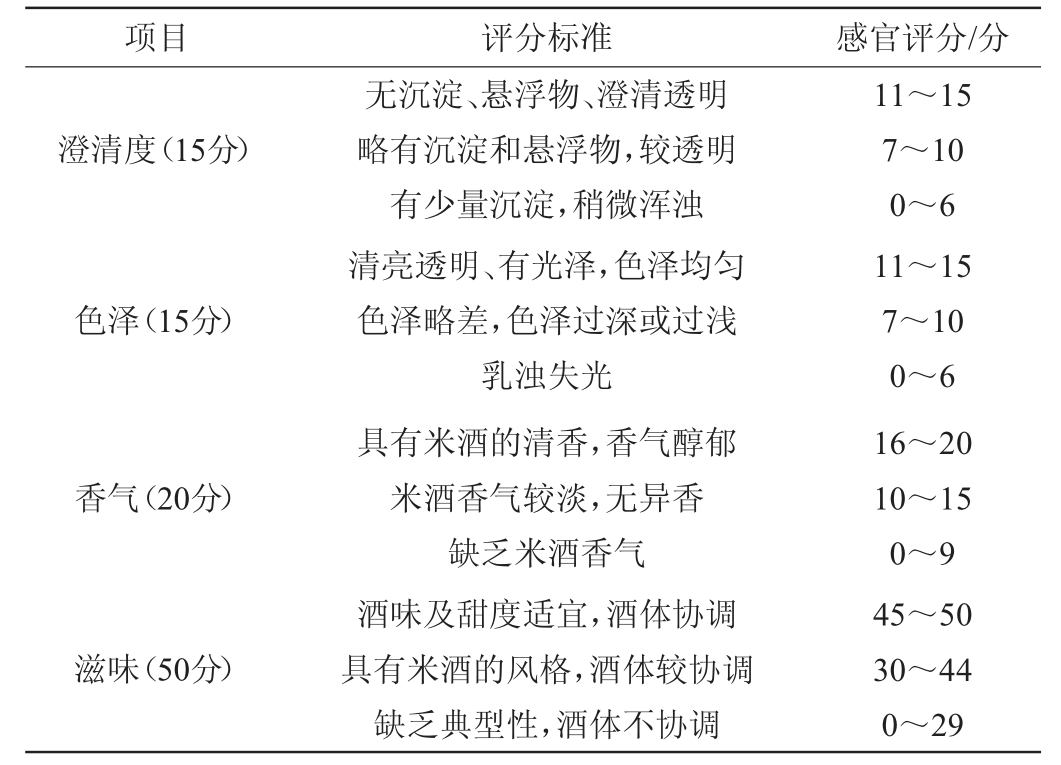
感官评价参照GB/T 13662—2018《黄酒》进行,9名品酒员从澄清度、色泽、香气、滋味4个方面对米酒进行感官评价,满分为100分。米酒感官评分标准见表3。
表3 米酒感官评价标准
Table 3 Sensory evaluation standards of rice wine
1.3.7 数据处理
试验重复3次,结果以“平均值±标准差”表示,制表软件为Excel 2019,制图软件为Origin2021,响应面分析软件为Design-Expert 8.0.6。
2 结果与分析
2.1 混菌组合对发酵米酒品质的影响
2.1.1 混菌组合对发酵米酒理化指标及感官评分的影响
混合发酵米酒的理化指标及感官评分标准见表4。
表4 混合发酵米酒的理化性质与感官评分
Table 4 Physicochemical properties and sensory scores of rice wine fermented by mixed strains
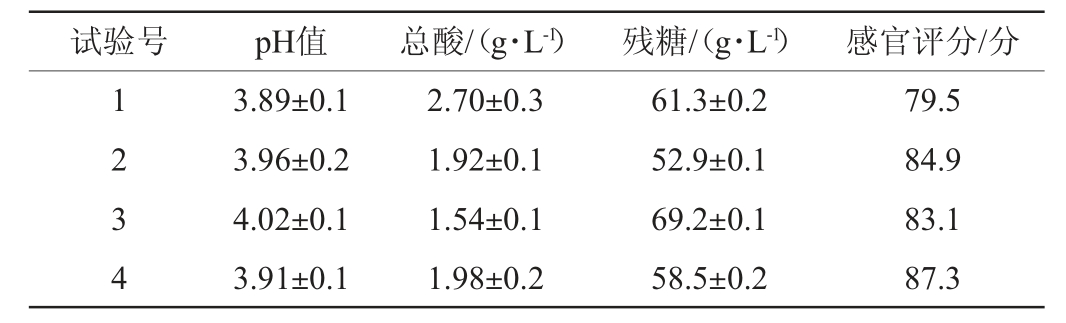
由表4可知,4组合制备米酒的pH值差异不明显,组合3制备米酒的总酸值最低(1.54 g/L),其原因可能是,接种W.anomalu LL-7导致米酒总酸值降低,与刘晓柱等[24]对异常威克汉姆酵母的实验结果较为接近。组合1制备米酒总酸值最高(2.70 g/L)的原因可能是,菌株S.fibuligera 3-1具有较强的产酸能力,对底物的利用较充分,这与王春晓等[25]对扣囊复膜酵母特性研究的结果较为相符;在多菌种发酵米酒中,3种酵母复合发酵的4号组合制备的米酒与未添加菌株S.fibuligera 3-1的3号组合相比,总酸含量提高了28.6%,与未添加W.anomalu LL-7的2号组合制备的米酒相比,残糖含量提高了10.6%,米酒酸甜度更为适中。在4个组合制备的米酒中,组合4号制备米酒的感官评分最高(87.3分),风味物质产出可能更佳,具有一定的研究价值。因此,菌株W.anomalus LL-7、S.fibuligera 3-1、S.cerevisiae H1混合发酵制备米酒效果较好。
2.1.2 混菌组合对发酵米酒挥发性风味物质的影响
组合1、组合2、组合3、组合4制备的米酒酒精度分别为3.03%vol、4.69%vol、4.13%vol、4.92%vol;由表5可知,与组合1相比,组合4制备的米酒的乙酸乙酯含量降低,可能是异常威克汉姆酵母与酿酒酵母组合发酵的抑制关系导致[26];组合1、组合2、组合3、组合4制备的米酒总高级醇含量分别为72.14 mg/L、160.58 mg/L、106.25 mg/L、164.95 mg/L,与组合1相比,添加了酿酒酵母的组合4制备的米酒高级醇含量也明显升高,可能在组合发酵中酿酒酵母是产出高级醇的主要菌株,与孙中贯等[27]在酿酒酵母高级醇代谢研究中的实验结论相类似。乙酸具有刺激性酸味,在米酒中含量不宜过高,其中组合4制备的米酒乙酸含量最低,为97.17mg/L。
表5 混菌发酵米酒的挥发性风味物质分析结果
Table 5 Analysis results of volatile flavor compounds in rice wine fermented by mixed strains mg/L
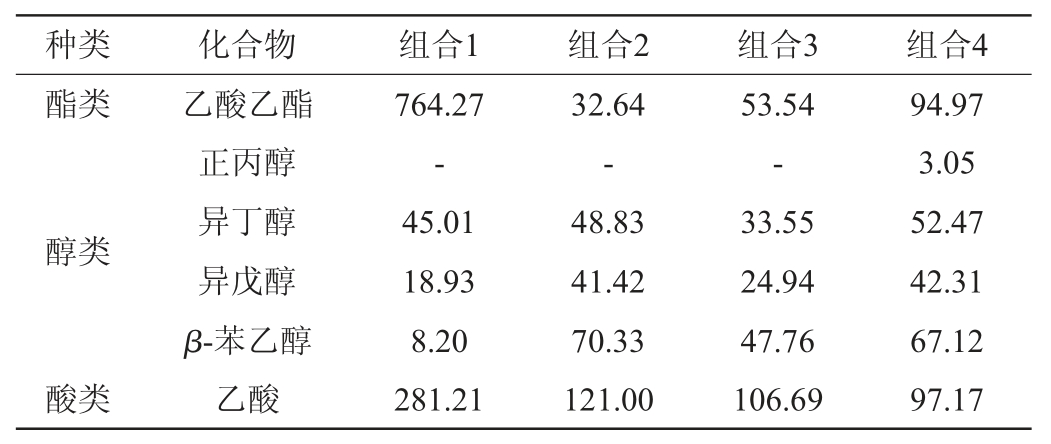
注:“-”表示未检测出。
综上,组合4制备的米酒酸甜度较为适中,具有果香等风味且不刺鼻,酒味浓郁,感官评分较高,因此选择组合4(W.anomalus LL-7、S.fibuligera 3-1、S.cerevisiae H1(1∶1∶1))进行后续实验。
2.2 米酒发酵工艺优化单因素试验
2.2.1 接种量的确定
酵母接种量对发酵米酒品质的影响见图1。由图1可知,随着接种量在2×106~6×106 CFU/mL范围内的不断增加,高级醇含量不断升高。当接种量在2×106~4×106CFU/mL范围内,感官评分逐渐增加;当接种量为4×106 CFU/mL,感官评分达到最高值,为90.5分;当接种量>4×106CFU/mL,感官评分逐渐下降。与MATEO J J等[28]报道的杂醇油含量伴随接种量提高不断升高的结论类似。因此,最适接种量为4×106 CFU/mL。
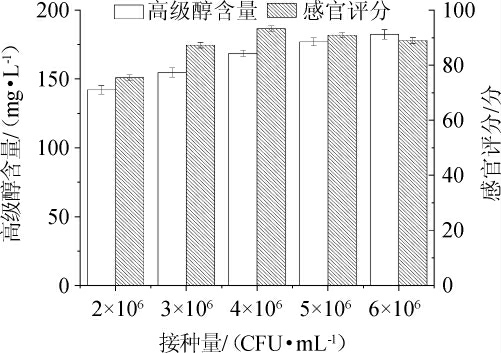
图1 酵母接种量对米酒品质的影响
Fig.1 Effect of yeast inoculum on the quality of rice wine
2.2.2 后发酵温度的确定
后发酵温度对发酵米酒品质的影响见图2。
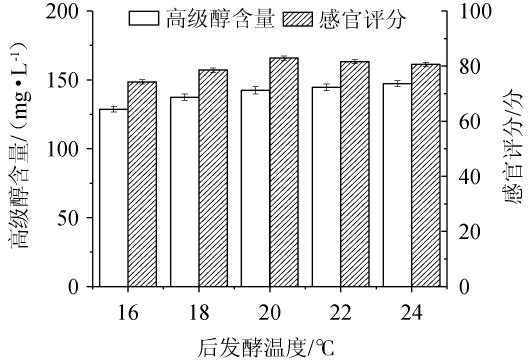
图2 后发酵温度对米酒品质的影响
Fig.2 Effect of post fermentation temperature on the quality of rice wine
由图2可知,随着后发酵温度在16~24 ℃范围内的上升,高级醇含量不断升高,但在温度为20~24 ℃范围内,高级醇含量上升较为缓慢,其原因可能是,较高温度导致相关酶活性降低[29]。当后发酵温度在16~20 ℃时,感官评分逐渐增加;当后发酵温度为20 ℃时,感官评分达到最高值,为83.1分;当后发酵温度高于20 ℃,感官评分逐渐下降。因此,最适后发酵温度为20 ℃。
2.2.3 后发酵时间的确定
后发酵时间对发酵米酒品质的影响见图3。由图3可知,随着后发酵时间在1~5 d范围内的增加,高级醇含量不断升高,其原因可能是,随着时间的延长,发酵更为充分,与张洋洋等[19]在实验中明确的米酒液态发酵中高级醇随时间变化的规律一致。随着后发酵时间在1~3 d范围内的增加,感官评分逐渐增加;当后发酵时间为3 d时,感官评分达到最大值,为83.1分;当后发酵时间>3 d,感官评分下降。因此,最适后发酵时间为3 d。
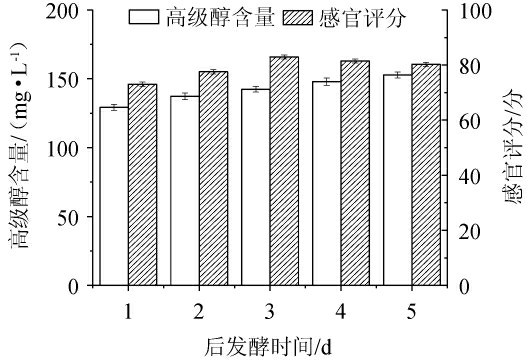
图3 后发酵时间对米酒品质的影响
Fig.3 Effect of post fermentation time on the quality of rice wine
2.3 米酒发酵工艺优化响应面试验结果
2.3.1 Box-Behnken试验结果与方差分析[31-32]
在单因素试验的基础上,以接种量(X1)、后发酵温度(X2)、后发酵时间(X3)为自变量,以高级醇含量(Y1)和感官评价(Y2)为响应值。采用Box-Behnken试验设计对米酒发酵工艺进行优化,Box-Behnken试验设计及结果见表6,方差分析结果见表7。
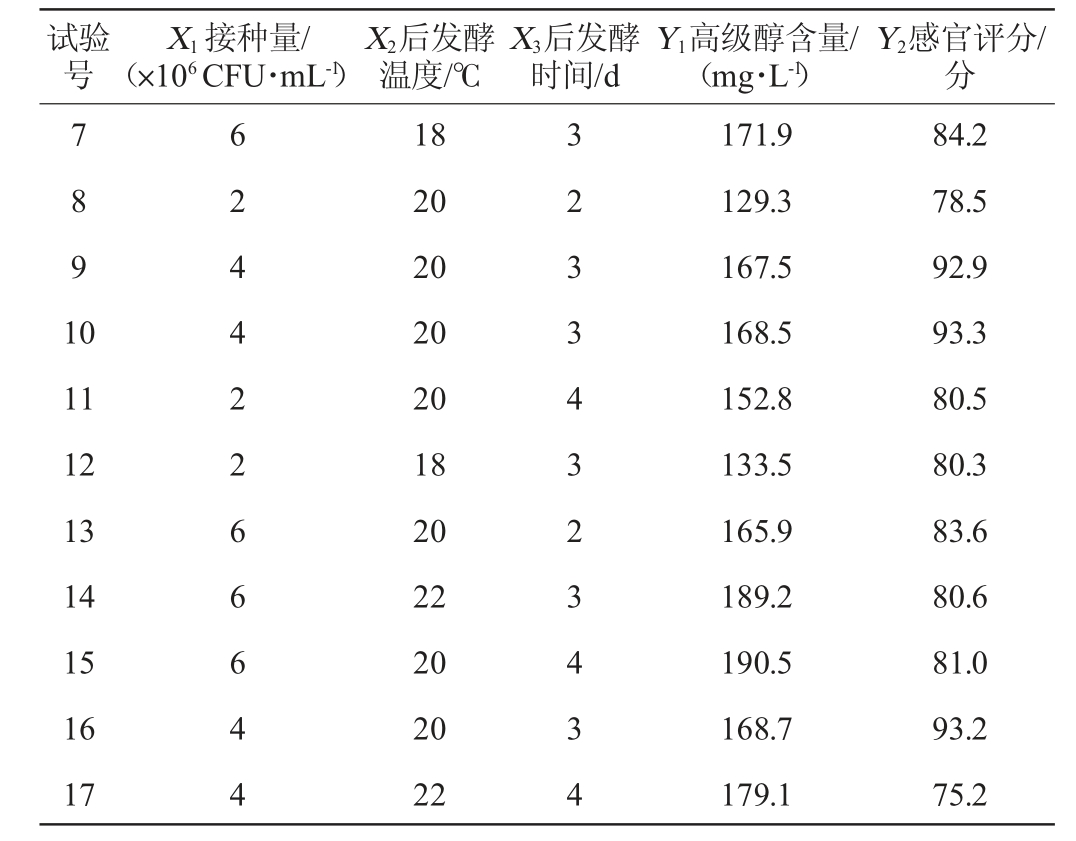
表6 米酒发酵工艺优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments for fermentation process optimization of rice wine
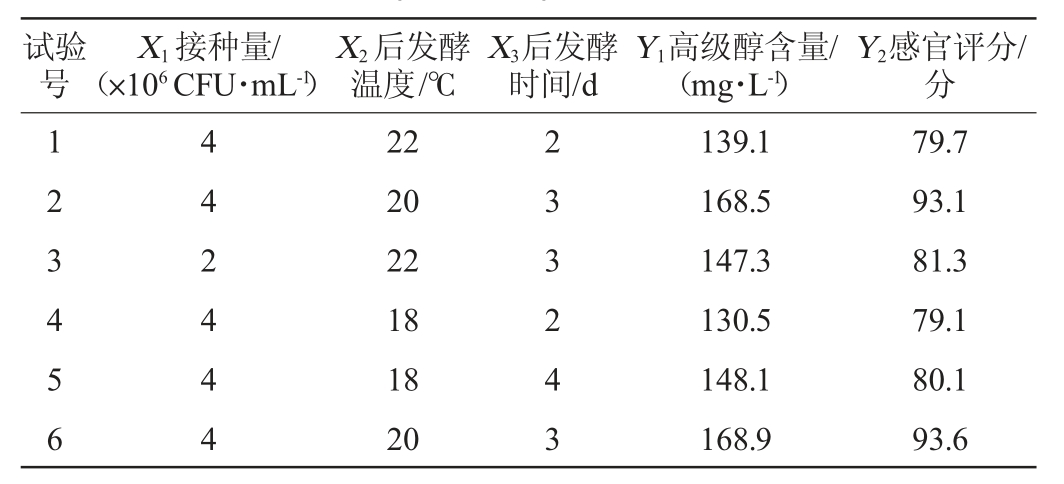
续表
运用Design Expert V8.0.6软件对表7中的结果进行拟合分析,分别得到高级醇含量(Y1)、感官评分(Y2)与接种量(X1)、后发酵温度(X2)、后发酵时间(X3)3个因素之间的二次回归方程:
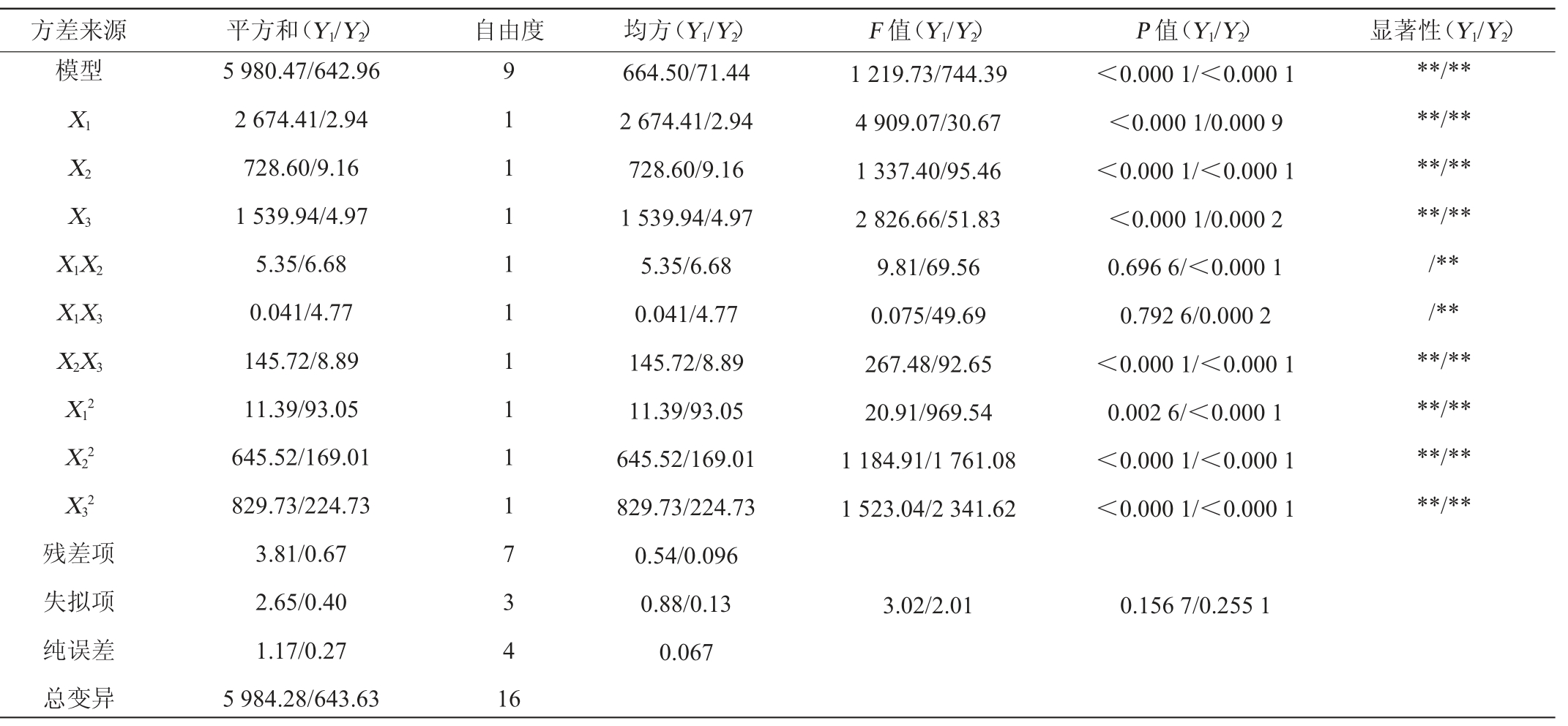
表7 回归模型方差分析
Table 7 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
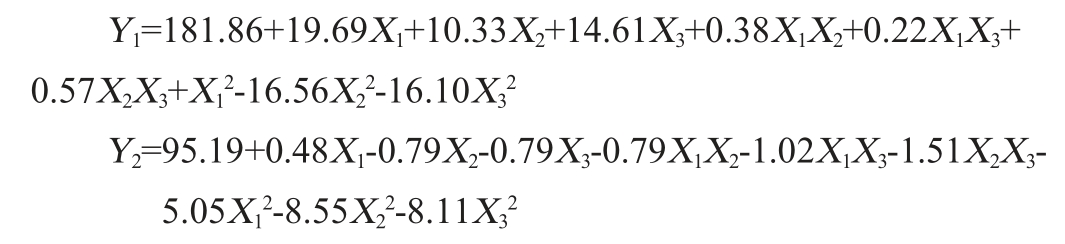
由表8可知,所建立的模型极显著(P<0.000 1),失拟项不显著(P>0.05),回归模型决定系数分别为R12=0.999 4、R22=0.999 0,调整决定系数R2Adj1=0.998 5、R2Adj2=0.997 6,说明高级醇和感官评分的变化分别有99.94%和99.90%来源于酵母接种量(X1)、后发酵温度(X2)、后发酵时间(X3)3个因素,回归模型与试验拟合度良好,具有较高的可靠性,受未知因素影响较少。由P值可知,一次项X1、X2、X3、交互项X2X3、二次项X12、X22、X32对高级醇含量影响极显著(P<0.01),其他项对高级醇含量影响不显著(P>0.05)。由F值可知,试验所选因素影响的强弱次序为:接种量(X1)>后发酵时间(X3)>后发酵温度(X2)。
由P值可知,一次项X1、X2、X3、交互项X1X2、X1X3、X2X3、二次项X12、X22、X32对感官评分影响均极显著(P<0.01)。由F值可知,三个因素对感官评价的影响主次关系是后发酵温度(X2)>后发酵时间(X3)>酵母接种量(X1)。
2.3.2 响应面交互作用分析
各因素交互作用对米酒高级醇含量和感官评分影响的响应面和等高线见图4。由图4A可知,后发酵温度(X2)与后发酵时间(X3)的等高线呈椭圆形,响应曲面较陡峭,说明两者交互作用对高级醇含量影响较大,达到极显著效果(P<0.01),而酵母接种量(X1)与后发酵时间(X3)、酵母接种量(X1)与后发酵温度(X2)的等高线近似为圆形,交互作用不显著(P>0.05)。由图4B可知,酵母接种量(X1)与后发酵时间(X3)、酵母接种量(X2)与后发酵时间(X3)、后发酵温度(X2)与后发酵时间(X3)的等高线均呈椭圆形,响应曲面较陡峭,说明两者交互作用对感官评分影响较大,交互作用显著(P<0.01)。这与方差分析结果一致。
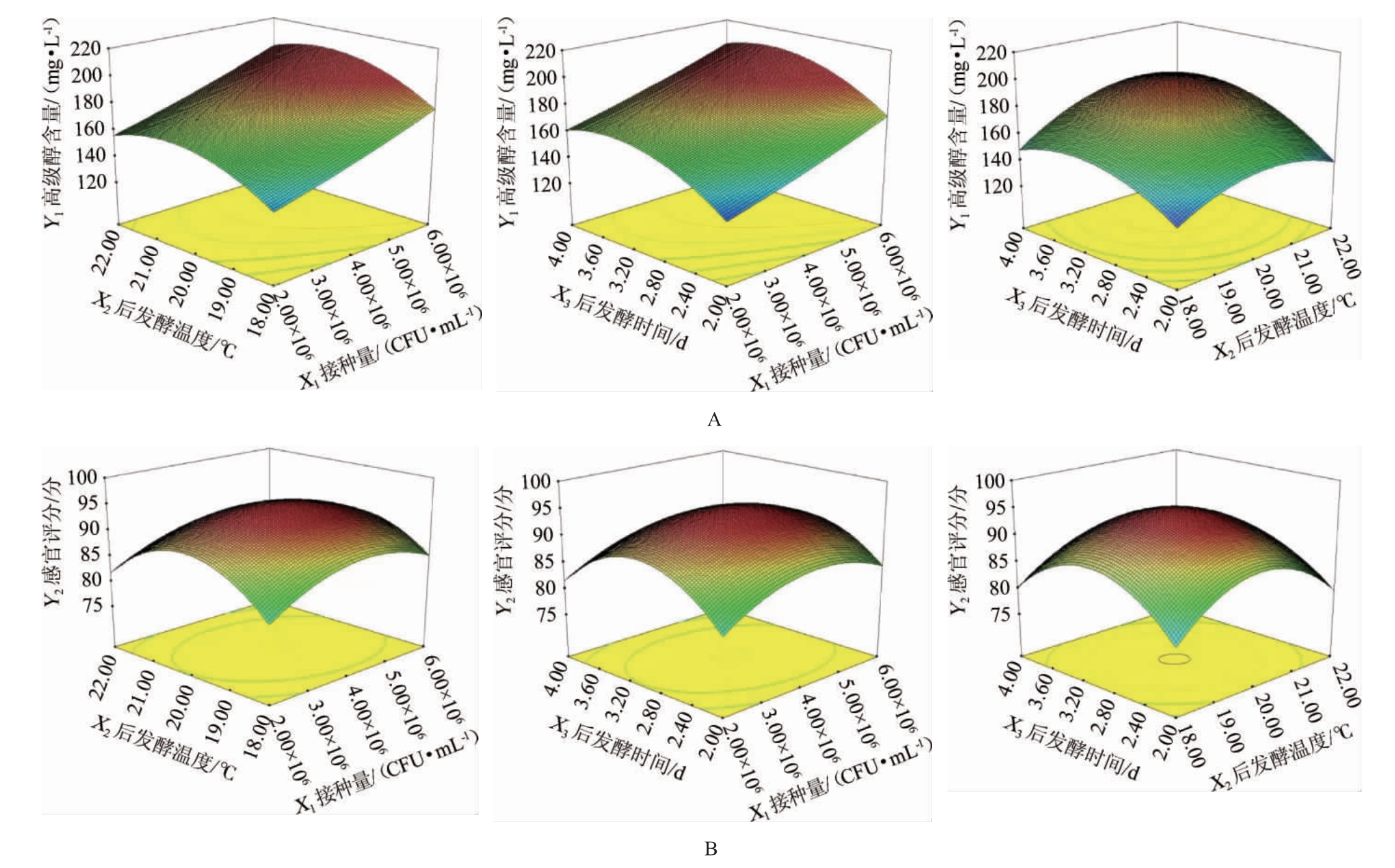
图4 各因素交互作用对高级醇含量(A)和感官评分(B)影响的响应曲面和等高线
Fig.4 Response surface plots and contour lines of interaction between various factors on higher alcohols contents (A) and sensory scores (B)
2.3.3 模型验证
利用Design Expert 8.0.6软件对所得回归方程进行回归,以高级醇含量偏低,感官评价得分偏高为目标,确定米酒发酵工艺最佳条件为:接种量3.06×106 CFU/mL、后发酵温度20.85 ℃、后发酵时间2.31 d,在此优化条件下,高级醇含量的预测值为149.465 mg/L,感官评分预测值为88.552分。考虑到实际操作的方便性,将发酵条件修正为:接种量3.0×106CFU/mL、后发酵温度21 ℃、后发酵时间2.5 d。在此优化条件下进行3次平行验证试验,测得高级醇含量实际值为153.1 mg/L,感官评分实际值为90.1分,与模型预测值较为一致,证实该模型可靠。
3 结论
该研究将3株酵母菌W.anomalus LL-7、S.fibuligera 3-1、S.cerevisiae H1混合(1∶1∶1)发酵制备米酒,通过单因素试验及响应面试验得到米酒最佳发酵工艺为:接种量3×106 CFU/mL、后发酵温度为21 ℃、后发酵时间为2.5 d。在此优化条件下,米酒高级醇含量为153.1 mg/L,感官得分为90.1分。高级醇含量降低了7.2%,感官品质有所提升。组合发酵酿造出的米酒口感更佳,酒体品质更高,对液态发酵工艺的优化有助于控制微生物的发酵环境,缩短发酵时间,提高米酒品质,实现效益最大化。
[1]GOU M,WANG H Z,YUAN H W,et al.Characterization of microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[2]WU H C,ZHANG S Y,MA Y Y,et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].J I Brewing,2017,123(1):113-120.
[3]臧威,谢广发,孙剑秋,等.绍兴黄酒酒药中酵母菌的物种资源[J].菌物学报,2015,34(6):1078-1084.
[4]陈佳楠,陈双,徐岩.不同酿酒酵母对黄酒挥发性香气物质的影响[J].工业微生物,2013,43(1):30-35.
[5]陈玉香,叶汶坤,何冬萍,等.酵母菌对红曲黄酒风味物质形成的影响[J].中国食品学报,2015,15(7):218-224.
[6]郭菁菁,朱志玉,陈通,等.酿酒酵母对黄酒品质及挥发性成分的影响[J].食品科技,2020,45(10):33-40.
[7]袁国亿,王春晓,何宇淋,等.酶标仪比色法检测浊米酒中高级醇含量[J].食品与发酵工业,2021,47(6):221-227.
[8]董洋,刘亚琼,刘姗姗.杂粮红曲酒高级醇及其挥发性风味物质研究[J].酿酒科技,2017(3):55-59.
[9]黄桂东,徐珊珊,刘惠,等.降黄酒高级醇无机氮源的筛选[J].食品与生物技术学报,2018,37(1):82-87.
[10]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-11.
[11]ZHONG X F,WANG A,ZHANG Y B,et al.Reducing higher alcohols by nitrogen compensation during fermentation of Chinese rice wine[J].Food Sci Biotechnol,2019,29(6):805-816.
[12]苟静瑜,贾智勇,闫宗科,等.降低白酒中高级醇含量的研究进展[J].酿酒,2016,43(4):25-29.
[13]王珍,周洋,李春丽,等.浅谈白酒中杂醇油的分析方法[J].酿酒科技,2017(6):77-79.
[14]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[15]王居伟,韩培杰,王雪薇,等.白酒发酵过程中常见酵母菌扣囊复膜酵母的研究进展[J].广西科学,2020,27(1):1-9.
[16]白梦洋,吴祖芳,李若云,等.果酒酵母菌多菌种混合培养的生长规律及挥发性风味物质的差异性分析[J].中国食品学报,2019,19(5):214-221.
[17]曾朝珍,张永茂,康三江,等.发酵酒中高级醇的研究进展[J].中国酿造,2015,34(5):11-15.
[18]陈玉香,张雯,蔡琪琪,等.发酵温度对异常维克汉姆酵母产挥发性风味物质的影响[J].中国食品学报,2016,16(9):122-128.
[19]张洋洋,张伟国,徐建中,等.米酒液态发酵过程中理化指标和风味物质变化规律[J].东北农业大学报,2020,51(12):79-89.
[20]张宸瑞,高瑞杰,缪礼鸿,等.高产酸扣囊复膜酵母的筛选与培养基配方优化[J].中国酿造,2021,40(7):153-159.
[21]国家市场监督管理总局,中国国家标准化管理委员会.GB/T 13662—2018黄酒[S].北京:中国标准出版社,2018.
[22]WANG Y,YUAN B,JI Y C,et al.Hydrolysis of hemicellulose to pro-duce fermentable monosaccharides by plasma acid[J].Carbohyd Polym,2013,97(2):518-522.
[23]陈明举,周迪,王鸿,等.基于GC-MS的浓香型白酒等级评判模型研究[J].中国酿造,2021,40(10):102-107.
[24]刘晓柱,黎华,李银凤,等.接种异常威克汉姆酵母对空心李果酒理化特性及香气组分的影响[J].食品科技,2020,45(11):21-27.
[25]王春晓,袁国亿,苏伟,等.白酒制曲环境和成品曲中产酸微生物分析[J].食品科学,2020,41(18):120-126.
[26]赵剑雷,邱树毅,王晓丹,等.异常威克汉姆酵母与酿酒酵母在混合发酵中的相互作用机制[J/OL].食品科学:1-12[2022-07-18].http://kns.cnki.net/kcms/detail/11.2206.ts.20211108.2009.008.html.
[27]孙中贯,刘琳,王亚平,等.酿酒酵母高级醇代谢研究进展[J].生物工程学报,2021,37(2):429-447.
[28]MATEO J J,JIMÉNEZ M,PASTOR A,et al.Yeast starter cultures affecting wine fermentation and volatiles[J]. Food Res Int,2001,34(4):307-314.
[29]袁华伟,张健,张雪婷,等.酿造米酒发酵条件的优化[J].中国酿造,2020,39(12):36-41.
[30]DERTLI E,TOKER O S,DURAK M Z,et al.Development of a fermented ice cream as influenced by in situ exopolysaccharide production:Rheological,molecular,microstructural and sensory characterization[J].Carbohydr Polym,2016,136:427-440.
[31]雷文平,吴诗敏,李彩虹,等.响应面法优化凝固型发酵椰奶工艺[J].中国酿造,2019,38(2):212-216.