天麻(Gastrodia elata Bl.)又名赤箭、独摇芝等[1],为兰科(Orchiidaceae)植物天麻的块茎部分,是重要的药食同源植物之一,与灵芝、杜仲并称为“贵州三宝”,含多种活性成分。2019年国家卫生健康委员会发布对天麻等9 种物质开展按照传统既是食品又是中药材的物质管理试点工作的通知[2],以其为原料的保健品和药膳的研究与开发逐渐受到关注,天麻酒作为天麻在食品领域的特色产品,具有较大的研究前景及开发价值。早期研究中天麻酒的提取周期过长,提取率不高。袁志鹰等[3]采用泡制的方法研究了天麻酒在不同泡制时间的药效成分溶出规律;于倩等[4]采用固态白酒浸泡的方式通过单因素,正交试验确定了提取天麻素的最佳条件并改善了天麻酒的口感。不少研究表明,渗漉法的动态提取的效率一般优于传统浸泡法[5]。以渗漉法制取天麻酒的工艺研究还有待科学的研究及探索,这将为天麻酒的生产开发提供新思路以及为今后的研究提供理论参考。
本研究以酱香型白酒、天麻为主要原料配以西洋参、枸杞子通过渗漉工艺制备天麻酒。采用天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1的功能成分溶出率之和为评价指标,探讨原料粒径、浸泡时间、料液比对天麻酒最佳渗漉工艺的影响,在单因素试验的基础上进行响应面试验,确定天麻酒的渗漉工艺,并采用小鼠模型分析天麻酒对小鼠肝组织的影响,探究渗漉工艺对天麻酒品质的影响以及其与普通酒对肝损伤的区别,为其在大健康产品开发方面提供理论基础和技术支撑。
1 材料与方法
1.1 材料与试剂
天麻:贵州毕节大方县;西洋参:吉林长白山;枸杞子:宁夏中宁;53%vol酱香型白酒基酒基:贵州省仁怀市茅台镇;天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1标准品(纯度>98.0%)、磷酸盐缓冲液(phosphate buffer solution,PBS)、Bradford蛋白检测试剂盒:索莱宝生物科技有限公司;甲醇、乙腈(均为色谱纯):美国TEDIA天地试剂公司;磷酸(分析纯):重庆川东化工集团有限公司;4%多聚甲醛溶液:北京雷根生物技术有限公司;白细胞介素-6(interleukin-6,IL-6)试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、前列腺素E2(prostaglandin E2,PGE2)试剂盒、白细胞介素-4(interleukin-4,IL-4)试剂盒:武汉华美生物工程有限公司;谷草转氨酶(aspartate aminotransferase,AST)试剂盒、谷丙转氨酶(alanine aminotransferase,ALT)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒:南京建成生物工程研究所。
雄性昆明(KM)小鼠50只,体质量(20±2)g,购于重庆腾鑫生物技术有限公司,动物生产许可证SCXK(京)2019-0008,饲养于温度(22±2)℃、相对湿度(55±5)%的清洁级动物房,控制照明时间为每天12 h,自由饮水和进食。
1.2 仪器与设备
渗漉筒:郑州科教玻璃仪器商城;Aniglent1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司;Phenomenex C18色谱柱:美国飞诺美科技有限公司;Scilogex MX-S漩涡混合器:美国Scilogex公司;有机系微孔滤膜(0.22 μm):北京兰杰柯科技有限公司;JA2003电子天平:上海菁海仪器有限公司;Millpore TM-D24UVB纯水超纯水一体机:美国Millipore公司;Eppendorf F5427R台式高速冷冻离心机:德国Eppendorf公司;-80 ℃900 Series超低温冰箱、Varioskan LUX酶标仪:美国Thermo Fisher Scientific公司;IMS-50雪花制冰机:山东博科生物产业有限公司。
1.3 方法
1.3.1 天麻酒的渗漉工艺流程及操作要点
原料预处理→称取原料→倒入渗漉装置→加酒基浸泡→收集渗漉液→定量→天麻酒
操作要点:
原料预处理:用纯净水将53%vol酒基稀释成37%vol酒基;精选表面干净、块头较大的天麻、西洋参、枸杞干果,切片、粉碎、过筛,备用。
称取原料:将过筛后的天麻、西洋参、枸杞按50∶3∶15质量比混匀,精密称取混合好的原料3.4 g。
酒基的浸泡:加入干物料9倍质量的37%vol酒基室温(25±2)℃浸泡6 h。
定量:收集渗漉液后,加入37%vol酒基定容至50 mL,得到天麻酒成品。
1.3.2 天麻酒渗漉工艺优化
(1)单因素试验
以天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1的溶出率之和为评价指标,分别探讨原料粒径(10目、24目、50目、65目、80目)、浸泡时间(2 h、4 h、6 h、8 h、10 h)、料液比(1∶3、1∶5、1∶7、1∶9、1∶11(g∶mL))对功能成分溶出率的影响。
(2)响应面试验
在单因素试验基础上,采用响应面试验设计,以粒径(A)、浸泡时间(B)、料液比(C)为自变量,天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1的功能成分溶出率之和(Y)为响应值,应用Design-Expert 8.0.6软件设计3因素3水平的响应面试验以确定最优的渗漉方法,Box-Behnken试验因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

1.3.3 功能成分含量的检测
采用高效液相色谱法测定天麻酒中天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1的含量,测定方法参考2020版中国药典[5]略作修改。
样品处理:将天麻酒过0.22 μm一次性针头式过滤器于样品瓶中,滤液待测。
高效液相色谱条件:Phenomenex C18色谱柱(4.6 mm×250 mm,5 μm),检测波长为203 nm;柱温40 ℃;流动相:0.05%磷酸水溶液(A)-乙腈(B);洗脱条件:0~16 min,98%A;16~25 min,98%~75%A;25~40 min,75%~65%A;流速:0.6 mL/min。
天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1四种功能成分溶出率计算公式如下:
1.3.4 天麻酒对小鼠肝组织的影响
(1)天麻酒低、中、高剂量的制备与小鼠分组
根据《中国居民膳食指南2016》中国成年男性每日推荐量不超过25 g纯酒精(相当于37%vol白酒85 mL),成年女性每日饮酒不超过15 g(相当于37%vol白酒50 mL),选择成人每日推荐量60 mL/(70 kg体质量·d),根据人鼠剂量换算,确定天麻酒的灌胃剂量为10 mL/kg。用同种37%vol酒基按最佳工艺制成的天麻酒作为中剂量,同等工艺减半药材量配制为低剂量,两倍的药材量配制作为高剂量。取50只KM小鼠,随机分为空白组,模型组(37%vol相同酒基),天麻酒低、中、高剂量组。所有小鼠按10 mL/kg进行灌胃,其中空白组灌胃生理盐水,模型组灌胃等量天麻酒的酒基,低、中、高剂量组灌胃天麻酒,每天1次,连续灌胃21 d。
(2)肝组织中生化指标的检测[7]
于末次灌胃结束后,小鼠禁食24 h,处死小鼠并摘取肝脏。准确称量0.1 g肝组织剪碎后加入0.9 mL的PBS,置于冰上研磨制备肝匀浆,在5 000 r/min下离心10 min,取上清液参照试剂盒要求测定小鼠肝组织中的ALT、AST、SOD活力、MDA、IL-4、IL-6、TNF-α、PGE2含量。
1.3.5 数据处理
采用Graphpad Prism 8.01绘图,Design-Expert 8.0.6软件进行响应面试验设计,数据分析采用SPSS 21.0软件进行分析,结果以“平均数±标准差”(xˉ±s)表示,组间均数比较采用单因素方差分析,P<0.05表示具有显著性差异,P<0.01表示具有极显著差异。
2 结果与分析
2.1 原料粒径对天麻酒中功能成分溶出率的影响
粒径对于渗漉是一个重要的影响因素[8]。原料粒径对天麻酒中功能成分溶出率之和的影响结果见图1。由图1可知,粒径在10~50目范围内,随着粒径目数的增大,四种功能成分的溶出率之和呈逐步上升趋势;当粒径目数到达50目时,四种功能成分的溶出率之和为3.519 mg/g;当粒径目数>50目之后,药材的粒径对功效成分的溶出率变化影响不再显著。由于药材颗粒过大,会导致溶剂消耗量过大,且溶出不充分。但当粒径过细时,会使药材粉末易结块,从而增加传质阻力使传质速率降低,不利于有效成分的溶出[9],由于药渣吸附酒也可能导致溶出率减小,且易造成渗漉过程中堵塞,增加试验的操作难度。因此,选择原料粒径为40目、50目、60目进行后续试验。
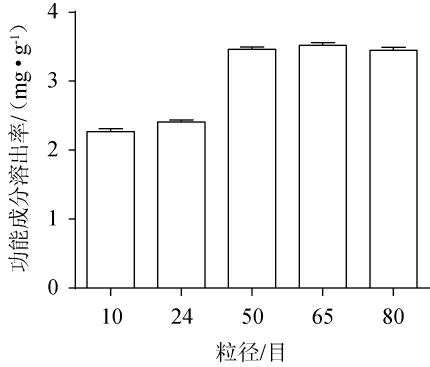
图1 原料粒径对功能成分溶出率的影响
Fig.1 Effect of raw material particle size on the dissolution rates of functional components
2.2 浸泡时间对天麻酒中功能成分溶出率的影响
渗漉法在渗漉前浸泡一定时间,更有利于各成分的溶质交换[10]。一般情况下浸渍时间较长时,活性成分浸出较多,但浸渍时间足够长时,药材中活性成分含量与溶液中含量会达到动态平衡,继续浸渍意义不大。随着时间延长,天麻素等物质可能由于分解或其他原因含量略微下降[3]。浸泡时间对天麻酒中功能成分溶出率之和的影响结果见图2。由图2可知,当渗漉前浸泡时间为2~6 h时,四种功能成分的溶出率之和呈逐步上升趋势,更有利于渗漉效率;当浸泡时间为6 h时,四种功能成分的溶出率之和最高,为3.474mg/g;当浸泡时间>6h之后,功效成分的溶出率之和变化不再显著。因此,选择浸泡时间5 h、6 h、7 h进行后续试验。
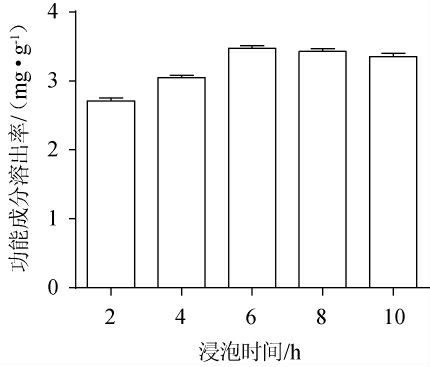
图2 浸泡时间对功能成分溶出率的影响
Fig.2 Effect of soaking time on the dissolution rates of functional components
2.3 料液比对功能成分溶出率之和的影响
料液比对天麻酒中功能成分溶出率之和的影响结果见图3。由图3可知,当料液比为1∶3~1∶9(g∶mL)时,四种成分溶出率之和随之呈升高趋势;当料液比为1∶9(g∶mL)时,四种功能成分的溶出率之和最高,为3.547 mg/g;当料液比为1∶9~1∶11(g∶mL)时,各物质溶出率之和随渗漉液增加变化不显著,可能是由于高料液比时所测成分充分溶解,但其他类杂质溶解增多,使得相对溶出率下降[11]。当料液比较小时,部分物质可能在渗漉过程中很快达到饱和状态,不能全部溶出,从而导致溶出率较低[12]。因此,选择料液比1∶7、1∶9、1∶11(g∶mL)进行后续试验。
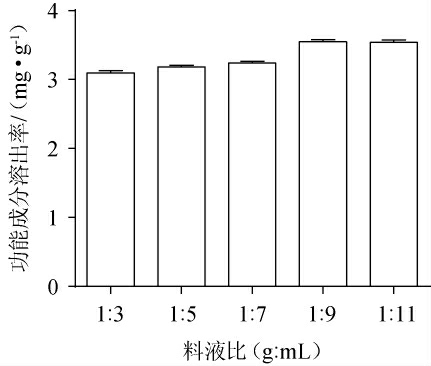
图3 料液比对功能成分溶出率的影响
Fig.3 Effect of solid-liquid ratio on the dissolution rates of functional components
2.4 响应面试验结果分析
2.4.1 回归模型的建立及方差分析
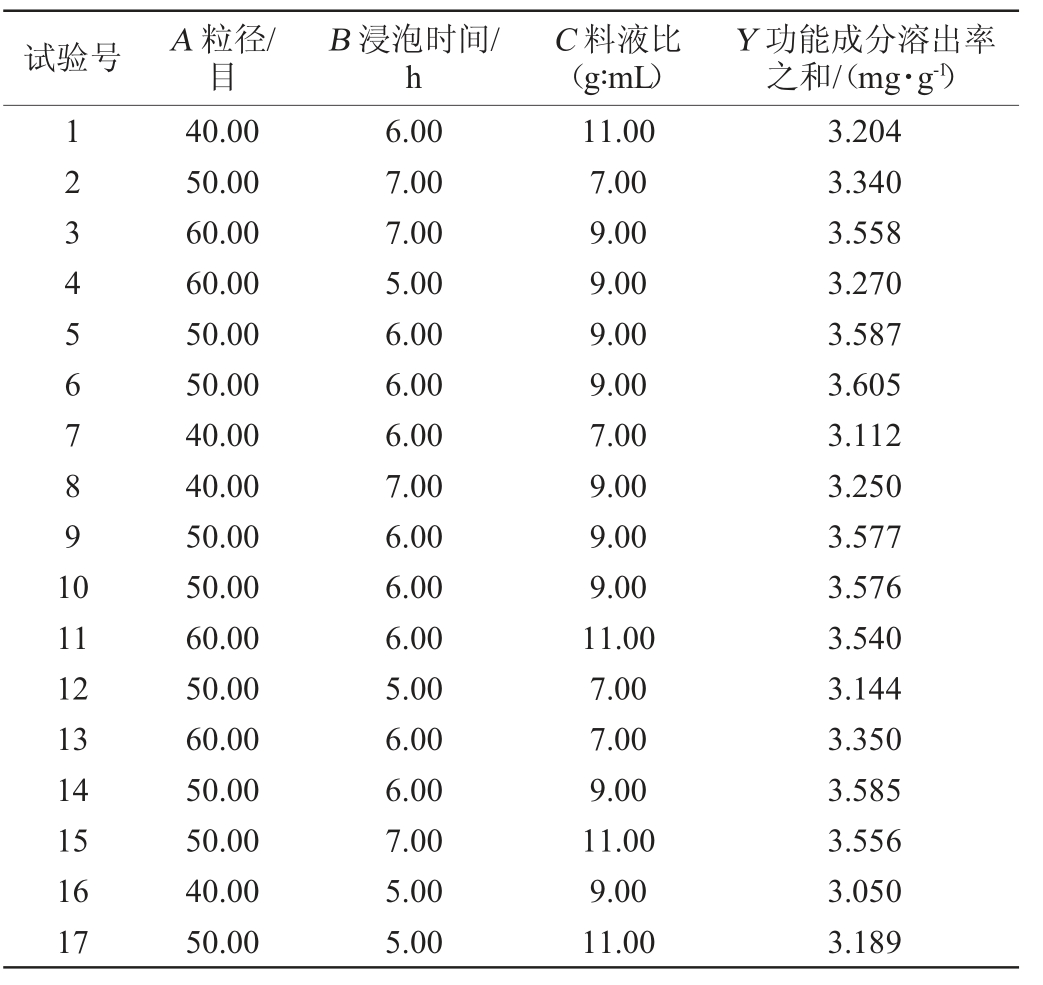
在单因素试验基础上,采用响应面试验设计,以粒径(A)、渗漉前浸泡时间(B)、料液比(C)为自变量,天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1的功能成分溶出率之和(Y)为响应值进行响应面试验,Box-Behnken试验设计及结果见表2。采用Design Expert 8.0.6软件对表2中试验结果进行多项回归拟合,得到天麻素、对羟基苯甲醇、人参皂苷Re、人参皂苷Rb1的溶出率之和(Y)对粒径(A)、浸泡时间(B)、料液比(C)的二次多项回归模型方程如下:
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
为检验回归方程有效性并确定各因素对功能成分溶出率之和的影响程度,对回归模型进行方差分析,结果见表3。由表3可知,所建立方程模型极显著(P<0.01),失拟项不显著(P>0.05),表明该模型方程与实际拟合度较好[13]。决定系数R2=0.987 8,调整决定系数R2Adj=0.972 1。根据P值可知,一次项A、B、C对功能成分溶出率之和存在显著影响(P<0.05);二次项A2、B2、C2均对功能成分溶出率之和的曲面效应影响极显著(P<0.01)。根据F值可知,各因素的影响顺序为粒径(A)>浸泡时间(B)>料液比(C)。
表3 回归方程系数显著性检验和方差分析
Table 3 Significance test and variance analysis of regression equation coefficient
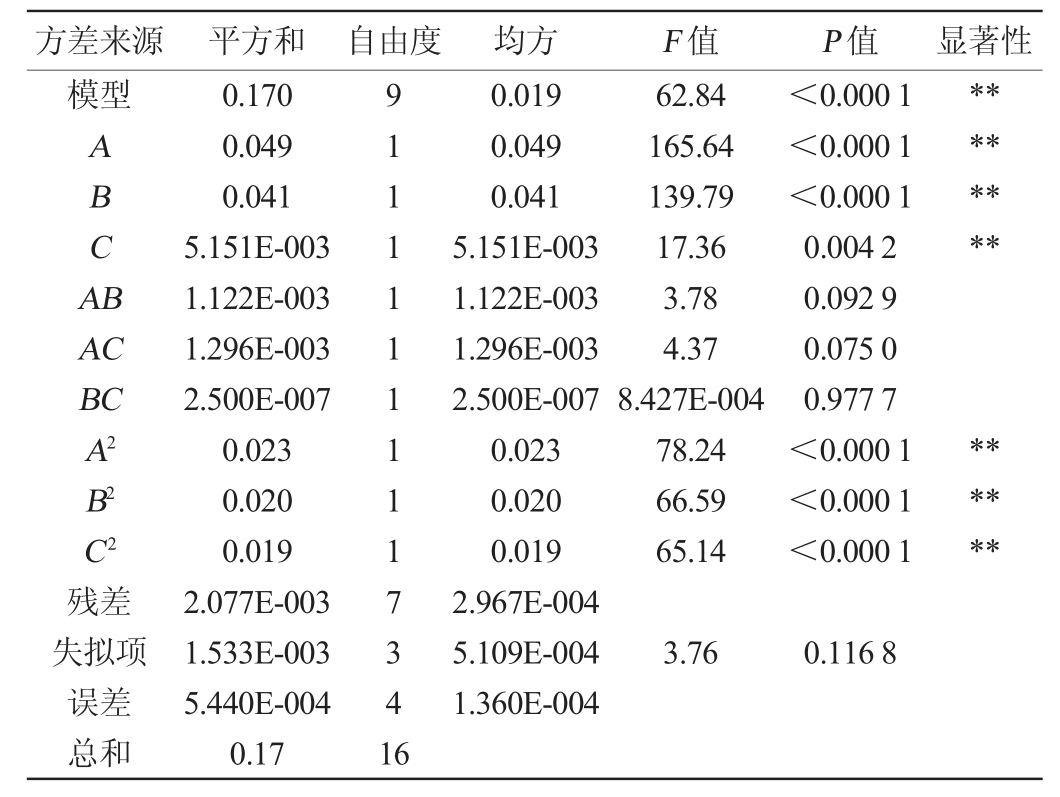
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
2.4.2 影响因子交互作用分析及验证试验
影响因子交互作用响应面图中,曲面越陡峭,则该因素对响应值的影响越显著,曲面越平,则该因素对响应值的影响越小[14-15]。由图4可知,浸泡时间和原料粒径、浸泡时间和料液比、原料粒径和料液比间的交互作用均不显著,试验结果与方差分析结果一致。
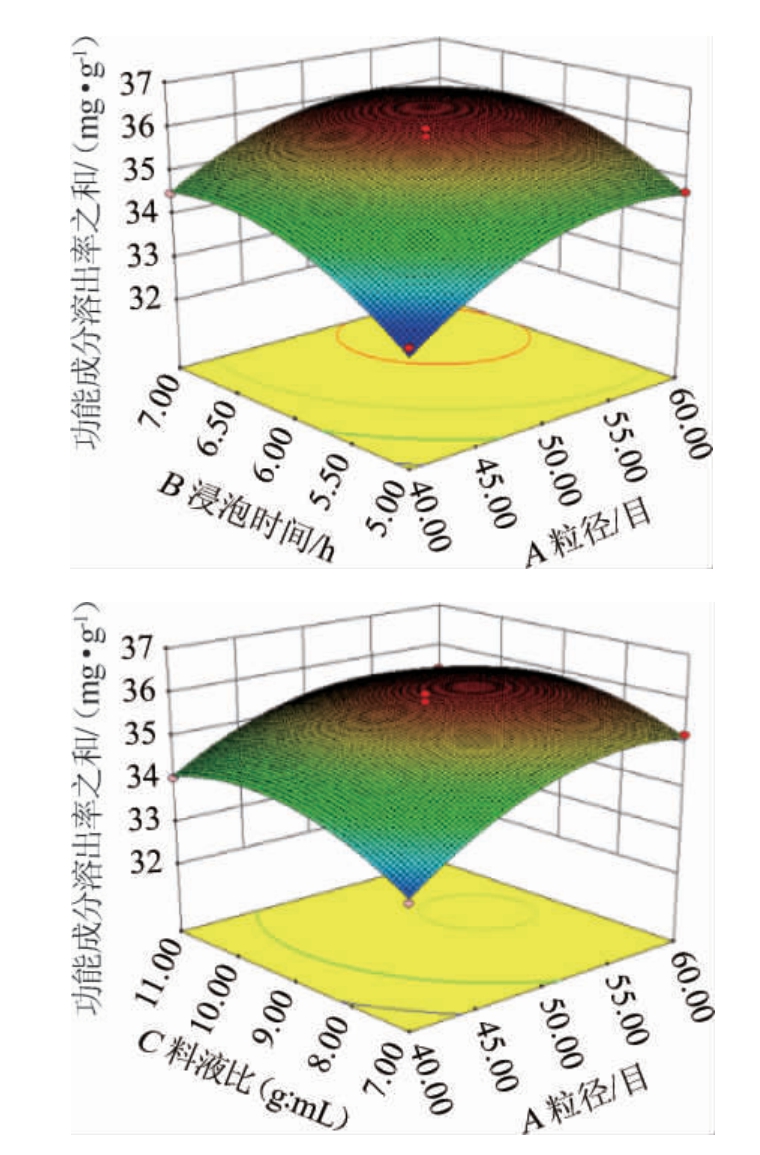
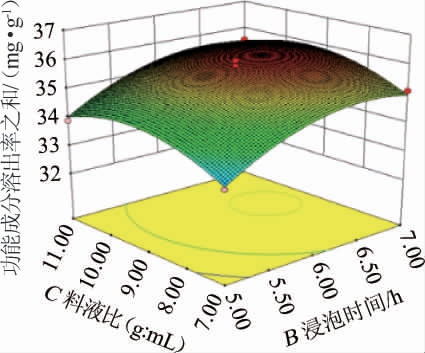
图4 各因素间交互作用对功能成分溶出率影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between various factors on dissolution rates of functional components
通过软件Design-Expert8.0.6分析得到天麻酒最佳渗漉条件:原料粒径51.33目,浸泡时间6.13h,料液比1∶9.27(g∶mL),在此条件下,功能成分溶出率之和理论值为3.615 mg/g。考虑到实际操作的简便,将渗漉条件调整为:粒径50目,料液比1∶9(g∶mL),浸泡时间6 h。在此优化条件下,经3次平行试验验证,功能成分溶出率之和实际值为(3.592±0.011)mg/g,结果与理论值相差不大,由此表明该试验模型可靠。
2.5 天麻酒对小鼠肝组织的影响
2.5.1 天麻酒对小鼠肝组织转氨酶水平的影响
谷丙转氨酶(ALT)和谷草转氨酶(AST)主要存在于肝细胞浆和线粒体内,是催化氨基酸和酮酸之间氨基转移的酶[16],当肝细胞受到损伤时,酶的活性会升高。常用ALT和AST的水平评价肝功能的损伤程度[17]。如表4所示,与空白组相比,模型组小鼠肝组织中ALT和AST水平显著升高(P<0.05),说明在酒精的长期刺激作用下,ALT、AST分泌持续增多,肝细胞受损程度大于自我修复能力,形成肝损伤。天麻酒各剂量组与模型组相比肝组织中ALT和AST水平都显著低于模型组(P<0.05),与饮用等量酒基相比,天麻酒能有效抑制转氨酶水平,使其趋于正常,说明天麻酒中的活性成分减轻了酒精对肝脏的损伤作用。
表4 天麻酒对小鼠肝组织谷丙转氨酶及谷草转氨酶水平的影响
Table 4 Effects of Gastrodia elata wine on alanine aminotransferase and aspartate aminotransferase levels in mice liver tissue
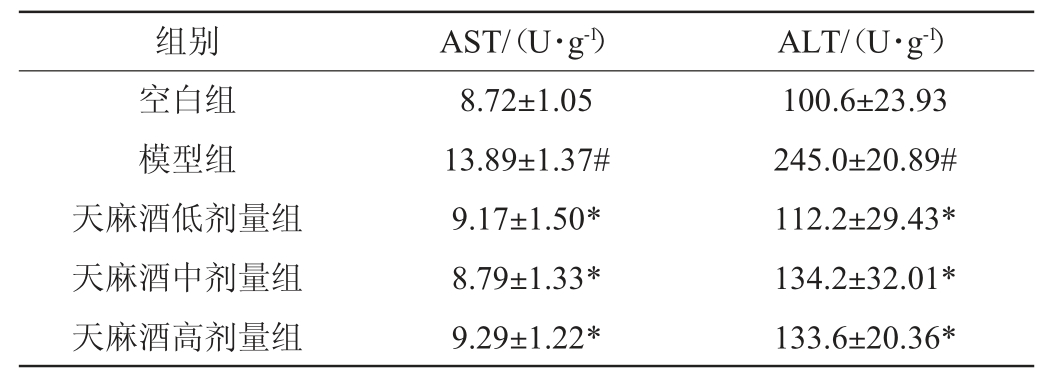
注:与空白组比,“#”表示对结果差异显著(P<0.05);与模型组比,“*”表示对结果差异显著(P<0.05)。下同。
2.5.2 天麻酒对小鼠肝组织抗氧化酶活性影响
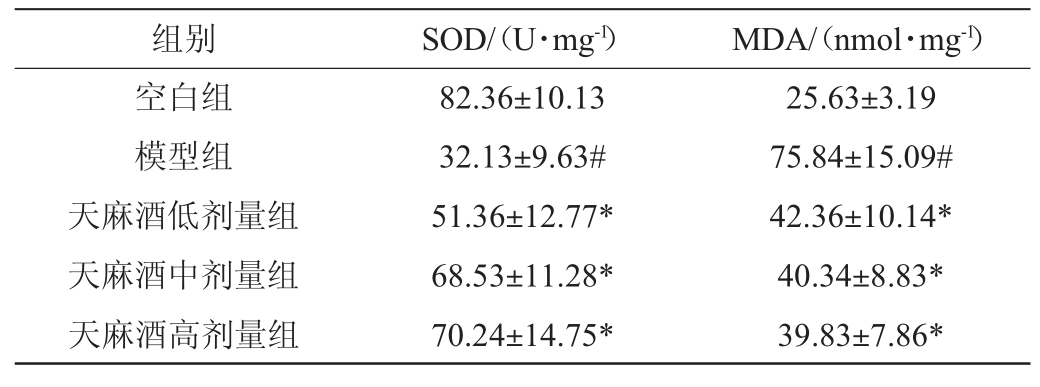
长期饮酒会促进自由基如活性氧簇(reactive oxygen species,ROS)的生成积累,打破肝组织抗氧化体系的平衡,引起氧化应激[18]。过量的ROS诱导产生脂质过氧化产物MDA,同时消耗SOD清除自由基来维持内环境稳态[19]。因此SOD、MDA的活性可反映自由基对肝脏的损伤程度[20]。
如表5所示,与空白组相比,饮酒后各组小鼠肝组织中SOD活性下降,MDA活性升高,其中模型组差异性显著(P<0.05),说明长期饮酒导致肝脏脂质过氧化加重,抗氧化水平减弱[21],提示酒精性肝损伤模型建立成功。天麻酒各剂量组与模型组相比,小鼠肝组织中SOD活性显著升高,MDA活性显著降低(P<0.05)。说明饮酒会导致机体发生脂质过氧化,而天麻酒中的活性成分可能通过减轻小鼠体内的氧化应激程度,缓解由于酒精摄入导致的肝损伤。
表5 天麻酒对小鼠肝组织超氧化物歧化酶及丙二醛水平的影响
Table 5 Effects of Gastrodia elata wine on superoxide dismutase and malondialdehyde levels in mice liver tissue
2.5.3 天麻酒对小鼠肝组织中炎症因子的影响
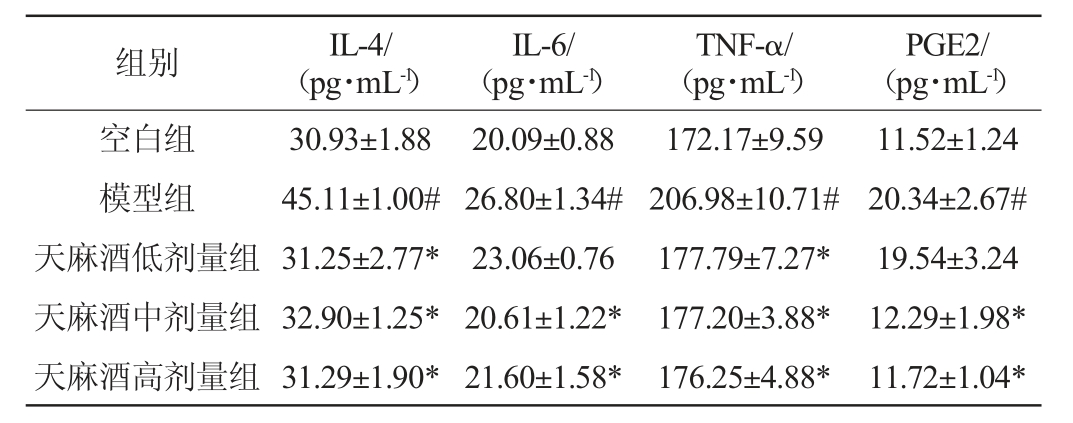
酒精及其代谢产物乙醛可诱导促炎细胞因子的释放,从而加重肝脏炎症和肝细胞凋亡[22]。肿瘤坏死因子-α(TNF-α)会促进中性粒细胞、单核细胞迁移并激活,加速活性氧自由基的生成,导致肝脏的进一步损害[23];白细胞介素-6(IL-6)在导致炎症反应的组织损伤过程中可直接诱导免疫细胞分化,损伤细胞[24];白细胞介素-4(IL-4)可促进免疫应答,与伤口修复和肝脏再生有关[25];前列腺素E2(PGE2)是一种重要的致炎因子,可以使血管通透性增加,使炎性细胞更易浸润。
如表6所示,模型组小鼠肝组织中IL-4、IL-6、TNF-α、PGE2水平显著高于空白组(P<0.05),说明酒精摄入导致肝细胞释放大量促炎因子,模型建立成功[26]。天麻酒中、高剂量组与模型组相比,IL-4、IL-6、TNF-α、PGE2水平显著低于模型组(P<0.05)。说明天麻酒中的活性成分可能通过抑制促炎细胞因子、缓解炎症反应对小鼠肝组织起保护作用。
表6 天麻酒对小鼠肝组织白细胞介素-4、白细胞介素-6、肿瘤坏死因子-α及前列腺素E2水平的影响
Table 6 Effects of Gastrodia elata wine on interleukin-4、interleukin-6、tumor necrosis factor-α and prostaglandin E2 levels in mice liver tissue
3 结论
通过单因素和响应面试验分析结合验证试验得到制备天麻酒的最佳工艺条件为:原料粒径50目、料液比1∶9(g∶mL)、浸泡时间6 h。在此优化条件下,4种功能成分溶出率之和为3.592 mg/g。该工艺制备方法操作简单,所研制的天麻酒色泽澄清透亮、活性成分丰富,具有较好的推广价值。天麻酒能有效降低小鼠肝组织的AST、ALT生化指标,肝细胞炎症因子(TNF-α、IL-6、IL-4、PGE2)水平以及提高抗氧化酶SOD,降低MDA水平,说明天麻酒具有减缓因酒精摄入导致的肝损伤作用。这为贵州天麻资源利用及特色食品产业的发展提供新思路。
[1]ZHAN H D,ZHOU H Y,SUI Y P,et al.The rhizome of Gastrodia elata Blume-An ethnopharmacological review[J]. J Ethnopharmacol,2016,189:361-385.
[2]单锋,周良云,蒋长顺,等.天麻的食用历史及发展建议[J].中国食品药品监管,2021(3):110-115.
[3]袁志鹰,李亚林,张朋,等.不同泡制时间天麻酒药效成分动态溶出规律研究[J].时珍国医国药,2020,31(3):609-611.
[4]于倩,张艺,苏瑶,等.天麻提取酒液与天麻渣液态发酵酒的调配酒初探[J].食品科技,2020,45(3):100-104.
[5]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2020:186-187.
[6]孙景莉,吕金课.天麻药酒渗漉法与冷浸法工艺比较[J].中医研究,2000(6):15-17.
[7]XU J J,LI H D,WU M F,et al.3-B-RUT,a derivative of RUT,protected against alcohol-induced liver injury by attenuating inflammation and oxidative stress[J].Int Immunopharmacol,2021,95(4):107471.
[8]王婉莹,瞿海斌,龚行楚.中药渗漉提取工艺研究进展[J].中国中药杂志,2020,45(5):1039-1046.
[9]柴美灵,李娜,乔宏萍,等.Box-Behnken法优化甘草多糖提取工艺及其体外抗氧化活性分析[J].食品工业科技,2021,42(23):192-200.
[10]李薪宇,牛曼思,杨阳,等.正交试验法优选复方金钗石斛保健酒渗漉工艺[J].中国酿造,2019,38(9):182-184.
[11]于倩,张艺,苏瑶,等.天麻提取酒液与天麻渣液态发酵酒的调配酒初探[J].食品科技,2020,45(3):100-104.
[12]CHRISTOU A,STAVROU I,KAPNISSI C.Continuous and pulsed ul-trasound-assisted extraction of carob's antioxidants:Processing parameters optimization and identification of polyphenolic composition[J].Ultrason Sonochem,2021,76:105630.
[13]YIRGU Z,LETA S,HUSSEN A,et al.Optimization of microwave-assisted carbohydrate extraction from indigenous Scenedesmus sp.grown in brewery effluent using response surface methodology[J].Heliyon,2021,7(5):e07115.
[14]CHEN L,ALCAZAR J,YANG T,et al.Optimized cultural conditions of functional yogurt for γ-aminobutyric acid augmentation using response surface methodology[J].J Dairy Sci,2018,101(12):10685-10693.
[15]SHEN J J,ZHU A S,GAO T T,et al.Optimization of extraction technology of sterols from discarded soybean pod by response surface methodology[J].Environ Challenges,2021,5:100272.
[16]XU L,YU Y F,SANG R,et al.Protective effects of taraxasterol against ethanol-induced liver injury by regulating CYP2E1/Nrf2/HO-1 and NF-κB signaling pathways in mice[J].Oxid Med Cell Longev,2018,2018:1-11.
[17]GUO Y H,ZHAO Q S,CAO L L,et al.Hepatoprotective effect of Gan Kang Yuan against chronic liver injury induced by alcohol[J].J Ethnopharmacol,2017,208:1-7.
[18]YANG C R,LIAO A M,CUI Y X,et al.Wheat embryo globulin protects against acute alcohol-induced liver injury in mice[J].Food Chem Toxicol,2021,153:112240.
[19]XU W,CHEN S H,ZHONG G S,et al.Effects of a combination of Japanese Raisin Tree Seed and Flower of Lobed Kudzuvine against acute alcohol-induced liver injury in mice[J].J Tradit Chin Med Sci,2020,7(1):59-67.
[20]GLADE M J,MEGUID M M.A glance at ethanol consumption,GSH suppression,and oxidative liver damage[J]. Nutrition,2017,33:199-203.
[21]SANG L X,KANG K,SUN Y,et al.FOXO4 ameliorates alcohol-induced chronic liver injury via inhibiting NF-κB and modulating gut microbiota in C57BL/6J mice[J].Int Immunopharmacol,2021,96(1):107572.
[22]FAN H,TU T T,ZHANG X,et al.Sinomenine attenuates alcohol-induced acute liver injury via inhibiting oxidative stress,inflammation and apoptosis in mice[J].Food Chem Toxicol,2021,159:112759.
[23]HAN X,LIU J,BAI Y F,et al.An iridoid glycoside from Cornus officinalis balances intestinal microbiome disorder and alleviates alcohol-induced liver injury[J].J Funct Foods,2021,82:104488.
[24]SILVA B S D,RODRIGUES G B,ROCHA S W S,et al.Inhibition of NF-κB activation by diethylcarbamazine prevents alcohol-induced liver injury in C57BL/6 mice[J].Tissue Cell,2014,46(5):363-371.
[25]GOH Y P S,HENDERSON N C,HEREDIA J E,et al.Eosinophils secrete IL-4 to facilitate liver regeneration[J].Proc Natl Acad Sci USA,2013,110(24):9914-9919.
[26]REN J,LI S J,SONG C L,et al.Black soybean-derived peptides exerted protective effect against alcohol-induced liver injury in mice[J].J Funct Foods,2021,87:104828.