丁香假单胞菌(Pseudomonas syringae)是一种革兰氏阴性、好氧的半活体营养菌[1],因首次是从丁香树中分离得到而被命名为丁香假单胞菌[2]。该菌根据宿主特异性、侵染症状和生理生化特点划分为50多个病原菌[3],寄生生长于180多种不同宿主体内。此菌可以引起核桃叶片呈斑点状坏死[4]、中华芒草[5]和金菊[6]的细菌性枯萎病、黄瓜角斑病[7]、葡萄花序和浆果腐烂[8]、猕猴桃[9]和樱桃[10]细菌性溃疡病,同时也能感染桑葚、杏、李、番茄、大豆、拟南芥等植物致病[11]。丁香假单胞菌可以通过植物组织碎片进行传播,能够附着在植物叶片表面生长,也能借植物气孔和下裂孔的自然开口或机械伤口进入植物内部[12]。因此,丁香假单胞菌是一种重要的植物致病菌,已被当做了解植物疾病的模式生物[13]。
因生长环境特殊,海洋微生物具有独特的生存策略,它们所产生的罕见代谢产物可能成为它们的生存优势,目前对海洋微生物资源的探索和次级代谢产物的研究已经成为热点之一[14]。如罗曼等[15]从南极沉积物样品中分离纯化出一株枯草芽孢杆菌斯氏亚种(Bacillus subtilis subsp.spizizenii),对植物致病菌如层生镰刀菌(Fusarium proliferatum)有较强抑制效果。深海来源的芽孢杆菌属物种因能产生大量酶和抗生素等,而被许多学者看作是优质益生菌[16]。ZHOU Y等[17]从南大西洋的深海沉积物中分离筛选得到一株能抑制曲霉突变株菌丝生长的环状芽孢杆菌(Bacillus circulans),且该菌对黄曲霉毒素前体的积累有阻碍作用。LI W等[18]研究发现,太平洋来源的深海微生物B5,可以产生抗茶拟盘多毛孢(Pseudopestalotiopsis theae)和茶炭疽病菌的活性物质。
本研究以生物抗菌活性为导向,从印度洋沉积物样品中分离纯化并筛选出能够抑制丁香假单胞菌生长的菌株,采用形态观察、生理生化实验及16S rDNA基因序列分析对其进行菌种鉴定,并对其抑菌广谱性进行研究,为后期从中探索得到高效力抗菌活性物研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品为自然资源部第三海洋研究所提供的西南印度洋沉积物(水深1 783 m)。
1.1.2 菌株
丁香假单胞菌(Pseudomonas syringae)BNCC 134219、大肠杆菌(Escherichia coli)CMCC 44102、金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538、副溶血弧菌(Vibrio parahaemolyticu)CGMCC 1.1616、铜绿假单胞菌(Pseudomonas aeruginosa)PAO1、鼠伤寒沙门氏菌(Salmonella typhimurium)CICC 21484、鲍曼不动杆菌(Acinetobacter baumannii)BNCC 194496、屎肠球菌(Enterococcus faecium)BNCC 336951、肺炎克雷伯氏菌(Klebsiella pneumoniae)BNCC 186113、白色念珠菌(Candida albicans)CMCC 52201:本实验室保藏。
1.1.3 培养基
营养肉汤(nutrient broth,NB)培养基[19]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,去离子水1 000 mL,pH=7.0。营养琼脂培养基:在此基础上加入琼脂30 g/L。
LB海水培养基[19]:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,海水1 000 mL。
LA海水培养基[19]:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,琼脂20 g,海水1 000 mL。
葡萄糖蛋白胨酵母膏(glucose peptone yeast extract,GPY)海水培养基[20]:蛋白胨2 g,酵母膏0.5 g,葡萄糖10 g,琼脂20 g,海水1 000 mL。
2216E海水培养基[21]:蛋白胨5 g,酵母膏1 g,磷酸铁0.1 g,琼脂20 g,海水1 000 mL。
脑心浸出肉汤(brainheartinfusionbroth,BHI)培养基[19]:蛋白胨10 g,脱水小牛脑浸粉12.5 g,脱水牛心浸粉5 g,NaCl 5g,葡萄糖2g,磷酸氢二钠2.5g,琼脂20g,去离子水1000mL。
MRS培养基[19]:葡萄糖20 g,蛋白胨10 g,牛肉浸粉20 g、吐温80 1 g、柠檬酸氢二铵2 g、乙酸钠5 g、磷酸氢二钾2 g、硫酸镁0.2 g,琼脂20 g,去离子水1 000 mL。
以上培养基均在121 ℃高压蒸汽灭菌15 min。
1.1.4 试剂
琼脂(生化试剂):广州赛国生物科技有限公司;氯化钠(分析纯)、酵母提取物(生化试剂)、葡萄糖(分析纯)、聚合酶链式反应(polymerase chain reaction,PCR)引物、SanPrep柱式脱氧核糖核酸(deoxyribonucleic acid,DNA)胶回收试剂盒:生工生物工程(上海)有限公司;胰蛋白胨(生化试剂)、琼脂糖(分析纯):奥博星生物技术有限公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
HVE-50高压灭菌器:日本HIRAYAMA公司;BSA224S电子天平:德国Sartorius公司;SW-CJ-2FD超净工作台:日本Airtech公司;SPX培养箱:宁波东南仪器有限公司;RV10旋转蒸发仪:德国IKA公司。
1.3 实验方法
1.3.1 海洋微生物的分离及纯化
采用涂布平板法和平板划线法[19]分离印度洋沉积物中的微生物,取1 g样品加入9 mL经过灭菌的60%的海水中,振荡2 h后静置,按10倍梯度依次稀释至10-7。取稀释度为10-7、10-6、10-5的样品各50 μL均匀涂布于LA海水培养基、2216E培养基、GPY培养基,置于28 ℃培养箱中恒温培养3 d。选取形态不同的微生物反复平板划线,得到纯化后的单菌落,37 ℃摇瓶培养24 h后与甘油混合,编号保存于-80 ℃冰箱中。
1.3.2 丁香假单胞菌拮抗菌株的筛选
将丁香假单胞菌以1%(V/V)的接种量接种于营养肉汤培养基中活化,30 ℃摇床培养2 d。再将分离得到海洋微生物以0.1%(V/V)的接种量接种于LB海水培养基中,37 ℃、180 r/min条件下培养24 h,即得到海洋微生物种子液。
初筛:采用滤纸片法[22]。在无菌条件下,吸取活化后的丁香假单胞菌100 μL均匀涂布于营养琼脂培养基上。在每种海洋微生物种子液中各放入5片直径为9 mm的滤纸圆片,浸泡10 min后整齐叠放在上述营养琼脂培养基上,30 ℃培养24 h,观察是否出现抑菌圈。
复筛:采用牛津杯法[23]。首先以0.1%(V/V)的接种量将分离得到的海洋微生物接种于LB海水培养基中,37 ℃、180 r/min条件下培养24 h。将得到的菌株发酵液在4 ℃、10 000 r/min条件下离心10 min,取其上清液旋转浓缩100倍,并通过0.22 μm的无菌微孔滤膜过滤后放到无菌离心管中。吸取活化后的丁香假单胞菌100 μL均匀涂布于营养琼脂培养基上,在此基础上放置牛津杯,杯内加入200 μL浓缩的海洋微生物发酵液,于30 ℃条件下培养24 h,采用游标卡尺测定透明圈直径,抑菌圈直径<10 mm属于低度敏感,10~15 mm属于中度敏感[24]。
1.3.3 丁香假单胞菌拮抗菌株的鉴定
(1)形态观察及生理生化实验
将筛选得到的丁香假单胞菌拮抗菌株划线接种于LA海水培养基中,观察其形态特点,再根据《常见细菌系统鉴定手册》[25]对其生理生化特征进行鉴定,包括革兰氏染色、糖发酵试验、吲哚试验等。
(2)分子生物学鉴定
选取通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-AAGTCGTAACAAGGTAACG-3'),采用菌落PCR的方法对筛选得到的丁香假单胞菌拮抗菌株的16S rDNA基因序列进行扩增。PCR扩增体系:模板7 μL,细菌通用引物27F和1492R 各2 μL,2×Taq Plus Master Mix酶25 μL,双蒸水(dd H2O)14 μL,总体积为50 μL;PCR扩增条件:95 ℃预变性5 min;98 ℃变性30 s,55 ℃退火15 s,72 ℃延伸2 min,共30个循环;72 ℃再延伸5 min。
将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 6.0软件中的邻接(neighbor-joining,NJ)法绘制系统发育树。
1.3.4 抑菌谱研究
采用琼脂扩散法探究菌株浓缩发酵液对各种致病菌的抑制效果[26]。鲍曼不动杆菌使用BHI培养基、肺炎克雷伯菌使用NB培养基、屎肠球菌使用MRS培养基,其他致病菌均使用LB培养基。
首先以0.1%(V/V)的接种量将筛选得到的海洋微生物接种于LB海水培养基中,37 ℃、180 r/min条件下摇床培养24 h。将得到的菌株发酵液在4 ℃、10 000 r/min条件下离心10 min,取其上清液旋转浓缩100倍,并通过0.22 μm的无菌微孔滤膜过滤后放到无菌离心管中。取37 ℃培养了12 h的致病菌种子液100 μL,与55 ℃左右相应的40 mL琼脂培养基混匀,倒平板,凝固后用直径为12 mm的打孔器打孔,并加入300 μL浓缩发酵液,三份平行,37 ℃条件下培养12 h后观察结果。
2 结果与分析
2.1 海洋微生物的分离纯化
从印度洋沉积物样品中共分离得到115株海洋微生物。
2.2 丁香假单胞菌拮抗菌株的筛选
2.2.1 初筛结果
以丁香假单胞菌为指示菌,用滤纸片法进行初筛,筛选得到33株具有拮抗效果的菌株,其中8株菌株的抑菌效果较好。
2.2.2 复筛结果
采用牛津杯法对8株抑菌效果较好的菌株进行复筛,结果见表1。由表1可知,菌株NO.4.1.3-1的抑菌圈直径最大,达到(12.63±0.06)mm,其抑菌效果见图1。
表1 丁香假单胞菌拮抗菌株的复筛结果
Table 1 Re-screening results of antagonistic strains of Pseudomonas syringae

图1 菌株NO.4.1.3-1对丁香假单胞菌的抑制效果
Fig.1 Inhibitory effect of strain NO.4.1.3-1 on Pseudomonas syringae
2.3 菌株NO.4.1.3-1的鉴定
2.3.1 形态观察
菌株NO.4.1.3-1的菌落及细胞形态见图2。由图2可知,菌株NO.4.1.3-1在LA海水培养基上呈不透明乳白色菌落,边缘不规则且不整齐,质地粘稠,培养1 d后单菌落出现褶皱。其镜检结果为革兰氏阳性菌,菌体为杆状。
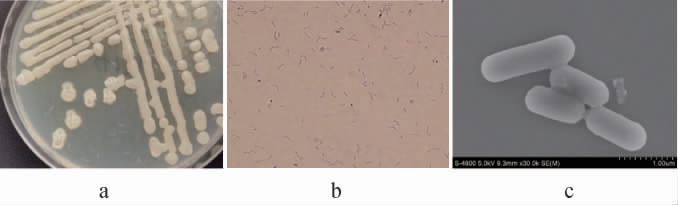
图2 菌株NO.4.1.3-1的形态学特征
Fig.2 Morphological characteristics of strain NO.4.1.3-1
a为菌落形态;b为革兰氏染色结果;c为扫描电镜结果。
2.3.2 生理生化实验结果
菌株NO.4.1.3-1的生理生化试验结果见表2。由表2可知,菌株NO.4.1.3-1能分解葡萄糖产酸且不产气,能使明胶液化,能产生过氧化氢酶,甲基红试验、V-P试验、淀粉水解试验、尿素试验、吲哚试验、硫化氢试验、柠檬酸盐试验结果均为阳性。
表2 菌株NO.4.1.3-1的生理生化特征
Table 2 Physiological and biochemical characteristics of strain NO.4.1.3-1
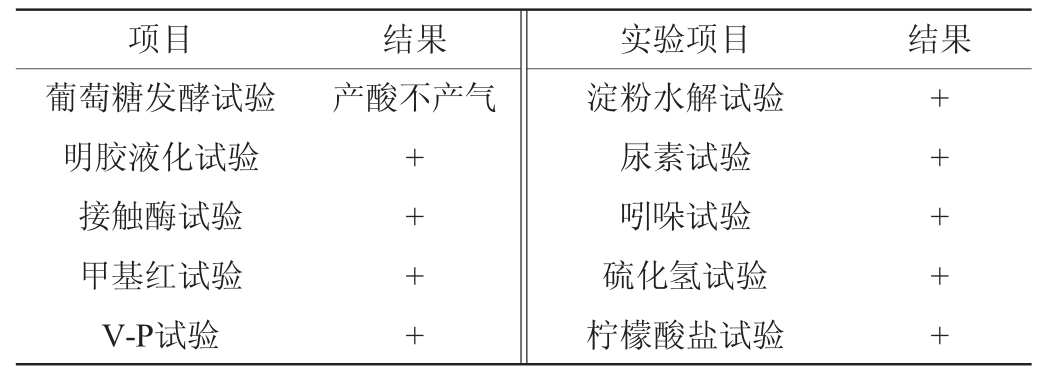
注:“+”表示结果呈阳性。
2.3.3 16S rDNA序列分析及系统发育树的构建
菌株NO.4.1.3-1的16S rDNA基因序列的PCR扩增产物经琼脂糖凝胶电泳检测,结果见图3。由图3可知,在1 700 bp左右出现目的条带,符合预期结果,说明PCR成功扩增出了目标序列。
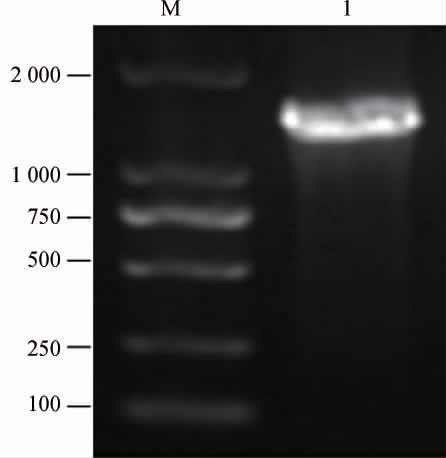
图3 菌株NO.4.1.3-1 16S rDNA基因序列PCR扩增产物的琼脂糖凝胶电泳结果
Fig.3 Agarose gel electrophoresis results of PCR amplification product of 16S rDNA sequence of strain NO.4.1.3-1
M:DL 2 000 DNA Marker;1:菌株NO.4.1.3-1的PCR扩增产物。
基于16S rDNA基因序列构建菌菌株NO.4.1.3-1的系统发育树,结果见图4。由图4可知,菌株NO.4.1.3-1与贝莱斯芽孢杆菌(Bacillus velezensis)聚在同一分支,亲缘关系最为接近,结合形态观察及生理生化特征,最终将该菌株鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。贝莱斯芽孢杆菌因其能产生多种抗菌代谢物(聚酮类[27]、脂肽类[28]及抗菌蛋白[29])而被得到广泛认可[30],并广泛应用于生物防治,肖倩等[31]经过离体叶片和盆栽试验发现贝莱斯芽孢杆菌HMQAU19044对黄瓜霜霉病有抑制作用,对染病的黄瓜幼苗叶片有保护和治疗作用;王青华等[32]研究表明,深海贝莱斯芽孢杆菌DH82对部分水产细菌性疾病有较好防治效果,也能有效抑制引起植物枯萎病的水贼镰刀菌。

图4 基于16S rDNA基因序列菌株NO.4.1.3-1的系统发育树
Fig.4 Phylogenetic tree of strain NO.4.1.3-1 based on 16S rDNA gene sequence
2.4 菌株NO.4.1.3-1的抑菌谱
菌株NO.4.1.3-1抑菌谱的测定结果见表3。由表3可知,该菌具有广谱的抑菌性,对供试的革兰氏阳性、阴性菌以及真菌致病菌都有一定的抑制作用。除了对屎肠球菌无抑制效果外,该菌对8株常见致病菌均有抑制作用。此外,在5株革兰氏阴性致病菌中,菌株NO.4.1.3-1对肺炎克雷伯氏菌的拮抗效力最强,抑菌圈直径达到(19.11±0.28)mm;在供试的革兰氏阳性致病菌中,菌株NO.4.1.3-1对金黄色葡萄球菌的抑制效果最好,抑菌圈直径达到(18.85±0.51)mm。WANG C等[33]研究发现,苹果树根际土壤来源的一株贝莱斯芽孢杆菌不仅具有拮抗拟轮枝镰孢菌(Fusarium oxysporum)的能力,而且能够促进湖北海棠的生长;任津莹等[34]从农田土壤中筛选获得1株有抑菌作用的贝莱斯芽孢杆菌N-3,该菌对金黄色葡萄球菌的抑制作用较强,与本试验结果一致。
表3 菌株NO.4.1.3-1抑菌谱的测定结果
Table 3 Determination results of antibacterial spectrum of strain NO.4.1.3-1
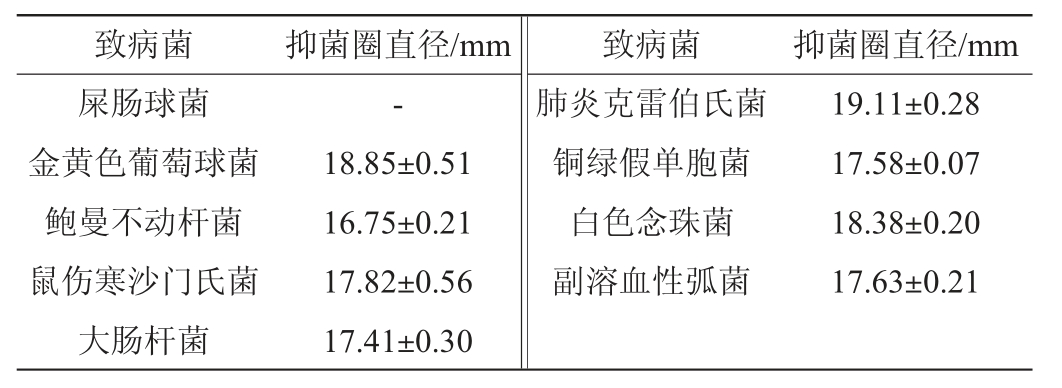
注:“-”表示无抑菌效果。
3 结论
本研究以丁香假单胞菌为指示菌,从印度洋沉积物中共分离出115株海洋微生物,其中33株对丁香假单胞菌有抑制作用,抑菌效果最优的为菌株NO.4.1.3-1,其抑菌圈直径达(12.63±0.06)mm。通过形态学观察、生理生化试验及分子生物学技术鉴定其为贝莱斯芽孢杆菌(Bacillus velezensis)。除屎肠球菌外,菌株NO.4.1.3-1对8种致病菌均有抑制作用,且对肺炎克雷伯氏菌、金黄色葡萄球菌的抑菌作用较好,具有较广的抑菌谱。
[1]RICO A,PRESTON G M.Pseudomonas syringae pv.tomato DC3000 uses constitutive and apoplast-induced nutrient assimilation pathways to catabolize nutrients that are abundant in the tomato apoplast[J]. Mol Plant Microb Interact,2008,21(2):269-282.
[2]DUDNIK A,DUDLER R.Non contiguous-finished genome sequence of Pseudomonas syringae pathovar syringae strain B64 isolated from wheat[J].Standard Genomic Sci,2013,8(3):420-429.
[3]QI M,WANG D,BRADLEY C A,et al.Genome sequence analyses of Pseudomonas savastanoi pv.glycinea and subtractive hybridization-based comparative genomics with nine Pseudomonads[J].Plos One,2011,6(1):e16451.
[4]KESHTKAR A R,KHODAKARAMIAN G,ROUHRAZI K.Isolation and characterization of Pseudomonas syringae pv.syringae which induce leaf spot on walnut[J].Eur J Plant Pathol,2016,146(4):837-846.
[5]CHOI O,KANG B,CHO S K,et al.Identification of Pseudomonas syringae pv.syringae causing bacterial leaf blight of Miscanthus sinensis[J].J Plant Dis Protect,2017,124(1):97-100.
[6]CHOI O,KANG B,CHO S K,et al.First report of Pseudomonas syringae pv. syringae causing bacterial leaf blight on Miscanthus giganteus[J]. J Plant Dise Protect,2016,123(3):137-140.
[7]SLOMNICKA R,OLCZAK-WOLTMAN H,BARTOSZEWSKI G,et al.Genetic and pathogenic diversity of Pseudomonas syringae strains isolated from cucurbits[J].Eur J Plant Pathol,2015,141(1):1-14.
[8]GERIN D,CARIDDI C,ANGELINI R M D M,et al.First report of pseudomonas grapevine bunch rot caused by Pseudomonas syringae pv. syringae[J].Plant Dis,2019,103(8):1954-1960.
[9]CHEN H,HU Y,QIN K,et al.A serological approach for the identification of the effector hopz5 of Pseudomonas syringae pv.actinidiae:a tool for the rapid immunodetection of kiwifruit bacterial canker[J]. J Plant Pathol,2018,100(2):171-177.
[10]VICENTE J G,ROBERTS S J.Discrimination of Pseudomonas syringae isolates from sweet and wild cherry using rep-PCR[J].Eur J Plant Pathol,2007,117(4):383-392.
[11]GIOVANARDI D,FERRANTE P,SCORTICHINI M,et al.Characterisation of Pseudomonas syringae isolates from apricot orchards in northeastern Italy[J].Eur J Plant Pathol,2018,151(4):901-917.
[12]LAVIN J L,KIIL K,RESANO O,et al.Comparative genomic analysis of two-component regulatory proteins in Pseudomonas syringae[J].Bmc Genomics,2007,8(1):397.
[13]ARNOLD D L,PRESTON G M. Pseudomonas syringae:enterprising epiphyte and stealthy parasite[J].Microbiology-Sgm,2019,165(3):251-253.
[14]李贺,林学政,何培青,等.南极抗细菌活性菌株的筛选及系统发育分析[J].微生物学通报,2011,38(2):264-269.
[15]罗曼,万婧倞,黄仕新,等.南极沉积物来源抗菌细菌的筛选及抑菌物质的鉴定[J].微生物学通报,2020,47(6):1787-1794.
[16]RAVINDRAN C,VARATHARAJAN G R,RAJASABAPATHY R,et al.Antibacterial activity of marine Bacillus substances against Vibrio cholerae and Staphylococcus aureus and in vivo evaluation using embryonic zebrafish test system[J].Ind J Pharmaceut Sci,2016,78(3):417-422.
[17]ZHOU Y,WANG J,GAO X,et al.Isolation of a novel deep-sea Bacillus circulus strain and uniform design for optimization of its anti-aflatoxigenic bioactive metabolites production[J].Bioengineered,2019,10(1):13-22.
[18]LI W,TANG X X,YAN X,et al.A new macrolactin antibiotic from deep sea-derived bacteria Bacillus subtilis B5[J].Nat Prod Res,2016,30(24):2777-2782.
[19]王晓彤,金黎明,俞勇,等.拮抗大肠杆菌的海洋微生物的筛选与鉴定[J].中国酿造,2020,39(6):43-46.
[20]倪孟祥,胡颖.北极海泥来源抗菌活性真菌的筛选及菌株H5的初步研究[J].化学与生物工程,2013,30(5):61-64.
[21]孙创,王金燕,张钰琳,等.利用改良培养基探究西太平洋海水可培养细菌多样性[J].微生物学报,2021,61(4):845-861.
[22]GOS F M W R,SAVI D C,SHAABAN K A,et al.Antibacterial activity of endophytic actinomycetes isolated from the medicinal plant Vochysia divergens(Pantanal,Brazil)[J].Front Microbiol,2017,8:1642.
[23]LIN L Z,ZHENG Q W,WEI T,et al.Isolation and characterization of fengycins produced by Bacillus amyloliquefaciens JFL21 and its broadspectrum antimicrobial potential against multidrug-resistant foodborne pathogens[J].Front Microbiol,2020,11:1-18.
[24]秦文文,梁剑平,郝宝成,等.茶树油对5种常见致病菌的体外抑菌作用研究[J].黑龙江畜牧兽医,2017(21):195-199.
[25]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-386.
[26]邱昊旻,刘博超,马启晨,等.北冰洋来源白色念珠菌拮抗菌株的分离与鉴定[J].中国酿造,2019,38(7):91-94.
[27]THURLOW C M,WILLIAMS M A,CARRIAS A,et al.Bacillus velezensis AP193 exerts probiotic effects in channel catfish(Ictalurus punctatus)and reduces aquaculture pond eutrophication[J].Aquaculture,2019,503:347-356.
[28]CHOWDHURY S P,UHL J,GROSCH R,et al.Cyclic lipopeptides of Bacillus amyloliquefaciens subsp. plantarum colonizing the lettuce rhizosphere enhance plant defense responses toward the bottom rot pathogen Rhizoctonia solani[J].Mol Plant-Microbe Interact,2015,28(9):984-995.
[29]HUANG L,LI Q-C,HOU Y,et al.Bacillus velezensis strain HYEB5-6 as a potential biocontrol agent against anthracnose on Euonymus japonicus[J].Biocontrol Sci Technol,2017,27(5):636-653.
[30]张德锋,高艳侠,王亚军,等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报,2020,47(11):3634-3649.
[31]肖倩,李守望,梁晨,等.贝莱斯芽孢杆菌对黄瓜霜霉病的作用方式和持效期[J].农药,2021,60(11):829-831.
[32]王青华,唐旭,孙晓晖,等.深海贝莱斯芽孢杆菌DH82的抑菌活性物质初步分离纯化及其抑菌谱检测[J].应用海洋学学报,2020,39(1):20-26.
[33]WANG C,ZHAO D,QI G,et al.Effects of Bacillus velezensis FKM10 for promoting the growth of Malus hupehensis rehd.and inhibiting Fusarium verticillioides[J].Front Microbiol,2020,10:2889.
[34]任津莹,陈鹏.一株贝莱斯芽孢杆菌的分离鉴定及其生物学特性研究[J].饲料研究,2022(2):79-82.