苗族红酸汤是由番茄、红辣椒、木姜子及生姜等原料经二次发酵制成的贵州省民族特色发酵食品,其既保留了原有的番茄红素和辣椒碱,又形成了乙酸、乳酸等风味成分,酸味醇厚[1]。据报道番茄红素和辣椒碱具有降低胆固醇,改善血脂和减轻炎症的作用[2-3],而有机酸具有抗氧化作用[4]。
肥胖会导致机体轻度慢性炎性反应,进而引起高血糖和血脂紊乱[5-10]。诸多研究表明,发酵食品可以通过降低肥胖者体内的炎性反应,改善机体的血糖及血脂代谢。ALI M W等[11]研究发现,发酵泡菜具有降血脂、抗氧化和抗炎的作用;DENG X等[12]研究发现,酿酒酵母(Saccharomyces cerevisiae)发酵的混合果汁可以抑制与肥胖相关的脂肪酶活力;WASTYK H C等[13]研究发现,发酵食品可以增加肠道菌群的多样性和物种丰富,减少身体的炎性反应。
目前,关于红酸汤对单纯性肥胖大鼠慢性炎症的研究鲜见报道,因此,本研究采用红酸汤灌胃高脂饮食诱导的单纯性肥胖大鼠,以灌胃等体积的蒸馏水为阳性对照,连续灌胃12周后,称量大鼠体质量,并测定Lee's指数、脂肪指数、空腹血糖(fasting plasma glucose,FPG)及血脂水平、肠道内容物pH及短链脂肪酸(short chain fatty acids,SCFAs)含量、血清及肠道组织中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin 6,IL-6)和单核细胞趋化蛋白1(monocyte chemoattractant protein,MCP-1)含量,探讨红酸汤对肥胖大鼠血清及肠道慢性炎症的影响,以期为贵州省民族特色发酵食品—苗族红酸汤的开发利用提供参考和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
苗族红酸汤:市售。
基础饲料:由贵州医科大学动物实验中心提供,其成分包括粗蛋白、粗脂肪、粗纤维、粗灰分、粗水分及微量元素和氨基酸等。高脂饲料:78.8%基础饲料、1%胆固醇、10%蛋黄粉、10%猪油、0.2%胆盐。
实验动物:无特定病原体(specific pathogen free,SPF)级雄性SD大鼠,6周龄,体质量(160±20)g,共40只,由贵州医科大学实验动物中心提供,许可证号为SCXK(辽)2020-0001。本次动物实验在贵州医科大学实验动物中心进行,已获得贵州医科大学实验动物伦理审查委员会批准(伦理审批号:NO.2100228)。实验环境:环境温度(25±0.5)℃,相对湿度55%,明暗交替周期12 h/12 h,保持良好通风。
1.1.2 试剂
肿瘤坏死因子-α(TNF-α)试剂盒、白细胞介素6(IL-6)试剂盒、单核细胞趋化蛋白1(MCP-1)试剂盒:武汉伊莱瑞特生物科技股份有限公司;短链脂肪酸(SCFAs)标准品(纯度≥98%):上海阿拉丁试剂有限公司;磷酸盐缓冲液(phosphate buffer saline,PBS)(分析纯):上海埃泽思生物科技有限公司;甲醇(分析纯):广东予能实验室设备科技有限公司。
1.2 仪器与设备
TDL-5000bR台式高速离心机:上海安亭仪器厂;GC-2010plus气相色谱(gas chromatography,GC)仪:日本岛津公司;SCIENTZ-ⅡD超声破碎仪、Multiskan GO超级酶标仪、HPX-9162MBE恒温孵育箱:美国Thermo Scientific公司;HD-F2600全自动血生化分析仪:济南汉方医疗器械有限公司。
1.3 实验方法
1.3.1 苗族红酸汤样品的制备
将苗族红酸汤和蒸馏水按质量比4∶1混匀稀释,稀释后的苗族红酸汤加热至沸腾,冷却,过滤去除残渣后备用。
1.3.2 实验动物分组及干预
实验动物分组:40只大鼠适应性饲喂基础饲料1周后,按照体质量随机分为4组,阴性对照组:饲喂普通饲料,灌胃等体积的蒸馏水;阳性对照组:饲喂高脂饲料,灌胃等体积的蒸馏水;低剂量酸汤组:饲喂高脂饲料,灌胃4 g/(kg·体质量)苗族红酸汤;高剂量酸汤组:饲喂高脂饲料,灌胃8 g/(kg·体质量)苗族红酸汤。
干预方式和时间:每日下午3点,以灌胃方式,连续干预12周,每次灌胃前称取大鼠体质量,其余时间动物可自由摄取饲料及饮水。干预期间记录大鼠的一般形态学特征,包括体态、毛发、精神状态、嗜睡情况、活动量以及死亡情况等。
1.3.3 实验动物解剖和取材
干预12周末,所有大鼠禁食12 h,腹腔注射1%的戊巴比妥钠进行麻醉,心尖取血并保存在非抗凝的生化管中,常温静置10~20 min后,3 000 r/min离心15 min后取血清分装,-80 ℃冷冻保存,用于血糖、血脂水平及血清炎症因子的测定。开腹取出小肠组织,-80 ℃冻存,用于肠道炎症因子的测定。取盲肠内容物于冻存管内,于-80 ℃保存,用于肠道内容物短链脂肪酸水平的测定。
1.3.4 脂肪指数和Lee's指数的测定[1]

1.3.5 血糖和血脂水平的检测
采用全自动血生化分析仪测定大鼠血清中空腹血糖(FPG)、甘油三酯(triglyceride,TG)、总胆固醇(total choles terol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平。
1.3.6 肠道内容物pH和短链脂肪酸的测定[14]
pH测定:将盲肠内容物0.5 g放于试管中,加入10倍体积蒸馏水,匀浆静置2 h后取上清液,用电子pH计测定其pH值。
短链脂肪酸的测定:取盲肠内容物50 mg,加入500 μL甲醇并混匀,超声提取10 min后在5 000 r/min条件下离心10 min,取上清液1 mL,用0.45 μm滤膜过滤,采用GC法测定肠道内容物短链脂肪酸。
1.3.7 血清和肠道炎症因子的检测
心尖取血离心后取得血清,立即按照试剂盒说明书检测血清中TNF-α、IL-6和MCP-1的含量;取0.5 g小肠组织,按照质量比1∶9加入PBS于玻璃研磨器中制得组织匀浆,离心后取上清液,按照试剂盒说明书检测肠道中TNF-α、IL-6和MCP-1的含量。
1.3.8 数据处理
试验重复3次,结果以“平均值±标准差”(X±S)表示,采用SPSS 22.0软件对数据进行统计分析。
2 结果与分析
2.1 苗族红酸汤对大鼠一般形态学特征的影响
实验期间大鼠未出现死亡,各组大鼠摄食和饮水情况正常。阳性对照组大鼠体态臃肿,腹部肥大,毛发色泽暗淡,大便黏腻,与阴性对照组及酸汤组大鼠比较,活动量明显减少,嗜睡,说明高脂饮食诱导下大鼠体态、毛发及精神状态等发生了改变。阴性对照组、低剂量酸汤组和高剂量酸汤组大鼠体态正常,毛发柔顺有光泽,大便干燥,活泼好动,说明大鼠在苗族红酸汤灌胃干预下的形态学特征未发生改变。
2.2 苗族红酸汤对大鼠体质量、Lee's指数及脂肪指数的影响
苗族红酸汤对大鼠体质量、Lee's指数和脂肪指数的影响见图1。由图1可知,开始干预前,各组大鼠体质量无显著差异(P>0.05),经12周干预后,阴性对照组、低剂量和高剂量酸汤组大鼠的体质量、Lee's指数、脂肪指数均显著低于阳性对照组(P<0.05),说明酸汤干预可以有效抑制高脂饮食所引起的体质量增加,同时能降低高脂饮食导致的大鼠体内脂肪积聚。
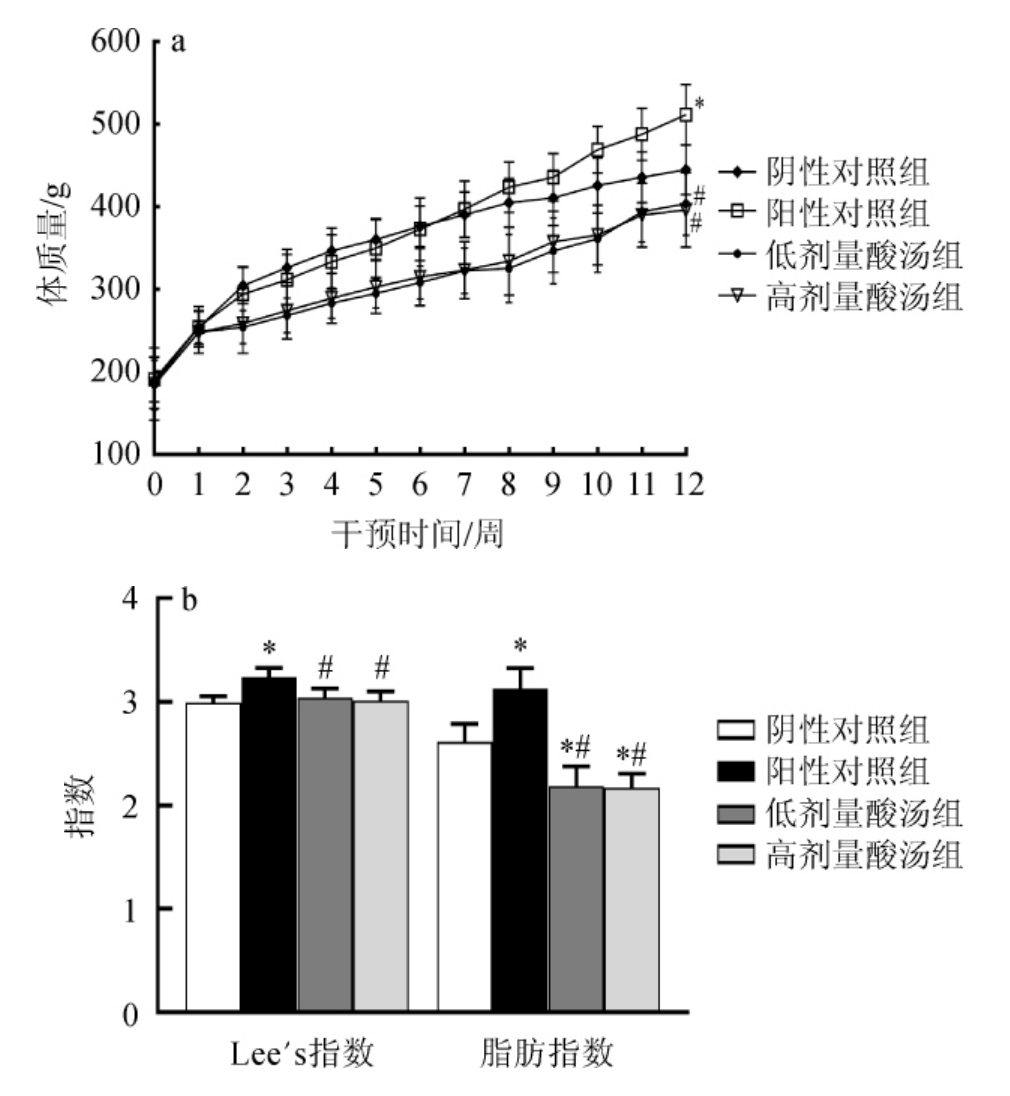
图1 苗族红酸汤对大鼠体质量(a)、Lee's指数和脂肪指数(b)的影响
Fig.1 Effect of Miao red sour soup on body mass (a),Lee's index and fat index (b) of rats
“*”表示与阴性对照组比较差异显著(P<0.05);“#”表示与阳性对照组比较差异显著(P<0.05)。下同。
2.3 苗族红酸汤对大鼠血糖和血脂的影响
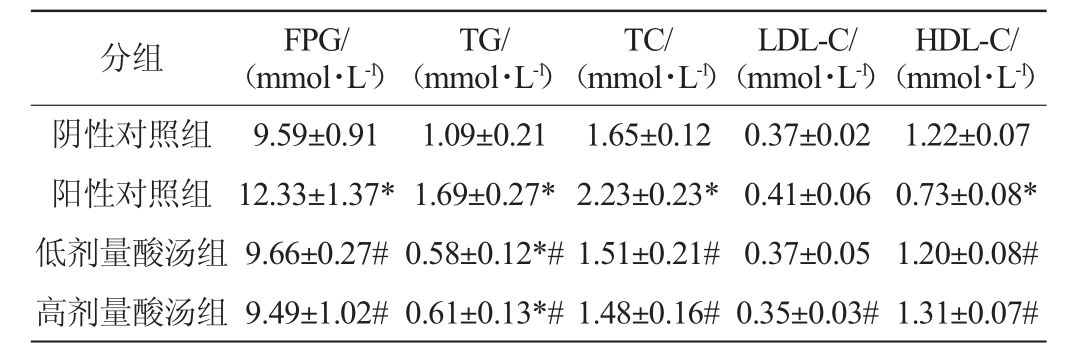
苗族红酸汤对大鼠血糖和血脂的影响见表1。由表1可知,与阴性对照组相比,阳性对照组大鼠的空腹血糖(FPG)及血清中的TG、TC的含量均显著升高(P<0.05),LDL-C含量升高,HDL-C含量显著降低(P<0.05),说明大鼠血脂代谢紊乱,结合其体质量和Lee's指数的显著升高,说明高脂饮食成功诱导大鼠单纯性肥胖。与阳性对照组相比,酸汤组大鼠的FPG、血清中的TG和TC含量显著降低(P<0.05),HDL-C含量显著升高(P<0.05),并且高剂量酸汤组大鼠血清中的LDL-C含量显著降低(P<0.05),说明贵州苗族红酸汤可以改善高脂饮食所导致的大鼠空腹血糖升高和血脂紊乱。
表1 苗族红酸汤对大鼠空腹血糖和血脂水平的影响
Table 1 Effect of Miao red sour soup on fasting blood glucose and serum lipid level of rats
2.4 苗族红酸汤对大鼠肠道内容物pH和短链脂肪酸含量的影响
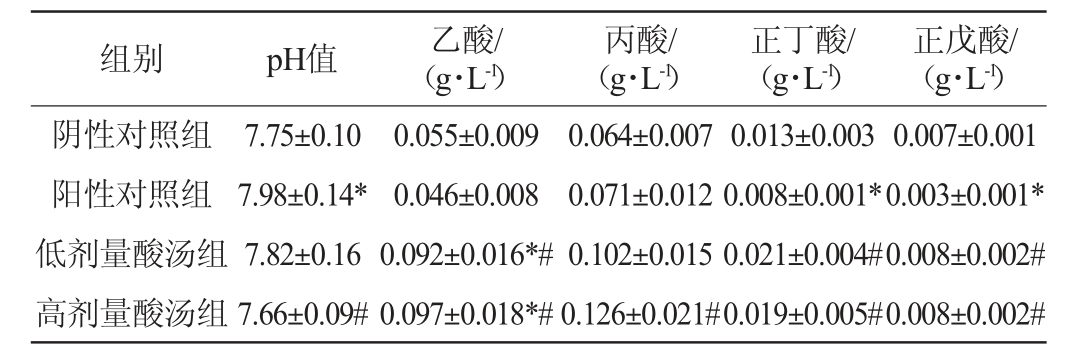
苗族红酸汤对大鼠肠道内容物pH和短链脂肪酸含量的影响见表2。由表2可知,与阳性对照组相比,阴性对照组和高剂量酸汤组肠道内容物的pH值显著降低(P<0.05),低剂量酸汤组肠道内容物的pH值降低,说明红酸汤可以调节防止高脂饮食诱导的肥胖大鼠肠道内容物pH值的升高。由表2亦可知,与阳性对照组相比,各剂量酸汤组大鼠肠道内容物中乙酸、正丁酸和正戊酸的含量显著升高(P<0.05),并且高剂量酸汤组大鼠肠道内容物中的丙酸含量显著升高(P<0.05),说明贵州苗族红酸汤可以有效增加大鼠肠道内容物中短链脂肪酸的含量。
表2 苗族红酸汤对大鼠肠道内容物pH值和短链脂肪酸含量的影响
Table 2 Effect of Miao red sour soup on pH and short-chain fatty acids content of cholesterol contents of rats
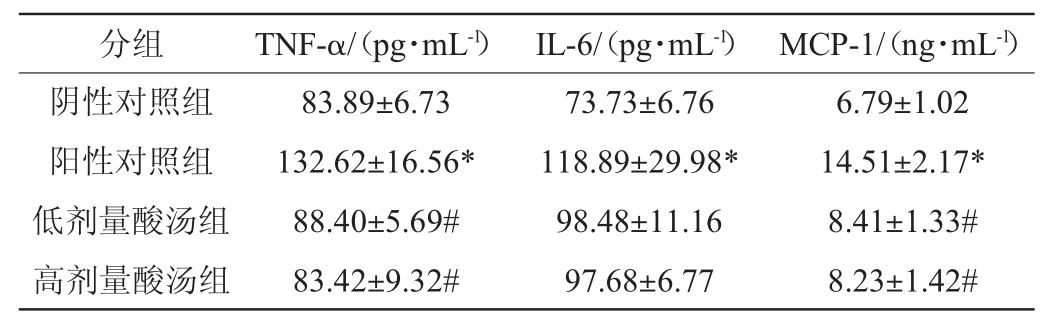
2.5 苗族红酸汤对大鼠炎症水平的影响
苗族红酸汤对大鼠血清和肠道组织炎症水平的影响分别见表3和表4。由表3和表4可知,与阴性对照组相比,阳性对照组大鼠经高脂饮食诱导发生肥胖后,大鼠血清及肠道中的炎症因子TNF-α、IL-6和MCP-1含量显著升高(P<0.05)。经过酸汤干预后,与阳性对照组相比,低剂量酸汤组和高剂量酸汤组各大鼠血清中的炎症因子TNF-α、IL-6和MCP-1含量显著降低(P<0.05),同时肠道组织中的炎症因子TNF-α和MCP-1含量也显著下降(P<0.05),说明贵州苗族红酸汤的干预可以有效减轻高脂饮食诱导大鼠肥胖时血清和肠道的炎症水平。
表3 苗族红酸汤对大鼠血清炎症水平的影响
Table 3 Effect of Miao red sour soup on serum inflammation levels of rats
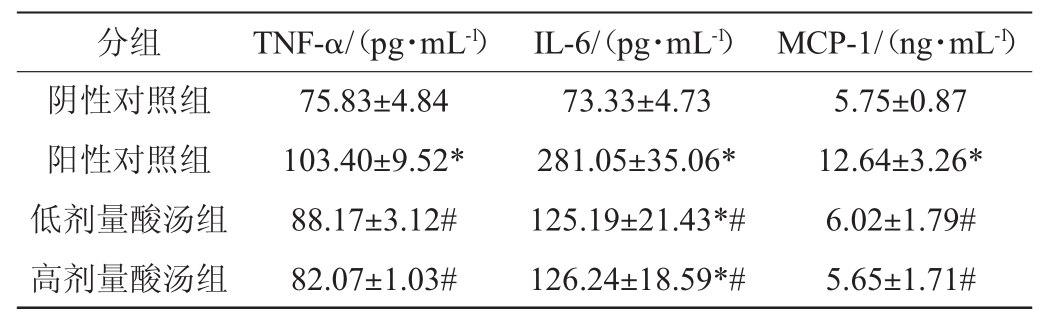
表4 苗族红酸汤对大鼠肠道炎症水平的影响
Table 4 Effect of Miao red sour soup on intestinal inflammation levels of rats
2.6 讨论
本研究通过高脂饮食诱导大鼠发生单纯性肥胖,在喂养高脂饮食的同时施以苗族红酸汤的干预。12周干预结束时测量各组大鼠的体质量、空腹血糖和血脂水平,发现阳性对照组的体质量、血糖、TG、TC以及Lee's指数和脂肪指数均高于阴性对照组。肥胖个体往往伴随着血脂代谢紊乱[15],而且Lee's指数是一个衡量全身性肥胖的重要指标[16]。说明阳性对照组大鼠在高脂饮食的诱导下发生了单纯性肥胖。喂养高脂饮食时给予苗族红酸汤,发现低剂量和高剂量酸汤组大鼠的体质量减轻,脂肪指数和Lee's指数降低,空腹血糖和血脂水平改善。说明苗族红酸汤对于高脂饮食诱导大鼠单纯性肥胖和血脂紊乱具有一定的预防效果。
肥胖的发生往往伴随着机体慢性炎性反应,在高脂饮食的诱导下,阳性对照组大鼠的血清和肠道炎症因子THF-α、IL-6和MCP-1的水平均有不同程度的上升,说明大鼠发生肥胖时机体也处于慢性炎症状态。研究表明,THF-α、IL-6和MCP-1是典型的促炎因子,参与机体慢性炎症的发生和发展[17]。THF-α可以抑制胰岛素的信号转导,引起血糖升高[18]。肥胖时脂肪组织可以分泌大量IL-6,而IL-6可以促进脂肪分解,升高游离脂肪酸,并抑制胰岛素肝糖原代谢从而引起胰岛素抵抗[19]。MCP-1是一种重要的炎症趋化因子,可以促使炎细胞渗入胰岛细胞,进而破坏胰岛细胞,是引发胰岛素抵抗等疾病的重要因素[20]。值得注意的是,喂养高脂饮食的同时给予苗族红酸汤,发现经过红酸汤干预后,大鼠血清及肠道组织中的炎症因子THF-α和MCP-1的表达明显减少,血清中IL-6含量降低,说明苗族红酸汤可以预防高脂饮食诱导大鼠肥胖时机体伴随的慢性炎症,继而发挥改善肥胖、胰岛素抵抗等慢性代谢性疾病的作用。同时,在高剂量酸汤的干预下,大鼠肠道内容物pH降低,恢复至阴性对照组大鼠水平,并且由于苗族红酸汤含有丰富的乙酸、乳酸等SCFAs,所以低剂量酸汤组和高剂量酸汤组肠道内容物中SCFAs的含量较阳性对照组明显升高,而SCFAs在免疫调节、抑制炎症反应及改善肥胖等方面具有重要作用[21-23]。一方面,SCFAs中的乙酸和丙酸可以与G蛋白耦联受体(G protein-coupled receptors,GPCRs)结合,激活GPR43受体,产生多种内分泌激素比如瘦素,瘦素可以通过血脑屏障直接作用于下丘脑,从而降低食欲,改善肥胖。另一方面,SCFAs中的丙酸和丁酸可以抑制脂多糖(lipopolysaccharide,LPS)的产生进而抑制IL-6和IL-12p40等促炎性因子的表达,也能通过抑制核转录因子κB(nuclear transcription factor-κB,NF-κB)通路抑制炎症因子IL-6和TNF-α的分泌,进而发挥调节免疫系统的作用[24]。说明苗族红酸汤可能通过增加肠道内容物中SCFAs的水平,进而抑制食欲和炎性因子的分泌来预防高脂饮食诱导的单纯性肥胖和机体慢性炎性状态。
诸多研究提出发酵食品具有降血脂、抗氧化、调节肠道菌群等作用[25],说明发酵食品具有潜在的健康作用。这提示了苗族红酸汤作为一种经微生物自然发酵并富含多种生物活性物质的发酵食品可能也具有预防肥胖、调节血脂等作用,与本研究结果一致。同时还发现了苗族红酸汤可以改善肥胖发生时机体伴随的慢性炎性反应,不仅为预防肥胖提供了新思路,也为苗族红酸汤的开发与利用提供了理论基础。
3 结论
采用红酸汤灌胃高脂饮食诱导的单纯性肥胖大鼠,以灌胃等体积的蒸馏水为阳性对照,连续灌胃12周后发现,与阳性对照组相比,低剂量(4 g/(kg·体质量))和高剂量(8 g/(kg·体质量))酸汤组大鼠的体质量减轻,Lee's指数和脂肪指数降低,FPG及血清中甘油三酯、总胆固醇和低密度脂蛋白胆固醇含量降低,高密度脂蛋白胆固醇含量升高,肠道内容物pH降低、短链脂肪酸含量增加,血清及肠道组织中TNF-α、IL-6和MCP-1含量降低。说明贵州苗族红酸汤作为一种发酵食品,对高脂饮食诱导的单纯性肥胖大鼠的血脂紊乱有一定预防作用,能改善其机体慢性炎性反应。
[1]鲁杨.凯里红酸汤成分及其对大鼠血脂调节作用研究[D].贵阳:贵州医科大学,2019.
[2]MOSQUEDA-SOLIS A,SANCHEZ J,PORTILLO M P,et al.Combination of capsaicin and hesperidin reduces the effectiveness of each compound to decrease the adipocyte size and to induce browning features in adipose tissue of western diet fed rats[J].J Agr Food Chem,2018,66(37):9679-9689.
[3]VALLVERDU-QUERALT A,REGUEIRO J,DE ALVARENGA J F,et al.Carotenoid profile of tomato sauces:effect of cooking time and content of extra virgin olive oil[J].Int J Mol Sci,2015,16(5):9588-9599.
[4]鲁青松,徐俐,牟琴,等.凯里红酸汤有机酸的提取及抗氧化活性[J].食品工业,2019,40(2):89-94.
[5]KYLE T K,DHURANDHAR E J,ALLISON D B.Regarding obesity as a disease:evolving policies and their implications[J]. Endocrinol Metab Clin N Am,2016,45(3):511-520.
[6]张元红.蛋氨酸限制改善高脂膳食小鼠肠道菌群抑制肥胖和炎症反应[D].无锡:江南大学,2018.
[7]刁红杰,鲁燕.Toll样受体4介导的炎症反应与肥胖和胰岛素抵抗的研究进展[J].中国糖尿病杂志,2016,24(11):1044-1048.
[8]KOJTA I,CHACINSKA M,BLACHNIO-ZABIELSKA A.Obesity,bioactive lipids,and adipose tissue inflammation in insulin resistance[J].Nutrients,2020,12(5):1305.
[9]WU H,BALLANTYNE C M.Metabolic inflammation and insulin resistance in obesity[J].Circ Res,2020,126(11):1549-1564.
[10]BLOOMER R J,KABIR M M,MARSHALL K E,et al.Postprandial oxidative stress in response to dextrose and lipid meals of differing size[J]. Lipid Health Dis,2010,9:79.
[11]ALI M W,SHAHZAD R,BILAL S,et al.Comparison of antioxidants potential,metabolites,and nutritional profiles of Korean fermented soybean (Cheonggukjang) with Bacillus subtilis KCTC 13241[J]. J Food Sci Technol,2018,55(8):2871-2880.
[12]DENG X,HOU Y,ZHOU H,et al.Hypolipidemic,anti-inflammatory,and anti-atherosclerotic effects of tea before and after microbial fermentation[J].Food Sci Nutr,2021,9(2):1160-1170.
[13]WASTYK H C,FRAGIADAKIS G K,PERELMAN D,et al.Gut-microbiota-targeted diets modulate human immune status[J]. Cell,2021,184(16):4137-4153.
[14]黄雨梅.丁酸盐对幽门螺杆菌感染小鼠的炎症、肠道菌群和粪便短链脂肪酸的影响[D].泸州:西南医科大学,2021.
[15]KLOP B,ELTE J W,CABEZAS M C.Dyslipidemia in obesity:mechanisms and potential targets[J].Nutrients,2013,5(4):1218-1240.
[16]董乃相,张书义,梁玉磊,等.针刺对不同性别单纯性肥胖大鼠Lee's指数与Leptin含量的影响[J].中医学报,2015,30(6):846-848.
[17]蔡坤,齐东飞,侯新伟,等.胰淀素表达的调控及病理意义[J].中国病理生理杂志,2012,28(11):2005.
[18]于亮宇,杨妮,王静,等.基于TNF-α和FABP4蛋白探究长期服用奥氮平导致胰岛素抵抗的作用机制[J].中国医院药学杂志,2020,40(8):880-884.
[19]曹欢,袁家楠,赵梦宇,等.血清分泌型卷曲相关蛋白5水平与糖尿病肾脏病患者的相关因素分析[J].中华糖尿病杂志,2021,13(10):978-983.
[20]胡敏,韩要武,李璐,等.体外三维血管生成模型的建立及肿瘤细胞分泌的MCP-1/VEGF对该模型的影响[J].中国病理生理杂志,2019,35(12):2187-2193.
[21]WANG L,REN B,HUI Y,et al.Methionine restriction regulates cognitive function in high-fat diet-fed mice:Roles of diurnal rhythms of SCFAs producing and inflammation-related microbes[J]. Mol Nutr Food Res,2020,64(17):e2000190.
[22]DENG M,QU F,CHEN L,et al.SCFAs alleviated steatosis and inflammation in mice with NASH induced by MCD[J]. J Endocrinol,2020,245(3):425-437.
[23]WANG Z,ZHANG X,ZHU L,et al.Inulin alleviates inflammation of alcoholic liver disease via SCFAs-inducing suppression of M1 and facilitation of M2 macrophages in mice[J]. Int Immunopharmacol,2020,78:106062.
[24]刘超,殷紫,许国莹,等.儿童肥胖症合并肺炎支原体感染TLR4/NF-κB信号通路与致炎细胞因子水平的关系[J].中华医院感染学杂志,2021,31(16):2522-2526.
[25]CHOI I H,NOH J S,HAN J S,et al.Kimchi,a fermented vegetable,improves serum lipid profiles in healthy young adults:randomized clinical trial[J]. J Med Food,2013,16(3):223-229.