芒果(Mangifera indica L.)是一种重要的热带水果,由于其香气独特、美味和高营养价值被加工成果浆、果汁饮料、发酵果汁、果酒等[1]。其中,发酵芒果汁具有巨大的市场潜力和良好的发展势头[2]。香气是衡量芒果汁产品质量的一个重要指标,但芒果汁加工过程中的热处理会导致香气成分的变化,影响果汁的风味[3]。
芒果含丰富的类胡萝卜素,其在加工过程中的降解可以产生许多具有花香和果香的重要风味物质[4]。C9~C15的类胡萝卜素衍生物不仅具有特殊的香味,而且还具有对人类有益的生物活性功能,如β-紫罗兰酮、β-环柠檬醛和β-大马士酮,它们的大量存在不仅可以赋予果汁特定风味,而且还可以促进机体生物活性的调节,具有降血脂、抑制癌细胞的功能[5]。因此,充分利用类胡萝卜素的降解作用来提高芒果汁的香气可以进一步提高芒果汁的品质[6]。FESSARD A等[7]研究发现,益生菌发酵可能是保持甚至改善加工水果产品的营养质量和风味的一种有效方法。有研究发现,乳酸菌可通过发酵积累乳酸来促进类胡萝卜素的降解,进而减少橙汁样品中的类胡萝卜素[8-9];一些特定种属的非酿酒酵母菌株,可以合成和分泌胞外糖苷酶,该酶对类胡萝卜素C13-降异戊二烯化合物的“果香和花香”糖苷有更好的催化选择性[10],提高了果汁果酒的香气复杂性和特色[11]。因此,将乳酸菌和非酿酒酵母应用于芒果汁的发酵,有望改善发酵芒果汁的香气,进而提高其产品质量。
本研究采用前期优选的2株乳酸菌植物乳杆菌(Lac tobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)和2株非酿酒酵母粘红酵母(Rhodotorula glutinis)、美极梅奇酵母(Metschnikowia pulcherrima)发酵模拟芒果汁,测定菌株在模拟芒果汁中的生长、发酵特性和产香能力,以期为乳酸菌和非酿酒酵母在发酵芒果汁中的组合应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
美极梅奇酵母(Metschnikowiapulcherrima,MP)GDMCC 140157、粘红酵母(Rhodotorula glutinis,RG)GDMCC2.27、植物乳杆菌(Lactobacillus plantarum,LP)GDMCC1.140、干酪乳杆菌(Lactobacillus casei,LC)GDMCC1.159:广东微生物菌种保藏中心。
1.1.2 试剂
β-胡萝卜素(纯度98%)、番茄红素(纯度80%):阿拉丁生化技术有限公司;二氯甲烷、吐温80、葡萄糖、蔗糖、果糖、柠檬酸、苹果酸(均为分析纯):国家标准物质中心。其他试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固(液)体培养基、MRS固(液)体培养基:青岛海博生物科技有限公司。
模拟芒果汁[12-15]:葡萄糖12 g/L、果糖39 g/L、蔗糖77 g/L、柠檬酸5.2 g/L、苹果酸8.8 g/L、β-胡萝卜素40 mg/L、番茄红素40 mg/L,pH调节至4.5,88 ℃巴氏杀菌15 min。
1.2 仪器与设备
T6紫外分光光度计:北京普析通用仪器有限公司;Ageilent1100高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;PerkinElmer TGA8000/SQ8T气相色谱-质谱(gas chromatograph-mass spectrometer,GC-MS)联用仪:广东省中科进出口有限公司。
1.3 方法
1.3.1 菌株活化及种子液制备
非酿酒酵母菌:采用接种环从YPD斜面培养基上挑取非酿酒酵母菌株接种于YPD液体培养基,28 ℃、150 r/min条件下培养24 h制成种子液(106 CFU/mL)。
乳酸菌:采用接种环从MRS斜面培养基上挑取乳酸菌菌株接种于MRS液体培养基中,37 ℃静置培养24 h制成种子液(108 CFU/mL)。
1.3.2 模拟芒果汁发酵
取4株菌株的种子液,以5%(V/V)的接种量接种至模拟芒果汁中,30 ℃、140 r/min条件下发酵72 h,每隔2 h取样,绘制菌株的生长曲线,每隔12 h取样测定pH值、类胡萝卜素降解率,发酵72 h后检测各理化指标及挥发性风味成分。以自然发酵的模拟果汁作空白对照(CK),每个样品重复测定3次。
1.3.3 分析检测
(1)生长曲线的绘制[16]
采用紫外分光光度计测定样品在波长600 nm处的吸光度值,每个样品平行测定3次,以培养时间(x)为横坐标,OD600nm值(y)为纵坐标,绘制各菌株的生长曲线。
(2)pH值的测定
使用pH计测定。
(3)类胡萝卜素降解率[17-20]
测定培养液在波长495 nm处的吸光度值,并计算类胡萝卜素降解率,其计算公式如下:
其中,A1为发酵0 h时的吸光度值,A2为发酵后的吸光度值。
(4)糖含量的测定
参照文献[21]使用HPLC法测定葡萄糖、果糖、蔗糖的含量。
(5)有机酸含量的测定
参照文献[22]使用HPLC法测定苹果酸、柠檬酸、乳酸的含量。
(6)挥发性香气成分的测定
采用顶空固相微萃取法(headspace solid-phase microextraction,HS-SPME)提取香气成分,采用GC-MS法进行检测分析[23-25],并计算气味活度值(odor activity value,OAV),其计算公式如下:
1.3.4 数据处理
采用Excel 2016对试验数据进行整理,采用SPSS 24.0软件进行单因素方差分析(analysis of variance,ANOVA),并对数据进行处理和分析,结果用“平均值±标准差”表示,利用Origin 2019b 64Bit软件绘图,利用R语言绘制热图进行层次聚类分析。
2 结果与分析
2.1 益生菌在模拟芒果汁中的生长曲线
4株菌株在模拟芒果汁中的生长曲线见图1。由图1可知,在模拟芒果汁中,植物乳杆菌和干酪乳杆菌分别经历了4 h和8 h的迟滞期后进入快速生长期,24 h之后几乎同时进入稳定期,说明乳酸菌在模拟芒果汁中生长良好;JIN X等[26]研究发现,乳酸菌在芒果汁体系中的迟滞期为4 h,之后进入快速生长期,可能的原因是芒果汁中的营养物质比模拟芒果汁中的营养物质更加丰富,导致迟滞期较短。由图1亦可知,美极梅奇酵母生长速度更快,没有明显的生长迟滞期,很快进入生长对数期,并在发酵12 h后进入稳定期;粘红酵母经历了约4 h的迟滞期,之后进入快速生长期,14 h后进入稳定期。原苗苗等[27]研究发现,美极梅奇酵母在YPD液体培养基中经历了约6 h的迟滞期后进入快速生长期;王蓉等[28]研究发现,粘红酵母在合成培养基中几乎没有迟滞期,这可能与所用的培养基不同所致。
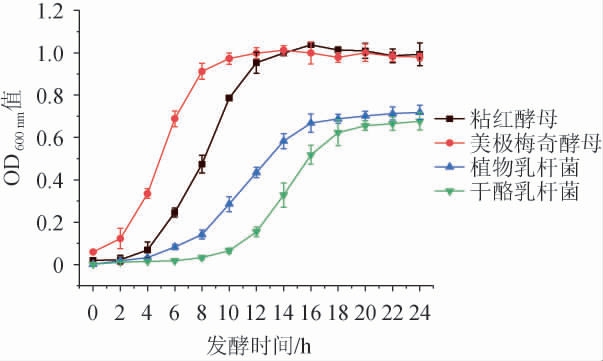
图1 益生菌在模拟芒果汁中的生长曲线
Fig.1 Growth curves of probiotics in simulated mango juice
2.2 益生菌在模拟芒果汁中的发酵特性
2.2.1 pH值的变化
4株益生菌发酵模拟芒果汁过程中pH值的变化见图2。由图2可知,空白对照组pH变化不明显(P>0.05),而非酿酒酵母菌及乳酸菌发酵模拟芒果汁过程中,pH均呈先下降后趋于平缓的趋势,且乳酸菌发酵组下降明显(P<0.05)。发酵72 h时,粘红酵母、美极梅奇酵母、植物乳杆菌和干酪乳杆菌发酵模拟芒果汁的pH值分别降低至4.74、4.65、3.63、3.74,乳酸菌发酵模拟芒果汁pH的快速降低与乳酸菌发酵产生了大量乳酸有关[26]。
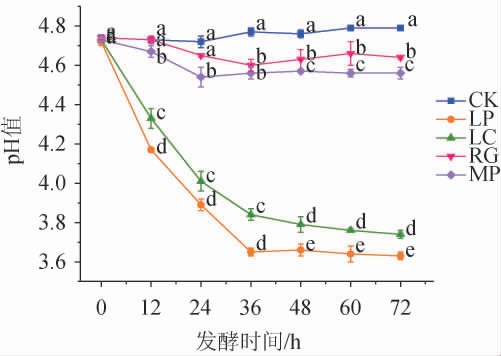
图2 益生菌发酵模拟芒果汁过程中pH值的变化
Fig.2 Changes in pH value during the fermentation of simulated mango juice by probiotics
不同小写字母表示差异显著(P<0.05)。下同。
2.2.2 糖含量的测定结果
4株益生菌发酵模拟芒果汁72 h后,果糖、葡萄糖、蔗糖的含量见图3。由图3可知,发酵72 h后,与空白对照组(68.60 g/L、11.00 g/L、33.20 g/L)相比,植物乳杆菌、干酪乳杆菌、粘红酵母、美极梅奇酵母发酵组的果糖、葡萄糖及蔗糖含量均下降,分别为48.49 g/L、9.00 g/L、17.97 g/L,54.04 g/L、10.81 g/L、23.50 g/L,4.10 g/L、9.16 g/L、14.47 g/L,16.69 g/L、5.19 g/L、10.34 g/L。其中,粘红酵母对果糖的利用率最强(94.02%),美极梅奇酵母对葡萄糖和蔗糖的利用率最强(46.27%;68.86%)。对总糖而言,粘红酵母消耗总糖量最大,总糖含量由112.80 g/L降低至23.73 g/L,总糖利用率为75.42%,其次是美极梅奇酵母,总糖含量降低至32.22 g/L,总糖利用率为71.44%,耗糖最少的为干酪乳杆菌,发酵后总糖含量为88.35 g/L,总糖利用率为21.68%。可见,不同微生物对糖的消耗能力有差异[29-30]。综上,美极梅奇酵母利用葡萄糖和蔗糖的能力优于粘红酵母,粘红酵母对果糖的利用能力更强,两株乳酸菌在模拟芒果汁体系中的糖利用能力较弱。
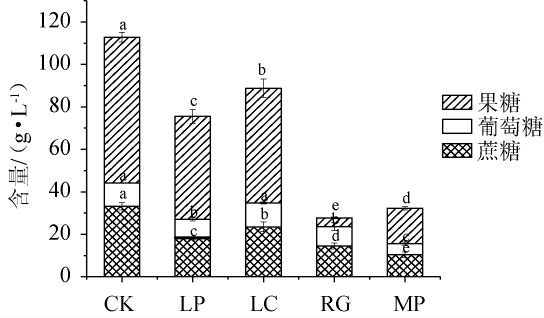
图3 益生菌发酵模拟芒果汁后糖含量的测定结果
Fig.3 Determination results of sugar contents in simulated mango juice after the fermentation by probiotics
2.2.3 有机酸含量的测定结果
4株益生菌发酵模拟芒果汁72 h后,有机酸含量见图4。
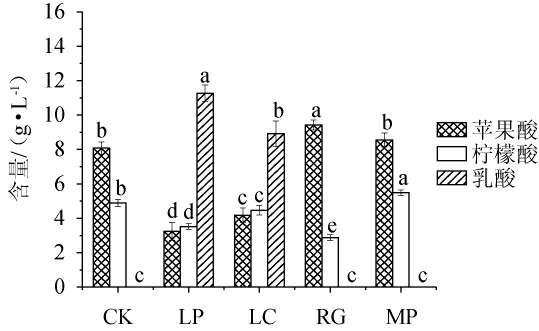
图4 益生菌发酵模拟芒果汁后有机酸含量的测定结果
Fig.4 Determination results of organic acid contents in simulated mango juice after the fermentation by probiotics
由图4可知,发酵72 h后,空白对照组模拟芒果汁中柠檬酸含量为4.89 g/L。与空白对照组相比,植物乳杆菌、干酪乳杆菌和粘红酵母发酵组柠檬酸含量均显著降低(P<0.05),分别为3.52 g/L、4.47 g/L和2.88 g/L;美极梅奇酵母发酵组柠檬酸含量略有增加,为5.49 g/L。发酵72 h后,空白对照组模拟芒果汁中的苹果酸含量为8.08 g/L。与空白对照组相比,植物乳杆菌、干酪乳杆菌发酵组苹果酸含量均显著降低(P<0.05),分别为3.25 g/L、4.18 g/L;粘红酵母和美极梅奇酵母发酵组苹果酸含量略有增加,推测可能是由于益生菌分解糖产生有机酸[31-32]。在空白对照组和两种非酿酒酵母发酵的模拟芒果汁中均未检测到乳酸。植物乳杆菌和干酪乳杆菌在模拟芒果汁中均可产生乳酸,发酵72 h后,乳酸含量分别为11.27 g/L、8.92 g/L。
2.2.4 类胡萝卜素降解率的测定结果
模拟芒果汁经益生菌发酵后类胡萝卜素的降解率见图5。由图5可知,发酵72 h后,空白对照组的类胡萝卜素降解率为13.77%,美极梅奇酵母和粘红酵母发酵组的类胡萝卜素降解率分别为20.27%和17.73%,植物乳杆菌和干酪乳杆菌发酵组的类胡萝卜素降解率分别为21.22%和19.80%。可见,乳酸菌发酵有利于类胡萝卜素的转化,可能与其发酵过程中产生较高含量的有机酸有关[15]。综上,所有菌株均可以降解类胡萝卜素,其中,植物乳杆菌发酵的模拟芒果汁对类胡萝卜素的降解效果最好。
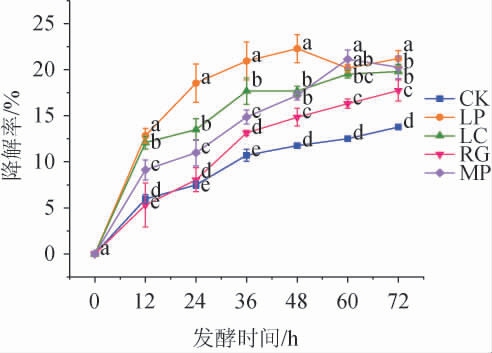
图5 益生菌发酵模拟芒果汁后类胡萝卜素的降解率的测定结果
Fig.5 Determination results of degradation rates of carotenoids in simulated mango juice after the fermentation by probiotics
2.3 益生菌发酵模拟芒果汁挥发性风味成分分析结果
2.3.1 模拟芒果汁发酵后挥发性香气成分分析
采用GC-MS法检测模拟芒果汁样品中的挥发性风味成分,结果见表1。
表1 益生菌发酵模拟芒果汁后挥发性风味成分的测定结果
Table 1 Determination results of aroma components in simulated mango juice after the fermentation by probiotics

续表
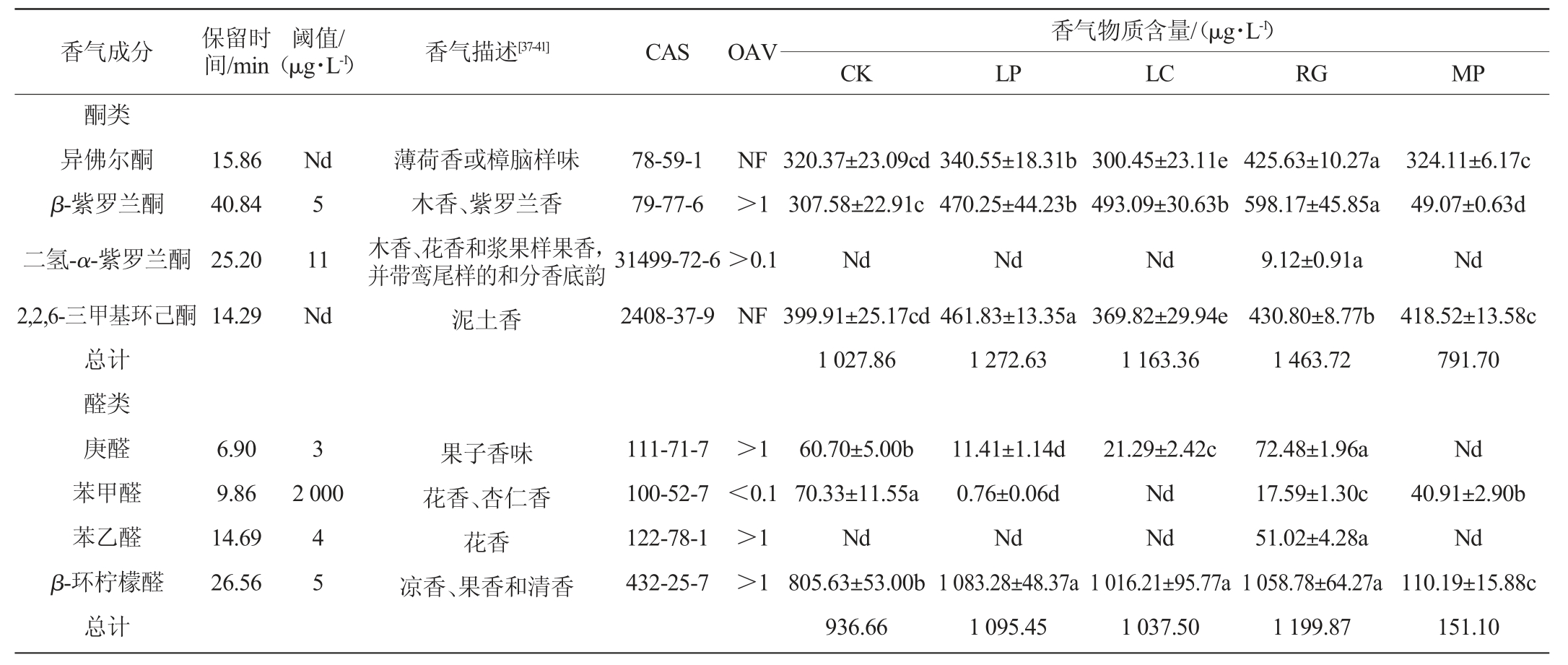
注:同一行不同字母表示差异显著(P<0.05)。“Nd”表示未检出,“NF”表示未检索出。
由表1可知,从5组模拟芒果汁样品中共检测到22种香气成分,包括醇类、酯类、酸类、萜烯类、酮类、醛类等,其中空白对照组检测到16种香气成分,粘红酵母和植物乳杆菌发酵组均检测到19种香气成分,美极梅奇酵母发酵组检测到16种香气成分,干酪乳杆菌发酵组检测到15种香气成分。
醇类物质主要呈清香和青鲜香气[31]。美极梅奇酵母发酵组醇类物质含量(5 308.78 μg/L)显著增加(P<0.05),且苯乙醇含量最高(5 220.82 μg/L),苯乙醇作为主要的芳香醇,具有甜香、玫瑰花香和蜂蜜香,可赋模拟芒果汁以独特的甜香味[19]。植物乳杆菌发酵也显著增加了醇类物质(正辛醇、壬醇、香茅醇)的含量(P<0.05),这与MANDHA J等[33]的研究结果一致。
酮类物质香气持久,贡献花香和果香[34-35]。除美极梅奇酵母发酵组外,植物乳酸菌、干酪乳杆菌和粘红酵母发酵后的模拟芒果汁酮类物质明显增加,分别为1272.63μg/L、1 163.36 μg/L和1 463.72 μg/L。
酯类物质具有甜味和果味[36]。模拟芒果汁中仅检测到2种酯类物质,分别为癸酸乙酯和二氢猕猴桃内酯。其中癸酸乙酯具有果香和酒香香气[37],二氢猕猴桃内酯带有香豆素样香气[38]。4种益生菌发酵模拟芒果汁后,酯类物质含量明显高于空白对照组(55.49 μg/L)。
酸对于新鲜果汁风味是必不可少的,但过量的酸可能会在果汁产生负面的香气[39]。在模拟芒果汁中检测到3种酸类物质,其中苯乙酸最丰富。植物乳杆菌和美极梅奇酵母发酵后,苯乙酸含量明显增加(P<0.05),尽管苯乙酸阈值相对较高(1 000 μg/L),但由于其含量高,对整体风味有很大的影响。
萜烯类物质具有玫瑰和柑橘香气[40]。模拟芒果汁经4种益生菌发酵后,萜烯类物质含量显著增加(P<0.05),且非酿酒酵母发酵组高于乳酸菌发酵组,分析原因可能是萜烯类物质在发酵过程中发生一些氧化反应,生成醇类、酮类等物质[33]。
醛类物质与果实成熟的特征香气密切相关[31]。除美极梅奇酵母发酵组外,植物乳酸菌、干酪乳杆菌和粘红酵母发酵后的模拟芒果汁醛类物质显著增加(P<0.05),其中,β-环柠檬醛化合物含量较高,因其化合物阈值小,对整体风味有很大的影响。
有研究表明,OAV在0.1~1.0之间的香气成分不会直接参与香气的呈现,而可能通过与其他成分的相互作用来促进香气的呈现[41]。因此,选取OAV>0.1时的香气成分进行进一步研究。
2.3.2 基于挥发性风味成分不同模拟芒果汁样品聚类分析
为了更直观地分析不同益生菌发酵的模拟芒果汁中香气物质的差异,基于挥发性风味成分进行聚类分析。结果见图6。
由图6可知,不同样品间存在较大差异。空白对照组模拟芒果汁中的香气物质较少。模拟芒果汁经不同益生菌发酵后,香气成分发生不同变化。植物乳杆菌发酵产生更多的β-环柠檬醛、正辛醇、壬醇、二氢猕猴桃内酯和2,6,6-三甲基环己酮。粘红酵母发酵产生更多的β-紫罗兰酮、庚醛、异佛尔酮、二氢-α-紫罗兰酮、苯乙醛、芳樟醇、3-蒈烯。美极梅奇酵母发酵后,产生的降异戊二烯化合物较少,苯乙醇、癸酸乙酯、苯乙酸和α-萜品烯含量较高。干酪乳杆菌发酵后则产生更多具有青草香味的正庚醇。
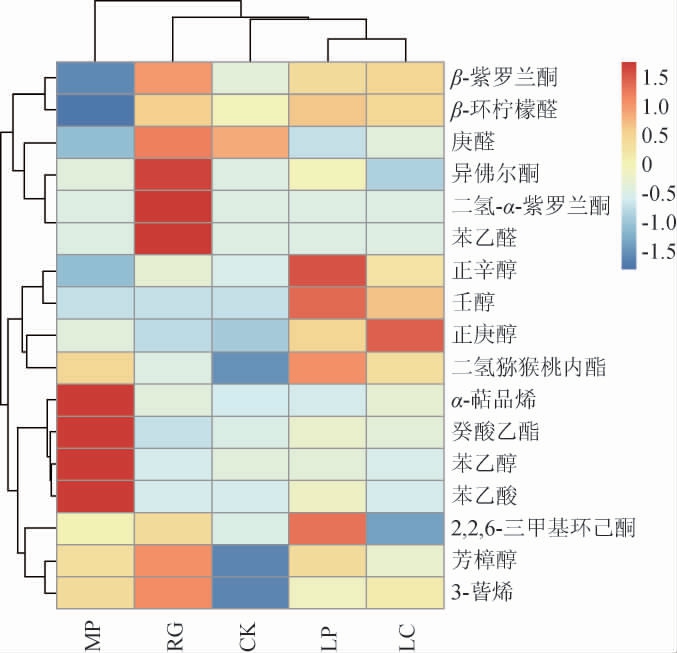
图6 基于挥发性风味成分益生菌发酵模拟芒果汁样品聚类分析结果
Fig.6 Results of cluster analysis of the volatile components in simulated mango juice after the fermentation by probiotics
2.3.3 模拟芒果汁发酵后降异戊二烯类化合物香气成分分析
降异戊二烯类化合物由于感官阈值较低而对果酒果汁香气品质具有重要影响[24],其是类胡萝卜素分解的产物,在果汁发酵产物的香气中起着关键作用。CAI C等[41]研究发现,枯草芽孢杆菌在内源添加类胡萝卜素基础培养基中发酵,提高了降异戊二烯化合物的指数。同样,前期研究发现,益生菌发酵内源添加β-胡萝卜素和番茄红素的模拟芒果汁中发现类似现象,并检测到二氢猕猴桃内酯、异佛尔酮、β-紫罗兰酮、二氢-α-紫罗兰酮、2,2,6-三甲基环己酮、β-环柠檬醛6种降异戊二烯化合物[23]。4株益生菌发酵模拟芒果汁后降异戊二烯类化合物的含量见图7。
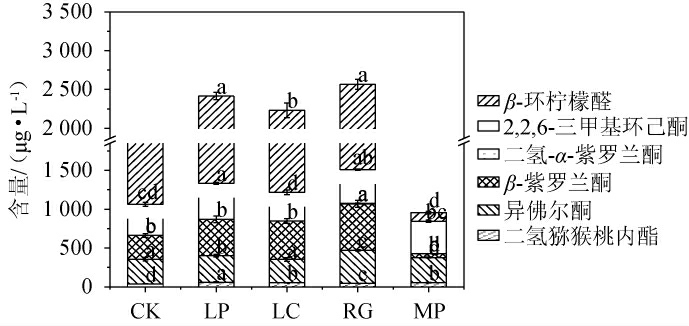
图7 益生菌发酵模拟芒果汁后降异戊二烯类化合物含量的分析结果
Fig.7 Analysis results of norisoprenoids compounds contents in simulated mango juice after the fermentation by probiotics
由图7可知,除美极梅奇酵母发酵组(955.82 μg/L)外,植物乳杆菌、干酪乳杆菌和粘红酵母发酵组中降异戊二烯化合物含量均显著高于空白对照组(1 868.56 μg/L)(P<0.05),分别为2415.72μg/L、2232.63μg/L、2567.51μg/L。结果表明,植物乳杆菌、干酪乳杆菌和粘红酵母3株菌株在模拟芒果汁发酵中可以提高降异戊二烯化合物含量,从而提发酵模拟芒果汁的特征香气质量。降异戊二烯化合物中,β-紫罗兰酮、异佛尔酮和2,2,6-三甲基环己酮是β-胡萝卜素中的C9~C10双键裂解引起的典型降解产物[41,43];β-环柠檬醛是由β-胡萝卜素C7~C8键断裂产生的[42];二氢猕猴桃内脂可能是由类胡萝卜素的初级氧化产物形成的[43];二氢-α-紫罗兰酮为胡萝卜素、油桃和烟草的风味前体,其是由α-紫罗兰酮通过催化加氢反应合成的[44]。
3 结论
该研究选用粘红酵母(Rhodotorula glutinis)、美极梅奇酵母(Metschnikowia pulcherrima)、植物乳杆菌(Lactobacillus plantarum)和干酪乳杆菌(Lactobacillus casei)发酵模拟芒果汁发现,4株益生菌在模拟芒果汁中均能良好生长,乳酸菌的产酸能力较好,且植物乳杆菌产酸能力最强,发酵模拟芒果汁72 h后,pH和有机酸含量分别为3.63、18.04g/L;非酿酒酵母的糖利用能力较好,且粘红酵母的糖利用能力最好,发酵模拟芒果汁72 h后,总糖含量为23.73 g/L;4株益生菌均能降解类胡萝卜素,其中植物乳杆菌的降解率最高,为21.22%;植物乳杆菌和粘红酵母的产香能力较好,从发酵模拟芒果汁中均鉴定出挥发性香气成分19种,且降异戊二烯香气含量较高,分别为2 415.72 μg/L、2 567.51 μg/L。说明4株益生菌均可以用于芒果汁发酵,以提高芒果汁中降异戊二烯类化合物的含量,进而提升芒果汁品质和香气复杂性。
[1]THARANATHAN R N,YASHODA H M,PRABHA T N.Mango(Mangifera indica L.),"The king of fruits"-An overview[J].Food Rev Int,2006,22(2):95-123.
[2]ZHOU L,GUAN Y,BI J,et al.Change of the rheological properties of mango juice by high pressure homogenization[J].LWT-Food Sci Technol,2017,82:121-130.
[3]EL-NEMR S E,ISMAIL I A,ASKAR A,et al.Aroma changes in mango juice during processing and storage[J].Food Chem,1988,30(4):269-275.
[4]LEWINSOHN E,SITRIT Y,BAR E,et al.Not just colors-carotenoid degradation as a link between pigmentation and aroma in tomato and watermelon fruit[J].Trends Food Sci Tech,2005,16(9):407-415.
[5]GENG J,ZHAO L,ZHANG H.Formation mechanism of isoprene compounds degraded from carotenoids during fermentation of goji wine[J].Food Qual Saf-oxford,2021,5(7):1-9.
[6]WOJDYLO A,NOWICKA P,BABELEWSKI P,et al.Phenolic and carotenoid profile of new goji cultivars and their anti-hyperglycemic,antiaging and antioxidant properties[J].J Funct Foods,2018,48:632-642.
[7]FESSARD A,KAPOOR A,PATCHE J,et al.Lactic fermentation as an efficient tool to enhance the antioxidant activity of tropical fruit juices and teas[J].Microorganisms,2017,5(2):23.
[8]MULTARI S,CARAFA I,BARP L,et al.Effects of Lactobacillus spp.on the phytochemical composition of juices from two varieties of Citrus sinensis L.Osbeck:'Tarocco'and 'Washington navel'[J]. LWT-Food Sci Technol,2020,125:109205.
[9]MUNTEAN E.HPLC assessment of carotenoids' stability during lactic acid fermentation of zucchini[J].J Food Sci,2007,1:191-198.
[10]HU K,ZHU X L,MU H,et al.A novel extracellular glycosidase activity from Rhodotorula mucilaginosa:its application potential in wine aroma enhancement[J]. Lett Appl Microbiol,2016,62(2):169-176.
[11]任学梅,姚红红,严幻汝,等.高产糖苷酶非酿酒酵母菌株筛选、鉴定及其在发酵过程中酶活性变化[J].食品科学,2022,4(11):1-13.
[12]王树林.沙棘酒香味前体物β-胡萝卜素降解产香规律及机理研究[D].杨凌:西北农林科技大学,2011.
[13]ZEPKA L Q,GARRUTI D S,SAMPAIO K L,et al.Aroma compounds derived from the thermal degradation of carotenoids in a cashew apple juice model[J].Food Res Int,2014,56:108-114.
[14]WANG S L,JIAO L X,LI Y H,et al.Degradation of β-carotene to volatile compounds in an aqueous model system to simulate the production of sea buckthorn wine[J].Int J Food Prop,2012,15(6):1381-1393.
[15]于奉生,孙志高,方明.β-胡萝卜素模拟体系超声降解机制研究[J].食品与发酵工业,2020,46(11):69-76.
[16]徐晓辉,王莉洁,孙丹,等.万寿菊悬浮培养细胞生产游离叶黄素工艺的研究[J].生物化工,2020,6(2):5-9.
[17]张云金.芒果果实色素与色泽变化规律及调控的研究[D].海南:海南大学,2010.
[18]蒿洪欣,许园园,刘冬,等.降解类胡萝卜素产香细菌的筛选及鉴定[J].食品科学,2014,35(9):152-156.
[19]赵璐,刘建花,张惠玲,等.不同酵母菌在枸杞酒酿造过程中对类胡萝卜素降解的影响[J].食品工业科技,2018,39(14):120-125.
[20]刘亚,李金鹏,齐晓琴,等.枸杞中微生物降解β-胡萝卜素特性研究[J].食品科技,2016,41(11):31-35.
[21]GEORGELIS N,FENCIL K,RICHAEL C M.Validation of a rapid and sensitive HPLC/MS method for measuring sucrose,fructose and glucose in plant tissues[J].Food Chem,2018,262:191-198.
[22]ZHAO J,LI H,XI W,et al.Changes in sugars and organic acids in wolfberry(Lycium barbarum L.)fruit during development and maturation[J].Food Chem,2015,173:718-724.
[23]UENOJO M,PASTORE G M.β-Carotene biotransformation to obtain aroma compounds[J].Food Sci Tech-brazil,2010,30:822-827.
[24]刘晓露,李记明,张葆春,等.不同酿酒酵母对白兰地香气的影响研究[J].中国酿造,2021,40(8):129-133.
[25]BABCOCK T,BORDEN J H,GRIES R,et al.Inter-kingdom signalingsymbiotic yeasts produce semiochemicals that attract their yellowjacket hosts[J].Entomol Exp Appl,2019,167(3):220-230.
[26]JIN X,CHEN W,CHEN H,et al.Comparative evaluation of the antioxidant capacities and organic acid and volatile contents of mango slurries fermented with six different probiotic microorganisms[J]. J Food Sci,2018,83(12):3059-3068.
[27]原苗苗,赵新节,姜凯凯,等.3株非酿酒酵母在模拟葡萄汁中的生长特性与发酵香气[J].食品工业科技,2018,39(9):111-118,123.
[28]王蓉,曹海宁,邓小美.不同碳源对粘性红酵母WP3生长及类胡萝卜素产量的影响[J].中国酿造,2017,36(9):132-136.
[29]徐媛,潘思轶.番茄红素在红葡萄柚汁模拟体系中降解机制研究[J].食品工业科技,2016,23(37):53-66.
[30]刘亚,刘建花,张惠玲,等.枸杞酒发酵主要代谢产物对类胡萝卜素降解的影响[J].食品科学,2017,38(14):36-41.
[31]PENG C T,WEN Y,TAO Y S,et al.Modulating the formation of Meili wine aroma by prefermentative freezing process[J].J Agr Food Chem,2013,61(7):1542-1553.
[32]XU X,BAO Y,WU B,et al.Chemical analysis and flavor properties of blended orange,carrot,apple and Chinese jujube juice fermented by selenium-enriched probiotics[J].Food Chem,2019,289:250-258.
[33]MANDHA J,SHUMOY H,DEVAERE J,et al.Effect of lactic acid fermentation of watermelon juice on its sensory acceptability and volatile compounds[J].Food Chem,2021,358:129809.
[34]ZHU M M,WANG S L,FAN M T,et al.In vitro study of the carotenoidcleavage enzyme from Staphylococcus pasteuri TS-82 revealed substrate specificities and generation of norisoprenoid flavors[J]. Food Sci Biotechnol,2016,25(1):221-227.
[35]BENITO S,HOFMANN T,LAIER M,et al.Effect on quality and composition of Riesling wines fermented by sequential inoculation with non-Saccharomyces and Saccharomyces cerevisiae[J].Eur Food Res Technol,2015,241(5):707-717.
[36]WANG X C,LI A H,DIZY M,et al.Evaluation of aroma enhancement for"Ecolly"dry white wines by mixed inoculation of selected Rhodotorula mucilaginosa and Saccharomyces cerevisiae[J].Food Chem,2017,228:550-559.
[37]SUN N,GAO Z,LI S,et al.Assessment of chemical constitution and aroma properties of kiwi wines obtained from pure and mixed fermentation with Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].J Sci Food Agr,2022,102(1):175-184.
[38]WELKE J E,ZANHUS M,LAZZAROTTO M,et al.Quantitative analysis of headspace volatile compounds using comprehensive two-dimensional gas chromatography and their contribution to the aroma of Chardonnay wine[J].Food Res Int,2014,59:85-99.
[39]刘梦培,李佳,靳学远,等.不同乳酸菌发酵杜仲叶水提液的香气成分分析[J].食品工业科技,2021,42(9):36-43.
[40]张璐,梁锦,黄天姿,等.单一及混合益生菌发酵猕猴桃果汁的香气成分分析[J].食品科学,2021,42(24):213-220.
[41]CAI C,ZHANG M,CHEN H,et al.Enhancement of norisoprenoid and acetoin production for improving the aroma of fermented mango juice by Bacillus subtilis-HNU-B3[J].Process Biochem,2022.
[42]DAY W C,ERDMAN J G.Ionene:a thermal degradation product of β-carotene[J].Science,1963,141(3583):808.
[43]ZOM H,LANGHOFF S,SCHEIBNER M,et al.Cleavage of β,β-carotene to flavor compounds by fungi[J].J Microbiol Biotechnol,2003,62(4):331-336.
[44]RAVICHANDRAN R.Carotenoid composition,distribution and degradation to flavour volatiles during black tea manufacture and the effect of carotenoid supplementation on tea quality and aroma[J]. Food Chem,2002,78(1):23-28.