木质纤维素是由D-葡萄糖通过β-1,4-糖苷键连接的直链多糖,是地球上最丰富的可再生资源[1-3]。木质纤维素在纤维素酶系的协同作用下最终可被降解为葡萄糖:内切葡聚糖酶(EC 3.2.1.4)随机作用于纤维素分子内部的非结晶区产生葡萄糖和短的纤维寡糖;外切葡聚糖酶(EC 3.2.1.91)沿着纤维素非还原末端由外向里水解β-1,4-糖苷键释放纤维寡糖、纤维二糖或葡萄糖;β-葡萄糖苷酶(EC 3.2.1.21)将纤维二糖或其他可溶性的纤维二糖和纤维寡糖水解成葡萄糖分子[4-5],减少这些中间产物对葡聚糖外切酶和葡聚糖内切酶的的抑制,提高纤维素酶系的水解糖化率,在纤维素的降解中起着非常关键的作用[6-10]。
目前,应用的β-葡萄糖苷酶大都产自于真菌[11-12],且对霉菌的研究较多[13]。β-葡萄糖苷酶是一种重要的工业酶,在多种生物转化中发挥重要作用,其被广泛应用于生物燃料[14-15]、造纸工业、纺织工业[16-17]、废弃物和食品的加工[18-20]。微生物所产的β-葡萄糖苷酶热稳定性差、产量低,严重制约了β-葡萄糖苷酶的工业化生产及应用[21-23]。因此,挖掘并纯化耐热的β-葡萄糖苷酶具有重要的意义。
本研究以前期从中国广西原始森林腐木的土壤中筛选得到的1株高产β-葡萄糖苷酶菌株芽枝霉菌(Cladosporium cladosporioides)Lcxs9[24]为研究对象,对其进行固态发酵产β-葡萄糖苷酶,采用硫酸铵沉淀及强阴离子交换柱对其所产β-葡萄糖苷酶进行分离纯化,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)对其分子质量进行检测,并对其酶学性质进行研究,以期为β-葡萄糖苷酶的应用奠定实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
芽枝霉菌(Cladosporium cladosporioides)Lcxs9:分离自广西环江县木论自然保护区原始森林腐木的土壤,保存于微生物及植物资源开发利用广西高校重点实验室。
1.1.2 试剂
蛋白浓度测定试剂盒:上海碧云天生物技术有限公司;蔗渣:宜州博庆制糖有限责任公司;七叶苷、水杨苷(均为分析纯):上海晶纯试剂有限公司;葡萄糖(分析纯):广州化学试剂厂;正丁醇、乙酸乙酯、氨水、三氯化铁、苯胺、丙酮、二苯胺(均为分析纯):国药集团化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):(分析纯):上海如吉生物科技发展有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[25]:称取200 g马铃薯,洗净去皮切碎,加水1 000 mL煮沸30 min,4层纱布过滤,加20 g葡萄糖和15 g琼脂,定容至1 000 mL。121 ℃高压蒸汽灭菌30 min。
固体发酵培养基[26]:蔗渣6 g,麸皮4 g,Mandels营养盐液30 mL,121 ℃高压蒸汽灭菌30 min。
β-葡萄糖苷酶酶活快速检测平板[27]:三氯化铁0.03%,七叶苷0.1%,琼脂1.5%。
1.2 仪器与设备
NGC色谱系统:美国Bio-Rad公司;ZWY-2102型立式全温度恒温摇床:上海智城分析仪器制造有限公司;Infinite M200PRO全波长酶标仪:上海精密科学仪器有限公司;AvantiJE落地式离心机:美国贝克曼库尔特公司;PHS-3B型pH仪:上海精密科学仪器有限公司。
1.3 方法
1.3.1 芽枝霉菌Lcxs9的固体发酵
将芽枝霉菌Lcxs9划线接种于PDA培养基,30 ℃条件下活化培养3 d。芽枝霉菌Lcxs9 PDA斜面菌种用10 mL生理盐水洗下制成孢子悬液(108 CFU/mL),按10%的接种量将孢子悬液接种于固体发酵培养基中,每天翻动两次,30 ℃培养4 d。
1.3.2 β-葡萄糖苷酶酶活的测定
(1)DNS法
粗酶液的制备:培养物中加入200 mL无菌双蒸水(ddH2O),40 ℃恒温水浴1 h,四层纱布过滤,6 000 r/min离心10 min,取上清液,得到粗酶液[26]。
β-葡萄糖苷酶酶活的测定[27]:反应体系中添加0.05 mL适当浓度的酶液和1mL 1%水杨苷溶液底物(采用0.02 mol/L pH4.8的柠檬酸-柠檬酸钠缓冲液配制)混匀,60 ℃条件下反应30 min,添加3 mL DNS试剂终止反应,沸水浴6 min后冷水浴,采用紫外分光光度计在波长540 nm处测定吸光度值。
β-葡萄糖苷酶酶活的定义[27]:每分钟产生1 μmol葡萄糖的酶量为1个酶活单位(U)。
(2)快速检测法[28]
取200 μL粗酶液点于β-葡萄糖苷酶酶活快速检测平板上,如果产生黑色沉淀点,说明具有β-葡萄糖苷酶酶活性。
1.3.3 可溶性总蛋白含量的测定方法
使用蛋白浓度测定试剂盒测定可溶性总蛋白质含量。
1.3.4 β-葡萄糖苷酶的纯化
盐析[29]:取7份粗酶液,每份100 mL,分别用相对饱和度为30%~90%(以10%的梯度递增)的硫酸铵进行沉淀,沉淀后于4 ℃条件下静置12 h过夜。盐析过夜后的酶液以8 000 r/min、4 ℃条件离心20 min,收集沉淀,并用pH 4.8的柠檬酸缓冲溶液溶解沉淀,并补足至原体积的1/5。
脱盐:采用Sephadex G-25凝胶柱快速脱盐,采用快速检测法测定β-葡萄糖苷酶酶活,依据酶活确定最佳硫酸铵纯化盐析区间,初步纯化酶产物4 ℃保存。
阴离子交换层析[30-31]:采用MonoQ10/100GL强阴离子交换层析柱,利用BioLogic Duo-Flow蛋白质纯化仪对初步纯化的酶进行进一步纯化,具体条件:Bio-压力530 psi,以pH 8.3的0.01 mol/L Tris-HCl为起始缓冲液,以含1 mol/L NaCl的pH为8.3的0.01 mol/L Tris-HCl为洗脱缓冲液,流速1 mL/min,0~0.3 mol/L NaCl线性梯度洗脱分离蛋白质,每管收集0.5 mL,纯化酶4 ℃保存。采用DNS法测定β-葡萄糖苷酶酶活,采用SDS-PAGE[32]法检测蛋白质的分子质量及纯度。
1.3.5 β-葡萄糖苷酶水解活性及转苷活性的测定
取10 mL 1%纤维二糖(采用0.02 mol/L pH 4.8的柠檬酸缓冲液配制),按体积比100∶1加入纯化后的酶液,30 ℃反应3 h,采用薄层层析法(thin layer chromatography,TLC)检测水解产物[33-34]。
1.3.6 β-葡萄糖苷酶酶学性质测定
(1)最适pH及pH稳定性
将β-葡萄糖苷酶与pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的缓冲液混合,在最适温度条件下测定酶活,并计算相对酶活力,确定β-葡萄糖苷酶的最适pH值。
将β-葡萄糖苷酶置于pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的缓冲液中,于4 ℃放置24 h后,30 ℃保持3 h,在最适pH值和最适温度下测定酶活,并计算相对酶活力,研究pH对β-葡萄糖苷酶稳定性的影响。
(2)最适温度及温度稳定性
采用最适pH的缓冲液溶解β-葡萄糖苷酶,分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃条件下测定酶活,并计算相对酶活力,确定β-葡萄糖苷酶的最适作用温度。
将β-葡萄糖苷酶分别置于30℃、40℃、50℃、60℃、70℃、80 ℃、90 ℃条件下恒温水浴保持60 min后,在最适pH和最适温度下测定酶活,并计算相对酶活力,研究温度对β-葡萄糖苷酶稳定性的影响。
(3)金属离子
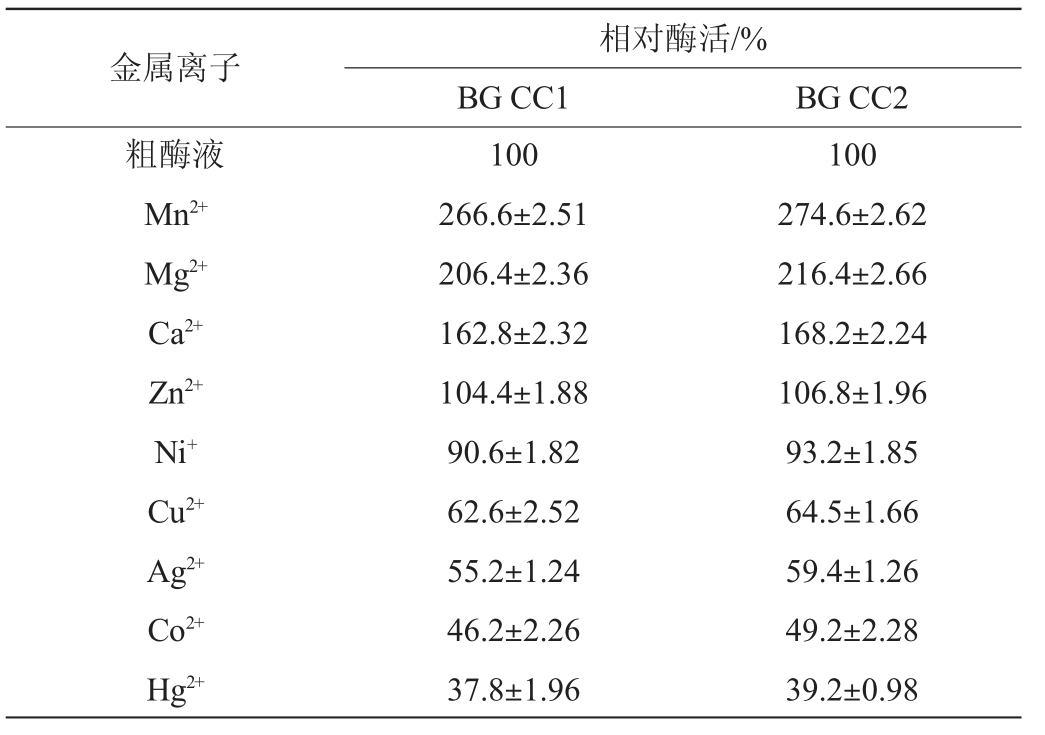
纯化酶液中添加不同的金属离子Mn2+、Mg2+、Ca2+、Zn2+、Ni+、Cu2+、Ag2+、Co2+、Hg2+,使终浓度为2 mmol/L,测定酶活,并计算相对酶活,研究不同金属离子对β-葡萄糖苷酶活性的影响。
相对酶活的定义:以粗酶液酶活为100%,其他条件下的酶活性与粗酶液酶活性的比值为相对酶活。
酶促反应动力学参数的测定[35]:以4-硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,pNPG)为底物,在pH4.8、30 ℃条件下测定酶活力,计算出相应的初始反应速度,利用双倒数作图法求得β-葡萄糖苷酶的米氏常数(Km)值和最大酶反应速率(Vmax)。
2 结果与分析
2.1 芽枝霉菌Lcxs9 β-葡萄糖苷酶的纯化
通过不同相对饱和度(30%~90%)的硫酸铵盐析后,测定β-葡萄糖苷酶酶活和可溶性蛋白含量,结果发现,当硫酸铵相对饱和度为70%时,β-葡萄糖苷酶酶活和可溶性蛋白含量最高。在此基础上,进一步采用MonoQ10/100GL强阴离子交换层析柱纯化β-葡萄糖苷酶,得到两个具有β-葡萄糖苷酶酶活的洗脱成分,分别编号为BG CC1、BG CC2,其酶活力和纯化情况见表1。
表1 芽枝霉菌Lcxs9产β-葡萄糖苷酶纯化过程
Table 1 Purification process of β-glucosidase produced by Cladosporium cladosporioides Lcxs9
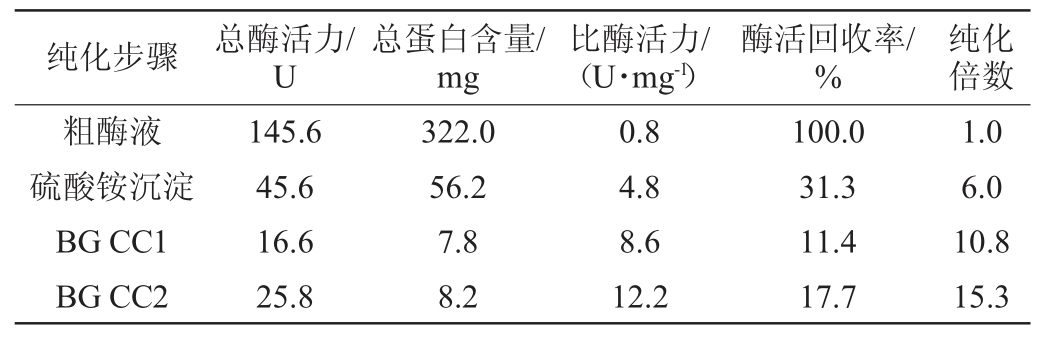
由表1可知,β-葡萄糖苷酶BG CC1和BG CC2的比酶活力分别为6.6 U/mg和12.2 U/mg,纯化回收率分别为11.4%和17.7%,纯化倍数分别为10.8和15.3。采用SDS-PAGE对β-葡萄糖苷酶BG CC1和BG CC2的纯度和分子质量进行测定,结果见图1。
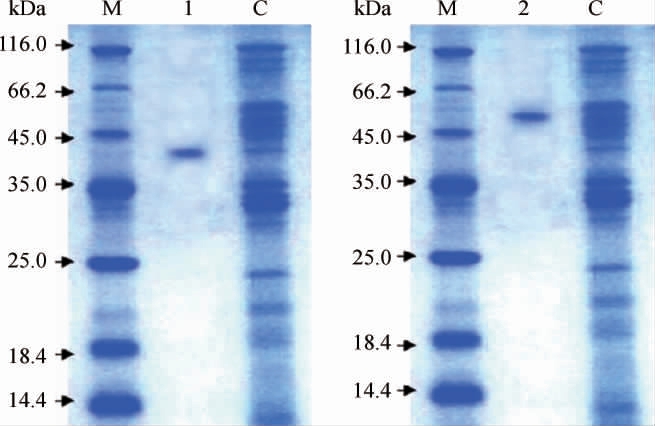
图1 β-葡萄糖苷酶SDS-PAGE检测结果
Fig.1 SDS-PAGE detection results of β-glucosidase
M为蛋白Marker,1为BG CC1,2为BG CC2,C为发酵原液。
由图1可知,β-葡萄糖苷酶BG CC1和BG CC2的分子质量分别为41 kDa和53 kDa,条带单一。
2.2 β-葡萄糖苷酶的水解活性及转苷活性
以1%纤维二糖为底物,β-葡萄糖苷酶BG CC1和BG CC2的水解活性及转苷活性见图2。由图2可知,β-葡萄糖苷酶BG CC1和BG CC2均具有水解活性,可以水解纤维二糖得到葡萄糖;同时具有转苷活性,可以利用低分子质量的单糖合成纤维三糖和纤维四糖。

图2 β-葡萄糖苷酶水解性质和转苷活性测定结果
Fig.2 Determination results of hydrolysis properties and transglycosidation activity of β-glucosidase
1为四种糖(G:葡萄糖、C2:纤维二糖、C3:纤维三糖、C4:纤维四糖)混合标样;2为葡萄糖标样;3为纤维二糖标样;4为纤维二糖+BG CC1;5为纤维二糖+BG CC2。
2.3 β-葡萄糖苷酶酶学性质测定结果
2.3.1 β-葡萄糖苷酶最适反应pH和pH稳定性实验
β-葡萄糖苷酶BG CC1和BG CC2的最适反应pH和pH稳定性试验结果见图3。由图3A可知,在30 ℃条件下,随着pH值的升高,β-葡萄糖苷酶BG CC1和BG CC2的酶活均呈先升高后下降的趋势,当pH为6.0时,两种β-葡萄糖苷酶的酶活均最高,因此,确定两个β-葡萄糖苷酶的最适反应pH值为6.0。由图3B可知,两种β-葡萄糖苷酶均在pH 3.0~12.0范围内较稳定,相对酶活均>40%。CHRISTAKOPOULOS P等[36]研究发现,尖孢镰刀菌(Fusarium oxysporum)所产的β-葡萄糖苷酶的最适pH为4.5;MATSUMOTO K等[37]研究发现,串珠镰刀菌(Fusarium moniliforme)所产的β-葡萄糖苷酶在pH 4.0~11.0范围内较稳定。芽枝霉菌Lcxs9所产的β-葡萄糖苷酶有较宽的pH耐受范围,说明具有更大的应用潜力。
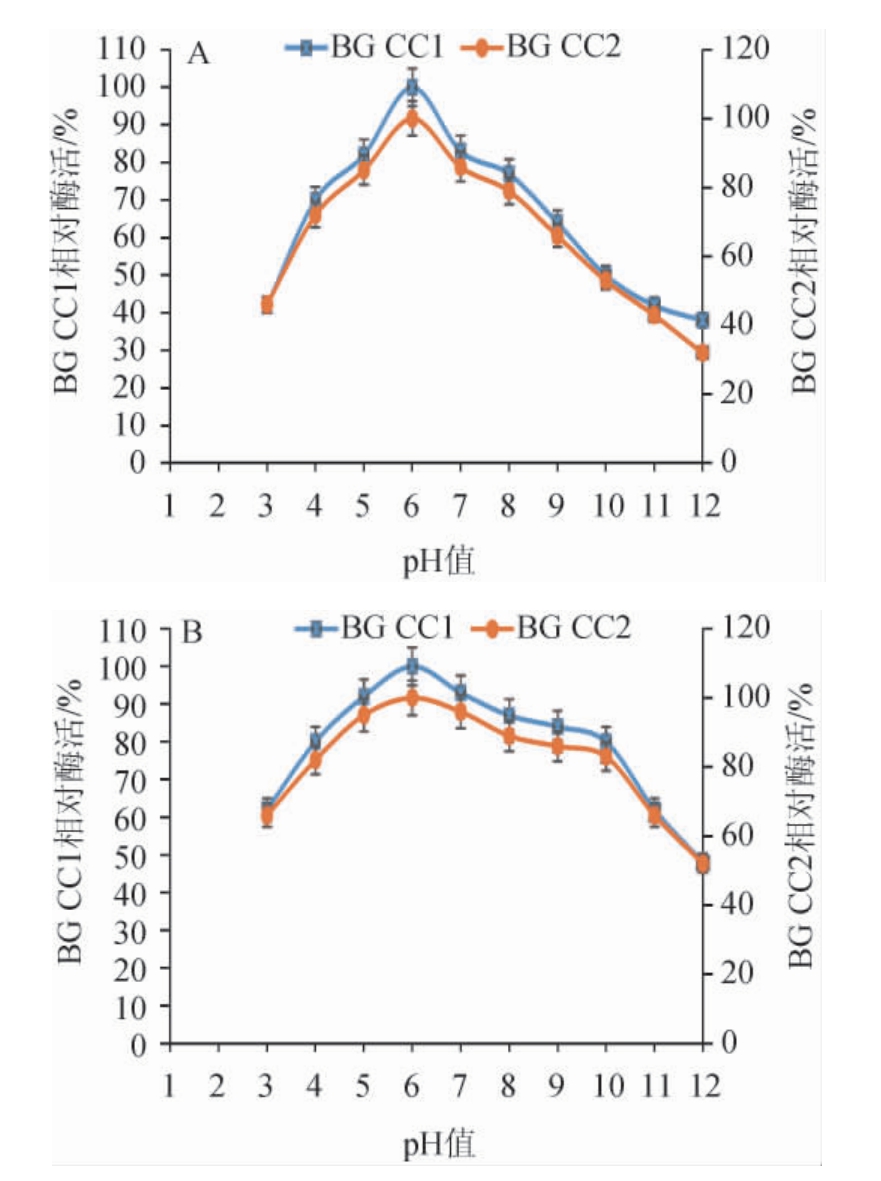
图3 β-葡萄糖苷酶BG CC1和BG CC2的最适pH(A)和pH稳定性(B)
Fig.3 Optimum pH (A) and pH stability (B) of β-glucosidase BG CC1 and BG CC2
2.3.2 β-葡萄糖苷酶的最适反应温度和热稳定性
β-葡萄糖苷酶BG CC1和BG CC2的最适反应温度和热稳定性试验结果见图4。由图4A可知,在最适pH6.0时,随着反应温度的升高,β-葡萄糖苷酶BG CC1和BG CC2的酶活呈先升高后下降的趋势,当反应温度为60 ℃时,β-葡萄糖苷酶BG CC1和BG CC2的酶活力最高,因此,确定两种β-葡萄糖苷酶的最适反应温度均为60 ℃。由图4B可知,两种β-葡萄糖苷酶均在20~80 ℃范围内稳定性较好,相对酶活均>50%。
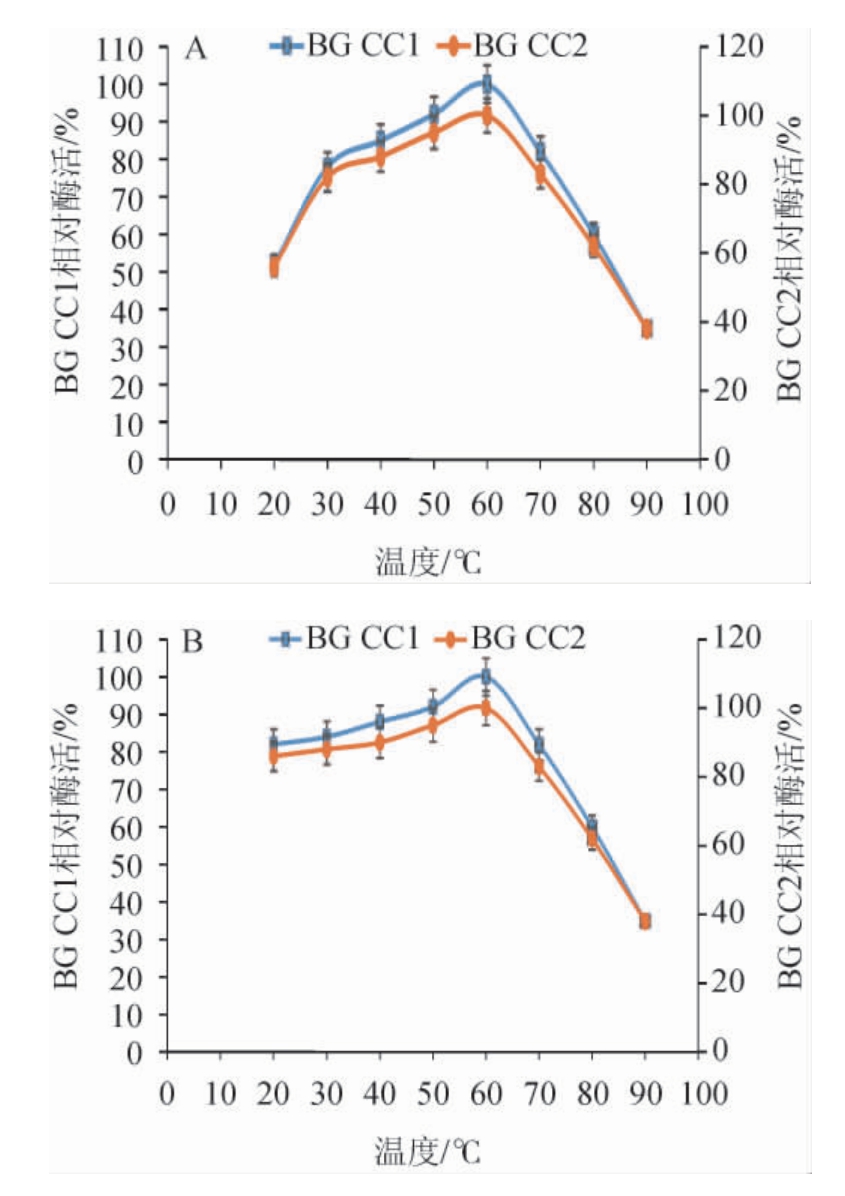
图4 β-葡萄糖苷酶的最适温度(A)和热稳定性(B)
Fig.4 Optimum temperature (A) and thermostability (B) of β-glucosidase
CHAN C S等[38]分离纯化得到的β-葡萄糖苷酶DT-Bgl的最适作用温度为70℃,可用于开发木质纤维素生物质有效糖化的生物工艺;LIEW K J等[16]从Jeotgalibacillus malaysiensis中分离纯化获得一种新的β-葡萄糖苷酶BglD5(GH1),其在65 ℃条件下稳定;TIWARI R等[22]研究发现,枯草芽孢杆菌(Bacillus subtilis)产的β-葡萄糖苷酶RA10在80 ℃条件下稳定,热稳定性β-葡萄糖苷酶有助于纤维素生物质有效糖化为可发酵糖;XIA W等[23]研究发现,热稳定性好的纤维素酶(60 ℃时保持稳定)水解纤维素糖化效率显著提高。芽枝霉菌Lcxs9所产的β-葡萄糖苷酶的最适反应温度为60 ℃,在20~80 ℃范围内稳定性较好,说明具有更大的应用潜力。
2.3.3 金属离子对β-葡萄糖苷酶的影响
金属离子在酶的催化反应中常作为活化剂或抑制剂[39-40],不同金属离子对β-葡萄糖苷酶BG CC1和BG CC2活力的影响见表2。由表2可知,Zn2+和Ni+对两种β-葡萄糖苷酶均无明显影响,Cu2+、Ag2+、Co2+、Hg2+对两种β-葡萄糖苷酶均有强烈的抑制作用,而Mn2+、Ca2+和Mg2+对两种β-葡萄糖苷酶均具有激活作用,分析原因可能是这些金属离子在低浓度下可以稳定酶的三级结构,并有助于酶活力中心与底物的亲和与结合催化过程,金属离子通过结合酶的活性中心从而影响酶的构象和活性[39-40]。
表2 金属离子对β-葡萄糖苷酶酶活的影响
Table 2 Effect of metal ions on the enzyme activity of β-glucosidase
2.3.4 β-葡萄糖苷酶动力学实验结果
利用pNPG为底物,测得芽枝霉菌Lcxs9所产两种β-葡萄糖苷酶的米氏常数Km均为2.76 mg/mL,最大反应速率(Vmax)均为20.6 U/mg。
3 结论
采用硫酸铵沉淀及强阴离子交换柱从芽枝霉菌Lcxs9固态发酵产物中分离纯化得到两种β-葡萄糖苷酶,分别命名为BG CC1和BG CC2,通过SDS-PAGE检测,其分子质量分别为41 kDa、53 kDa,比酶活力分别为8.6 U/mg、12.2 U/mg。两种酶都具有水解活性,可以水解纤维二糖得到葡萄糖;同时具有转苷活性,可以利用低分子质量的单糖合成纤维三糖和纤维四糖。两种酶的最适作用pH及温度均分别为6.0、60 ℃,均在pH 4~10和20~80 ℃条件下较稳定,Ag2+、Co2+、Cu2+、Hg2+对两种酶均有抑制作用,而Mn2+、Ca2+和Mg2+均有明显的激活作用,Zn2+和Ni+无明显影响。利用4-硝基苯基-β-D-吡喃葡萄糖苷(pNPG)为底物,两种酶的动力学常数Km和最大反应速率(Vmax)均分别为2.76 mg/mL、20.6 U/mg。本研究首次报道芽枝霉菌Lcxs9可以利用甘蔗蔗渣为碳源固态发酵产耐高温的β-葡萄糖苷酶。
[1]CHANDRASEKAR K,KUMAR A N,KUMAR G,et al.Electro-fermentation for biofuels and biochemicals production:Current status and future directions[J].Bioresource Technol,2021,323:124598.
[2]MIKULSKI D,KLOSOWKI G.Hydrotropic pretreatment on distillery stillage for efficient cellulosic ethanol production[J]. Bioresource Technol,2020,300:122661.
[3]ZALDIVAR J,NIELSEN J,OLSSONL L.Fuel ethanol production from lignocellulose:a challenge for metabolic engineering and process integration[J].Appl Microbiol Biotechnol,2001,56:17-34.
[4]FAN L H,ZHANG Z J,MEI S,et al.Engineering yeast with bifunctional minicellulosome and cellodextrin pathway for coutilization of cellulosemixed sugars[J].Biotechnol Biofuels,2016,9:137.
[5]HAQ I U,NAWAZ A,LIAQAT B,et al.Pilot scale elimination of phenolic cellulase inhibitors from alkali pretreated wheat straw for improved cellulolytic digestibility to fermentable saccharides[J].Front Bioeng Biotechnol,2021,9:658159.
[6]QUARANTIN A,CASTIGLIONI C,SCHÄFER W,et al.The Fusarium graminearum cerato-platanins loosen cellulose substrates enhancing fungal cellulase activity as expansin-like proteins[J]. Plant Physiol Biochem,2019,139:229-238.
[7]ZHOU Z,JU X,CHEN J J,et al.Charge-oriented strategies of tunable substrate affinity based on cellulase and biomass for improving in situ saccharification:A review[J].Bioresource Technol,2021,319:124159.
[8]ARA JO E A,DIAS A H S,KADOWAKI M A S,et al.Impact of cellulose properties on enzymatic degradation by bacterial GH48 enzymes:Structural and mechanistic insights from processive Bacillus licheniformis Cel48B cellulase[J].Carbohydr Polym,2021,264:118059.
JO E A,DIAS A H S,KADOWAKI M A S,et al.Impact of cellulose properties on enzymatic degradation by bacterial GH48 enzymes:Structural and mechanistic insights from processive Bacillus licheniformis Cel48B cellulase[J].Carbohydr Polym,2021,264:118059.
[9]AICH S,DATTA S.Engineering of a highly thermostable endoglucanase from the GH7 family of Bipolaris sorokiniana for higher catalytic efficiency[J].Appl Microbiol Biotechnol,2020,104(9):3935-3945.
[10]HIRASAWA H,SHIOYA K,MORI K,et al.Cellulase productivity of Trichoderma reesei mutants developed in Japan varies with varying pH conditions[J].J Biosci Bioeng,2019,128(3):264-273.
[11]梁金凤,汪涯,肖依文,等.内生真菌Eupenicillium javanicum R57水解京尼平苷β-葡萄糖苷酶的分离纯化及其酶学性质[J].菌物学报,2017,36(11):1543-1555.
[12]邢雪岩.丝状真菌来源β-葡萄糖苷酶的高效表达与酶学性质分析[D].天津:天津科技大学,2017.
[13]郭金玲,陈程鹏,周一郎,等.黑曲霉β-葡萄糖苷酶的分离纯化及酶学性质研究[J].中国酿造,2021,40(2):83-87.
[14]BOHUTSKYI P,PHAN D,KOPACHEVSKY A M,et al.Synergistic codigestion of wastewater grown algae-bacteria polyculture biomass and cellulose to optimize carbon-to-nitrogen ratio and application of kinetic models to predict anaerobic digestion energy balance[J]. Bioresource Technol,2018,269:210-220.
[15]GOMES D G,SERNA-LOAIZA S,CARDONA C A,et al.Insights into the economic viability of cellulases recycling on bioethanol production from recycled paper sludge[J]. Bioresource Technol,2018,267:347-355.
[16]LIEW K J,LIM L,WOO H Y,et al.Purification and characterization of a novel GH1 beta-glucosidase from Jeotgalibacillus malaysiensis[J].Int J Biol Macromol,2018,115:1094-1102.
[17]LI Y,GAO N,ZHANG X Y,et al.Sophorolipid production using lignocellulosic biomass by co-culture of several recombinant strains of Starmerella bombicola with different heterologous cellulase genes from Penicillum oxalicum[J].Appl Biochem Biotechnol,2021,193(2):377-388.
[18]SINGH N,MATHUR A S,GUPTA R P,et al.Enhanced cellulosic ethanol production via consolidated bioprocessing by Clostridium thermocellum ATCC 31924[J].Bioresource Technol,2018,250:860-867.
[19]XU Y H,ZHOU Q,LI M F,et al.Tetrahydro-2-furanmethanol pretreatment of eucalyptus to enhance cellulose enzymatic hydrolysis and to produce high-quality lignin[J].Bioresource Technol,2019,280:489-492.
[20]YANG G,YANG D Q,WANG X D,et al.A novel thermostable cellulaseproducing Bacillus licheniformis A5 acts synergistically with Bacillus subtilis B2 to improve degradation of Chinese distillers' grains[J].Bioresource Technol,2021,325:124729.
[21]FUSCO F A,FIORENTINO G,PEDONE E,et al.Biochemical characterization of a novel thermostable β-glucosidase from Dictyoglomus turgidum[J].Int J Biol Macromol,2018,113:783-791.
[22]TIWARI R,SINGH P K,SINGH S,et al.Bioprospecting of novel thermostable β-glucosidase from Bacillus subtilis RA10 and its application in biomass hydrolysis[J].Biotechnol Biofuels,2017,10:246.
[23]XIA W,XU X X,QIAN L C,et al.Engineering a highly active thermophilic β-glucosidase to enhance its pH stability and saccharification performance[J].Biotechnol Biofuels,2016,9:147.
[24]覃拥灵,何海燕,刘园园,等.产β-葡萄糖苷酶野生真菌的筛选鉴定及酶学性质研究[J].中国酿造,2012,31(3):53-57.
[25]沈萍,陈向东(主编).微生物学实验[M].第四版,北京:高等教育出版社,2007:241-244.
[26]QIN Y L,HE H Y,LI N,et al.Isolation of a thermostable cellulase-producing Fusarium chlamydosporum and characterization of the cellulolytic enzymes[J].World J Microb Biot,2010,26(11):1991-1997.
[27]SHOEMAKER S P,BROWN R D.Characterization of endo-1,4-beta-Dglucanases purified from Trichoderma virid[J].Biochim Biophys Acta,1978,523:147-161.
[28]KWON K S,LEE J,KANG H G,et al.Detection of β-glucosidase activity in polyacrylamide gels with esculin as substrate[J]. Appl Environ Microbiol,1994,12:4584-4458.
[29]郭蔼光,郭泽坤(主编).生物化学实验技术[M].北京:高等教育出版社,2007:62-64.
[30]QIN Y L,FU Y,LI Q Q,et al.Purification and enzymatic properties of a difunctional glycoside hydrolase from Aspergillus oryzae HML366[J].Indian J Microbiol,2020,60:475-484.
[31]QIN Y L,LI Q Q,LUO F F,et al.One-step purification of two novel hermotolerant β-1,4-glucosidases from a newly isolated strain of Fusarium chlamydosporum ML278 and their characterization[J].AMB Expr,2020,10:182.
[32]PAULA R G D,ANTONIEˇTO A C C,CARRARO C B,et al.The duality of the MAPK signaling pathway in the control of metabolic processes and cellulase production in Trichoderma reesei[J].Sci Rep,2018,8:14931.
[33]IBRAHIM A M,HAMOUDA R A,El-NAGGAR N E A,et al.Bioprocess development for enhanced endoglucanase production by newly isolated bacteria,purification,characterization and in-vitro efficacy as antibiofilm of Pseudomonas aeruginosa[J].Sci Rep,2021,11(1):9754.
[34]QIN Y L,ZHANG Y K,HE H Y,et al.Screening and identification of a fungal β-glucosidase and the enzymatic synthesis of gentiooligosaccharide[J].Appl Biochem Biotechnol,2011,163:1012-1019.
[35]LINEWEAVER H,BURK D.The determination of enzyme dissociation constants[J].J Am Chem Soc,1934,56:658-666.
[36]CHRISTAKOPOULOS P,KEKOS D,MACRIS B J,et al.Purification and characterization of a less randomly acting endo-1,4-beta-D-glucanase from the culture filtrates of Fusarium oxysporum[J]. Arch Biochem Biophys,1995,316(1):428-433.
[37]MATSUMOTO K,ENDO Y,TAMIYA N,et al.Studies on cellulase produced by the phytopathogens:purification and enzymatic properties of cellulase of Fusarium moniliforme[J].J Biochem,1974,76(3):563-572.
[38]CHAN C S,SIN L L,CHAN K G,et al.Characterization of a glucosetolerant β-glucosidase from Anoxybacillus sp.DT3-1[J]. Biotechnol Biofuels,2016,9:174.
[39]TEMEL Y,KOCYIGIT U M.Purification of glucose-6-phosphate dehydrogenase from rat (Rattus norvegicus) erythrocytes and inhibition effects of some metal ions on enzyme activity[J].J Biochem Mol Toxicol,2017,31(9):e21927.
[40]PAN Q,WANG J,GAO Y L,et al.Identification of two novel fowl adenovirus C-specific B cell epitopes using monoclonal Antibodies against the capsid hexon protein[J]. Appl Microbiol Biotechnol,2018,102:9243-9253.