特香型白酒主体香为清香带浓香,细闻有焦糊香,浓、清、酱香型白酒特征兼而有之,但又不接近哪一种香型。“曲为酒之骨”,酒曲作为酿酒生产中的一种糖化剂、发酵剂与生香剂,在发酵过程中起着至关重要的作用,故有“有美酒必备佳曲”之说[1]。在酿酒生产过程中,酒曲在提高出酒率、降低粮耗、增加优质品率、保持香型稳定等方面有着重要的作用[2]。不同类型的酒曲能生产不同类型的酒。酒曲微生物是发酵产酒的本质原因,所以只要了解酒曲中微生物的习性与作用,就能够对改善酒曲品质以及出酒的质量起到指导生产的作用。
国内有关酒曲的相关研究较多,但有关特香型酒曲霉菌控制则相对少见。刘效毅等[3]通过分子生物学对高温大曲中的微生物进行序列分析,鉴定得到大曲中细菌主要是芽孢杆菌、放线菌、葡萄球菌、微球菌;霉菌主要是青霉、曲霉、毛霉、交链孢霉、茎点霉菌、球毛壳、散囊菌、红曲霉。酒曲中霉菌的生长伴随着大曲生产的整个环节,特香型大曲中霉菌类群占一定比例,数量能达到104 CFU/g,主要是毛霉、青霉和曲霉[4-5]。霉菌能够产生分解淀粉和蛋白质的酶,不同种类的霉菌能够产生不同种类的酶,在不同的发酵条件下产生的酶种类与作用都不尽相同,其主要功能是分泌糖化酶、液化酶及蛋白酶,对分解酿酒原料中的淀粉、蛋白质等大分子物质具有积极的推动作用,使得整个反应体系中糖类及氨基酸含量升高,可为其他微生物的代谢提供基础物质,亦为后续的酒体风味形成奠定基础[6-8]。霉菌的主要来源为空气、场地、原辅料、母曲及人体[9]。随着白酒工艺的日渐发展,消费群体层次的改变,白酒行业也在不断进行着改革创新,人们对白酒的品质要求也日渐提高。特香型酒曲的贮藏期在3~6个月不等[10],如何保证酒曲在贮藏期的品质质量现已成为了各个酒厂的关键问题。酒曲在贮藏期最常见的质量问题就是长霉,适量的霉菌在酒曲中有加强风味、提高酒曲质量的作用[11]。但是霉菌过多则会使得酒曲出现霉变结块、有杂质、风味不纯等问题。如若使用了这些霉变酒曲酿酒会使酒体带有邪杂味,色泽与醇厚感也会大打折扣,还对人体健康有很大的威胁[12]。
本研究以江西某企业提供的不同质量特香型酒曲为原料,测定了霉菌二次生长大曲的理化指标,并对毛霉的理化性质、对酵母产酒精能力的影响进行分析,为后续特香型大曲的防霉抑霉工作提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验样品
同一批次霉菌二次生长曲样(霉心曲块、霉曲整块)与正常曲样(好曲整块)若干:江西某特香型酒企提供;米根霉(Rhizopus oryzae)1号、酿酒酵母(Saccharomyces cerevisiae):保存于中南林业科技大学食品科学与工程学院。
1.1.2 化学试剂
葡萄糖、氢氧化钠、盐酸、可溶性淀粉、碘、碘化钾、DL5 000 Marker(均为分析纯或生化试剂):国药集团化学试剂有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
A:马铃薯葡萄糖培养基(potato dextrose agar,PDA):200 g马铃薯,20 g葡萄糖,17 g琼脂,1 000 mL蒸馏水。115 ℃灭菌20 min。
B:PDA+大曲浸出汁(10%):200 g马铃薯,20 g葡萄糖,17 g琼脂,900 mL蒸馏水,100 mL大曲浸出汁。
大曲浸出汁液(10%):将100 g正常曲样捣碎,加900 mL水,振荡1 h,过滤,弃去滤渣,收集大曲浸出汁。115 ℃灭菌20 min。
1.2 仪器与设备
AC2-2E8超净工作台:新加坡艺思高科技有限公司;YXQ-50A立式高压灭菌锅:上海博讯实业有限公司医疗设备厂;MIR-150A恒温培养箱:上海三腾仪器有限公司;YCW-160B摇床:上海捷呈实验仪器有限公司;3730XL测序仪、2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;Legend Micro17离心机:Thermo公司;JY300C电泳仪、JYDF电泳槽、JY04S-3C凝胶成像仪:北京君意东方电泳设备有限公司;DFD-700水浴锅:北京中兴伟业仪器有限公司。
1.3 实验方法
1.3.1 酒曲样品菌群分析方法
内部转录间隔区核糖体脱氧核糖核酸(internal transcribed spacer ribosomal deoxyribonucleic acid,ITS rDNA)扩增子测序,是通过特异性引物扩增样本中原核生物ITSrDNA的可变区,构建高通量测序文库并对ITS rDNA可变区序列进行分析,从而鉴定环境中原核微生物的组成与丰度的方法。ITS rDNA扩增子测序的实验流程包括样本基因组DNA的提取与质检、ITS rDNA可变区扩增与测序文库构建、高通量测序等多个步骤,该部分操作委托苏州金唯智公司进行测试,将所有优化后的序列与物种操作单元(operational taxonomic units,OTU)代表序列进行比对,与OTU代表序列相似性在97%以上的序列为同一OTU,统计生成OTU丰度表。
1.3.2 特香型大曲理化指标的测定
水分测定:使用差重法,将大曲试样置于101 ℃条件下烘干3 h并取出冷却称质量,重复试验直至质量恒定(精确至0.001 g)[13]。
糖化力测定:使用滴定法,参考QB/T4257—2011《酿酒大曲通用分析方法》[14]。空白对照记录其消耗葡萄糖体积为V1,正式实验记录其消耗葡萄糖体积V2,糖化力按下式计算:
式中:X1为糖化力,mg/(g·h);V1、V2是消耗葡萄糖溶液体积,mL。
淀粉含量测定:参考QB/T4257—2011《酿酒大曲通用分析方法》。
液化力测定:制备5%酶液,使用比色法测定液化力,参考QB/T4257—2011《酿酒大曲通用分析方法》,记录下反应时间t。液化力以下式计算:
式中:X2为液化力,g/(g·h);V是酶液定容体积,mL。
酸度测定:取大曲试样10 g,加无菌水200 mL,常温振荡30 min,收集滤液。吸取样液20 mL加无菌水30 mL,用0.1 mol/L氢氧化钠溶液滴定至pH为8.2,记录氢氧化钠溶液体积V1,同时做空白实验,记录体积V0,酸度以下式计算[15]:
式中:X3为酸度,mmol/10 g;c为氢氧化钠溶液浓度,mol/L;V1、V0是消耗氢氧化钠溶液体积,mL。
1.3.3 霉菌的分离鉴定
取霉菌二次生长明显的大曲,将发霉部分(约10 g)取下,加入90 mL无菌水,放入锥形瓶中振荡1 h,将其孢子完全振荡至悬液中。以涂布的方式将上述孢子悬液涂布至A、B两种培养基中,30 ℃备用。使用DNA提取试剂盒提取DNA,进行PCR扩增、凝胶电泳。ITS rDNA扩增子的引物对为ITS1:5'-TCCGTAGGTGAACCTGCGG-3',ITS4:5'-TCCTCCGCTTATTGATATGC-3'。菌种鉴定序列与美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行比对。ITS扩增体系为:1×PCR mix 45 μL、ITS1(10P)2 μL、ITS4(10P)2 μL、DNA模板1 μL。PCR扩增程序见表1。
表1 聚合酶链反应扩增程序
Table 1 PCR amplification procedure

1.3.4 伞状毛霉对酵母产酒精能力的影响
酵母产酒精能力的测定参照王犁烨等[16]的方法,将菌液浓度均为106 CFU/mL的霉菌孢子悬液与酿酒酵母菌悬液以不同比例混合,以5%的接种量分别装于有杜氏小管以及15 mL的PDA液体培养基的试管中,要确保杜氏小管内无气泡,30 ℃摇床培养。每隔12 h观察一次产气情况并记录杜氏小管内的气体体积[17]。
1.3.5 pH适应性
配制PDA培养基后灭菌,在超净台中使用1 mol/LNaOH溶液或1 mol/L HCl溶液调整其pH值分别为5、6、7、8、9、10、11、12。将霉菌二次生长曲样在30 ℃自然湿度条件下培养3 d,每隔12 h测其菌落直径[18-19]。
1.3.6 温度适应性
将接种霉菌的平板分别于25℃、30℃、35℃、40℃、45℃,自然湿度条件下培养3 d,每隔12 h测其菌落直径[20]。
1.3.7 湿度适应性
将霉菌接种的平板分别于湿度70%、75%、80%、85%、90%、95%,30 ℃条件下培养3 d,每隔12 h测其菌落直径[21]。
1.3.8 数据处理
运用Excel 2019进行数据收集处理,Origin 9.0进行绘图。
2 结果与分析
2.1 OTU聚类分析
由表2可知,霉菌二次生长酒曲的OTU6毛霉为主要的二次生长霉菌,其数量显著高于优质酒曲5~10倍。而在根霉OTU数量上,好曲要多于霉菌二次生长的酒曲。
表2 酒曲样品OTU聚类分析
Table 2 OTU cluster analysis of Jiuqu sample
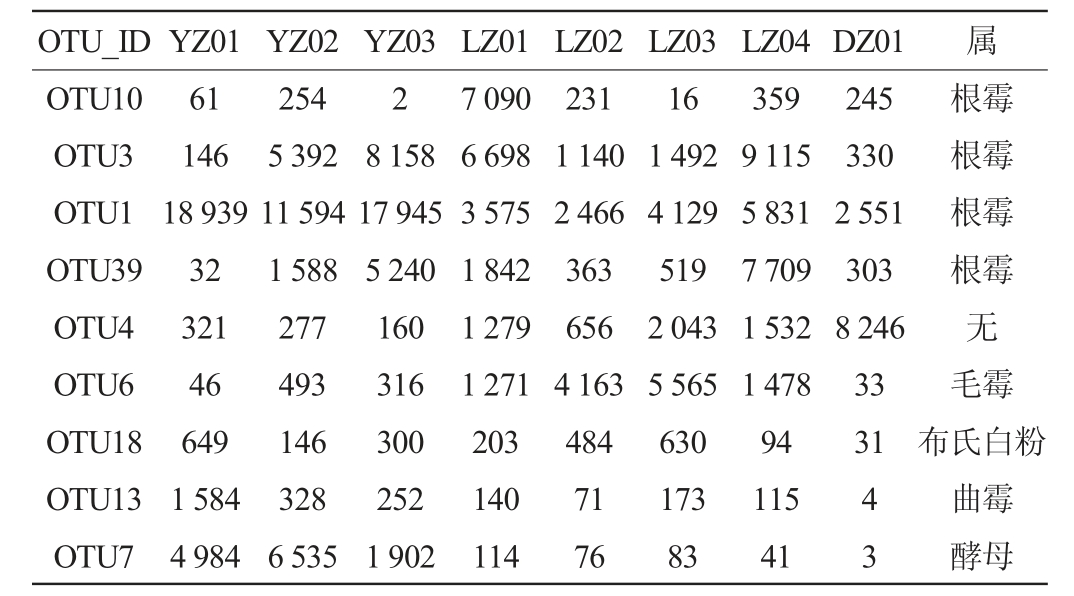
注:YZ01为好曲整块,YZ02为好曲中心,YZ03为好曲皮面,LZ01为霉曲整块,LZ02为霉曲中心,LZ03为霉曲心外3~6 cm,LZ04为霉曲心外6~9 cm,DZ为丢糟。
2.2 特香型大曲理化指标测定
2.2.1 水分含量测定
大曲贮存的时间越长,成曲中的水分含量就越低,表明发酵产生的游离水分越多、挥发程度越好,大曲发酵的成熟度就越好。由图1可知,霉心曲块、好曲整块、霉曲整块的水分含量依次为14.5%、12.5%、11.7%。霉心曲块水分含量最高,所以霉菌生长的最好;而霉曲整块的水分含量比好曲整块要低,分析原因是因为霉心处水分含量比整体高,能促进真菌细菌的生长繁殖,而微生物的大量繁殖会产生热量,会导致周围的曲块水分蒸发[22-23]。
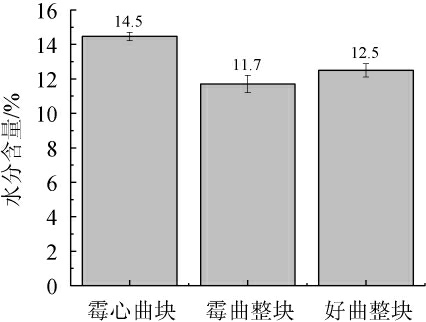
图1 酒曲水分含量比较
Fig.1 Comparison of moisture contents of Jiuqu
2.2.2 糖化力测定
糖化力是衡量酒曲糖化作用强弱最重要的指标,指的是酒曲中具有糖化作用的酶及微生物将淀粉转化为糖的能力,酒曲糖化力的高低受到很多因素(如温度、湿度、微生物生长情况等)的影响,是酒曲最为重要的理化指标之一。由图2可知,好曲整块、霉曲整块、霉心曲块的糖化力依次为818.6 mg/(g·h)、669.8 mg/(g·h)、622.8 mg/(g·h)。毛霉的糖化力本就比根霉要低很多,分析原因是因为酒曲中毛霉的二次生长影响了根霉的糖化作用。糖化力下降导致大曲糖化能力不足,淀粉转化为糖的能力下降,曲中糖分减少[24]。
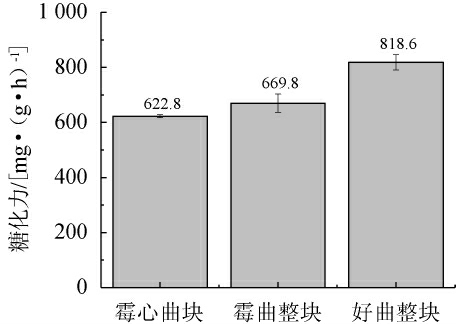
图2 酒曲糖化力比较
Fig.2 Comparison of saccharification power of Jiuqu
2.2.3 淀粉含量测定
由图3可知,霉心曲块、霉曲整块、好曲整块的淀粉含量依次为34.84 g/100 g、35.66 g/100 g、37.59 g/100 g,好曲整块的淀粉含量最高。淀粉含量不足会导致转化成糖分的含量降低,进一步导致酒精产量不足[25]。
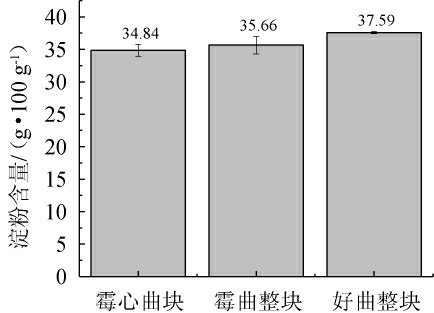
图3 酒曲淀粉含量比较
Fig.3 Comparison of starch contents of Jiuqu
2.2.4 液化力测定
液化酶能够水解淀粉,产生糊精、低聚糖和单糖,并为后续的发酵过程提供底物。由图4可知,霉心曲块、霉曲整块、好曲整块的液化力依次为0.168 g(/g·h)、0.216 g(/g·h)、0.259 g(/g·h)。液化力降低会使得酵母产酒精能力下降,无法将糖转化为乙醇,使得酒精度不足,口感下降[26]。
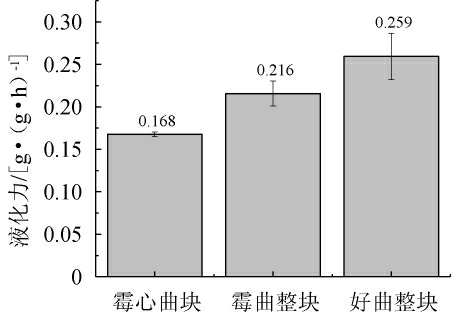
图4 酒曲液化力比较
Fig.4 Comparison of liquefaction power of Jiuqu
2.2.5 酸度测定
酒曲的酸度大小可以反映出大曲复合曲香物质的强弱程度。由图5可知,霉心曲块、霉曲整块、好曲整块的酸度依次为0.65 mmol/L、1.12 mmol/L、1.54 mmol/L。其中霉心处的酸度低于特香型大曲酸度的最低值(0.8 mmol/10 g)。有可能是二次生长的霉菌抑制了产酸微生物的产酸代谢,导致其活性下降,产酸性能也随之下降。
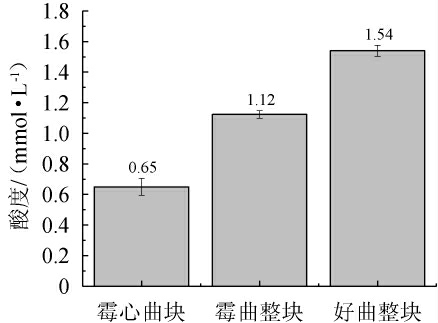
图5 酒曲酸度比较
Fig.5 Comparison of acidity of Jiuqu
2.3 分离霉菌的菌落形态及分子生物学鉴定
由图6可知,通过微生物菌落形态观察,菌落絮状,初为白色或灰白色,后变为灰褐色,菌丝密集且成絮状,顶端有黑色小点;显微镜下菌丝极少分隔,有分枝,无假根及匍匐菌丝。孢子囊较大、球形、顶生内含孢子量多。孢子囊孢子球形、椭圆形。孢囊梗单生、不成束,单轴分枝或假单轴样分枝,初步判断该菌为毛霉菌。由表3可知,菌株A3和A4与伞状毛霉(Lichtheimia corymbifera)(BMU07174)同源性达100%,亲缘关系最近,结合形态观察,鉴定该毛霉为伞状毛霉(Lichtheimia corymbifera)。
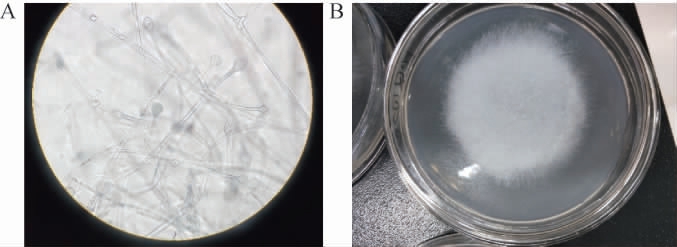
图6 分离霉菌菌株的菌落形态
Fig.6 Colony morphology of isolated mould strains
A为菌丝形态;B为菌落形态。
表3 菌株的同源性比对结果
Table 3 Comparison results of homology of strains

注:A3、A4分别为培养基A、B培养出的霉菌。
2.4 伞状毛霉对酵母产酒精能力影响
因为酵母在发酵过程中产生CO2和酒精,所以产CO2的量与发酵产乙醇的量具有对应关系,以此判断酵母产酒精的能力[27-28]。由表4可知,空白实验和全毛霉发酵的实验中,培养基中没有产生气体。而全酵母实验中产气量为最多,达到了5 cm。在混菌发酵中,随着伞状毛霉比例的增加,产气量下降,说明产酒精能力下降;但达到1∶1的接种量比之后,随伞状毛霉比例的增加,产气量维持一定。
表4 酿酒酵母与伞状毛霉比例对酵母产酒精能力的影响
Table 4 Effect of Saccharomyces cerevisiae and Mucor umbellifera ratio on alcohol production of yeast
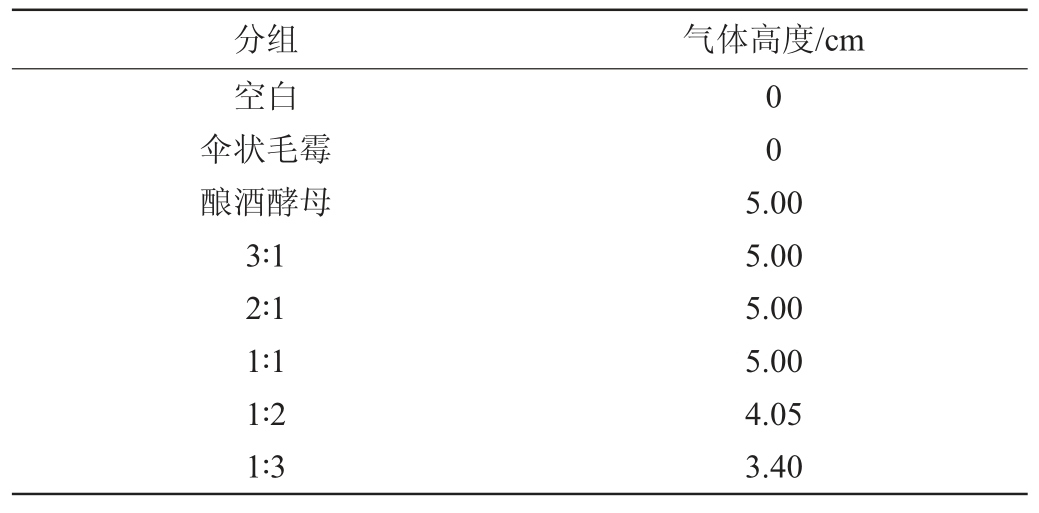
注:表中不同比例均表示为酿酒酵母和伞状毛霉的接种量比例。
2.5 伞状毛霉的生长特性
2.5.1 pH适应性
由图7可知,pH值为7的时候霉菌的菌落直径最大,pH越高霉菌的菌落直径越小。在pH为12时,霉菌的生长环境最差,生长速率也最慢。pH的适应从强到弱依次为pH7>pH9>pH8>pH6>pH5>pH10>pH11>pH12。虽然pH对毛霉菌落直径有一定影响,但整体趋势未发生太大变化,pH的适应范围较大。说明pH值对霉菌生长的影响在一定范围内十分有限,所以只需将pH值控制在5~11之间即可。
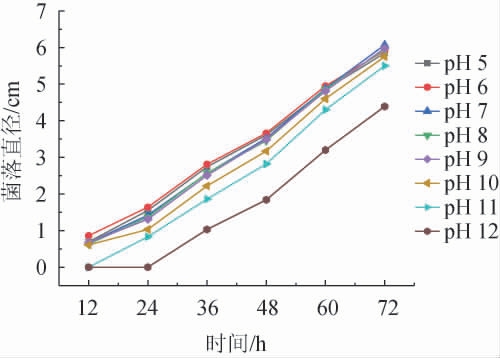
图7 不同pH对伞状毛霉生长的影响
Fig.7 Effect of pH on the growth of Mucor umbellifera
2.5.2 温度适应性
由图8可知,霉菌在35 ℃时的与菌落直径最大,低于35 ℃或高于40 ℃的生长速率与菌落直径均有下降趋势,其最佳生长温度为35~40 ℃。温度的适应性从强到弱依次为35 ℃>40 ℃>30 ℃>45 ℃>25 ℃。说明霉菌生长对温度的要求是比较高的,而且对其生长的影响较大,温度适应性的分界线也比较明显。
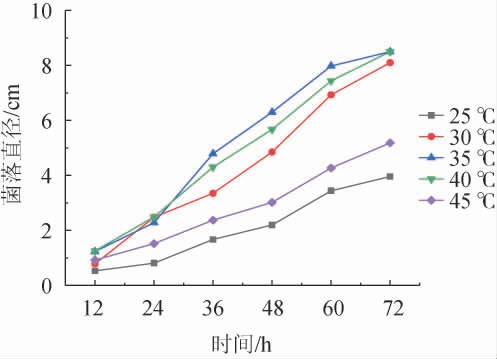
图8 不同温度条件对伞状毛霉生长的影响
Fig.8 Effect of different temperature on the growth of Mucor umbellifera
2.5.3 湿度适应性
由图9可知,相对湿度在80%时霉菌的菌落直径与生长速率最大。在相对湿度低于70%或高于85%时,霉菌的生长受显著抑制。相对湿度适应性从强到弱依次为80%>75%>70%>90%>85%>95%。湿度适应性的分界线也比较明显,且对毛霉有较大的的生长影响。
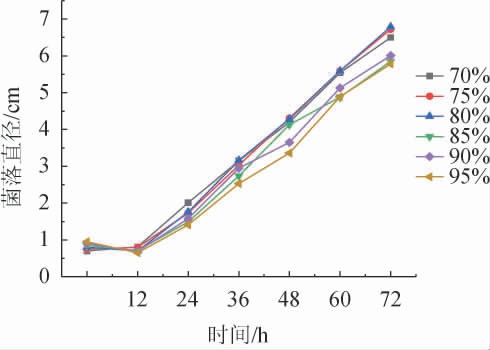
图9 不同相对湿度对伞状毛霉生长的影响
Fig.9 Effects of different relative humidity on the growth of Mucor umbellifera
3 结论
通过比较不同质量大曲理化指标得知,如果一块大曲的伞状毛霉菌出现了二次生长的情况,其糖化力、液化力等重要的酿酒指标均会降低。而这些指标都是环环相扣的,淀粉通过糖化作用转化为糖分,又通过液化作用产生酒精,每一个环节的能力都弱一些,最后出酒的风味就会大打折扣,使酒的糖度、酒精度、风味都远低于标准。
通过对储藏期二次生长霉菌的鉴定,得出特香型大曲储藏期二次生长的霉菌为伞状毛霉。伞状毛霉的生长环境在pH5~10时差距并不明显,储藏期大曲的平均水分含量要控制在12.5%,储藏温度控制在25 ℃,环境相对湿度不要超过70%为最佳条件。
[1]李维青.白酒的香气与香型[J].酿酒,2007,34(2):5-7.
[2]王俏,郭聃洋,王旭亮,等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技,2015(6):6-10.
[3]刘效毅,郭坤亮,辛玉华.高温大曲中微生物的分离与鉴定[J].酿酒科技,2012(6):52-55.
[4]陈孝,温承坤,巩园园,等.酒曲的研究进展[J].中国酿造,2019,38(10):7-11.
[5]张会敏.古井贡酒微生物群落结构及其与主要风味物质的关联研究[D].哈尔滨:哈尔滨工业大学,2017.
[6]郭旭.中国近代酒业发展与社会文化变迁研究[D].无锡:江南大学,2015.
[7]戴奕杰,李宗军,田志强,等.酱香型白酒酿造过程中微生物及其代谢产物研究进展[J].酿酒科技,2018(11):85-96.
[8]汤涵岚.基于宏基因组分析增温对食醋大曲固态发酵过程中微生物菌群的影响[D].广州:华南理工大学,2019.
[9]陈笔.酱香型白酒酿造过程中霉菌群落结构以及霉菌与酵母相互作用的研究[D].无锡:江南大学,2014.
[10]印璇.北方酱香型白酒功能微生物的选育及应用[D].乌鲁木齐:新疆农业大学,2014.
[11]潘菲.高糖化力霉菌的筛选及其对特香型白酒酿造出酒率和风味的影响[D].南昌:南昌大学,2018.
[12]靳沛.大曲和麸曲相结合液态发酵白酒的酿造及理化性质的研究[D].沈阳:沈阳农业大学,2020.
[13]刘明明.兼香型白酒工艺研究[D].济南:齐鲁工业大学,2013.
[14]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
[15]石飞.米酒制作工艺对其发酵馒头品质影响研究[D].郑州:河南工业大学,2018.
[16]王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
[17]乔岩.酱香型大曲曲虫综合防治及贮存质量变化的研究[D].贵阳:贵州大学,2016.
[18]李良,郑桂朋,吴昊,等.浓香型白酒夏冬两季生产车间及大曲中霉菌与放线菌的分离纯化[J].中国酿造,2017,36(11):54-58.
[19]王犁烨,王浩臣,马珊,等.常压室温等离子体选育高产酒精及酸的酿酒酵母[J].食品与机械,2019,35(5):26-31.
[20]贺银凤.酸马奶酒中微生物的分离鉴定及抗菌因子的研究[D].呼和浩特:内蒙古农业大学,2008.
[21]杜木英.西藏青稞酒发酵微生物及酿造技术研究[D].重庆:西南大学,2008.
[22]陈玉婷.自然发酵豆酱中产蛋白酶、淀粉酶霉菌的分离筛选及应用[D].沈阳:沈阳农业大学,2019.
[23]王改利.玉米储藏期霉菌活动、品质变化及挥发性物质成分分析[D].郑州:河南工业大学,2010.
[24]王俏,郭聃洋,王旭亮,等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技,2015(6):6-10.
[25]肖辰.泸型酒中温大曲微生物群落的演替及其对酒醅发酵的贡献[D].无锡:江南大学,2018.
[26]张丽,卢红梅,陈莉,等.酱香型大曲贮存过程中发酵性能变化的研究[J].现代食品科技,2017,33(9):231-237.
[27]杨帆.酱香型白酒中乳酸代谢机理及调控策略的研究[D].无锡:江南大学,2020.
[28]凌梦荧.绍兴黄酒麦曲的关键指标筛选及品质评价方法研究[D].无锡:江南大学,2019.