酱香型白酒独特的感官特征和风味物质组成,必然与其独特的酿造工艺密切相关,即生产实践的不断优化和总结得出的“12987”工艺和“四高两长、一大一多”的工艺特征[1-3]。“一年生产周期、两次投料、九次蒸煮、八次发酵、七次流酒”最终呈现七个轮次的酱香型白酒原酒[4]。轮次酒作为酱香型白酒的基础酒,是酱香型白酒工艺中重要的环节,其品质的高低直接决定了酱香型白酒品质的优劣。已有研究报道,在酱香型白酒七个轮次酒中,第一、二轮次酒酱香味不突出,乙酸乙酯含量偏高,整体风格偏向于清香型白酒[5],而第三、四、五轮次酒具有酱香突出、香气纯正、酒体醇厚等特点,人们将第三、四、五轮次这种品质优的酒统称为大回酒[6-7]。
在酱香型白酒轮次发酵和多轮次取酒过程中,由于季节变化、原辅料差异、工艺操作等[8-9]方面的不同,会导致酒醅的理化性质和微生物演替发生变化[10-11]。微生物代谢作为白酒风味物质的重要来源,微生物的变化直接影响白酒风味物质形成[12-13]。因此,不同轮次酒在感官风格上具有明显不同[14]。实际生产中,监测理化指标的规律性变化是控制轮次酒风味品质的重要途径[15-16]。已有研究表明酱香型大曲酒发酵过程中微生物数量、酒醅理化指标以及白酒品质之间有着密不可分的关系[17]。然而,关于轮次酒的研究多集中在感官差异方面,关于以风味经验控制为主的酱香型白酒轮次酒发酵机理缺乏研究。
本研究以酱香型白酒大回酒为研究对象,采用风味组学和高通量测序等技术分析大回酒风味物质和大回酒酒醅中微生物组成,以及大回酒酒醅的理化、大回酒的风味物质和大回酒酒醅中微生物三者之间的关联性,以揭示茅台地区酱香大回酒潜在的轮次发酵机理。
1 材料与方法
1.1 材料与试剂
酱香型白酒第三、四、五轮次酒醅和原酒:取自贵州省仁怀市某酒厂;乙酸乙酯、乳酸乙酯、正丙醇、乙醛、乙缩醛等标准品(均为色谱纯):美国Sigma-Aldrich公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Clarus600气相色谱仪(gas chromatography,GC)(配火焰离子检测器(flame ionization detector,FID)):美国Perkin Elmer公司;安捷伦1260高效液相色谱(high performance liquid chromatography,HPLC)分析仪:美国Agilent公司;ICS-300离子色谱分析仪(配EG40淋洗液自动发生器、电导检测器和Chromeleon6.80色谱工作站):美国DIONEX公司。
1.3 方法
1.3.1 理化指标检测
酒醅中水分、酸度、淀粉、还原糖等指标的测定依据中国酒业协会团体标准T/CBJ 004—2018《固态发酵酒醅通用分析方法》分析。
1.3.2 气相色谱分析
醇类、醛类、酯类等挥发性风味物质参考韩兴林等[18]采用气相色谱法进行测定。毛细管柱选用CP-Wax 57 CB(50 m×0.25 mm×0.2 μm)。载气为N2、H2和空气,流速分别为1 mL/min、45 mL/min和450 mL/min,以10∶1分流比设定。进样量为1 μL。进样器温度设置为240 ℃,升温程序设置为:35 ℃保持6 min;以4 ℃/min升至60 ℃,继续以6 ℃/min升至110 ℃,保持3 min,再以6 ℃/min升至205 ℃,保持13 min。同一酒样进行三次平行测定。
1.3.3 离子色谱分析
样品中有机酸的检测参考唐坤甜等[19]的方法,采用离子色谱法进行检测。色谱柱采用IonPac AS11-HC型分离柱(250mm×4mm),IonPacAG11-HC型保护柱(50mm×4mm),色谱条件:流动相为480mmol/LNaOH溶液等度淋洗60min,流速为0.4 mL/min,进样量为25 μL,温度为30 ℃。
1.3.4 基因组提取及高通量测序
酒醅中微生物基因组的提取依照说明书,采用试剂盒(E.Z.N.A.Soil DNA Kit)的方法进行提取[20-21]。
天津诺和致源生物信息科技有限公司采用高通量测序(Illumina Miseq PE250)平台对样品进行测序,细菌使用SILVA138数据库进行物种注释,真菌使用Unit(v8.2)数据库进行物种注释,以上均使用NovaSeq6000进行上机测序,测序策略PE250。
1.3.5 数据分析
每个样品至少3次重复,实验数据以“平均值±标准差”表示,显著性差异以P<0.05为标准。典范对应分析(canonical correspondence analysis,CCA)采用Canoco 4.5软件。采用SPSS24.0软件进行相关性分析,GraphPad Prism5.0软件做柱形图,Gephi0.9.1软件做网络图。
2 结果与分析
2.1 酱香型白酒大回酒酒醅理化特征
对酱香型白酒三、四、五轮次酒醅的理化指标进行分析,结果见表1。
表1 大回酒酒醅理化指标的测定结果
Table 1 Determination results of physicochemical indexes of Dahui-jiu Jiupei
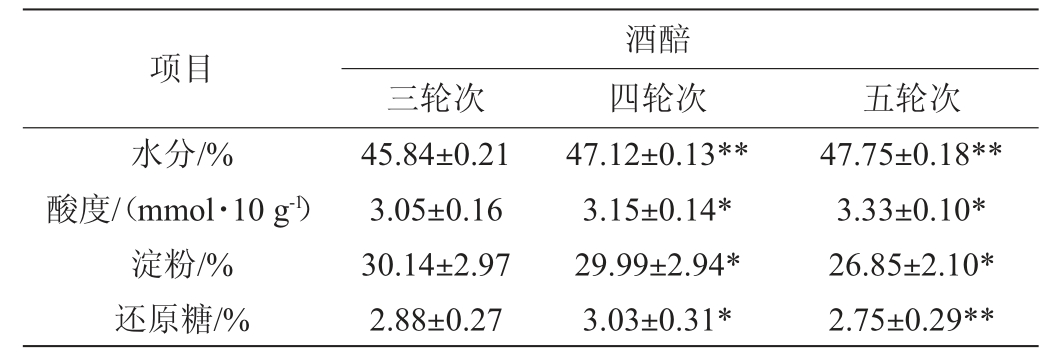
注:第四、五轮次分别与第三轮次相比,“*”表示差异性显著(0.01≤P<0.05),“**”表示差异性极显著(P<0.01)。
由表1可知,酱香型白酒第三、四、五轮次酒醅的理化特征:水分含量范围为45.84%~47.75%,酸度范围为3.05~3.33 mmol/10 g,淀粉含量范围为26.85%~30.14%,还原糖含量为2.75%~3.03%。第四、五轮次酒醅在水分、酸度、淀粉和还原糖含量等理化指标上与第三轮次酒醅均有显著或极显著性差异(P<0.05)。第三、四、五轮次酒醅相比,水分含量和酸度随轮次逐渐提高,淀粉含量随轮次逐渐降低,还原糖含量随轮次呈现先增加后降低的变化趋势。
2.2 酱香型白酒大回酒风味物质特征
对酱香型白酒大回酒酒醅蒸馏得到的轮次酒进行风味分析,结果见表2。
由表2可知,共检测到43种主要风味物质,其中酯类22种,醇类14种,醛类7种和酮类2种。酯类物质含量较高的主要包括乳酸乙酯、乙酸乙酯,其中乳酸乙酯含量最高。随着轮次的增加,乳酸乙酯的含量呈现先增加后降低的变化趋势,在第四轮次达到最大值,为(5 366.69±35.77)mg/L,乙酸乙酯的含量随轮次增加呈现先降低后略微升高的变化趋势,其在第四轮次与第五轮次样品中的含量相差不大。醇类物质含量较高的主要包括正丙醇、异戊醇和甲醇,其中含量最高的醇类物质是正丙醇。正丙醇含量随轮次的增加呈现先降低后略微增加的变化趋势,第四轮次与第五轮次样品中正丙醇的含量相差不大。异戊醇的含量随轮次增加呈现逐渐增加的变化趋势。甲醇的含量随轮次的增加呈现逐渐升高的变化趋势。醛类物质主要包括乙醛、糠醛和乙缩醛,其中乙醛和糠醛的含量随轮次的增加呈现逐渐上升的变化趋势,乙缩醛的含量随轮次的增加呈现先降低后升高的变化趋势。酮类物质包括丙酮和3-羟基-2-丁酮,其中3-羟基-2-丁酮的含量相对较高,随着轮次的增加,3-羟基-2-丁酮的含量呈现逐渐增加的变化趋势,在第五轮次样品中达到最大值,为(138.09±10.15)mg/L。
表2 大回酒风味物质含量的测定结果
Table 2 Determination results of flavor compounds content in Dahui-jiu mg/L
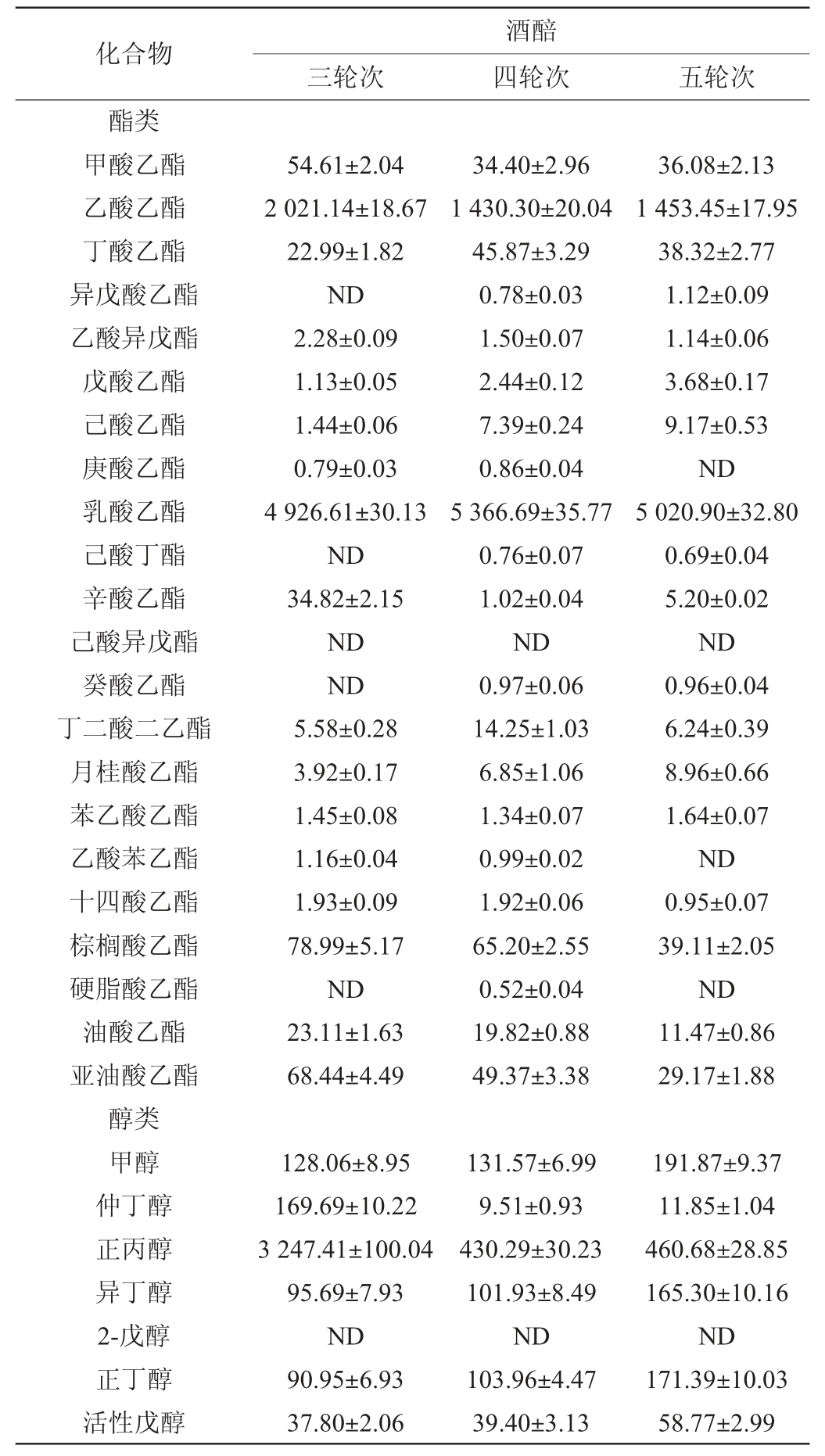
续表

注:“ND”表示未检出。
2.3 酱香型白酒大回酒酒醅细菌群落结构
2.3.1 细菌群落多样性
对酱香型白酒大回酒酒醅细菌菌群的多样性进行分析,结果见表3。
表3 大回酒酒醅细菌菌群多样性分析结果
Table 3 Analysis results bacterial flora diversity of Dahui-jiu Jiupei
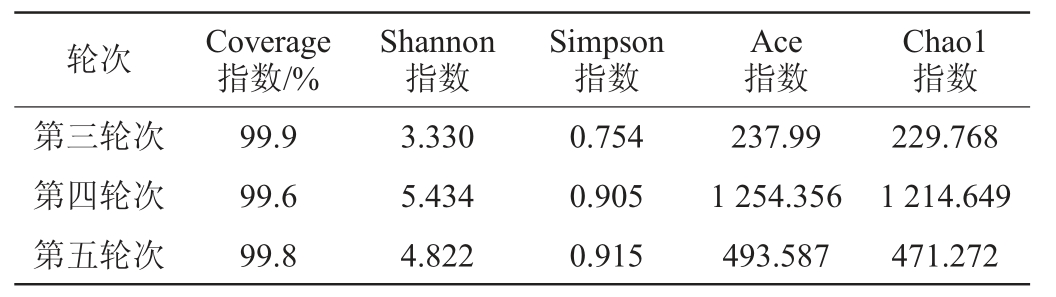
由表3可知,细菌群落多样性指数分析显示,酱香型白酒第三、四、五轮次酒醅样品测序的Coverage指数均在99%以上,样品的测序覆盖率高,测序结果能够真实反映样品中的微生物群落结构。Shannon指数和Simpson指数显示,第三、四、五轮次酒醅的群落多样性可分为两个等级,其中,相对于第四、五轮次酒醅,第三轮次酒醅中细菌的这两种指数的数值较小,且第四、五轮次酒醅中细菌的这两种指数的数值相差不明显。因此,第四、五轮次酒醅中细菌群落多样性较高,第三轮次酒醅中细菌群落多样性较低。Chao1指数和Ace指数显示,第三、四、五轮次酒醅中细菌群落丰富度按照这两种指数的数值大小进行排序,结果显示两指数的大小顺序一致,因此,第三、四、五轮次酒醅群落丰富度大小依次为:第四轮次>第五轮次>第三轮次,三者的Chao1指数和Ace指数数值相差较为明显,说明三者在群落丰富度上差别较大。
2.3.2 细菌群落结构
采用高通量测序(16S rDNA)的方法对酱香型白酒大回酒酒醅细菌在属水平上的物种组成进行分析,相对丰度排名前30的细菌属见图1。
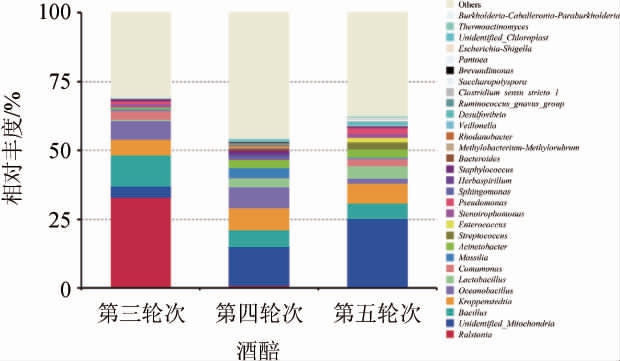
图1 大回酒酒醅细菌在属水平的相对丰度
Fig.1 Relative abundance of bacteria in Dahui-jiu Jiupei at genus level
高通量测序的结果显示,第三、四、五轮次酒醅样品中共检测到282个属,其中相对丰度>1%的细菌属共有17种,相对丰度较高的有劳尔氏菌属(Ralstonia)、Unidentified_Mitochondria和芽孢杆菌属(Bacillus),是大回酒轮次酒醅中主要的细菌组成。第三轮次酒醅中的优势细菌属是劳尔氏菌属(Ralstonia),占总丰度的33.03%,其次是芽孢杆菌属(Bacillus)和海洋杆菌(Oceanobacillus),分别占总丰度的11.47%和6.80%。第四轮次酒醅中的优势细菌属是Unidentified_Mitochondria,占总丰度的14.09%,其次是克氏假单胞菌(Kroppenstedtia)和海洋杆菌(Oceanobacillus),分别占总丰度的7.94%和7.77%。第五轮次酒醅中的优势细菌属与第四轮次相同,是Unidentified_Mitochondria,占总丰度的25.10%,其次是克氏假单胞菌(Kroppenstedtia)和芽孢杆菌属(Bacillus),分别占总丰度的7.23%、5.67%。因此,第三轮次与第四、五轮次酒醅在属水平上的主要细菌菌群差异较大。在细菌种类上,第四、五轮次酒醅细菌种类一致,第三轮次与第四、五轮次不同,这与Shannon指数和Simpson指数的分析结果一致。在细菌丰度上,第四轮次与第五轮次酒醅的优势菌群(Unidentified_Mitochondria)丰度差别较大,分别为14.09%和25.10%,而第三轮次酒醅在细菌种类和丰度上与第四、五轮次均差别较大,因此第三、四、五轮次酒醅在细菌丰度上形成了明显的梯度差异,这与Chao1指数和Ace指数的分析结果一致。
2.4 酱香型白酒大回酒酒醅真菌群落结构
2.4.1 真菌群落多样性
对酱香型白酒大回酒酒醅真菌菌群的多样性进行分析,结果见表4。
表4 大回酒酒醅真菌菌群多样性分析结果
Table 4 Fungal flora diversity analysis results of Dahui-jiu Jiupei
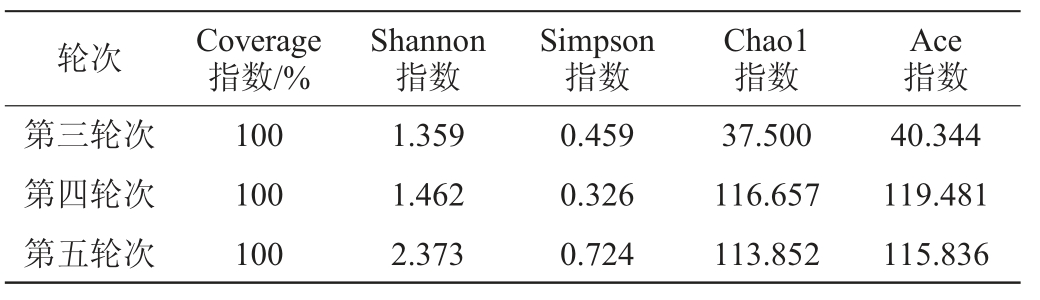
由表4可知,真菌群落多样性指数分析显示酱香型白酒第三、四、五轮次酒醅样品测序的Coverage指数均达到了100%,样品的测序覆盖率高,测序结果能够真实反映样品中的微生物群落结构。Shannon指数和Simpson指数显示,第三、四、五轮次酒醅的真菌群落多样性可分为两个等级,其中,相对于第五轮次酒醅,第三、四轮次酒醅中真菌的这两种指数的数值相近且较小。第五轮次酒醅中真菌的这两种指数的数值较大。因此,第三、四轮次酒醅中真菌群落多样性较低,第五轮次酒醅中真菌群落多样性较高。Chao1指数和Ace指数显示,第三轮次酒醅该两种指数的数值较小,第四、五轮次酒醅对应的两种指数相近且较大,因此,第三轮次酒醅真菌群落丰富度较小,第四、五轮次酒醅真菌群落丰富度较大,且第四、五轮次酒醅在真菌丰富度上接近,第三轮次与第四、五轮次酒醅差别较大。
2.4.2 真菌群落结构
采用高通量测序的方法对酱香型白酒大回酒酒醅真菌在属水平上的物种组成进行分析,相对丰度排名前30的真菌属见图2。
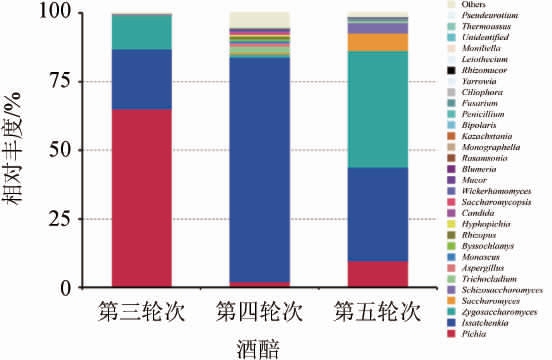
图2 大回酒酒醅真菌在属水平的相对丰度
Fig.2 Relative abundance of fungus in Dahui-jiu Jiupei at genus level
高通量测序的结果显示,第三、四、五轮次酒醅样品中共检测到112个真菌属,其中相对丰度>1%的真菌属共有10种,分别是毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)、接合酵母属(Zygosaccharomyces)、酵母菌属(Saccharomyces)、裂殖酵母(Schizosaccharomyces)、短梗蠕孢属(Trichocladium)、曲霉属(Aspergillus)、红曲霉(Monascus)、丝衣霉菌属(Byssochlamys)、根霉属(Rhizopus),是大回酒轮次酒醅中主要的真菌组成。
第三轮次酒醅中优势真菌属是毕赤酵母属(Pichia),占总丰度的65.12%,其次是伊萨酵母属(Issatchenkia)和接合酵母属(Zygosaccharomyces),分别占总丰度的21.66%和12.31%。第四轮次酒醅中的优势真菌属是伊萨酵母属(Issatchenkia),占总丰度的81.88%,其次是毕赤酵母属(Pichia)和接合酵母属(Zygosaccharomyces),分别占总丰度的2.01%和1.14%。第五轮次酒醅中的优势酵母属是接合酵母属(Zygosaccharomyces),占总丰度的42.48%,其次是伊萨酵母属(Issatchenkia)和毕赤酵母属(Pichia),分别占总丰度的34.16%和9.63%。由第三、四、五轮次酒醅中丰度较高的真菌种类及丰度分析,毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)和接合酵母属(Zygosaccharomyces)三类真菌是大回酒轮次酒醅中的丰度较高的真菌,第三、四、五轮次酒醅在主要真菌种类上相同。在真菌丰度上,第三、四、五轮次酒醅的差异较大,毕赤酵母属、伊萨酵母属和接合酵母属分别在第三、四、五轮次酒醅中成为优势真菌属,这可能与真菌随轮次的演替有关。
2.5 酱香型白酒大回酒风味潜在调控机制分析
2.5.1 理化指标与微生物关联性
以理化指标为环境因子,采用典范对应分析对酱香型白酒大回酒酒醅理化环境和微生物之间的关联性进行研究,其典范对应分析结果见图3。
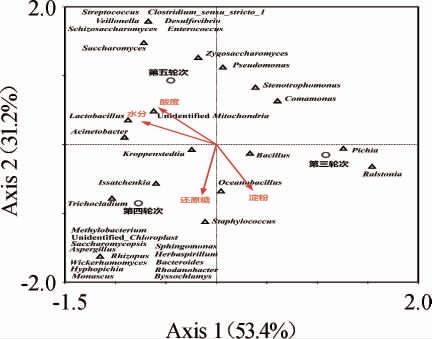
图3 酒醅理化指标与微生物之间的典范对应分析
Fig.3 Canonical correspondence analysis between physicochemical indexes and microorganisms of Jiupei
由图3可知,在水分、酸度、淀粉和还原糖四种理化指标中,水分和酸度对酒醅中微生物的影响相对较大,淀粉和还原糖对酒醅微生物的影响相对较小。环境因子对轮次酒醅的潜在影响分析显示,对第三轮次酒醅影响最大的环境因子是水分,其次是酸度,淀粉和还原糖对第三轮次酒醅的影响较小。对第四轮次酒醅影响最大的环境因子是还原糖,淀粉、水分和酸度对第四轮次酒醅的影响相对较小。对第五轮次酒醅影响最大的环境因子是淀粉,其次是酸度,水分和还原糖对第五轮次酒醅的影响相对较小。
环境因子对轮次酒醅中微生物潜在影响的分析显示,与酸度和水分呈现正相关的微生物主要有15种,包括细菌12种和真菌3种,其中可能对酸度和水分影响较大的微生物主要有不动杆菌属(Acinetobacter)、乳杆菌属(Lactobacillus)和Unidentified_Mitochondria等。与酸度和水分呈现负相关的微生物主要有5种,包括细菌4种和真菌1种。与淀粉呈现正相关的微生物主要有17种,包括细菌10种和真菌7种,其中可能对淀粉影响较大的微生物是海洋杆菌(Oceanobacillus)。与还原糖呈现正相关的微生物主要有18种,包括细菌和真菌各9种,可能对还原糖影响较大的微生物有海洋杆菌(Oceanobacillus)、葡萄球菌属(Staphylococcus)和伊萨酵母属(Issatchenkia)等。
总体上,受水分、酸度、淀粉、还原糖等环境因子影响且在轮次酒醅中相对丰度较高的微生物主要有15种,其中细菌10种,分别为Kroppenstedtia、不动杆菌属(Acinetobacter)、乳杆菌属(Lactobacillus)、Unidentified_Mitochondria、单胞菌属(Stenotrophomonas)、假单胞菌(Pseudomonas)、芽孢杆菌属(Bacillus)、劳尔氏菌属(Ralstonia)、葡萄球菌属(Staphylococcus)和海洋杆菌(Oceanobacillus),真菌5种,分别为接合酵母属(Zygosaccharomyces)、酵母菌属(Saccharomyces)、毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)和短梗蠕孢属(Trichocladium)。
2.5.2 微生物与风味物质关联性
根据大回酒酒醅中主要微生物(相对丰度>1%)的组成和演替,以及大回酒中风味物质的组成及变化规律,采用Spearman相关性分析研究微生物与风味物质之间的关联性并构建微生物与风味物质间的调控网络图,结果见图4。
在相对丰度>1%的27种微生物中,至少与一种风味物质呈(共43种,表2)显著相关性(P<0.05)的微生物有26种。由图4可知,异戊酸乙酯、乙酸异戊酯、戊酸乙酯、己酸乙酯等23种风味物质受劳尔氏菌属(Ralstonia)、Unidentified_Mitochondria、乳杆菌属(Lactobacillus)和酵母菌属(Saccharomyces)的影响较大,甲酸乙酯、乙酸乙酯、丁酸乙酯、乳酸乙酯等11种风味物质受Kroppenstedtia、毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)和短梗蠕孢属(Trichocladium)的影响较大,庚酸乙酯、苯乙酸乙酯、正己醇、1,2-丙二醇等8种风味物质受海洋杆菌(Oceanobacillus)影响较大。总体上,与风味物质相关性较强的微生物主要有乳杆菌属(Lactobacillus)、Unidentified_Mitochondria、海洋杆菌(Oceanobacillus)、酵母菌属(Saccharomyces)、劳尔氏菌属(Ralstonia),其次是Kroppenstedtia、伊萨酵母属(Issatchenkia)、短梗蠕孢属(Trichocladium)和毕赤酵母属(Pichia),上述9种微生物(细菌5种,真菌4种)可能是影响风味物质的主要微生物种类。
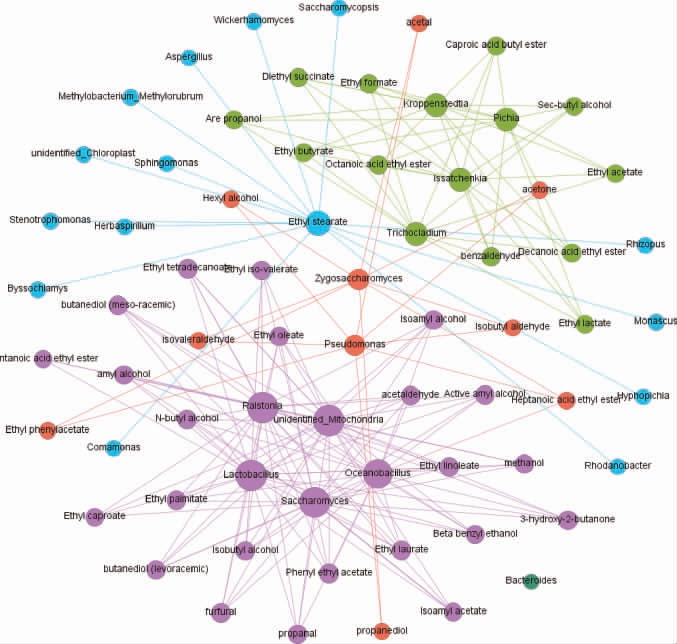
图4 风味物质与属水平微生物群落相关性分析结果
Fig.4 Correlation analysis results between flavor substances and microbial community at genus level
不同颜色代表关联性的强弱,紫色表示关联性强,可达40.58%;蓝色表示关联性较强,可达21.74%;浅绿色表示关联性相对较强,可达21.74%;橘红色表示关联性较弱,可达14.49%;绿色表示关联性相对较弱,可达1.45%。
2.6 讨论
在上述微生物中,9种可能主要影响大回酒风味的微生物同时也可能是受水分、酸度、淀粉和还原糖影响的主要微生物种类,是对理化指标和风味物质均有较大影响的微生物。基于此,在大回酒酿造过程中,人们既能通过理化指标影响这些微生物的种类和代谢,也可以间接通过理化指标的变化反映出大回酒风味的稳定性。因此,在人们通过监测理化指标控制大回酒风味稳定中,这9种微生物可能是酿造过程起主要作用的功能微生物。
在酱香型白酒酿造过程中,水分、酸度、淀粉和还原糖等理化指标是企业监控酿造过程和酒品质稳定的重要途径。水分的高低影响微生物的代谢活性,且水分也直接影响酸度的大小,水分与酸度两者共同对微生物的代谢起作用,这可能是水分与酸度呈现正相关(见图3)的原因之一。在与酸度呈现正相关的微生物中,一些微生物能够代谢产酸,如Lactobacillus代谢产生乳酸,还有一些微生物能够促进产酸,如酵母菌属(Saccharomyces),它具有促进产酸菌代谢产酸的能力[22],相反地,多种微生物在酸性条件下生长受到抑制或其他影响,与酸度呈现反比,如芽孢杆菌属(Bacillus)、劳尔氏菌属(Ralstonia)和葡萄球菌属(Staphylococcus)等。在酿造过程中,产酸微生物能够产酸使得酸度提高,而酸度的提高同时也抑制了另一部分微生物的生长和代谢,因此,酸度和微生物之间相互影响,酸度是影响微生物的重要因素,也是微生物代谢和演替的重要体现。淀粉和还原糖均是微生物生长和代谢的碳源和能源,两者在与微生物的相关性上有较大的一致性,在丰度变化上较为相似,这些微生物与淀粉、还原糖均呈现正相关,相关性大小的差异可能与微生物利用淀粉和还原糖的难易程度不同有关。海洋杆菌(Oceanobacillus)已被证实涉及糖酵解、糖异生等代谢途径[23],芽孢杆菌属(Bacillus)可代谢产生淀粉酶促进淀粉的分解与利用,如解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)等[24-25],这可能是海洋杆菌(Oceanobacillus)和芽孢杆菌属(Bacillus)与淀粉和还原糖呈正相关的重要原因之一。
微生物代谢是大回酒风味物质的重要来源,理化指标与微生物相互影响的同时,酒体的风味物质组成同时也发生相应变化,如乳杆菌属(Lactobacillus)等产酸微生物使得酒体酸味增加,芽孢杆菌属(Bacillus)、酵母菌属(Saccharomyces)等菌属丰度的提高能够使3-羟基-2-丁酮等醛酮类、酯类等香气成分含量提高[18]。因此,理化指标既能反映微生物的代谢,也能间接反映或推测风味物质的形成,这可能是酱香型大回酒酿造机理之一。
3 结论
本研究以酱香型白酒大回酒及其对应酒醅为研究对象,通过分析大回酒风味物质、酒醅理化性质和微生物群落结构,探索大回酒轮次发酵的机理。酱香型白酒大回酒酒醅的水分、酸度、淀粉和还原糖范围分别为45.84%~47.75%、3.05~3.33 mmol/10 g、26.85%~30.14%和2.75%~3.03%。通过高通量测序,明确了大回酒酒醅中的优势细菌属为劳尔氏菌属(Ralstonia)、Unidentified_Mitochondria和芽孢杆菌属(Bacillus),优势真菌属为毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)和接合酵母属(Zygosaccharomyces)。
CCA分析显示,可能受水分、酸度、淀粉、还原糖等环境因子影响(或影响这些环境指标)的微生物主要有15种(细菌10种,真菌5种)。相关性分析显示,影响风味物质的微生物主要有9种(细菌5种,真菌4种),分别为乳杆菌属(Lactobacillus)、Unidentified_Mitochondria、海洋杆菌(Oceanobacillus)、酵母菌属(Saccharomyces)、劳尔氏菌属(Ralstonia)、Kroppenstedtia、伊萨酵母属(Issatchenkia)、短梗蠕孢属(Trichocladium)和毕赤酵母属(Pichia),且该9种微生物均是可能受水分、酸度、淀粉、还原糖等环境因子影响的微生物种类。因此,9种微生物可能是既影响风味又影响理化指标的主要微生物种类。在监测理化指标控制大回酒风味稳定性的过程中,该9种微生物可能是其中起主要作用的微生物。微生物对理化指标、风味物质的双向影响可能是人们通过观察理化指标的规律性变化预测风味物质稳定的潜在机理之一。在下一阶段工作中,将进一步验证理化指标、微生物和风味物质之间的内在联系,为大回酒的生产控制提供可靠的理论依据。
[1]邱声强,唐维川,赵金松,等.酱香型白酒生产工艺及关键工艺原理简述[J].酿酒科技,2021(5):7.
[2]崔利.形成酱香型酒风格质量的关键工艺是“四高两长,一大一多”[J].酿酒,2007,34(3):12.
[3]余乾伟.传统白酒酿造技术[M].北京:中国轻工业出版社,2010.
[4]王婧,王晓丹,邱树毅,等.酱香型白酒酿造体系风格特征形成探究[J].酿酒,2015,42(4):99-104.
[5]马宇.基于风味组学策略研究酱香型白酒关键成分及其呈香呈味特性[D].贵阳:贵州大学,2019.
[6]赵文武,陈仁远.大曲酱香轮次基酒感官质量问题探讨[J].现代食品,2020(5):92-99.
[7]张娇娇,郭松波,余硕文,等.基于多元色谱和主成分分析解析酱香型白酒大回酒风味品质研究[J].中国酿造,2021,40(11):161-168.
[8]龚荣,李卫东,黄进,等.酱香型白酒下沙,糙沙过程中高粱淀粉糊化的影响因子及相关过程控制[J].酿酒科技,2019(12):36-39.
[9]卢君,唐平,山其木格,等.不同封窖方式对酱香白酒基础酿造的影响[J].食品与发酵工业,2020,46(2):203-207.
[10]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[11]冯海燕,卢君,陈竹君,等.酱香型白酒出入窖糟醅性能评价的技术研究[J].酿酒科技,2021(8):35-42.
[12]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[13]WU Q,CHEN B,XU Y.Regulating yeast flavor metabolism by controlling saccharification reaction rate in simultaneous saccharification and fermentation of Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2015,200C:39-46.
[14]张健,高海燕,赵镭,等.白酒理化指标及其与香气品质的关系[J].食品科学,2010,31(10):283-286.
[15]陈华明,沈晖,付立业.一种酱香型白酒窖面糟醅及窖面酒的制作方法:CN108165425A[P].2018-06-15.
[16]王邦坤,张维山.北方大曲酱香酒云门陈酿高温堆积发酵工艺探讨[J].酿酒,2019,46(3):40-42.
[17]王晓丹,张小龙,陈孟强,等.酱香型白酒窖内发酵过程中酒醅理化指标与细菌的变化趋势研究[J].酿酒,2014,41(3):21-24.
[18]韩兴林,潘学森,刘民万,等.云门酱香型白酒风味特征的分析研究[J].酿酒科技,2014(10):6-8.
[19]唐坤甜,赵彩云,韩兴林,等.白酒味觉成分有机酸含量分析及其对酿造工艺的影响[J].食品与发酵工业,2016,42(7):202-208.
[20]王海燕.PCR-DGGE技术对清香型汾酒微生物群落结构演变规律的研究[D].无锡:江南大学,2014.
[21]彭璐,明红梅,董异,等.不同曲层中高温大曲质量差异性研究[J].食品与发酵工业,2020,46(3):58-64.
[22]叶凯.窖泥中产酸微生物的筛选与应用[D].武汉:湖北工业大学,2020.
[23]HIDETO T,HIDEKI N,YOSHIHIRO T,et al.A deeply branching thermophilic bacterium with an ancient acetyl-coa pathway dominates a subsurface ecosystem[J].PLoS ONE,2012,7(1):e30559.
[24]刘丹,陈杰,罗惠波,等.浓香型大曲中的枯草芽孢杆菌对固态混菌发酵体系的扰动效应[J].食品与发酵工业,2021,47(11):38-44.
[25]刘润泽,王世伟,王卿惠,等.解淀粉芽孢杆菌酶系及其应用研究进展[J].高师理科学刊,2019,39(3):6.