大曲作为中国白酒和醋酿造过程中的糖化发酵剂,具有自然接种的特点,其中丰富的菌系、酶系和物系对产品的风味和品质有重要影响[1-2]。在白酒生产过程中,大曲中丰富的微生物通过代谢活动驱动发酵过程[3-4]。
芽孢杆菌(Bacillus)是大曲中广泛存在且丰度较高的微生物类群[5-6],具有强大的水解酶系统,许多芽孢杆菌都具有较强的水解淀粉和蛋白质的能力[7-8]。芽孢杆菌作为胞外蛋白酶的高产菌株,可以将原料中的蛋白质类物质分解成小分子的氨基酸从而被其他微生物所利用,或产生多肽类物质[9-10]。同时,芽孢杆菌在发酵过程中可以产生如4-甲基愈创木酚、4-乙基愈创木酚等对人体有益的功能性物质[11-12]。愈创木酚类物质不但是白酒中的特征香气物质,同时具有细胞内抗氧化的功能[13-14]。ZHANG W等[15]利用分离得到的高产四甲基吡嗪的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)强化麸曲生产;WANG P等[16]研究发现,接种地衣芽孢杆菌(Bacillus licheniformis)后,大曲中微生物的相对丰度发生了变化,芽孢杆菌、曲霉、毕赤酵母属、糖杆菌属和其他微生物的相对丰度增加;YAN Z等[17]研究发现,某些地衣芽孢杆菌菌株具有抗菌活性。同时在食品发酵过程中,不同微生物间的相互作用造就了终产品的风味与品质[4]。因此,分离和利用性能优良的芽孢杆菌对白酒的酿造具有重要意义。
本研究首先采用传统培养法从中高温大曲中分离、鉴定芽孢杆菌,对其多样性进行分析;然后根据环境耐受性筛选优良菌株;最后再通过液态接种发酵验证功能微生物在发酵体系中的作用,利用代谢组学方法研究功能菌株的代谢特性,以期了解功能菌对大曲品质的影响,并为优化大曲的质量和稳定性提供理论依据。
1 材料与方法
1.1 材料与试剂
中高温大曲(粉末):安徽古井贡酒股份有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司;Ex Taq DNA聚合酶(5 U/μL):日本TaKaRa公司。其他试剂均为国产分析纯。
LB固(液)体培养基:北京奥博星生物技术有限公司。
发酵培养基:5 g麸皮,100 mL蒸馏水,121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
AG 223B1聚合酶链式反应(polymerase chain reaction,PCR)仪:德国EPPENDORF公司;UV-2802紫外分光光度计:美国UNICO公司;Mutiskan酶标仪:美国Thermo Fisher Scientific公司;7890B-5977A气相色谱质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:安捷伦科技有限公司;AVANCE II 500MHz核磁共振仪:德国Bruker公司。
1.3 方法
1.3.1 芽孢杆菌的分离及鉴定
分离:取5 g大曲样品于95 mL无菌磷酸盐缓冲液(phosphate buffer saline,PBS)中,振荡30 min后,按10倍梯度稀释至10-6,选取稀释度为10-4、10-5、10-6的稀释液分别涂布于LB固体培养基表面,置于37 ℃恒温培养箱中培养24 h。挑选单菌落划线于LB固体培养基上,进行多次分离纯化。
鉴定:采用细菌DNA提取试剂盒提取分离菌株的基因组DNA,以其为模板进行PCR扩增[18],PCR扩增产物用1%琼脂糖凝胶电泳检测。将PCR扩增产物送华大基因(北京)有限公司进行纯化并测序,并将双向测序结果应用Vector NTI软件处理,处理后将序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,最后得到鉴定结果。
1.3.2 环境耐受性测定
将分离得到的芽孢杆菌接种于LB液体培养基中,37 ℃、160 r/min条件下培养至OD600nm值为1.0±0.2时作为种子液;以2%(V/V)的接种量将种子液接种至pH值分别为3.0和4.0、乙醇体积分数分别为10%和15%的LB液体培养基,37 ℃、160r/min条件下培养,每隔24h取样测定培养液的OD600nm值。
1.3.3 液态接种发酵实验
以2%(V/V)的接种量将单株芽孢杆菌或两株芽孢杆菌混合培养液(1∶1)(OD600nm值为1.0±0.2)接种于发酵培养基,37 ℃、160 r/min条件下培养6 d。
1.3.4 代谢物测定
参照文献[19],以4-甲基-2-戊醇(125 mg/L)为内标,采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合GC-MS对发酵液中的挥发性风味物质进行测定。参照文献[20],采用核磁共振氢谱法(1hydrogen-nuclear magnetic resonance,1H-NMR)测定发酵液中非挥发性代谢物含量。
1.3.5 数据处理与分析
通过SPSSStatistics20.0软件中单因素方差分析,比较不同数据之间差异的显著性。通过Origin 8.0软件对不同发酵液中代谢物质进行主成分分析(principalcomponentanalysis,PCA),探究不同菌株发酵液代谢轮廓的相似和不同之处。
2 结果与分析
2.1 中高温大曲中芽孢杆菌的多样性
通过传统培养分离法及16S rRNA基因序列分析从中高温大曲中共分离鉴定到46株芽孢杆菌,结果见表1。
表1 中高温大曲中芽孢杆菌的鉴定结果
Table 1 Identification results of Bacillus strains in medium-high temperature Daqu

由表1可知,46株芽孢杆菌归属于10个种,分别为枯草芽孢杆菌(Bacillus subtilis)、贝莱斯芽孢杆菌(Bacillus velezensis)、苏云金芽孢杆菌(Bacillus thuringiensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、地衣芽孢杆菌(Bacillus licheniformis)、暹罗芽孢杆菌(Bacillussiamensis)、巨大芽孢杆菌(Bacillus megaterium)、蜡状芽孢杆菌(Bacil lus cereus)、假蕈状芽孢杆菌(Bacillus pseudomycoides)、萎缩芽孢杆菌(Bacillus atrophaeus),其中以贝莱斯芽孢杆菌和苏云金芽孢杆菌占比最高,分别占芽孢杆菌总数的21.74%和19.57%,其次是蜡状芽孢杆菌(15.22%),大曲中最为常见的地衣芽孢杆菌、枯草芽孢杆菌和解淀粉芽孢杆菌分别占芽孢杆菌总数的6.52%、8.70%和13.04%。芽孢杆菌是中高温大曲中的主要菌群[21],通过传统培养法可知,芽孢杆菌种类繁多,不同芽孢杆菌可能协同参与了白酒发酵过程,参与合成了白酒特征的风味代谢物。
2.2 芽孢杆菌对酿酒环境的耐受性
在白酒酿造过程中,酸度(pH)和乙醇含量最高分别能达到3和12%[22]。测定46芽孢杆菌对酿酒环境的耐受性,以确保微生物可以在酿酒环境中仍然发挥优良特性。结果发现,其中10株菌株对酿酒环境具有较高的耐受性。将测定结果进行标准化后绘制热图[23],结果见图1。由图1可知,10株芽孢杆菌在pH 4.0酸性条件下,均表现出良好的耐受性,在体积分数10%和15%的乙醇环境条件下耐受性均较弱,体积分数为10%的乙醇已抑制多数芽孢杆菌的生长。其中,菌株BA-5、BS-7和BV-10对酸性和乙醇都表现出相对较强的耐受能力。

图1 芽孢杆菌对酿酒环境的耐受性测定结果
Fig.1 Determination results of tolerance of Bacillus strains to brewing environment
2.3 芽孢杆菌挥发性代谢轮廓特征
为了测定芽孢杆菌在酿酒环境中的代谢特征,对菌株BA-5、BS-7和BV-10的单菌株和不同芽孢杆菌混合菌株发酵液的挥发性风味物质进行测定,共得到23种挥发性代谢物。基于挥发性代谢物对不同菌株发酵液进行主成分分析,结果见图2。
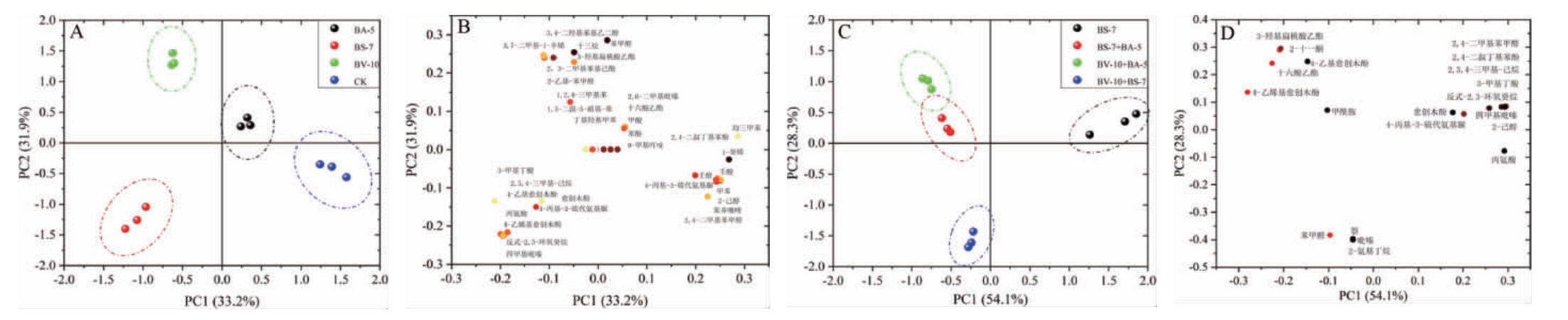
图2 基于挥发性代谢物不同菌株发酵液的主成分分析结果
Fig.2 Results of principal component analysis of fermentation broth of different strains based on volatile metabolites
A为单菌株发酵液中挥发性代谢物的PCA得分图;B为单菌株发酵液中挥发性代谢物的PCA载荷图;C为混合菌株发酵液中挥发性代谢物的PCA得分图;D为混合菌株发酵液中挥发性代谢物的PCA载荷图。
由图2可知,单菌株发酵液的挥发性代谢物PC1和PC2的方差贡献率分别为33.2%和31.9%,累计方差贡献率为65.1%,说明两个主成分能够解释各样品之间的绝大部分差异。主成分分析结果表明,单菌株发酵后挥发性代谢物得到了明显的区分。菌株BA-5发酵液与1,2,4-三甲基苯、2,3-二甲基苯基己酯、2-乙基苯甲醛、1,3-二溴-5-硝基苯等表现出较强的正相关;菌株BS-7发酵液与四甲基吡嗪、愈创木酚、4-乙基愈创木酚、4-乙烯基愈创木酚等表现出较强的正相关;菌株BV-10发酵液与苯酚、2,4-二叔丁基苯酚、2,6-二甲基吡嗪、均三甲苯和十六酸乙酯表现出较强的正相关,说明不同芽孢杆菌对对挥发性代谢物贡献有所不同。
由图2亦可知,混合菌株发酵液的挥发性代谢物PC1和PC2的方差贡献率分别为54.1%和28.3%,累计方差贡献率为81.4%,说明两个主成分能够解释各样品之间的绝大部分差异,主成分分析结果表明,混合菌株发酵后的挥发性代谢物得到了明显的区分,说明混菌发酵对发酵液中的挥发性代谢物特征有一定影响。菌株BS-7和BA-5的混合发酵液与4-乙基愈创木酚、4-乙烯基愈创木酚、3-羟基扁桃酸乙酯和十六酸乙酯表现出较强的正相关;菌株BV-10和BS-7的混合发酵液与苯甲醛、萘和吡嗪表现出较强的正相关。根据PCA图中样品分布,混合菌株BV-10和BA-5的代谢特征和混合菌株BS-7和BA-5较为相似。
综上所述,菌株BS-7单独发酵时能够产生较多的愈创木酚、四甲基吡嗪、2,4-二叔丁基苯酚和2,4-二甲基苯甲醛,与ZHANG R等[24]的研究结果一致,说明芽孢杆菌在白酒固态发酵风味产生方面有重要贡献。由于愈创木酚类物质是白酒中重要的特征香气及健康因子[11-14],本研究进一步对3种愈创木酚类物质(愈创木酚、4-乙基愈创木酚、4-乙烯基愈创木酚)的含量进行分析,结果见图3。
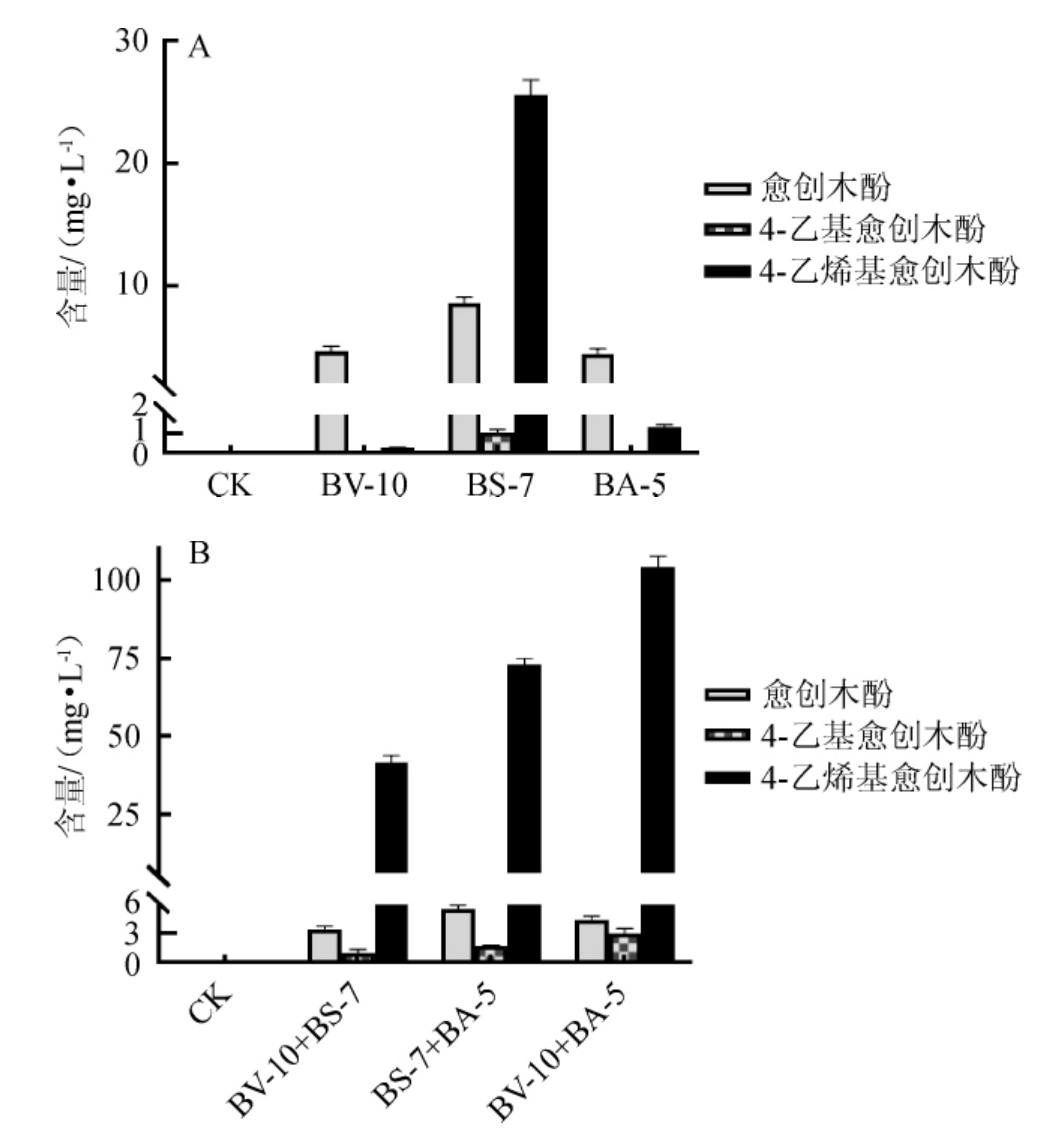
图3 单菌株(A)及混合菌株(B)发酵液中愈创木酚类物质含量的测定结果
Fig.3 Determination results of guaiacol contents in fermentation broth of single strain (A) and mixed strain (B)
由图3可知,愈创木酚普遍存在于芽孢杆菌发酵液中,愈创木酚在菌株BS-7发酵液中含量最高,为8.56 mg/L,在菌株BS-7分别与菌株BV-10、BA-5的混合发酵液中含量有所下降。单菌发酵时,只在菌株BS-7发酵液中检测到4-乙基愈创木酚(1.07 mg/L),混菌发酵时,在不同组间均检测到4-乙基愈创木酚。在单菌和混菌发酵液中均检出4-乙烯基愈创木酚,单菌发酵时,在菌株BS-7发酵液中含量最高(25.57 mg/L);混菌发酵时,在菌株BV-10与BA-5的混合发酵液中含量最高(104.47 mg/L),而在菌株BV-10与BS-7的混菌发酵液中含量较低(41.67 mg/L),说明了菌株BV-10和BA-5之间存在协同作用。在复杂微生物群落中,微生物间相互作用类型和强度同时影响着功能微生物的作用[25]。结果表明,芽孢杆菌在酒精发酵过程中促进了愈创木酚类功能物质的产生,不同芽孢杆菌间的相互作用可能影响愈创木酚类物质含量。
2.4 芽孢杆菌非挥发性代谢轮廓特征
从单菌株和不同芽孢杆菌混合菌株发酵液中共检测到52种非挥发性代谢物,包括11种糖类物质、14种醇类物质、12种氨基酸类物质、15种有机酸及衍生物和其他物质,结果见图4。
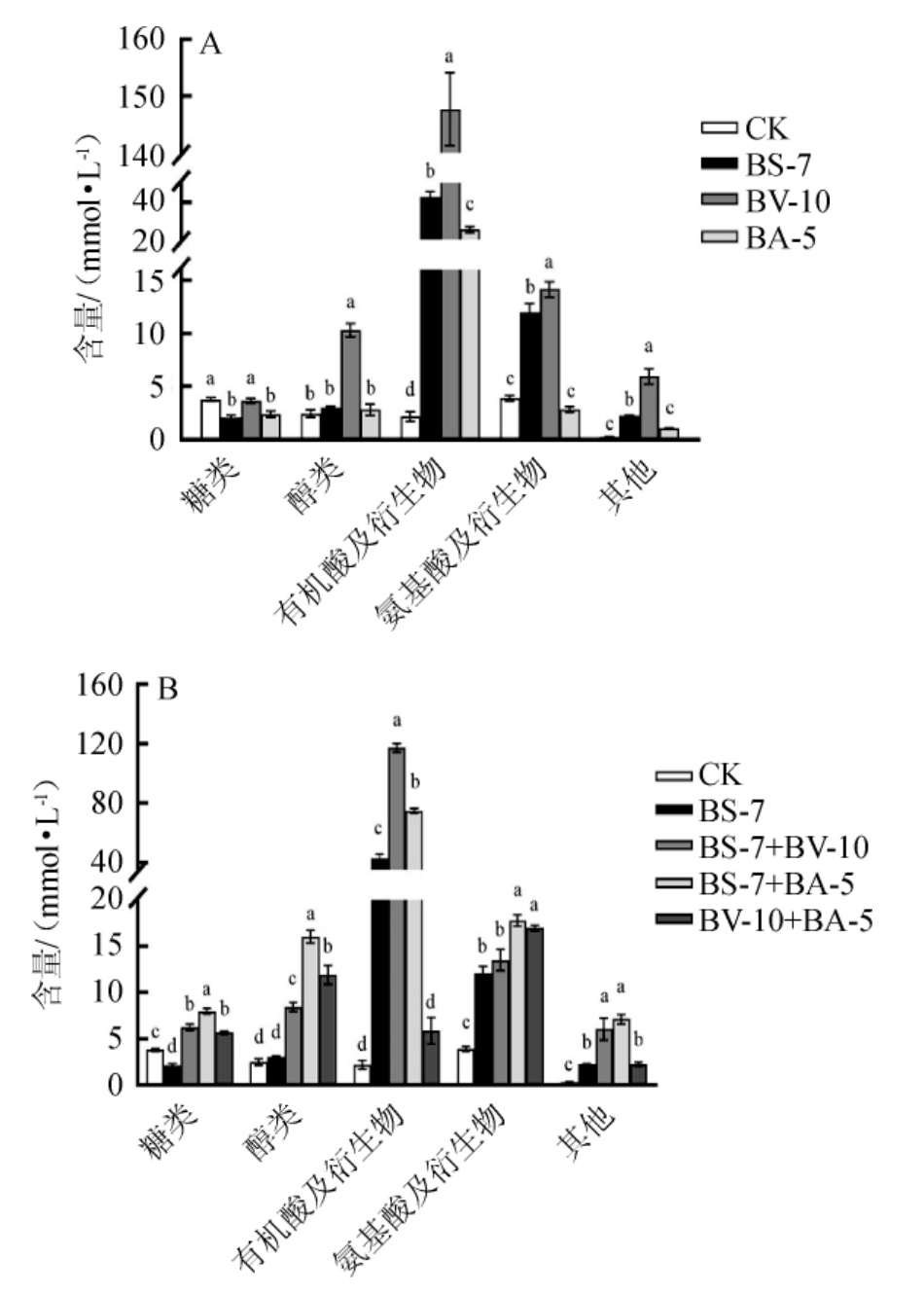
图4 单菌株(A)和混合菌株(B)发酵液中非挥发性代谢物含量测定结果
Fig.4 Determination results of non-volatile metabolites contents in fermentation broth of single strain (A) and mixed strain (B)
不同小写字母表示差异显著(P<0.05)。
由图4可知,糖类物质方面,单菌发酵时,菌株BV-10发酵液中的糖类物质含量最高(4.2 mmol/L);混菌发酵时,菌株BS-7和BA-5的混合发酵液中糖类物质含量最高(8.6 mmol/L)。醇类物质方面,单菌发酵时,菌株BV-10发酵液中的醇类物质能力最高(12.1 mmol/L);混菌发酵时,菌株BS-7和BA-5的混合发酵液中醇类物质含量最高(16.2 mmol/L)。有机酸及衍生物方面,单菌发酵时,菌株BV-10发酵液中的有机酸及衍生物含量最高(147 mmol/L);混菌发酵时,菌株BS-7和BV-10的混合发酵液中有机酸及衍生物含量最高(116 mmol/L),且所有发酵液中的有机酸及衍生物含量均显著高于对照组CK(P<0.05)。氨基酸及衍生物方面,单菌发酵时,菌株BV-10发酵液中的氨基酸及衍生物含量最高(14.6 mmol/L);混菌发酵时,菌株BS-7和BA-5混合发酵液中氨基酸及衍生物含量最高(17.6mmol/L)。总体上看,单菌株BV-10产非挥发性代谢物能力最强,尤其在生成醇类物质及有机酸类物质的能力方面,菌株BS-7和BV-10在分解蛋白质方面的能力较强。混合菌株发酵时,整体氨基酸形成能力增强。虽然单菌株BS-7和BA-5单菌株发酵时,产生醇类物质含量较低,但其混合培养后,醇类物质含量显著增强。
根据非挥发性代谢物构成,对各组发酵液样品进行PCA,结果见图5。
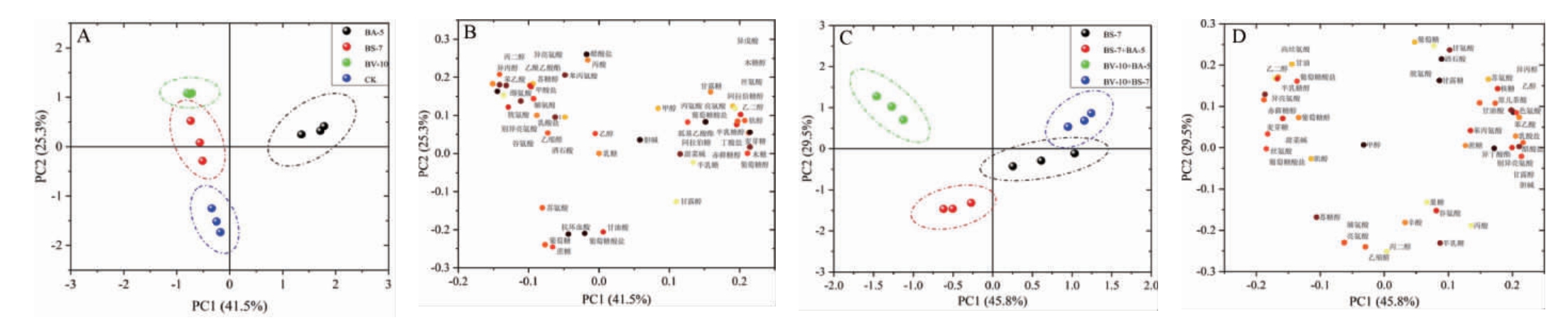
图5 基于非挥发性代谢物不同菌株发酵液的主成分分析结果
Fig.5 Results of principal component analysis of fermentation broth of different strains based on non-volatile metabolites
A为单菌株发酵液中非挥发性代谢物的PCA得分图;B为单菌株发酵液中非挥发性代谢物的PCA载荷图;C为混合菌株发酵液中非挥发性代谢物的PCA得分图;D为混合菌株发酵中非挥发性代谢物的PCA载荷图。
由图5可知,单菌株发酵液中非挥发性物质PC1和PC2的方差贡献率分别为41.5%和25.3%,累计方差贡献率为66.8%,说明两个主成分能够解释各样品之间的绝大部分差异。其中菌株BS-7和BV-10两组聚在一起,整体处于PC1的负方向上,与苏氨酸、谷氨酸、胱氨酸、缬氨酸、异亮氨酸、脯氨酸和苯丙氨酸等氨基酸类物质以及蔗糖、葡萄糖呈现出较强的正相关,氨基酸作为标志性代谢物的特征较明显,这可能与其所具有的分泌蛋白酶能力有关[8]。菌株BA-5与半乳糖、阿拉伯糖等糖类物质以及阿拉伯糖醇、赤藓糖醇、葡萄糖醇和木糖醇等多元醇类物质表现出较强的正相关,多元醇作为标志性代谢物的特征明显,说明菌株BA-5产生多元醇的能力较强,此结果与WOLDEMARIAMYOHANNES K[26]所得结果一致,解淀粉芽孢杆菌对醇类物质的产生有重要贡献。
由图5亦可知,混合菌株发酵液中非挥发性物质PC1和PC2的方差贡献率分别为45.8%和29.5%,累计方差贡献率为65.3%,说明说明两个主成分能够解释各样品之间的绝大部分差异。菌株BV-10和BS-7的混合发酵液与菌株BS-7的单菌株发酵液较为相似。菌株BS-7和BA-5的混菌发酵液与脯氨酸、亮氨酸、苏糖醇和肌醇呈较强的正相关。菌株BV-10和BS-7的混菌发酵液与甘氨酸、胱氨酸、苏氨酸等氨基酸类物质,葡萄糖、蔗糖、核糖等糖类物质和酒石酸、原儿茶酸、苯乙酸等有机酸及其衍生物表现出较强的正相关。菌株BV-10和BA-5的混菌发酵液与甘油、半乳糖醇、赤藓糖醇、葡萄糖醇等多元醇类物质和氨基酸类物质表现出较强的正相关,说明接种不同芽孢杆菌对非挥发性代谢物的贡献不同,多菌株协同作用对白酒发酵起到重要作用。
3 结论
通过对中高温大曲中芽孢杆菌多样性及酿酒环境耐受性进行筛选,从49株芽孢杆菌中得到3株耐受性优良的芽孢杆菌菌株,分别为解淀粉芽孢杆菌(Bacillus amyloliq-uefaciens)BA-5、枯草芽孢杆菌(Bacillus subtilis)BS-7和贝莱斯芽孢杆菌(Bacillus velezensis)BV-10。对其单菌株和混合菌株共培养时的代谢特性进行初探,发现愈创木酚类物质普遍存在于芽孢杆菌发酵液中,其中以菌株BS-7单独培养时含量最高,为8.56 mg/L。同时芽孢杆菌混合发酵会导致4-乙烯基愈创木酚的生成量增多,在菌株BV-10和BA-5混合培养后,达到104.47 mg/L。结果表明,芽孢杆菌单菌株及种间协同作用对白酒酿造中的特征物质形成具有重要影响。
[]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[2]ZHENG X W,HAN B Z.Baijiu,Chinese liquor:history,classification and manufacture[J].J Ethn Foods,2016,3(1):19-25.
[3]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J]. J Agr Food Chem,2018,66(22):5425-5432.
[4]HUANG X N,FAN Y,LU T,et al.Composition and metabolic functions of the microbiome in fermented grain during light-flavor Baijiu fermentation[J].Microorganisms,2020,8(9):1281.
[5]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter (Fen-Daqu),revealed by culture-dependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[6]施安辉,关纪奎,张文璞,等.徐坊大曲的微生物区系及其优势菌的鉴定[J].酿酒科技,2001(6):26-28.
[7]RAI A K,SANJUKTA S,CHOURASIA R,et al.Production of bioactive hydrolysate using protease,β-glucosidase and α-amylase of Bacillus spp.isolated from kinema[J].Bioresource Technol,2017,235:358-365.
[8]CONTESINI F J,DE MELO R R,SATO H H.An overview of Bacillus proteases:from production to application[J].Crit Rev Biotechnol,2018,38(3):321-334.
[9]王梦超,郑宏臣,赵兴亚,等.实验室芽孢杆菌菌种库中高产蛋白酶、糖基转移酶菌株的测定与筛选[J].中国酿造,2020,39(12):81-85.
[10]SUMI C D,YANG B W,YEO I C,et al.Antimicrobial peptides of the genus Bacillus:A new era for antibiotics[J].Can J Microbiol,2015,61(2):93-103.
[11]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):51-57.
[12]施小明,徐岩,崔凤元,等.枯草芽孢杆菌在白酒生产中的应用[J].酿酒科技,2012(2):49-53.
[13]ZHAO D,SUN J,SUN B,et al.Intracellular antioxidant effect of vanillin,4-methylguaiacol and 4-ethylguaiacol:three components in Chinese Baijiu[J].Rsc Adv,2017,7(73):46395-46405.
[14]ARBAB S H,HUSSAIN R,KHAN Q F,et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu(starters):A review[J].Food Res Int,2020,138:109830.
[15]ZHANG W,SI G,RAO Z,et al.High yield of tetramethylpyrazine in functional Fuqu using Bacillus amyloliquefaciens[J].Food Biosci,2019,31:100435.
[16]WANG P,WU Q,JIANG X,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[17]YAN Z.Monitoring the ecology of Bacillus during Daqu incubation,a fermentation starter,using culture-dependent and culture-independent methods[J].J Microbiol Biotechnol,2013,23(5):614-622.
[18]黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[19]PANG X N,HAN B Z,HUANG X N,et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Sci Rep,2018,8(1):1-12.
[20]HUANG X N,YU S Z,HAN B Z,et al.Bacterial community succession and metabolite changes during sufu fermentation[J]. LWT-Food Sci Technol,2018,97:537-545.
[21]MAO J,LIU X,GAO T,et al.Unraveling the correlations between bacterial diversity,physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT-Food Sci Technol,2022,154:112764.
[22]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. Int J Food Microbiol,2011,146(1):31-37.
[23]QUAN J,CAI G,YANG M,et al.Exploring the fecal microbial composition and metagenomic functional capacities associated with feed efficiency in commercial DLY pigs[J].Front Microbiol,2019,10:52.
[24]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[25]BLASCHE S,KIM Y,MARS R A,et al.Metabolic cooperation and spatiotemporal niche partitioning in a kefir microbial community[J].Nat Microbiol,2021,6(2):196-208.
[26]WOLDEMARIAMYOHANNES K,WAN Z,YU Q,et al.Prebiotic,probiotic,antimicrobial,and functional food applications of Bacillus amyloliquefaciens[J].J Agr Food Chem,2020,68(50):14709-14727.