香菇作为一种药食两用菌有着广泛的用途。在药用方面,香菇中含有丰富的活性成分,在抗肿瘤、护肝、抗病毒、调节免疫力等方面有很好的功效[1-3],因此人们对香菇在医学领域的应用有着较深入的研究。在食用方面,香菇因其具有特殊的风味,深受人们的喜欢。鲜香菇高温加工制作成干香菇时,碳水化合物经过热降解、美拉德反应等化学变化从而产生香气[4],遗传、生长环境等多种因素亦会影响香菇的香气[5]。香菇的挥发性成分中,香味阈值以上的挥发性成分对风味起关键作用[6]。
香菇挥发性成分的萃取方法主要可分为两大类:溶剂萃取法和顶空萃取法。LIAO P H等[7]利用同时蒸馏萃取法(simultaneous distillation extraction,SDE)提取啤酒中的酯类化合物,发现该方法对设备要求简单,成本较低,但对蒸气压低的组分萃取不完全;MILLER K G等[8]在实验过程中发现,超临界流体萃取法(supercritical fluid extraction,SFE)无溶剂残留,但是实验过程中萃取物很容易将管路堵塞;FRANCHINA F A等[9]利用动态顶空吹扫-捕集技术对不同风味的啤酒进行鉴定,此方法可以减少热不稳定物质的分解,但操作繁琐、成本高;PAIVA A C等[10]综述了顶空固相微萃取(head space solid phase micro-extraction,SPME)对环境、食品、生物等样品的萃取,操作方便、重复性好、检测限可达到ng/g~pg/g级别,但分析结果受吸附头的影响较大。顶空固相微萃取(HS-SPME)是一种集采样、萃取、浓缩、进样于一体,操作简单、克服了固相萃取吸附剂孔道易堵塞缺点的萃取方法[11]。煎煮法和水蒸气蒸馏法对设备的要求较低,操作过程更加方便、简单,所需试剂无毒无害,提高了其应用效率。样品只需经过简单的处理便可利用HS-SPME进行富集。
挥发性成分常见的检测方法有:高效液相色谱(high performance liquid chromatography,HPLC)技术[12]、电子鼻技术[13]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术[14]。其中HPLC法操作简单、进样量小、检测准确性高;电子鼻可以通过传感器监测成分的微小变化,反映样品中整体挥发性化合物的信息,但传感器具有选择性、限制性,因此对于不同化合物需要更换不同传感器,成本较高。GC-MS可用于痕量物质分析,检测灵敏度高,消耗溶剂少,但在进行分析前需要进行复杂的处理,所用时间较长[15]。
因此本实验分别采用煎煮法、水蒸气蒸馏法处理干香菇,两种方法得到的香菇提取液的挥发性化合物的比较未见报道,特采用HS-SPME-GC-MS对干香菇游离态、键合态挥发性进行分析比较,为香菇的风味研究和应用提供参考。
1 材料与方法
1.1 材料与试剂
干香菇:武汉海芳工贸发展有限公司。
正戊烷、乙酸乙酯、甲醇、乙醚、二氯甲烷、柠檬酸、磷酸氢二钠、氯化钠(均为分析纯)、仲辛酮(纯度≥99.9%):国药集团化学试剂有限公司;安博莱特(Amberlite)XAD-2大孔吸附树脂(粒径0.25~0.83 mm):美国Supelco公司;纤维二糖酶(130 U/g):美国Sigma-Aldrich公司。
1.2 仪器与设备
雷磁PHS-3C型pH计:上海精密科学仪器有限公司;RE-2000B型旋转蒸发器:上海贤德实验仪器有限公司;SHZ-Ⅲ循环水式多用真空泵:临海谭式真空泵设备有限公司;6890N/5975MSD气质联用仪:美国Agilent公司;固相微萃取头(50/30 μm DVB/CAR/PDMS):美国Supelco公司;针捕集动态针(0.7 cm Carboxen1000、0.7 cm DVB、0.7 cm PDMS):德国PAS公司;CONCEPT多功能样品前处理系统:德国PAS公司;20 mL带隔垫(1.5 mm)顶空螺纹口样品瓶:美国Agilent公司。
1.3 实验方法
1.3.1 香菇提取液的制备
取100.0 g干香菇菌盖置于粉碎机内粉碎,称取等量45.0 g香菇粉末分别放于两个三颈烧瓶中,分别采用煎煮法和水蒸气蒸馏法提取5 h,冷却,减压过滤,分别得到400 mL香菇提取液。
1.3.2 样品中游离态挥发性组分的前处理
取8 mL香菇提取液置于20 mL顶空螺纹口样品瓶中,再分别向其中加入2.0 g NaCl、磁力搅拌子,以20 μL仲辛酮(1.010 2 g/L)为内标制成游离态挥发性组分的待测样品。两种方法得到的香菇提取液各重复3次实验,并直接用于GC-MS进行检测。
1.3.3 样品中键合态挥发性组分的前处理
利用索氏提取法提取活化安博莱特XAD-2大孔吸附树脂,正戊烷、乙酸乙酯、甲醇依次回流处理30.0 g树脂,每个溶剂回流处理12 h,然后将甲醇作为溶剂湿法装柱。
首先用1 000 mL去离子水平衡树脂,洗至无醇味;上350 mL香菇提取液样品,控制流速为3 mL/min,待提取液距离树脂上端3 cm时关闭层析柱开关,静置过一夜,依次用500 mL去离子水、400 mL乙醚-戊烷(1∶1,V/V)溶剂淋洗,除去水溶性的糖、酸、游离态挥发性化合物等;用450 mL甲醇对待测成分进行洗脱并旋蒸至近干(水浴温度35 ℃)。
配制0.1 mol/L柠檬酸-0.2 mol/L磷酸氢二钠缓冲溶液(pH 5.2),将样品少量多次的溶解在30 mL缓冲液中。为保证结果的准确性,降低残存的游离态组分对结果的影响,因此用90 mL等体积比的二氯甲烷-正戊烷溶剂分3次进行萃取。取下层水相加入500 mg纤维二糖酶进行酶解,为保证酶的最佳活性,将样品置于37 ℃恒温箱中。酶解48 h后取8 mL溶解液置于20 mL顶空螺纹口样品瓶中,再分别向其中加入2 g NaCl、磁力搅拌子,以20 μL仲辛酮(1.010 2 g/L)为内标制成键合态挥发性组分的待测样品,重复3次,用于GC-MS检测。
1.3.4 GC-MS 分析条件
HS-SPME:50 ℃平衡30 min,50 ℃萃取80 min,解吸5 min。
GC条件:J&W HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;载气(He)流速1 mL/min;分流进样,分流比5∶1。程序升温:起始温度60 ℃,以10 ℃/min升至110 ℃;以15 ℃/min升至140 ℃,保持10 min;以10 ℃/min升至180 ℃,保持3 min;以10 ℃/min升至250 ℃,保持5 min;以10 ℃/min升至280 ℃。
MS条件:离子源温度230 ℃;电子电离(electron ionization,EI)源模式;电子能量70 eV;质量扫描范围45~550 u;扫描方式:全扫描;调谐文件为标准调谐。
1.3.5 定性定量分析方法
利用GC-MS分析检测,借助C6~C20正构烷烃的保留时间计算色谱峰的保留指数(retention index,RI),参照美国国家标准与技术研究院(national institute of standards and technology,NIST)08数据库对谱图进行初步检索及质谱分析,比对文献报道的保留指数,对各个色谱峰辅助定性。
以20 μL仲辛酮的乙醇溶液(1.010 2 g/L)为内标物,采用内标法定量。根据式(1)计算挥发性成分的含量[16]。
式中:xi表示组分含量,μg/L;ms表示内标化合物质量浓度,μg/L;Ai表示化合物的峰面积;As表示内标物峰面积;fi表示待测组分对内标物的质量校正因子(量纲为1)。
2 结果与分析
采用HS-SPME富集不同方法提取的干香菇菌盖中挥发性成分,利用GC-MS对化合物进行检测,结果见图1。由图1可知,利用煎煮法得到的香菇提取液中游离态挥发性成分有41种,键合态挥发性成分有19种;利用水蒸气蒸馏法得到的香菇提取液中游离态挥发性成分有42种,键合态挥发性成分有19种。
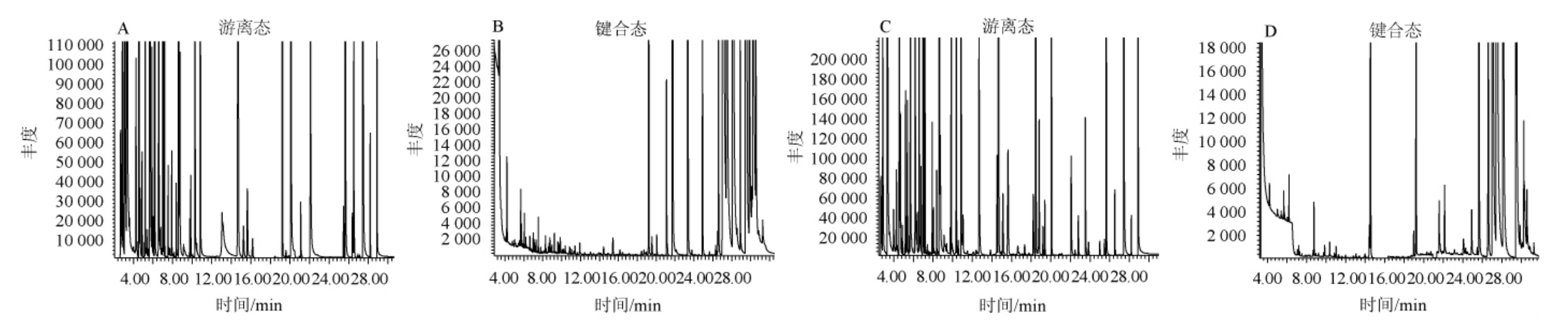
图1 煎煮法(A、B)及水蒸气蒸馏法(C、D)得到香菇提取液中挥发性成分GC-MS分析总离子流色谱图
Fig.1 Total ion chromatogram of volatile components in Lentinus edodes extract by decocting method (A,B) and steam distillation method (C,D) analyzed by GC-MS
由于流动相的极性大于固定相的极性,且根据图1,对于游离态挥发性成分来说,保留时间较短的时候峰个数比较多,说明游离态挥发性成分中含极性较大的物质种类比较多;对于键合态挥发性成分来说,保留时间较长的时候峰个数比较多,说明键合态挥发性成分中含极性较小的物质种类比较多。
以内标法进行定量分析,解析干香菇菌盖中挥发性成分的具体物质及含量,结果如表1所示。
表1 干香菇挥发性成分分析结果
Table 1 Analysis results of volatile components in dried Lentinus edodes
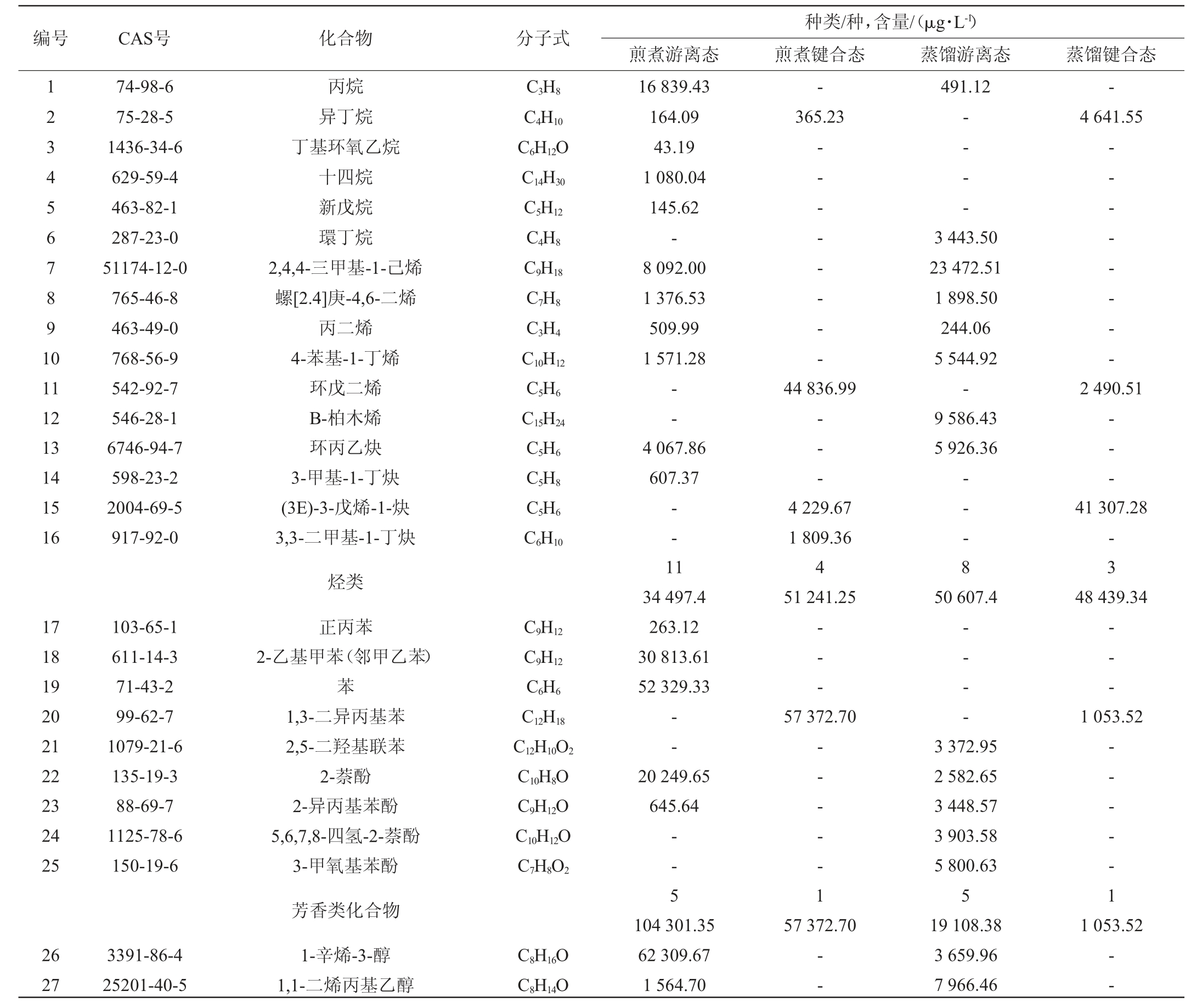
续表
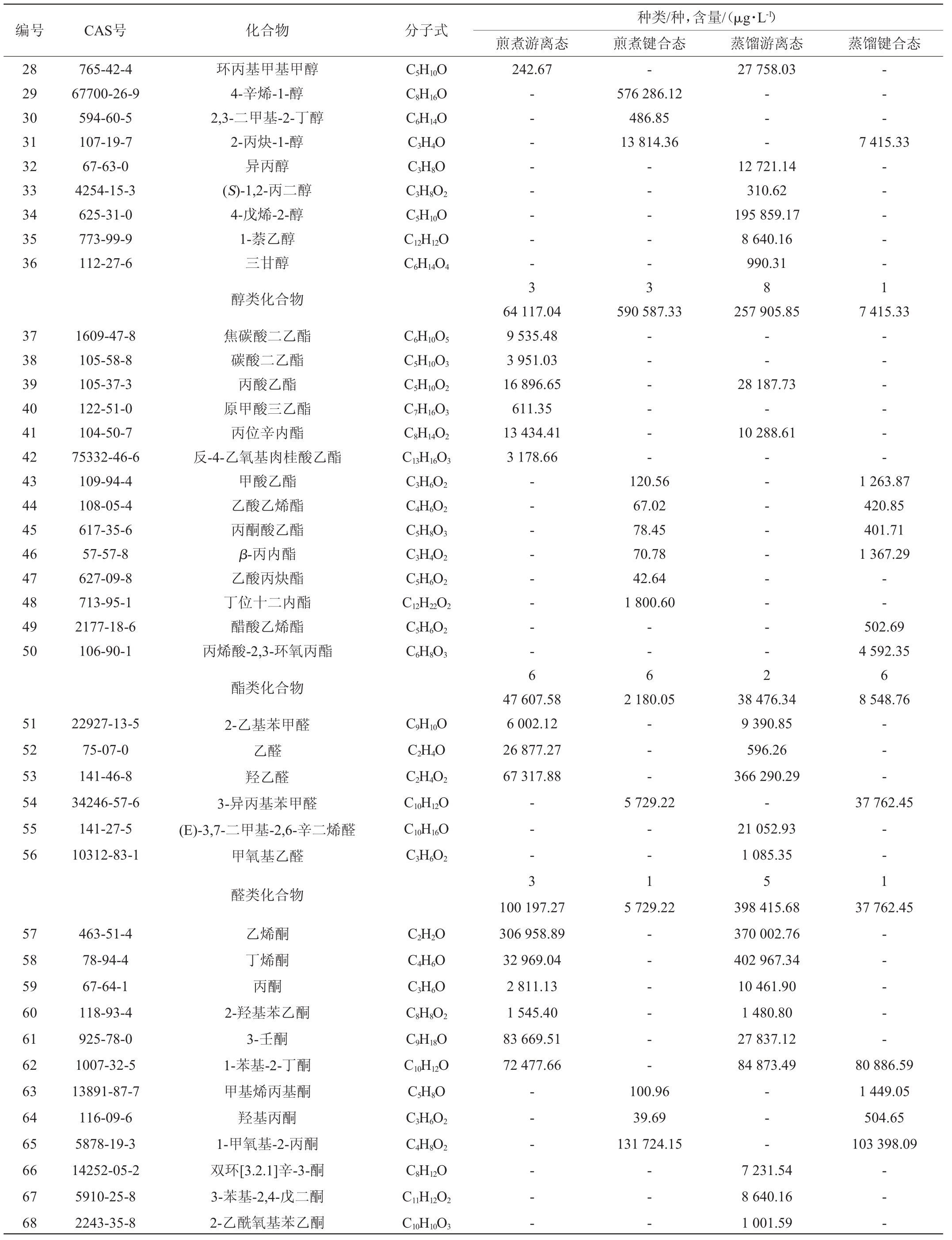
续表
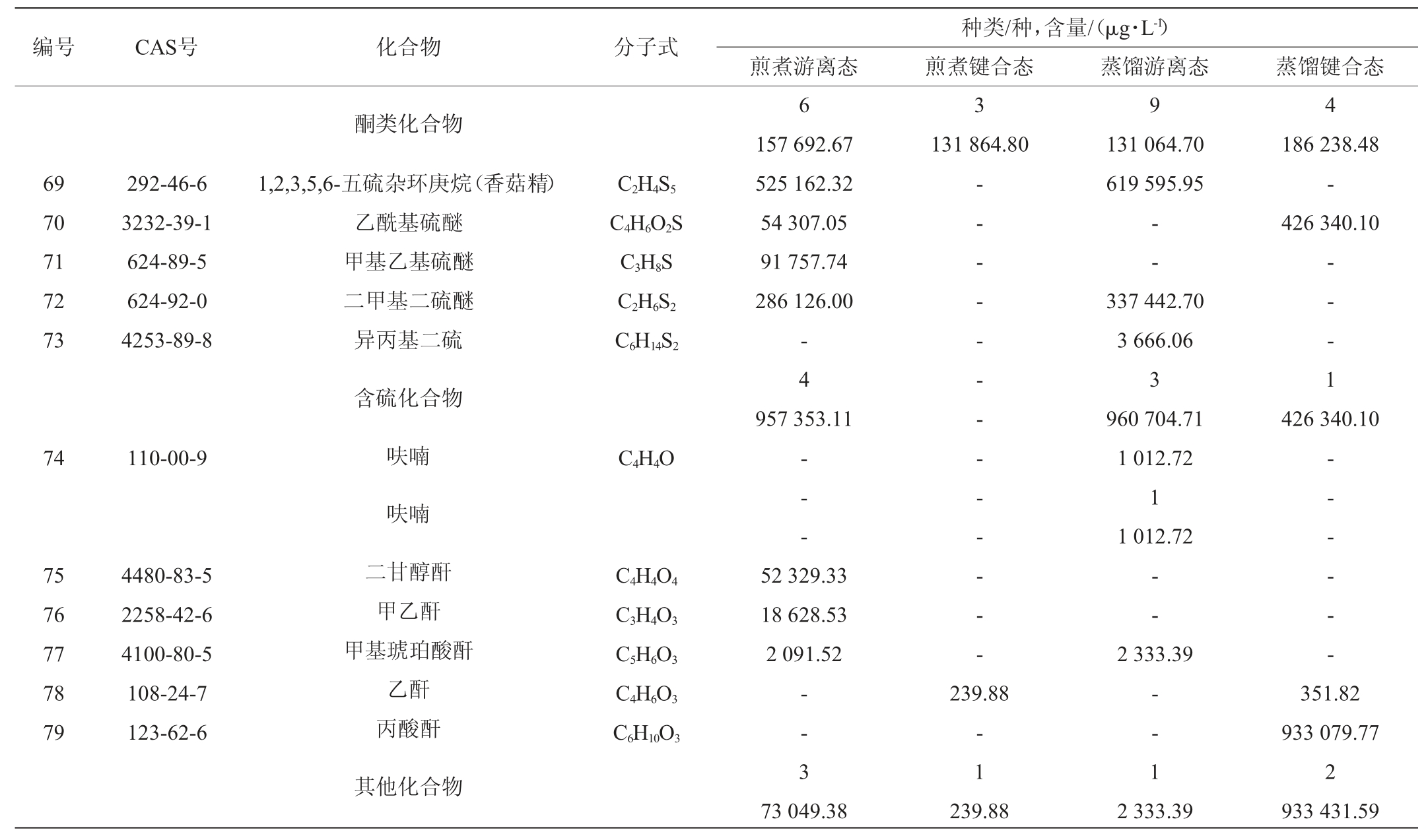
注:“-”表示未检出或低于检测限。
根据表1可得,两种方法提取的干香菇中共同的游离态挥发性成分23种,共同的键合态挥发性成分14种。利用煎煮法得到的香菇提取液中,含有烃类(15种)、芳香类(6种)、醇类(6种)、酯类(12种)、醛类(4种)、酮类(9种)、含硫化合物(4种)等化合物,其中含硫化合物的含量最多;利用水蒸气蒸馏法得到的香菇提取液中,烃类(11种)、芳香类(6种)、醇类(9种)、酯类(8种)、醛类(6种)、酮类(13种)、含硫化合物(4种)、呋喃(1种)等化合物,其中含硫化合物的含量最多。两种方法都是游离态的种类及含量多于键合态,利用两种方法得到的香菇提取液的挥发性成分有所差异,利用水蒸气蒸馏法得到的香菇提取液中检测到呋喃,而利用煎煮法得到的香菇提取液中未检测到。
虽然香菇中含有众多挥发性化合物,但起主要作用有两类:以醇为主的八碳化合物和含硫化合物[17]。在脂肪氧化酶催化亚油酸时会产生有特征蘑菇风味的八碳化合物[18],其中最为突出的成分是1-辛烯-3-醇,在鲜香菇中有着特殊的地位,干香菇中亦可检测到,但其含量低于鲜香菇。如表1所示,两种不同方法处理的香菇的游离态中都可检测到1-辛烯-3-醇,在利用煎煮法得到的香菇提取液的游离态中含量为4.05%,在利用水蒸气蒸馏法得到的香菇提取液的游离态中含量为0.20%。含硫化合物是主要影响干香菇的风味的物质,如表1中二甲基二硫醚、1,2,3,5,6-五硫环庚烷等。香菇酸作为香菇中的前体化合物,在补谷氨酸基转肤酶和半胧氨酸亚矾裂解酶的催化下,经过二硫环丙烷中间体聚合成1,2,3,5,6-五硫环庚烷(香菇精)[19]。香菇精的热稳定性较差,容易受温度的影响,在其形成的过程中伴随着二甲基二硫醚等含硫化合物的产生[20]。
如表1所示,通过煎煮法、水蒸气蒸馏法处理的干香菇菌盖的游离态、键合态中,含硫化合物的含量分别为957 353.11 μg/L、0、960 704.71 μg/L、426 340.10 μg/L。不同处理方法影响香菇挥发性成分,刘璐等[21]研究发现,利用蒸汽漂烫、沸水漂烫处理鲜香菇大大影响了香菇中含硫化合物的相对含量,蒸汽烫漂鲜香菇,含硫化合物相对含量增至87.64%;香菇经沸水烫漂,含硫化合物降为2.85%。本实验采用煎煮的方式处理干香菇,得到的香菇提取液的含硫化合物含量为40.3%,经水蒸气蒸馏得到的香菇提取液中含硫化合物的相对含量为39.5%。杨肖等[22]用不同方法处理香菇,用SPME-GC-MS技术检测不同状态香菇中的挥发性成分,总共检测到72种挥发性成分。本实验采用两种不同方法处理干香菇,利用HS-SPME-GC-MS检测分析,在干香菇菌盖中得到79种挥发性成分。安晶晶等[23]采用SDE-GC-MS技术,从鲜香菇和干香菇两种不同状态的香菇出发,对其风味成分进行了对比。本实验以干香菇为研究对象,研究了影响其风味物质的化合物含量,将鲜香菇加热干燥制成干香菇的过程中,八碳化合物氧化分解,含量越来越少,相反,含硫化合物的含量增多,成为干香菇的重要风味物质。李文等[24]分析香菇不同阶段特征性挥发性成分,在其6个生长阶段中,总共检测到134种起重要作用的挥发性化合物。本实验分别采用煎煮法、水蒸气蒸馏法提取干香菇菌盖中挥发性成分,利用HS-SPME-GC-MS对挥发性成分进行富集、检测,不同方法处理的香菇得到的挥发性成分的含量和种类有所不同。香菇的挥发性成分种类繁多,正是由含硫化合物、以醇类为主的八碳化合物、醚类等物质共同作用影响了香菇特殊的风味[25]。
3 结论
通过采用HS-SPME-GC-MS对煎煮法、水蒸气蒸馏法得到的香菇提取液进行富集、检测分析,分别检测其游离态挥发性成分和键合态挥发性成分。利用煎煮法得到的香菇提取液的游离态挥发物41种,键合态挥发物19种;利用水蒸气蒸馏法得到的游离态挥发物42种,键合态挥发物19种。分别利用煎煮法、水蒸气蒸馏法得到的香菇提取液,挥发性成分的数量相近,但是在含量、种类上有所差异。相较于煎煮法,水蒸气蒸馏法处理的香菇风味更浓郁,主要是因为香菇提取液中挥发性成分的含量更高,尤其是决定干香菇特殊风味物质的含硫挥发性化合物的含量更高,如二甲基二硫醚、1,2,3,5,6-五硫环庚烷等,因此在对干香菇进行精深加工时采用水蒸气蒸馏法保证了香菇类产品浓郁的独有风味。不仅满足了大众对香菇风味的需求,还为香菇的发展带来经济效益。经过HS-SPME吸附萃取,与GC-MS检测分析,简单快速、高灵敏度、高效的检测到干香菇中挥发性组分,为开发香菇的风味物质产品提供方法学的支撑。
[1]蒋敏,陈若冰,陈涛.香菇活性成分提取工艺研究及药理学研究进展[J].生命的化学,2018,38(6):797-802.
[2]张淇淇,周良,朱俊豪,等.香菇的药用价值及其产品开发前景[J].长江蔬菜,2020,37(2):38-43.
[3]林金楠,韩盼盼,范亚玲,等.蘑菇菇脚的活性成分、营养价值及应用研究进展[J].天津农业科学,2019,25(6):37-41.
[4]ZHANG P Y,SUN H Y,FANG T,et al.Effects of nitric oxide treatment on flavour compounds and antioxidant enzyme activities of button mushroom (Agaricus bisporus) during storage[J].Food Qual Safety,2020,4(3):135-142.
[5]CHEN Z Q,GAO H Y,WU W J,et al.Effects of fermentation with different strains on the umami taste of Shiitake mushroom(Lentinus edodes)[J].LWT-Food Sci Technol,2021,141(12):110889.
[6]LAI C L,YANG J S,LIU M S.Effects of c-irradiation on the flavour of dry shiitake(Lentinus edodes Sing)[J].J Sci Food Agr,1994,64(1):19-22.
[7]LIAO P H,YANG H H,WU P C,et al.On-line coupling of simultaneousdistillation-extraction using likens-nickerson apparatus with gas chromatography[J].Anal Chem,2020,92:1228-1235.
[8]MILLER K G,POOLE C F,CHICHILA T M P.Solvent-assisted supercritical fluid extraction for the isolation of semivolatile flavor compounds from the cinnamons of commerce and their separation by series-coupled column gas chromatography[J].J Sep Sci,1995,18(8):461-471.
[9]FRANCHINA F A,ZANELLA D,LAZZARI E,et al.Investigating aroma diversity combining purge-and-trap,comprehensive two-dimensional gas chromatography,and mass spectrometry[J].J Sep Sci,2019,43(9-10):1790-1799.
[10]PAIVA A C,CRUCELLO J,PORTO N A,et al.Fundamentals of and recent advances in sorbent-based headspace extractions[J].Trends Anal Chem,2021,139(3):116252-116269.
[11]孙伶俐,董婧,段正超,等.柠檬果茶中游离态和键合态挥发性成分分析[J].分析试验室,2020,39(4):394-398.
[12]汪冬冬,鲍永碧,管锐,等.温度对甘蓝泡菜发酵过程中风味的影响[J].食品与发酵工业,2021,47(2):233-240.
[13]CHI X L,SHAO Y W,PAN M H,et al.Distinction of volatile flavor profiles in various skim milk products via HS-SPME-GC-MS and E-nose[J].Eur Food Res Technol,2021,247(6):1539-1551.
[14]TIAN P,ZHAN P,TIAN H L,et al.Analysis of volatile compound changes in fried shallot(Allium cepa L.var.aggregatum)oil at different frying temperatures by GC-MS,OAV,and multivariate analysis[J].Food Chem,2021,345:128748.
[15]杨旖旎,杨桂秋,杨小洪,等.老鹰茶游离和键合态挥发性成分的分析[J].食品与发酵工业,2019,45(3):254-260.
[16]梁淼,杨艳,石嘉悦,等.酶/酸水解毛叶木姜子中键合态香味成分的比较[J].精细化工,2020,37(5):989-996.
[17]TASAKI Y,KOBAYASHI D,SATO R,et al.Variations of 1-octen-3-ol and lipoxygenase gene expression in the oyster mushroom Pleurotus ostreatus according to fruiting body development,tissue specificity,maturity,and postharvest storage[J].Mycoscience,2019,60(3):170-176.
[18]涂宝军,陈尚龙,马庆昱,等.3种干燥方式对香菇挥发性成分的影响[J].食品科学,2014,35(19):106-110.
[19]张书香,谢建春,孙宝国.固相微萃取/气-质联用分析香菇挥发性香味成分[J].北京工商大学学报(自然科学版),2010,28(2):1-5,13.
[20]梁怡,刘改霞,李朋泰,等.不同培养基对香菇挥发性风味物质的影响[J].食品研究与开发,2020,41(24):17-23.
[21]刘璐,黄文,程薇,等.烫漂方式对香菇挥发性成分的影响[J].现代食品科技,2017,33(3):210-215,265.
[22]杨肖,张莉莉,孔琰,等.应用SPME-GC-MS对比分析4种不同处理方式下香菇中的挥发性风味成分[J].食品科技,2017,42(11):300-307.
[23]安晶晶,王成涛,刘国荣,等.鲜香菇与干香菇挥发性风味成分的GC-MS分析[J].食品工业科技,2012,33(14):68-71.
[24]李文,陈万超,杨焱,等.香菇生长过程中挥发性风味成分组成及其风味评价[J].核农学报,2018,32(2):325-334.
[25]XUN W,WANG G Y,ZHANG Y J,et al.Analysis of flavor-related compounds in four edible wild mushroom soups[J].Microchem J,2020,159:105548-105560.