解淀粉芽孢杆菌(Bacillus amyloliquefaciens)产生的抑菌物质主要有大分子抗菌蛋白类和小分子抑菌肽类细菌素如表面活性素(Surfactin)、枯草素(Iturin)与丰原素(Fengucin)[1]。由于近几年抗生素在农业领域的大量使用,导致寄生植物的微生物与动物体内的微生物产生相应耐药性,而小分子抑菌肽类细菌素具有绿色、无毒、安全、高效等优点被当成替代抗生素的主要物质之一。解淀粉芽孢杆菌作为一种高效的生防菌已被广泛应用于饲料行业、植物病虫害以及水果保鲜等领域[2-5]。由于小分子抑菌肽类产量低、提取方法复杂以及生产成本较高等因素制约其商业化的应用[6]。抑菌物质的粗提取是为后续进一步分离纯化获得单一抗菌物质、研究其特定结构的重要一步。
目前,粗提抑菌物质的方法主要有硫酸铵盐析[7]、有机溶剂萃取法[8]、酸沉淀法[9]以及凝胶柱层析法[10]等。硫酸铵盐析作为一种使用最为广泛的方法不仅可以保持蛋白或多肽的抑菌活性,而且成本低廉、操作简单[11]。例如王伟等[12]利用70%硫酸铵盐析粗提法提取出解淀粉芽孢杆菌(Bacillus amyloliquefaciens)W5所产的约12.3 kDa的细菌素;ZIMINA M I等[13]将培养18 h的短小芽孢杆菌(Bacillus pumilus)发酵液进行硫酸铵沉淀后,其细菌素的抑菌活性最高;PERUMAL V I等[14]将贝莱斯芽孢杆菌(Bacillus velezensis)发酵液经80%饱和硫酸铵盐析后,经过凝胶过滤层析得到6.5 kDa的细菌素。有机溶剂萃取法具有高效便捷、无残留、可蒸发去除等优点也作为常用的提取方法之一。花榜清[15]将牛类芽孢杆菌(Paenibacillus bovis sp.nov)发酵液利用乙酸乙酯、正丁醇、氯仿和石油醚四种有机溶剂萃取细菌素,比较后得出利用正丁醇的萃取效果最佳,且经过8次萃取之后,样品已基本无抑菌活性;YANG D等[16]利用甲醇从类芽孢杆菌(Paenibacillus)JSa-9发酵液中提取出对大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)均有抑制作用的3种拮抗化合物;樊丽娟等[17]利用乙酸乙酯和氯仿对内生解淀粉芽孢杆菌发酵液进行萃取,经质谱鉴定后,乙酸乙酯萃取物中存在10种独有化合物,而氯仿萃取物中存在11种独有化合物。酸沉淀法是利用上清液pH环境改变时对周边蛋白质吸附能力的改变来粗提抑菌物质。许亦峰等[18]利用酸沉淀法粗提枯草芽孢杆菌(Bacillus subtilis)发酵液,所得细菌素粗产物的效价是硫酸铵沉淀法的2倍,并且其产物的比活力提高了55.46%。不同的粗提方法对于后续分离纯化抗菌肽均有不同的影响,需要根据抑菌肽的性质与纯化的目的来决定。不同抑菌物质的粗提方法将会直接影响后续的纯化效率。
前期已筛选得到的一株产抑菌物质的解淀粉芽孢杆菌,为探究粗提抑菌物质的最适方法,本研究利用硫酸铵沉淀法、酸沉淀法、乙酸乙酯萃取法、甲醇抽提法以及凝胶过滤层析法对抑菌物质的粗提取与分析,为后续抑菌物质的进一步纯化及结构鉴定提供重要的实验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)A13:本实验室分离鉴定并保存;大肠杆菌(Escherichia coli):北京全式金生物技术有限公司。
1.1.2 化学试剂
蛋白胨、琼脂粉(均为生化试剂):北京Solarbio科技有限公司;氢氧化钠、氯化钠、乙酸乙酯(均为分析纯):天津市北辰方正试剂厂;盐酸(分析纯):廉江市爱廉化试剂有限公司;硫酸铵(分析纯):天津欧博凯化工有限公司;甲醇(分析纯):天津市致远化学试剂有限公司;Tris(Ultra Pure):北京酷来博生物科技有限公司;牛血清蛋白(bovine serum albumin,BSA)标准品(纯度>99%)、Bradford工作液:上海生工生物工程有限公司。
1.1.3 培养基及Buffer的配制
LB液体培养基:蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L,去离子水1 L,pH值调至6.5。121 ℃灭菌20 min。
LB半固体(软琼脂)培养基:LB液体培养基中加入琼脂粉8.0 g/L。121 ℃灭菌20 min。
LB固体培养基:LB液体培养基中加入琼脂粉15.0 g/L。121 ℃灭菌20 min。
1 mol/L Tris-HCl:121.1 g Tris,加超纯水约900 mL,用浓盐酸调pH值至8.0,后定容至1 L,置于4 ℃冰箱,备用。
Buffer A:37.5 mL 4 mol/L NaCl,20 mL 1 mol/L Tris-HCl,加超纯水定容至1 L,pH值调至7.5,过0.22 μm滤膜并超声30 min,置于4 ℃冰箱,备用。
1.2 仪器与设备
SQP电子天平、PB-10酸度计:赛多利斯科学仪器(北京)有限公司;SW-CJ-1FD超净工作台:南京菲奇工贸有限公司;85-2B恒温磁力搅拌器:江苏金怡仪器有限公司;YM50 50L立式压力蒸汽灭菌锅:上海高致精密仪器有限公司;J-26S XP高效离心机:贝克曼库尔特(美国)股份有限公司;xiande-2000A旋转蒸发器:上海贤德实验仪器有限公司;瑞士InfiniteF200多功能酶标仪:上海艾研生物科技有限公司;FD5-5安瓿冻干系统:西盟(美国)国际集团公司;SuperdexTM75凝胶层析柱(10 mm×310 mm,13 μm):上海基星生物科技有限公司;AKTA pure蛋白质层析纯化系统:美国Cytiva公司;GYCX-1450多功能层析柜:厦门国仪科学仪器有限公司。
1.3 方法
1.3.1 发酵上清液的制备[19]
将经过37 ℃、220 r/min振荡培养24 h的解淀粉芽孢杆菌A13发酵上清液经8 000 r/min、4 ℃离心10 min,去沉淀,即得解淀粉芽孢杆菌A13的发酵上清液。
1.3.2 抑菌实验
使用改良牛津杯法[20],即将灭菌的牛津杯(Φ6 mm×8 mm×10 mm)放置无菌培养皿中,倒入含有大肠杆菌菌液的LB软琼脂培养基,待培养基凝固后,用无菌镊子取出牛津杯,即形成孔洞,再向孔洞中加入100 μL试验样品,待样品风干后,倒置于30 ℃培养箱培养24 h,使用直尺测量其抑菌圈直径,直径>8 mm表明具有抑菌活性,直径越大说明抑菌效果越强。
1.3.3 细菌素粗提液的制备
(1)硫酸铵盐析法[21]
将硫酸铵固体缓慢加入100 mL发酵上清液中,使溶液中硫酸铵饱和度为10%、20%、30%、40%、50%、60%、70%、80%,在25 ℃下充分溶解后,转移至冷库(10 ℃)搅拌过夜,再经过8 000 r/min 离心20 min,去上清留沉淀,向沉淀中加入10 mL的Buffer A复溶,再次8 000 r/min离心10 min,将上清液过0.22 μm无菌滤膜,透析后并做抑菌验证,选取抑菌效果最佳的样品储存于-20 ℃冰箱并做后续试验。
(2)酸沉淀法[22]
将100 mL发酵上清液分为A与B组分别至于烧杯中,将其pH值调至2.0,放置4 ℃冰箱中过夜。A组先以8 000 r/min离心20 min后用10 mL Buffer A复溶,再用3 mol/L NaOH调pH值至中性;B组先用3 mol/L NaOH调pH值至中性,再以8 000 r/min离心20 min后用10 mL Buffer A复溶。两组复溶样品均过0.22 μm无菌滤膜并做抑菌验证,选取最佳组存于-20 ℃冰箱并做后续试验。
(3)甲醇抽提法[23]
将100 mL发酵上清液预冻后置于冷冻干燥机中,待其形成冻干粉后取出,加入与发酵上清液等体积的甲醇在磁力搅拌器上抽提6 h,结束后过0.22 μm滤膜并做抑菌验证,同时以甲醇为阴性对照做抑菌验证。再将滤液于旋转蒸发仪中于50 ℃、50 r/min条件下进行蒸干,再用10 mL Buffer A进行复溶,再次过无菌滤膜,存于-20 ℃备用。
(4)乙酸乙酯萃取法[24]
将100 mL发酵上清液置于烧杯中,按乙酸乙酯与发酵上清液体积比为0.5∶1.0、1.0∶1.0、2.0∶1.0、3.0∶1.0(V/V)进行萃取,搅拌均匀后,室温放置过夜,吸出有机相置于旋转蒸发仪中于50 ℃、50 r/min条件下进行蒸干,再用10 mL Buffer A进行复溶并过0.22 μm无菌滤膜进行抑菌验证,选择抑菌效果最佳比例样品存于-20 ℃备用。
1.3.4 粗提液回收率的计算
将硫酸铵盐析法、酸沉淀法、乙酸乙酯萃取法以及甲醇抽提法的粗提无菌滤液进行抑菌实验,以初始发酵上清液作为对照进行抑菌实验,分别测其抑菌圈直径大小。以抑菌圈面积比作为回收率值。具体公式如下:
式中:10为浓缩倍数;4为牛津杯外径半径,mm;R为粗提液抑菌圈半径,mm;r为发酵上清液抑菌圈半径,mm。
1.3.5 粗提液抑菌蛋白含量的测定[25]
分别配制不同浓度的牛血清蛋白(BSA)溶液,分别吸取BSA溶液与待测样品20 μL至96孔板中,再加入200 μL的Bradford工作液,反应5 min后,在酶标仪上测各孔在波长600 nm条件下的吸光度值。以蛋白质质量浓度(x)为横坐标,各孔在波长600 nm条件下的吸光度值(y)为纵坐标绘制标准曲线。测定待测样品时,每个样品设计3个重复,取平均值后根据标准曲线回归方程计算出蛋白质量浓度。
1.3.6 凝胶过滤层析分离纯化[26]
先用超纯水洗蛋白纯化系统与SuperdexTM75凝胶层析柱,再用Buffer A进行洗脱平衡后,分别将硫酸铵盐析法、酸沉淀法、乙酸乙酯萃取法以及甲醇抽提法的粗提备用液1 mL以1 mL/min的流速加入SuperdexTM75 层析柱中,以Buffer A作为梯度洗脱液,洗脱样品并在280 nm波长下检测蛋白图谱。收集出峰位置的每管洗脱液以大肠杆菌为指示菌按1.3.2方法做抑菌验证。
1.3.7 数据处理
采用Excel 2016软件对数据进行分析处理后,用Origin 9.5软件进行绘图。
2 结果与分析
2.1 不同硫酸铵饱和度盐析对抑菌活性的影响
发酵上清液经不同硫酸铵饱和度盐析后得到的粗提细菌素对大肠杆菌的抑菌活性见图1。由图1可知,当发酵液中硫酸铵饱和度为10%时,经过离心后其基本无沉淀,且经Buffer复溶后没有抑菌活性。当硫酸铵饱和度为20%~80%时,出现显著的抑菌活性,并且随着硫酸铵饱和度的增大,抑菌活性逐渐增强,抑菌圈直径分别为15.33 mm、16.73 mm、17.67 mm、20.76 mm、20.67 mm、23.33 mm。当硫酸铵饱和度为80%时,其抑菌活性达到最大值,抑菌圈直径为23.67 mm。因此,选择硫酸铵饱和度为80%。
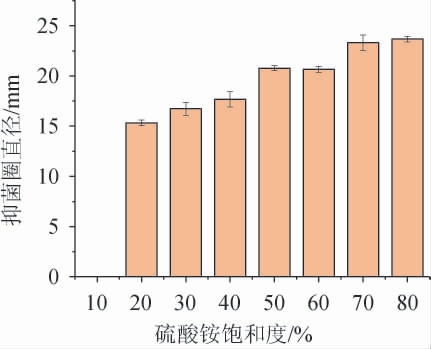
图1 不同硫酸铵饱和度对抑菌物质粗提的影响
Fig.1 Effect of different ammonium sulfate saturation on the crude extraction of antibacterial substances
2.2 酸沉淀操作方法的抑菌活性比较
酸沉淀的两组操作方法得到的抑菌活性见图2。由图2可知,当以酸沉淀A组操作方法粗提抑菌物质时,其抑菌活性都在产生的沉淀中,而此时中性的发酵上清已经完全没有抑菌活性。当以B组操作方法进行粗提时,pH值先调至中性,其产生的沉淀又会立刻溶解,只能离心出少量沉淀,且沉淀没有抑菌活性。并且经过A组方法得到的粗提物的抑菌圈直径为22.67 mm显著强于B组上清的抑菌圈直径15.1 mm。因此,当以酸沉淀方法提取抑菌物质时,酸沉淀静置过夜后应当先离心复溶后,再将pH调至中性,方能得到粗提抑菌活性高的物质。
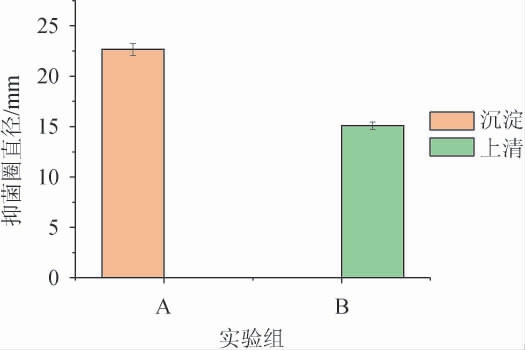
图2 两组酸沉淀方法的比较
Fig.2 Comparison of two groups of acid precipitation methods
2.3 不同比例乙酸乙酯萃取对抑菌效果的影响
不同比例乙酸乙酯萃取对粗提物抑菌效果的比较见图3。由图3可知,随着乙酸乙酯的比例逐渐增大,其抑菌效果也不断增强,抑菌圈直径分别为18.7 mm、23.9 mm、25.0 mm。当乙酸乙酯与上清液的体积比为3∶1时,其萃取出的有机相抑菌效果最显著,抑菌圈直径达到25.5 mm,但是在萃余相中也还存在抑菌效果。说明当其乙酸乙酯与上清液的体积比为3∶1时,并没有完全萃取出其抑菌物质。因此,再次加入3倍体积的乙酸乙酯至萃余相中进行二次萃取,有机相中的抑菌效果明显减弱,并且萃余相中仍然存在一些抑菌效果,说明经过二次萃取后,仍有残留抑菌物质未被萃取出。
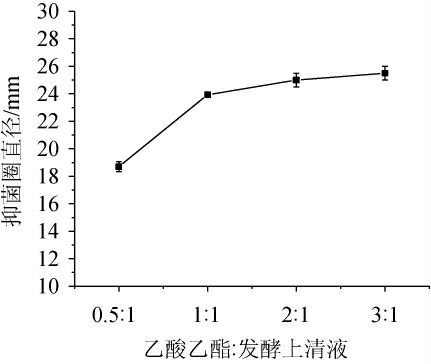
图3 不同比例乙酸乙酯萃取对抑菌效果的影响
Fig.3 Effect of different proportion of ethyl acetate extraction on antibacterial effect
2.4 粗提液回收率及蛋白质量浓度的测定
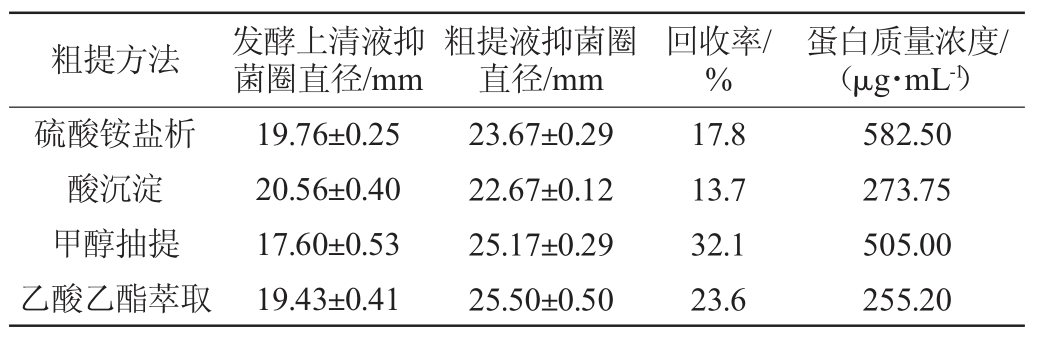
四种方法粗提抑菌活性的回收率及蛋白质量浓度见表1。由表1可知,四种不同方法对等体积发酵液的粗提,四种粗提液的回收率均处于较低水平,且蛋白质量浓度也存在较大的差异。从粗提液的回收率看,甲醇抽提法效果最佳,其回收率达到32.1%,且以甲醇为阴性对照组中无抑菌圈出现,乙酸乙酯回收率为23.6%,硫酸铵饱和度为80%回收率为17.8%,酸沉淀法所得回收率最低,为13.7%。对粗提抑菌物质产物进行蛋白质量浓度测定,参照标准曲线回归方程y=0.002 9x+0.463 2(R2=0.993 5)进行计算。经过同等体积发酵液与Buffer A复溶后,硫酸铵饱和度为80%盐析的蛋白质量浓度最高,达到582.50 μg/mL,甲醇抽提效果次之,蛋白质量浓度达到505.00 μg/mL,乙酸乙酯的蛋白质量浓度最低,为255.20 μg/mL。虽然该解淀粉芽孢杆菌发酵上清液用甲醇抽提法提取出的蛋白质量浓度比硫酸铵盐析法低,但抑菌效果更强,可能是由于甲醇粗提法中所提取出的蛋白质中含有更多的抑菌成分。
表1 不同提取方法的粗提液回收率、蛋白含量及其抑菌效果的测定结果
Table 1 Determination results of the recovery rate,protein content and antibacterial effect of crude extract by different extraction methods
2.5 粗提液的凝胶层析及洗脱液的抑菌活性
SuperdexTM75凝胶层析柱是一种能进行高效分离蛋白、多肽等物质的分离柱,不仅能分离小分子物质(分子质量3 000 Da),也能分离大分子物质(分子质量70 000 Da),因此被广泛运用于蛋白与多肽类物质的分离纯化。根据前期准备好的发酵液粗提液,分别进行凝胶过滤层析后,结果见图4。由图4A可知,四种粗提液进行分离后其分离效果具有较大差异。当经过硫酸铵饱和度为80%盐析法进行初步分离时,其吸收峰数较多且较为集中;由图4B可知,当经过酸沉淀法进行初步分离时,其吸收峰数较多,洗脱出较多物质;由图4C可知,当用甲醇抽提法进行初步分离时,其吸收峰数明显减少,且峰与峰之间分离效果较好;由图4D可知,当用乙酸乙酯萃取法进行初步分离时,其吸收峰均尖锐且连续。
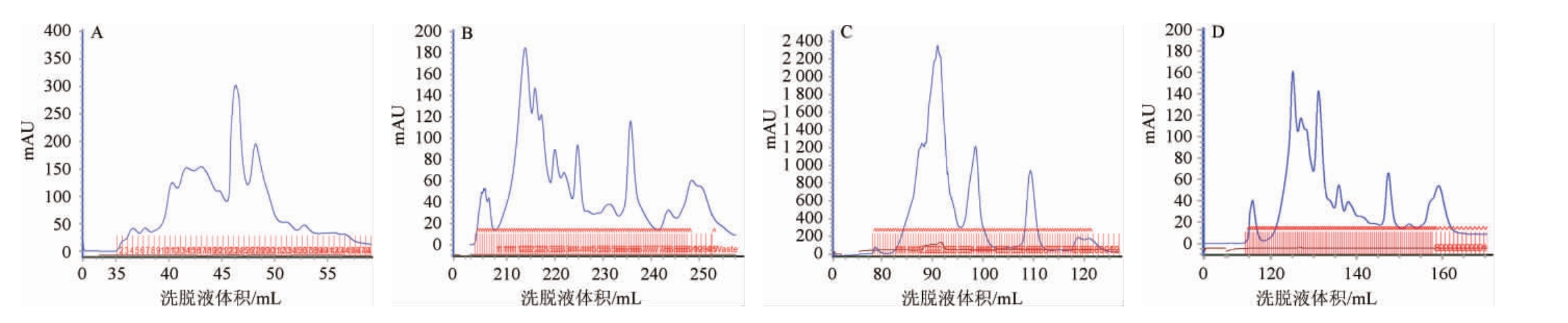
图4 四种萃取方法粗提液SuperdexTM75凝胶柱层析色谱图
Fig.4 SuperdexTM75 gel column chromatography of crude extract by four kinds of extraction methods
A:硫酸铵盐析法;B:酸沉淀法;C:甲醇抽提法;D:乙酸乙酯萃取法。
将四种粗提液进行凝胶柱层析后的洗脱液进行抑菌活性检测,结果见表2。由表2可知,当用硫酸铵饱和度为80%盐析法的所有洗脱液中,2~8号管中具有显著抑菌效果,16~20号管有较弱的抑菌效果;酸沉淀法的所有洗脱液进行抑菌验证时,基本无抑菌效果,只有少数收集管中存在抑菌效果且其抑菌效果不明显;当用甲醇抽提法的所有洗脱液进行抑菌验证,在第2、第50号收集管中具有显著抑菌效果,第3、第34与第54号收集管中存在较弱的抑菌效果;当用乙酸乙酯法的所有洗脱液进行抑菌验证后,在第37、第92号管中有显著抑菌效果,还有少数收集管中存在不明显的抑菌效果。因此,通过对四种方法的所有洗脱液进行抑菌验证后,抑菌物质被先后分离出的粗提方法为硫酸铵盐析法、甲醇抽提法、乙酸乙酯萃取法、酸沉淀法,且以硫酸铵盐析法分离出的抑菌活性物质最多。此外,以硫酸铵盐析法粗提抑菌物质时,被分离出的抑菌活性物质主要分布在两个区域,说明以硫酸铵盐析法粗提出的抑菌物质至少为两种。
表2 四种提取方法洗脱液抑菌验证试验结果
Table 2 Results of bacteriostatic verification tests of eluent by four kinds of extraction methods
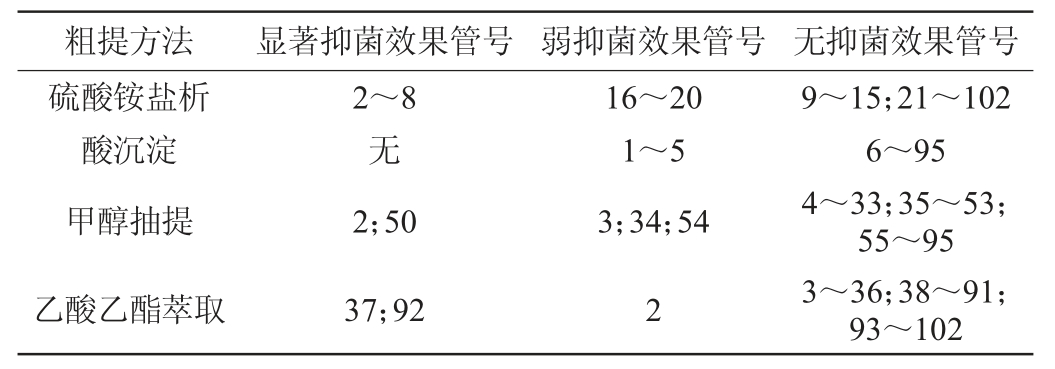
注:“显著抑菌效果”表示产生明显的圆形抑菌圈现象;“弱抑菌效果”表示产生小的且不规则形状抑菌圈现象”。
3 结论
本实验以解淀粉芽孢杆菌A13为研究对象,通过硫酸铵盐析法、酸沉淀法、甲醇抽提法和乙酸乙酯萃取法进行发酵液的粗提取及优化,结果表明以硫酸铵盐析对粗提液得制备时,硫酸铵饱和度为80%的蛋白质量浓度最高为582.50 μg/mL,其回收率为17.8%,抑菌圈直径为23.67 mm。当发酵上清液以硫酸铵盐析法粗提时,使用SuperdexTM75凝胶层析柱可以有效地优先洗脱出抑菌物质,且至少能分离出两种抑菌物质。由于解淀粉芽孢杆菌所产生的抑菌物质主要为肽类及蛋白类抑菌物质,因此,硫酸铵盐析法为粗提解淀粉芽孢杆菌A13抑菌物质的合适方法。
[1]贺海滨,苏峻冬,滕凯,等.解淀粉芽孢杆菌研究进展[J].现代农业科技,2021,2(2):101-104.
[2]连燕萍.解淀粉芽孢杆菌MG-3抗菌物质的分离纯化及其应用[D].福州:福州大学,2016.
[3]LIM S M,YOON M,CHOI G J,et al.Diffusible and volatile antifungal compounds produced by an antagonistic Bacillus velezensis G341 against various phytopathogenic fungi[J].P Pathol J,2017,33(5):488-498.
[4]HONG P,HAO W N,LUO J J,et al.Combination of hot water, Bacillus amyloliquefaciens HF-01 and sodium bicarbonate treatments to control postharvest decay of mandarin fruit[J].Postharvest Biol Tec,2014,88:96-102.
[5]阎然,傅茂润,陈蕾蕾,等.解淀粉芽孢杆菌NCPSJ7对采后脐橙绿霉病的防治作用及机制[J].食品科学,2021,42(17):193-200.
[6]THIAGO S,ADRIANO B,SAVIO L B,et al.Physical and nutritional conditions for optimized production of bacteriocins by lactic acid bacteria-A review[J].Crit Rev Food Sci,2019,59(17):2839-2849.
[7]王青华,唐旭,孙晓晖,等.深海贝莱斯芽孢杆菌DH82的抑菌活性物质初步分离纯化及其抑菌谱检测[J].应用海洋学学报,2020,39(1):20-26.
[8]曹雪梅,李欢,陈茹,等.海洋细菌GM-1-1菌株抗菌物质初步分离及其抗菌作用机理初步研究[A].中国植物病理学会.中国植物病理学会2018年学术年会论文集[C].中国植物病理学会:中国植物病理学会,2018:1.
[9]施碧红,蔡良,郑永标,等.枯草芽孢杆菌FB123所产抗菌物P3c的分离纯化及其表面活性功能分析[J].福建师范大学学报(自然科学版),2012,28(6):106-111.
[10]成潇龙,杨海麟,章升,等.黄酒酿造浸米水中抑菌物质的分离纯化鉴定及其活性的测定[J].中国酿造,2015,34(5):48-51.
[11]罗晓蕾,施碧红,刑佩佩,等.细菌素粗提方法的比较[J].安徽农学通报,2010,16(4):45-46,140.
[12]王伟,李津津,迟海.解淀粉芽孢杆菌素Amylocyclicin W5的纯化及其抑菌机理[J].食品科学,2021,42(7):29-34.
[13]ZIMINA M I,GAZIEVA A F,SUKHIH S A,et al.The properties of bacteriocins obtained under the different conditions[J].Food Raw Mater,2017,5(2):128-136.
[14]PERUMAL V,YAO Z,KIM J A,et al.Purification and characterization of a Bacteriocin,BacBS2,produced by Bacillus velezensis BS2 isolated from Meongge Jeotgal[J].J Microbiol Biotechn,2019,29(7):1033-1042.
[15]花榜清.Paenibacillus bovis sp.nov.BD3526抗菌物质的分离纯化、结构表征及其性质的研究[D].无锡:江南大学,2017.
[16]YANG D,ZHAO X L,HUA B,et al.Isolation and characterization of peptide antibiotics LI-F04 and polymyxin B6 produced by Paenibacillus polymyxa strain JSa-9[J].Peptides,2011,32(9):1917-1923.
[17]樊丽娟,郭海,杨成德,等.内生解淀粉芽孢杆菌262AG6抑菌物质的初步探究[J].西北农业学报,2020,29(6):912-920.
[18]许亦峰,罗晓蕾,施碧红.不同提取剂对粗细菌素提取效果的影响[J].微生物学杂志,2013,33(1):35-38.
[19]BAHARUDIN M M A,NGALIMAT M S,MOHD S F,et al.Antimicrobial activities of Bacillus velezensis strains isolated from stingless bee products against methicillin-resistant Staphylococcus aureus[J].PloS One,2021,16(5):e0251514-e0251514.
[20]张雪,谈诗谣,钱斯日古楞,等.一株解淀粉芽孢杆菌的特性及抑菌活性研究[J].中国畜牧兽医,2018,45(5):1251-1257.
[21]李姝江,梁漫,朱天辉,等.杂交竹梢枯病拮抗菌的筛选及抗菌蛋白分析[J].南京林业大学学报(自然科学版),2013,37(6):27-32.
[22]李振森.解淀粉芽孢杆菌Y-32-1产细菌素的研究[D].青岛:青岛科技大学,2014.
[23]李方舟.普洱茶树叶片内生细菌Bacillus velezensis FZ06的基因组测序及抗菌活性代谢产物研究[D].广州:华南理工大学,2020.
[24]刘安,赵华,张朝正.贝莱斯芽孢杆菌抑菌物质的分析及提取优化[J].中国酿造,2019,38(12):63-68.
[25]KHRANTSOV P,KALASHNIKOVA T,BOCHKOVA M,et al.Measuring the concentration of protein nanoparticles synthesized by desolvation method:Comparison of Bradford assay,BCA assay,hydrolysis/UV spectroscopy and gravimetric analysis[J].Int J Pharm,2021,599:120422-120422.
[26]李红红.产细菌素枯草芽孢杆菌的生物学特性研究[D].济南:山东大学,2019.