乳酸链球菌素(Nisin)是乳酸乳球菌乳酸亚种(Lactococcus lactis subsp.lactis)等菌株产生的抗菌肽,对大多数革兰氏阳性菌和芽孢杆菌存在显著抑制作用[1-2],因其在生物体内易于降解,因而不会引起生物耐药性,被公认为安全无毒的天然食品添加剂[3]。
Nisin是由34个氨基酸组成的多肽[4],属于次级代谢产物,但其合成却显示出初级代谢的特征并与细胞生长耦联[5-6],因而Nisin高效合成依赖于较高的菌体密度[7]。作为兼性厌氧菌,乳球菌三羧酸循环不完整,糖酵解是主要的能量生成途径[8],因而其糖代谢产能效率并不高,细胞生物量合成所需营养分子基本来自环境吸收或吸收后进一步合成,而非由糖代谢从头合成[9]。另外,乳球菌糖代谢为同型乳酸发酵[10],乳酸积累导致pH下降和酸胁迫效应[11],进而抑制糖酵解效率、细胞生长和Nisin合成效率[12]。因而,发酵后期菌体停止生长甚至自溶的原因是酸胁迫以及Nisin对细胞代谢活性的抑制[13],而不仅仅是营养耗损[14],乳球菌有限的生物量和耐酸能力严重限制了其Nisin的生产能力[15]。乳球菌还是多种维生素、氨基酸的营养缺陷型[16],并不能同化无机氮源。该菌株具有复杂的蛋白水解系统[17],包括蛋白酶、氨基酸和肽转运蛋白以及胞内肽酶[18],而且菌株间蛋白水解能力以及对氮源的利用能力存在较大差异[19]。
为了提高乳球菌细胞生长和Nisin合成效率,本研究通过正交试验优化发酵培养基,并在摇瓶培养的基础上,进行10 L发酵罐分批发酵验证试验,考察能快速启动细胞生长和产物合成的分割发酵模式[20]对Nisin合成的影响,确定最适分割发酵工艺,为发酵生产Nisin提供有益参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株乳酸乳球菌乳酸亚种(Lactococcus lactis subsp.lactis):本实验室保藏。
1.1.2 化学试剂
蛋白胨、酵母浸粉(均为生化试剂):安琪酵母股份有限公司;玉米浆、蔗糖(均为食用级):市售;三水合磷酸氢二钾、氯化钠、七水硫酸镁、一水硫酸锰、柠檬酸三铵、轻质碳酸钙、浓硫酸、稀盐酸、蒽酮(均为分析纯):国药集团化学试剂有限公司;Nisin标准品(1 000 IU/mg):美国Sigma公司。
1.1.3 培养基
斜面种子培养基:1.5%胰蛋白胨,1.5%酵母浸粉,1.5%牛肉膏,1%葡萄糖,1%乙酸钠,0.2%磷酸氢二钠,0.2%柠檬酸三铵,1%轻质碳酸钙,2%琼脂,pH 6.8。
初始发酵培养基:4%蛋白胨,2%蔗糖,1%玉米浆,0.2%磷酸氢二钾,0.2%氯化钠,0.02%七水硫酸镁,0.005%一水硫酸锰,0.5%柠檬酸三铵,0.6%轻质碳酸钙,pH 6.8。
发酵培养基:3%蛋白胨,1%酵母浸粉,2%蔗糖,1%玉米浆,0.2%磷酸氢二钾,0.2%氯化钠,0.02%七水硫酸镁,0.005%一水硫酸锰,0.5%柠檬酸三铵,0.6%轻质碳酸钙,pH 6.8。
平板计数培养基:2%酵母浸膏,0.5%氯化钠,2%琼脂,pH 7.4~7.5。
上述培养基均在121 ℃条件下灭菌20 min。
1.2 仪器与设备
YXQ-75SII立式压力蒸汽灭菌器:上海博讯医疗生物仪器股份有限公司;SPX-150D恒温生化培养箱:上海博讯实业有限公司医疗设备厂;V-1300可见分光光度计:上海美析仪器有限公司;HNV-211B恒温培养振荡器:天津市欧诺仪器仪表有限公司;Ultimate 3000高效液相色谱(high performance liquid chromatography,HPLC)仪:湖北鼎泰高科有限公司;S-10生物传感器分析仪:深圳市西尔曼科技有限公司;CJ-2D无菌操作台:天津泰斯特仪器有限公司;10 L机械搅拌通风发酵罐:上海保兴生物设备有限公司。
1.3 方法
1.3.1 种子液制备
-80 ℃冰箱保存的乳酸乳球菌乳酸亚种(Lactococcus lactis subsp.lactis)甘油管接斜面种子培养基的平板,30 ℃培养24 h后转接茄子瓶(装液量为60 mL/250 mL),30 ℃培养24 h,无菌操作加入60 mL无菌水,并用无菌竹签将菌苔挑起混合于无菌水中,得到种子液,备用。
1.3.2 温度和不同氮源对乳酸乳球菌生物量的影响
在28 ℃、30 ℃、32 ℃、35 ℃条件下,分别考察4%蛋白胨(单一氮源)、3%蛋白胨和1%酵母浸粉(复合氮源)对细胞生长代谢的影响。
1.3.3 发酵培养基配方优化正交试验
在前期单因素试验的基础上,选择培养基成分中蛋白胨(A)、蔗糖(B)、玉米浆(C)添加量为影响因素进行L9(33)正交设计试验,分别以乳酸乳球菌生物量以及Nisin效价为考察指标,确定最佳发酵培养基。正交试验因素与水平见表1。
表1 发酵培养基配方优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for optimization of fermentation medium formula
1.3.4 摇瓶培养及10 L发酵罐分批发酵验证试验
以生物量以及Nisin效价为评价指标,采用优化培养基摇瓶培养,并在此基础上进行10 L发酵罐分批发酵验证试验。
摇瓶培养:装液量为50 mL/250 mL发酵培养基,每瓶接种种子液0.45 mL。置于30 ℃摇床间歇振荡培养12 h(每小时200 r/min运转30 s后,转速调为0 r/min)。
10 L发酵罐分批发酵:10 L发酵罐中装7 L发酵培养基,接种60 mL种子液,30 ℃、100 r/min不通气培养20 h。
1.3.5 分割发酵
分割发酵指分批发酵达到一定程度后放料,并补加等量新鲜培养基继续培养的发酵方式,其具有快速启动细胞生长和产物合成的优势[20]。分割发酵过程为:使用优化后发酵培养基在10 L发酵罐进行分批发酵(具体条件同1.3.4),Nisin效价达到峰值(0~18 h)后放料,放料体积比例为70%、75%、80%、85%(罐内保留体积比例为30%、25%、20%、15%),后通氮气(为兼性厌氧菌的乳酸乳球菌提供快速启动生长的厌氧环境)30 min的同时接入发酵培养基,定容至7 L,继续按30 ℃、100 r/min不通气培养。
1.3.6 分析检测
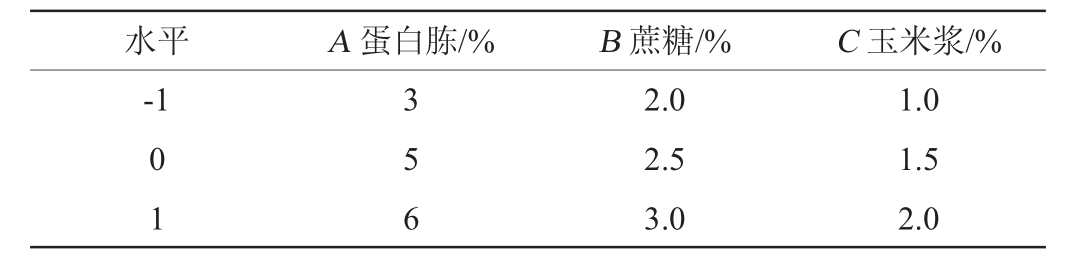
生物量(以细胞数计)测定:稀释涂布平板法[21];菌体对基质消耗的得率系数(Yx/s)=生物量(108 CFU/mL)/达到该时间点的总糖消耗量(g/L);总糖(以蔗糖计)测定:硫酸-蒽酮法[22];乳酸测定:生物传感仪[23];Nisin平均合成速率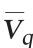 =Nisin效价(IU/mL)/达到该效价时的发酵时间(h);产物对菌体的得率系数(Yp/x)=Nisin效价(IU/mL)/达到该时间点的最大生物量(108 CFU/mL)。
=Nisin效价(IU/mL)/达到该效价时的发酵时间(h);产物对菌体的得率系数(Yp/x)=Nisin效价(IU/mL)/达到该时间点的最大生物量(108 CFU/mL)。
Nisin效价测定:采用HPLC法。具体方法如下:
(1)样品处理
发酵液用盐酸稀释至一定的倍数,pH在2.0~2.7之间[24],12 000 r/min离心20 min,经0.45 μm滤膜过滤后备用。
(2)Nisin标准液制备以及标准曲线的绘制
称取0.25 g Nisin标准品于50 mL容量瓶中,以0.01 mol/L的盐酸溶液(pH2.0)定容,得到Nisin标准工作液(5000IU/mL)。准确吸取标准工作液2mL、4mL、6mL、8mL、10mL至10mL容量瓶中,并用0.01 mol/L的盐酸溶液(pH2.0)定容。得到系列Nisin标准液,其乳酸链球菌素标准溶液的最终效价分别为1 000 IU/mL、2 000 IU/mL、3 000 IU/mL、4 000 IU/mL、5 000 IU/mL,经0.45 μm微孔滤膜过滤,浓度由低到高进样,以Nisin效价(x)为横坐标,以峰面积(y)为纵坐标,绘制Nisin标准曲线。
(3)色谱条件
流动相为水和乙腈以81∶19(V/V)混溶(加入0.05%三氟乙酸);流速1 mL/min;检测波长200 nm;柱温40 ℃;进样量20 μL。
1.3.7 数据处理
实验数据为3组平行试验均值,通过Origin 9.0和SPSS 23.0进行作图以及数据处理分析。
2 结果与分析
2.1 温度和氮源对乳酸乳球菌生物量的影响
考察4%蛋白胨(单一氮源)和以1%的酵母浸粉替代1%的蛋白胨(复合氮源,1%酵母浸粉+3%的蛋白胨)对乳酸乳球菌生长代谢及菌体对基质消耗的得率系数(Yx/s)的影响,结果见表2。
表2 不同温度和氮源对菌体生长及菌体对基质消耗的得率系数的影响
Table 2 Effects of different temperature and nitrogen sources on the growth of bacteria and yield coefficient of substrate consumption

由表2可知,在28~35 ℃培养时,复合氮源生物量均比单一氮源生物量提高15%~45%左右,这可能与复合氮源的肽和氨基酸组成更能满足细胞转运系统[18]对肽分子质量和氨基酸组成有关。复合氮源条件下30 ℃培养的峰值生物量为3.1×109 CFU/mL,较28 ℃和35 ℃提高25%~30%,与32 ℃峰值生物量接近。
由表2可知,复合氮源条件下,30 ℃的Yx/s最高,较28 ℃、32 ℃和35 ℃分别提高52%、18.5%和39%。说明30 ℃是该菌株的最适生长温度,与SAFARI R等[25]报道一致。在各个温度条件下,复合氮源相对于单一氮源的Yx/s均有提高,在最适生长温度30 ℃条件下,复合氮源Yx/s较单一氮源提高78%。进一步说明了复合氮源条件下细胞利用基质的转化效率高于单一氮源。
因此,确定发酵氮源组成为3%蛋白胨、1%酵母浸粉,培养温度为30 ℃。
2.2 发酵培养基配方优化正交试验
在前期单因素试验基础上,以蛋白胨(A)、蔗糖(B)、玉米浆(C)添加量为影响因素,以乳球菌生物量以及Nisin效价为考察指标,进行L9(33)正交设计试验,正交试验结果见表3,方差分析见表4。
表3 发酵培养基配方优化正交试验结果与分析
Table 3 Results and analysis of orthogonal tests for optimization of fermentation medium formula
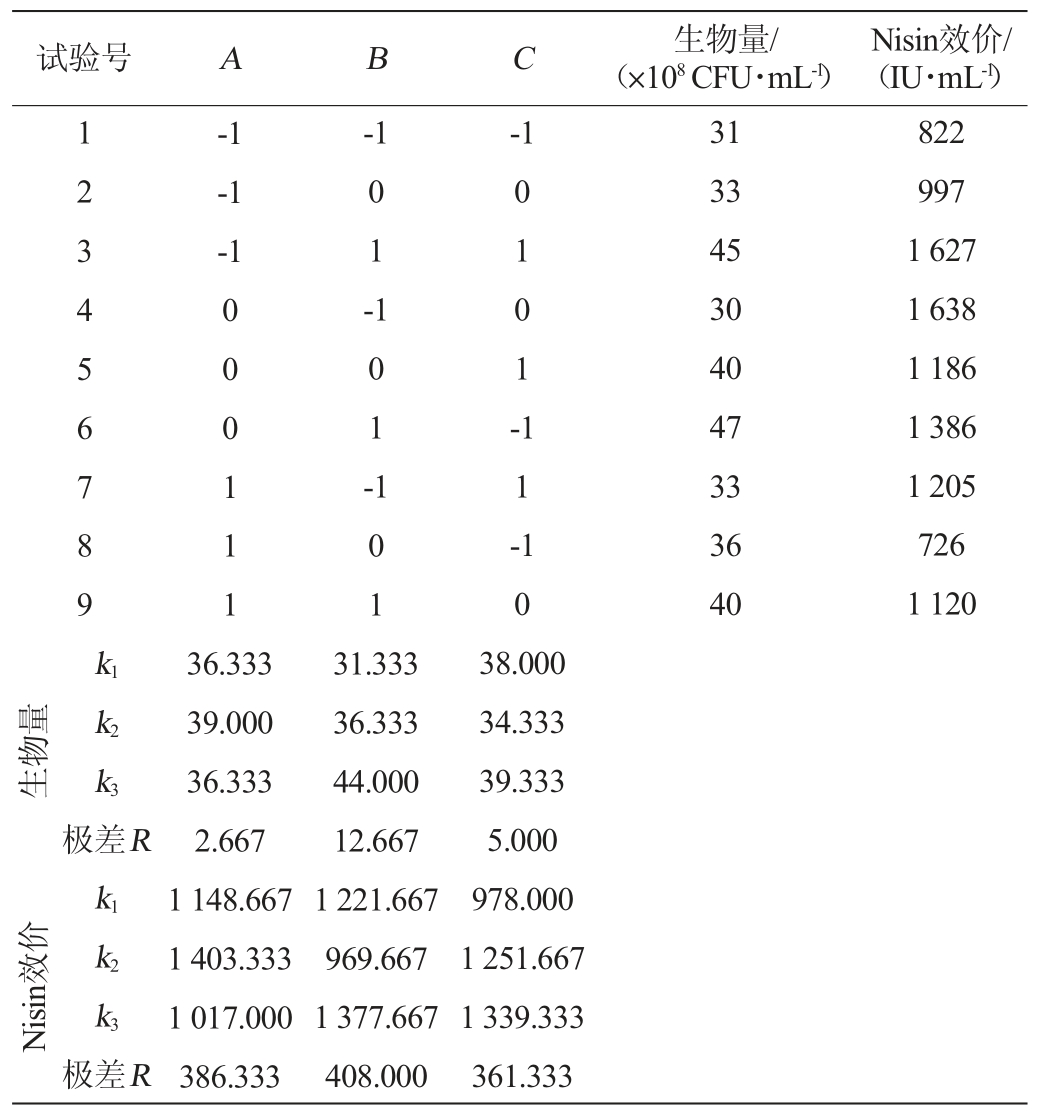
表4 以生物量为评价指标正交试验结果方差分析
Table 4 Variance analysis of orthogonal tests results using biomass as evaluation index
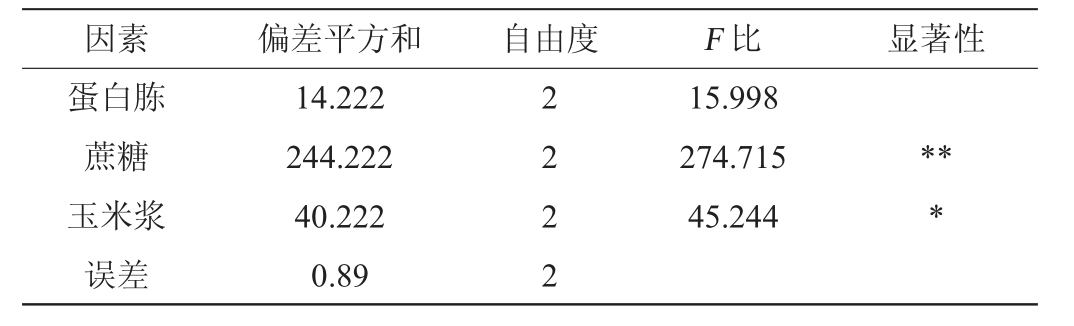
注:“*”表示因素对菌体生长情况的影响具有显著性(P<0.05);“**”表示因素对菌体生长情况的影响具有极显著性(P<0.01)。
由表3可知,影响菌体生物量的3个因素主次顺序为蔗糖>玉米浆>蛋白胨,最佳发酵培养基组合为A2B3C3,即蛋白胨5%,蔗糖3%,玉米浆2%;影响Nisin效价的3个因素主次顺序为蔗糖>蛋白胨>玉米浆,最佳发酵培养基组合为A2B3C3,即蛋白胨5%,蔗糖3%,玉米浆2%。这也验证了关于Nisin随细胞生长而生产并依赖于较高的菌体密度,即Nisin合成与细胞生长耦联[5-6]的论述。由表4可知,蔗糖对菌体生物量具有极显著影响(P<0.01),玉米浆对菌体生长具有显著影响(P<0.05)。
综上,最佳发酵培养基为蛋白胨5%,蔗糖3%,玉米浆2%。
2.3 摇瓶水平发酵培养基对乳酸乳球菌生长代谢的影响
以正交优化后发酵培养基配方(蛋白胨5%,蔗糖3%,玉米浆2%)作为优化组,发酵培养基配方(蛋白胨3%,蔗糖2%,玉米浆1%)作为对照组,考察摇瓶水平发酵培养基优化前后培养基对乳酸乳球菌生长的影响,结果见图1。由图1A可知,发酵时间6~11 h为对数生长期,优化组峰值生物量(11 h)为4.9×109 CFU/mL,较对照提高43%。由图1B可知,Nisin随着细胞的生长而持续合成,在12 h达到峰值,优化组Nisin效价峰值(1 660 IU/mL)较对照组提高20%。结果表明,优化培养基在摇瓶水平能够较为合理的满足乳酸乳球菌生长以及合成Nisin的需要。
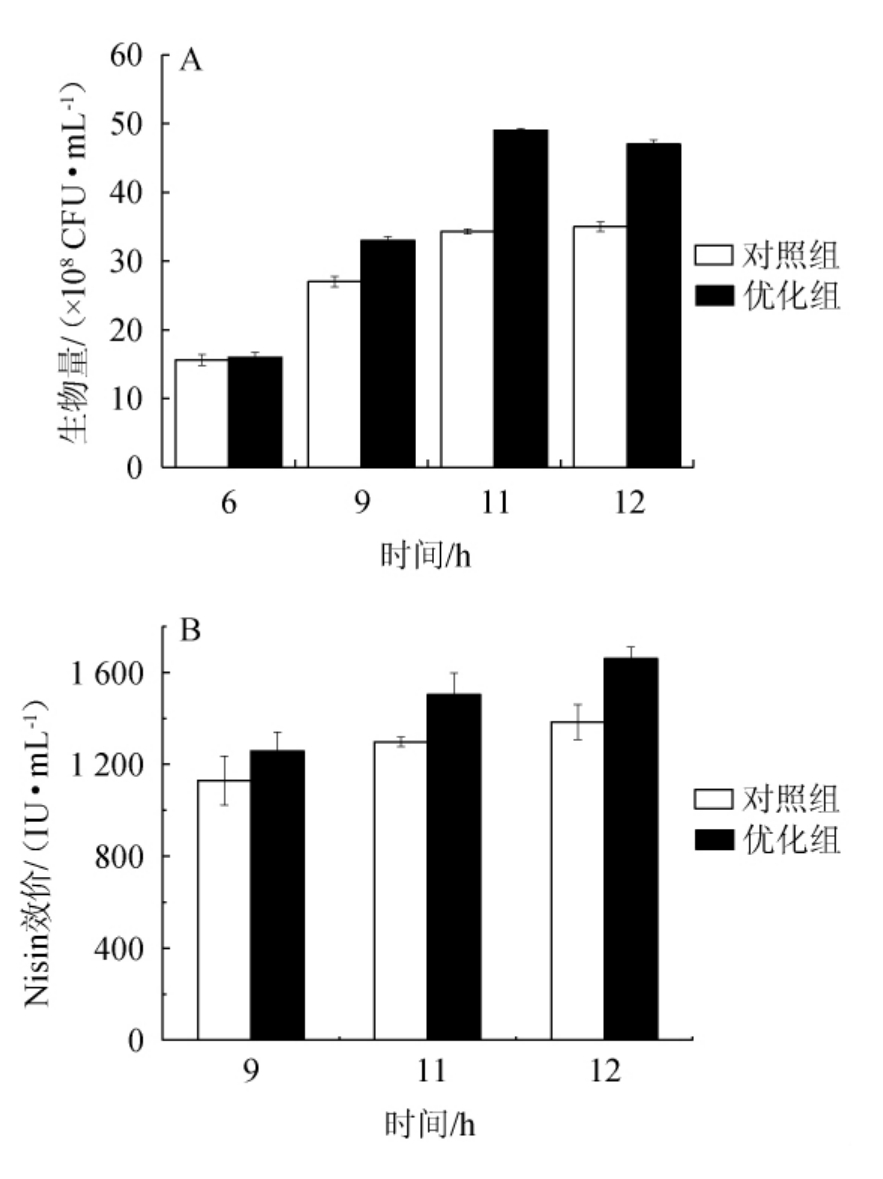
图1 摇瓶水平发酵培养基优化前后对细胞生长(A)和Nisin合成(B)的影响
Fig.1 Effects of fermentation medium on cell growth (A) and Nisin production (B) in flask cultures before and after optimization
2.4 10 L发酵罐水平分批发酵培养基对乳酸乳球菌生长代谢的影响
以正交优化后发酵培养基配方(蛋白胨5%,蔗糖3%,玉米浆2%)作为优化组,发酵培养基配方(蛋白胨3%,蔗糖2%,玉米浆1%)作为对照组,考察10 L发酵罐水平分批发酵培养基优化前后对乳酸乳球菌生长代谢的影响,结果见图2。
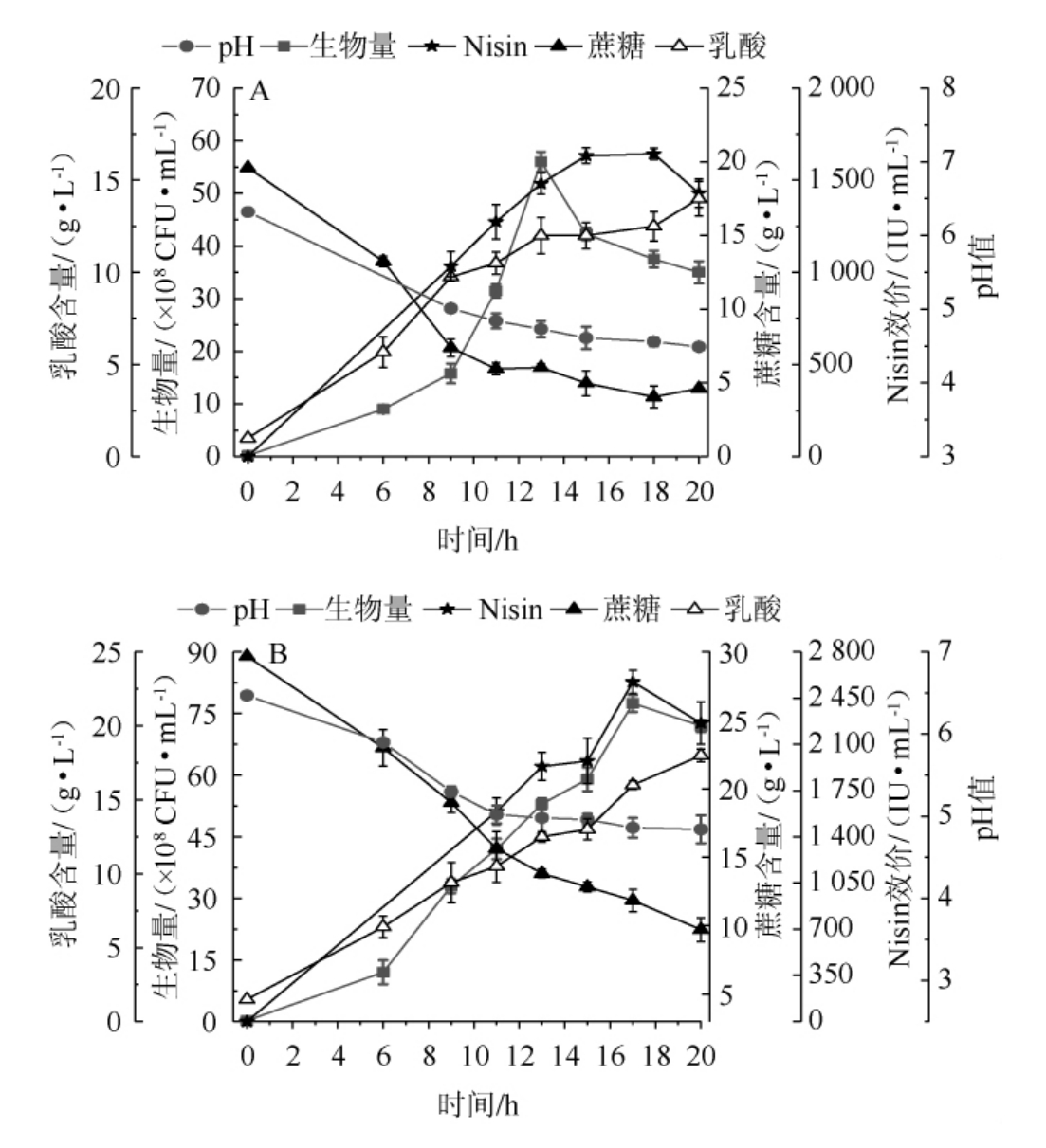
图2 10 L发酵罐水平发酵培养基优化前(A)、后(B)对细胞生长和Nisin合成的影响
Fig.2 Effects of fermentation medium on cell growth and Nisin production in a 10 L bioreactor before (A) and after (B)optimization
由图2A可知,对照组生物量13 h达到峰值,为5.6×109 CFU/mL,后自溶至3.5×109 CFU/mL。而Nisin效价15 h达到峰值,为1 643 IU/mL,Nisin平均合成速率v¯q为109.5 IU/(mL·h)。蔗糖由19.6 g/L迅速消耗至(11 h)5.96 g/L后缓慢消耗至4.62g/L(20h),0~11h糖消耗速率为1.24g/(L·h),而11~20 h糖消耗速率0.15 g/(L·h)。同时,乳酸由1 g/L迅速合成至10.5 g/L(11 h)后缓慢合成至14 g/L(20 h),0~11 h乳酸合成速率为0.86 g/(L·h),11~20 h乳酸合成速率为0.38 g/(L·h)。显然11 h前后糖利用、细胞生长及乳酸生成发生重大变化。由于乳酸乳球菌乳酸发酵是其能量供应的主要来源[10],但乳酸的积累又对细胞代谢活性产生抑制[12],因而11 h后可能存在酸胁迫和能量供应不足的矛盾。
由图2B可知,优化组对数生长至17 h到达峰值,为7.75×109 CFU/mL,较对照提高了38%,13 h细胞生物量(5.3×109 CFU/mL)与对照持平,但优化组对数期较对照延长了4 h。显然,加强碳源供给能够有效促进菌体生长。伴随细胞生长,Nisin合成至17 h达到峰值2 573 IU/mL,Nisin平均合成效率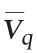 为151.4 IU/(mL·h),分别较对照提高56.6%和38.2%。说明氮源的增加以及其比例的改变有助于Nisin合成。另外,消后蔗糖由29.7 g/L迅速消耗至(11 h)15.6 g/L,17 h蔗糖质量浓度为11.8 g/L。0~11 h糖消耗速率为1.28 g/(L·h),与对照持平;11~17 h糖消耗速率为0.63 g/(L·h),较对照提升320%。同时,乳酸由0 h的1.5 g/L迅速合成至11 h的11.5 g/L、17 h的16 g/L。0~11 h乳酸合成速率为0.9 g/(L·h),略高于对照。11~17 h乳酸合成速率为0.75 g/(L·h),较对照提升97%。结果表明,优化培养基在11 h后能持续促进细胞生长,为Nisin高效合成提供了高细胞密度基础[5,13],而且在糖供应增强的情况下,细胞的耐酸性也增强了。
为151.4 IU/(mL·h),分别较对照提高56.6%和38.2%。说明氮源的增加以及其比例的改变有助于Nisin合成。另外,消后蔗糖由29.7 g/L迅速消耗至(11 h)15.6 g/L,17 h蔗糖质量浓度为11.8 g/L。0~11 h糖消耗速率为1.28 g/(L·h),与对照持平;11~17 h糖消耗速率为0.63 g/(L·h),较对照提升320%。同时,乳酸由0 h的1.5 g/L迅速合成至11 h的11.5 g/L、17 h的16 g/L。0~11 h乳酸合成速率为0.9 g/(L·h),略高于对照。11~17 h乳酸合成速率为0.75 g/(L·h),较对照提升97%。结果表明,优化培养基在11 h后能持续促进细胞生长,为Nisin高效合成提供了高细胞密度基础[5,13],而且在糖供应增强的情况下,细胞的耐酸性也增强了。
对照组产物对菌体的得率系数(Yp/x)为29.2IU/108CFU,而优化组Yp/x为33.2 IU/108 CFU,提高了13.7%。结果表明,优化后氮源浓度以及比例(蛋白胨以及玉米浆)不仅能给细胞的生长提供丰富的氮源,还能为Nisin合成提供更丰富的肽分子前体,进而促进了单位细胞的Nisin合成效率。
2.5 分割发酵对Nisin合成的影响
分割发酵[20]方式能快速启动细胞生长从而促进Nisin快速合成,因此考察分割发酵方式对乳球菌生长及Nisin合成能力的影响,结果见表5和图3。
表5 分割发酵平均细胞生长速率及平均Nisin效价合成速率结果分析
Table 5 Results analysis of average cell growth rate and average Nisin synthesis rate of segmentation fermentation
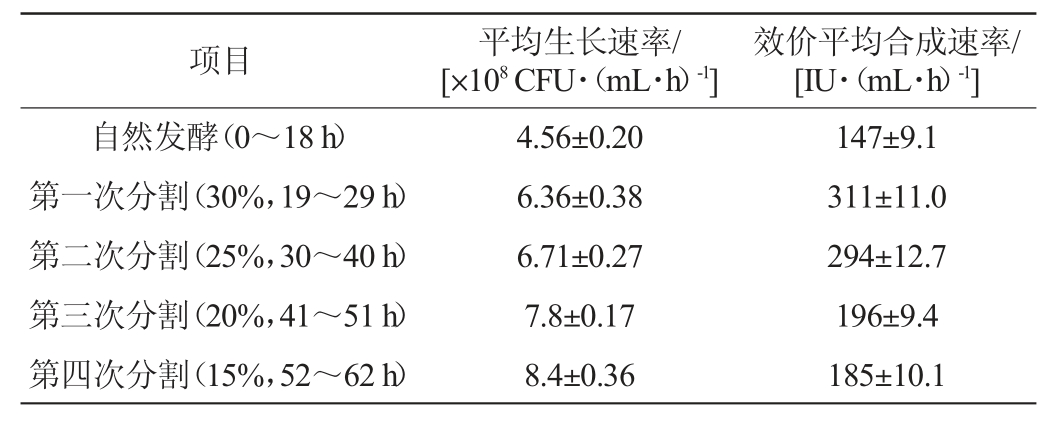
由表5和图3可知,乳酸乳球菌分批发酵对数生长至17h(8.1×109CFU/mL),平均生长速率为4.76×108CFU/(mL·h)。Nisin合成与生长耦联,18 h的Nisin效价为2 656 IU/mL,平均合成速率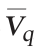 为147 IU(/mL·h)。
为147 IU(/mL·h)。
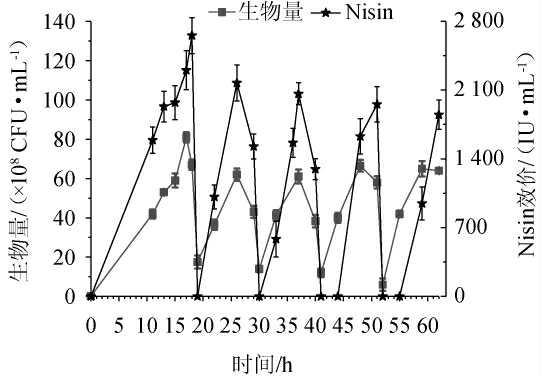
图3 18 h、29 h、40 h和51 h分割发酵对细胞生长和Nisin合成的影响
Fig.3 Effects of segmentation fermentation on cell growth and Nisin production in a 10 L bioreactor at 18 h,29 h,40 h and 51 h,respectively
18 h以30%的比例进行分割培养,分割后(19 h)生物量为1.75×109 CFU/mL,Nisin效价为0 IU/mL,对数生长7 h达到6.2×109 CFU/mL,Nisin效价达到峰值(26 h,2 174 IU/mL),平均生长速率为6.36×108 CFU/(mL·h),较分批发酵提高40%;Nisin平均合成速率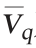 为311 IU/(mL·h),较分批发酵增长112%。
为311 IU/(mL·h),较分批发酵增长112%。
29 h以25%的比例进行分割培养,分割后(30 h)生物量为1.4×109 CFU/mL,Nisin效价为0 IU/mL,对数生长7 h达到6.1×109CFU/mL,Nisin效价达到峰值(37 h,2 063 IU/mL),平均生长速率为6.71×108 CFU/(mL·h),较分批发酵提高41%;Nisin平均合成速率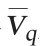 为294 IU/(mL·h),较分批发酵增长100%。
为294 IU/(mL·h),较分批发酵增长100%。
40 h以20%的比例进行分割培养,分割后(41 h)生物量为1.2×109 CFU/mL,Nisin效价为0 IU/mL,对数生长7 h达到6.65×109 CFU/mL,Nisin效价经10 h生长达到峰值(51 h,1 956 IU/mL),平均生长速率为7.8×108 CFU/(mL·h),较分批发酵提高64%;Nisin平均合成速率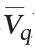 为196IU/(mL·h),较分批发酵增长33%。
为196IU/(mL·h),较分批发酵增长33%。
51 h以15%的比例进行分割培养,分割后(52 h)生物量为6×108 CFU/mL,Nisin效价为0 IU/mL,对数生长7 h达到6.5×109 CFU/mL,Nisin效价经10 h生长达到峰值(62 h,1 850 IU/mL),平均生长速率为8.4×108 CFU/(mL·h),较分批发酵提高76%;Nisin平均合成速率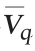 为185IU/(mL·h),较分批发酵增长26%。
为185IU/(mL·h),较分批发酵增长26%。
15%、20%、25%和30%分割比例平均生长速率较分批培养分别提高了76%、64%、41%和40%;而30%、25%、20%和15%分割比例的Nisin平均合成速率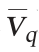 较分批培养分别提高了112%、100%、33%和26%。显然分割比例越大,Nisin平均合成速率
较分批培养分别提高了112%、100%、33%和26%。显然分割比例越大,Nisin平均合成速率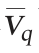 越高。考虑到分割发酵比例越高,用于Nisin产品生产的发酵液体积就越少,而且30%分割比例较25%分割比例
越高。考虑到分割发酵比例越高,用于Nisin产品生产的发酵液体积就越少,而且30%分割比例较25%分割比例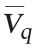 仅仅提高5.8%,因此确定25%为最适分割比例。
仅仅提高5.8%,因此确定25%为最适分割比例。
3 结论
本研究通过正交试验确定乳酸乳球菌的最佳培养基配方为5%蛋白胨,3%蔗糖,2%玉米浆,1%酵母浸粉,0.2%磷酸氢二钾,0.2%氯化钠,0.02%七水硫酸镁,0.005%一水硫酸锰,0.5%柠檬酸三铵,0.6%轻质碳酸钙,pH 6.8;培养温度为30 ℃。摇瓶发酵11 h生物量为4.9×109 CFU/mL,较对照提高43%,Nisin效价为1 660 IU/mL,较对照提高20%。10 L罐分批发酵中生物量在17 h达到7.75×109CFU/mL,较对照提高38%,Nisin效价为2 573 IU/mL,较对照提高56.6%。分批发酵对数生长18 h(Nisin平均合成速率v¯q为147 IU/(mL·h),以不同比例分割发酵并继续培养7 h,第二次分割发酵(25%)的Nisin平均合成速率达到294 IU/(mL·h),较分批发酵提高了100%。该研究结果为Nisin工业发酵提供一定的理论以及数据支撑。
[1]KHELISSA S,CHIHIB N E,GHARSALLAOUI A.Conditions of nisin production by Lactococcus lactis subsp.lactis and its main uses as a food preservative[J].Arch Microbiol,2021,203(2):465-480.
[2]IBARRA-SÁNCHEZ L A,EL-HADDAD N,MAHMOUD D,et al.Advances in nisin use for preservation of dairy products[J].J Dairy Sci,2020,103(3):2041-2052.
[3]DELVES-BROUGHTON J,BLACKBURN P,EVANS R J,et al.Applications of the bacteriocin,nisin[J].Anton Leeuw,1996,69(2):193-202.
[4]BEGLEY M,COTTER P D,HILL C,et al.Glutamate decarboxylase-mediated nisin resistance in Listeria monocytogenes[J].Appl Environ Microbiol,2010,76(19):6541-6546.
[5]ZEYNEP G E,CEYHUN K,SEDEF T.Higher nisin yield is reached with glutathione and pyruvate compared with heme in Lactococcus lactis N8[J].Braz J Microbiol,2020,51(3):1247-1257.
[6]KÖRDIKANLIOGˇLU B,S,IMS,EK Ö,SARIS P E.Nisin production of Lactococcus lactis N8 with hemin-stimulated cell respiration in fed-batch fermentation system[J].Biotechnol Prog,2015,31(3):678-685.
[7]DE ARANZ L J,JOZALA A F,MAZZOLA P G,et al.Nisin biotechnological production and application:a review[J].Trends Food Sci Technol,2009,20(3-4):146-154.
[8]SONG A A L,IN L L A,LIM S H E,et al.A review on Lactococcus lactis:from food to factory[J].Microb Cell Fact,2017,16(1):55.
[9]TEUSINK B,SMID E J.Modelling strategies for the industrial exploitation of lactic acid bacteria[J].Nat Rev Microbiol,2006,4(1):46-56.
[10]SUN Z H,YU J,DAN T,et al.Phylogenesis and evolution of lactic acid bacteria[M].Berlin:Springer,2014:1-101.
[11]SIMSEK Ö,SARIS P E.Cycle changing the medium results in increased nisin productivity per cell in Lactococcus lactis[J].Biotechnol Lett,2009,31(3):415-421.
[12]SAUER M,RUSSMAYER H,GRABHERR R,et al.The efficient clade:lactic acid bacteria for industrial chemical production[J].Trends Biotechnol,2017,35(8):756-769.
[13]KUIPERS O P,BEERTHUYZEN M M,DE RUYTER P G,et al.Autoregulation of nisin biosynthesis in Lactococcus lactis by signal transduction[J].J Biol Chem,1995,270(45):27299-27304.
[14]PAPADIMITRIOU K,ALEGRÍA Á,BRON P A,et al.Stress physiology of lactic acid bacteria[J].Microbiolo Mol Biol Rev,2016,80(3):837-890.
[15]刘家亨.高产nisin乳酸乳球菌的构建及新型nisin生产体系的开发[D].天津:天津大学,2018.
[16]ZHANH H M,WANG Q J,FISHER D J,et al.Deciphering a unique biotin scavenging pathway with redundant genes in the probiotic bacterium Lactococcus lactis[J].Sci Rep,2016,6:25680.
[17]LAW J,HAANDRIKMAN A.Proteolytic enzymes of lactic acid bacteria[J].Int Dairy J,1997,7(1):1-11.
[18]KOK J,VAN GIJTENBEEK L A,DE JONG A,et al.The evolution of gene regulation research in Lactococcus lactis[J].FEMS Microbiol Rev,2017,41(Supp1):S220-S243.
[19]KALETTA C,ENTIAN K D.Nisin,a peptide antibiotic:cloning and sequencing of the nisA gene and posttranslational processing of its peptide product[J].J Bacteriol,1989,171(3):1597-1601.
[20]亓正良,杨海麟,张玲,等.高酸度醋发酵工艺研究[J].食品与生物技术学报,2010,29(6):911-915.
[21]董安利.乳酸乳球菌乳酸亚种BL19的高密度培养研究[D].呼和浩特:内蒙古农业大学,2019.
[22]刘桂茹.不同硫酸蒽酮比色定糖法的比较[J].天津农业科学,2016,22(3):5-7,22.
[23]任石苟,李奠础,许志芳.生物传感分析仪在乳酸发酵中的应用研究[J].食品工程,2011(3):47-51.
[24]ZHENG H J,ZHANG D,GUO K M,et al.Online recovery of nisin during fermentation coupling with foam fractionation[J].J Food Eng,2015,162:25-30.
[25]SAFARI R,MOTAMEDZADEGAN A,OVISSIPOUR M,et al.Use of hydrolysates from yellowfin tuna(Thunnus albacares)heads as a complex nitrogen source for lactic acid bacteria[J].Food Bioproc Tech,2012,5(1):73-79.