作为世界上六大著名蒸馏酒之一,白酒是一项充满创造智慧和文化魅力的发明[1],在中国商业发酵产品中发挥着重要作用。通常以粮谷为主要原料,以大曲、小曲、麸曲、酶制剂及酵母等为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏、陈酿、勾调而成[2]。近年来,随着生活水平的提高和生活方式的改变,中国饮酒人群保持着较大基数。尽管许多研究表明适度饮酒有助于身体健康[3-5],但过量饮酒也会导致多种疾病[6-11]。由于肝脏是乙醇代谢的主要器官,因此,长期大量饮酒会导致严重的肝脏类疾病[12-13]。
酒在人体内以乙醇代谢为主。饮酒后,乙醇经口腔、胃和肠道被吸收[14],只有小部分通过肺、尿液或汗液直接排出,约95%的乙醇被肝脏氧化代谢[15],主要的氧化途径有:包括乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)的乙醇脱氢酶氧化系统,微粒体乙醇氧化酶系统以及过氧化氢酶途径[16]。正常情况下,ADH和ALDH途径是乙醇代谢最主要的途径,首先,乙醇被ADH氧化为乙醛,然后通过ALDH氧化为乙酸[17],乙酸最终通过三羧酸循环代谢为二氧化碳和水排出体外[18]。但当乙醇超过酶的代谢能力时,代谢产物会在体内积聚,研究表明,乙醛积聚是饮酒后产生有害影响的主要因素,包括面部发红、头痛、恶心和呕吐、肝硬化和癌症[19-20]等。
目前的研究集中于将ADH和ALDH作为靶点,筛选天然解酒成分及开发新型解酒产品[21-22],或是通过模拟白酒特征成分的组成自制白酒,探究乙醇及其同系物对乙醇代谢的影响[23-24]。然而,酒体风味成分对乙醇代谢关键酶的作用及调控一直被忽略。实际上,白酒主要由水、乙醇(占98%)和微量成分(占2%)组成,成分对白酒风味起决定性作用[25]。随着风味成分组成和含量研究的深入,发现白酒具有溶胶体系部分属性,多种成分间相互影响、相互作用可能会影响体内乙醇的主要代谢效率,间接导致不同产地的白酒产生不同的生理乃至心理效应。
在之前的实验中[26],采用增量法和分光光度法测定了四种浓香型白酒中10种代表性风味成分(醇类和酯类)对ADH和ALDH活性的影响。结果表明醇类和酯类的加入会抑制ADH活性;而除了正丙醇,其他醇类和酯类浓度的升高会不同程度地促进ALDH活性,且向酒样中添加不同的风味成分对两种酶的抑制率也有所不同。ADH作为乙醇代谢过程中的第一个酶,其氧化速率决定了乙醇代谢能否顺利完成,因此,本研究选择酶学实验中对ADH抑制率高(>15%)的样品[26],通过构建小鼠灌胃模型,灌胃白酒、高醇白酒、高酯白酒及同浓度的酒精溶液,测定不同白酒及其主要风味成分的增量变化对乙醇代谢及其关键代谢酶的影响,对于行业优化酒体设计乃至引导消费者树立正确的饮酒观念和饮酒方法等方面有着重要的理论依据和意义。
1 材料与方法
1.1 材料与试剂
1.1.1 试验小鼠和白酒样品
无特定病原体(specific pathogen free,SPF)级的雄性昆明小鼠(20±2)g(许可证号:SYXK(川)2019-189):成都达硕实验动物有限公司。
不同乙醇浓度的浓香型白酒样品(SC1:68%vol、SC2:48%vol、SC3:38%vol):四川某酒厂;浓香型白酒样品(JS:40.8%vol):江苏某酒厂。采用气相色谱法测定白酒中代表醇类和酯类含量[26],结果见表1。
表1 浓香型白酒中代表性醇类和酯类的浓度
Table 1 Concentrations of representative alcohols and esters in strong-flavor Baijiu
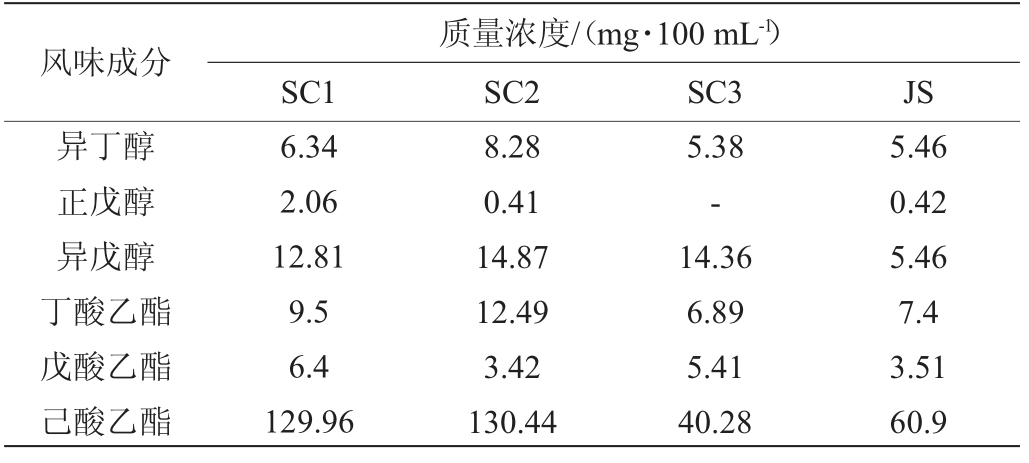
注:“-”表示未检出。
1.1.2 化学试剂
异丁醇、正戊醇、异戊醇、丁酸乙酯、戊酸乙酯、己酸乙酯(均为色谱纯):天津精细化工研究所;叔丁醇、乙腈(均为色谱纯)、小鼠乙醇脱氢酶酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、小鼠乙醛脱氢酶ELISA试剂盒:成都容辰嘉华生物技术有限公司;1 mL肝素钠抗凝管:江苏康健医疗用品有限公司。
1.2 仪器与设备
GC911-III型气相色谱仪、WondaCap WAX 色谱柱(30 m×0.25 mm×0.25 μm):四川知本分析科技有限公司;PRACTUM224-1CN电子分析天平:北京赛多利斯科学仪器有限公司;F6/10-10G型FLUKO超细匀浆器:上海弗鲁克流体机械制造有限公司;Biofuge stratos台式高速冷冻离心机:美国赛默飞世尔科技公司;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司;SpectraMAX Plus384酶标仪:上海美谷分子仪器有限公司。
1.3 方法
1.3.1 酒样预处理
实验组样品:通过计算表1中风味成分含量与总含量的比值,将风味成分(异丁醇、正戊醇、异戊醇、丁酸乙酯、戊酸乙酯、己酸乙酯)以1%的添加量分别添加到酒样中[26],充分摇匀。
酒精对照组样品:将酒精溶液的酒精含量分别调整为68%vol、48%vol、38%vol、40.8%vol。
1.3.2 实验动物分组及处理
SPF级的雄性昆明小鼠饲养于温度为(20±2)℃,相对湿度为(60±2)%,光照/黑暗周期为12 h的房间内。适应性喂养3 d后,将小鼠随机分为空白组、酒精对照组和酒样组(SC1组、SC2组、SC3组、JS组),再将SC1组分为:SC1酒样组、SC1+异丁醇组、SC1+正戊醇组、SC1+戊酸乙酯组;将SC2组分为SC2酒样组、SC2+异丁醇组、SC2+丁酸乙酯组、SC2+己酸乙酯组;将SC3组分为SC3酒样组、SC3+丁酸乙酯组;将JS组分为JS酒样组、JS+异丁醇组、JS+异戊醇组、JS+丁酸乙酯组,共17组,每组各6只。每天上午9点灌胃一次,连续7d。初始灌胃剂量为2.5 mL/kg体质量,每次增加1 mL/kg体质量,最后一次灌胃剂量为10 mL/kg体质量,每次灌胃前称体质量,以调整灌胃剂量。实验期间小鼠自由饮水及摄食。
1.3.3 行为学测定
旷场实验:实验装置为聚乙烯塑料露天场地(100 cm×100 cm×40 cm)[27],观察并记录小鼠在灌胃10 min内的行走次数和站立次数。每次实验之间用体积分数为75%乙醇擦拭场地,避免残留气味或分泌物等因素影响小鼠行为[1]。
平衡木实验:一根水平木杆(60 cm×1 cm)悬挂在装有垫料的盒子上方50 cm处。根据文献方法[28],在实验前一天,训练每只小鼠通过平衡木3次,如果小鼠不能走到另一端,可以轻推臀部或稍微扭动尾巴来诱导其移动。正式实验前,将小鼠移入实验室适应2 h。灌胃10 min后,将每只小鼠置于平衡木的一端观察其行为,并记录行走评分。评分标准如下:顺利通过平衡木得1分,前肢或后肢滑落得2分,悬挂或抱住平衡木得3分,直接跌落得4分。
1.3.4 血液中乙醇和乙醛浓度的测定
采用气相色谱法测定血液中乙醇和乙醛的浓度。
样品前处理:第7天灌胃2 h后,采用摘眼球法取血,将血样置于肝素钠抗凝管中,5 000 r/min离心15 min后,收集500μL上清液,加入叔丁醇(1mg/mL,20μL)和乙腈(1mg/mL,480 μL),混合后10 000 r/min离心10 min,通过0.22 μm有机滤膜过滤。
气相色谱条件:GC911-III型气相色谱仪上配有Wonda Cap WAX色谱柱(30 m×0.25 mm×0.25 μm),检测器温度250 ℃,进样口温度250 ℃,柱流量为1.5 mL/min,分流比为1∶20,进样量为1 μL。柱温为程序升温,升温条件:烘箱温度最初为48 ℃,以3 ℃/min的加热速率升温至55 ℃,维持6 min,再以30 ℃/min的速率升温至200 ℃,维持2 min。
1.3.5 肝脏中ADH和ALDH活性的测定
小鼠取血后采用颈椎脱臼法处死。立即取出肝脏,用4 ℃生理盐水清洗,滤纸吸干后储存于-80 ℃,随后根据试剂盒的原理与方法采用双抗体夹心法检测小鼠肝脏中ADH和ALDH水平。
1.3.6 统计分析
所有实验结果均采用IBM SPSS Statistics 26.0软件分析,使用最小显著性差异(least significant difference,LSD)检验进行组间比较。P<0.05认为差异有统计学意义。使用Graphpad prism 8.0软件绘制数据图。
2 结果与分析
2.1 行为学测定
旷场实验根据动物的趋避性,可用于检测小鼠在新环境中的自发活动行为以及探索行为[29]。旷场实验的行为指标测定结果见图1。由图1A可知,灌胃SC1酒样后,小鼠站立次数增多,行走次数减少;SC1+正戊醇组、SC1+戊酸乙酯组小鼠行走次数多于68%vol酒精溶液组、SC1酒样组,差异显著(P<0.05)。由图1B可知,灌胃SC2酒样后,小鼠站立次数和行走次数增多;SC2+异丁醇组小鼠行走次数少于SC2酒样组,差异显著(P<0.05)。由图1C可知,灌胃SC3酒样后,小鼠站立次数增多,行走次数减少。由图1D可知,灌胃JS酒样后,小鼠站立次数减少;JS+丁酸乙酯组小鼠行走次数少于40.8%vol酒精溶液组、JS酒样组,差异显著(P<0.05)。与空白组相比,酒样组和酒精对照组小鼠站立次数均增加,说明小鼠的活动能力和探索能力均受到了乙醇影响,且灌胃不同产地的浓香型白酒后行为表现有着差异。研究表明,异戊醇含量愈高的浓香型白酒,饮后不适感愈强,影响小鼠的自发行动[30]。
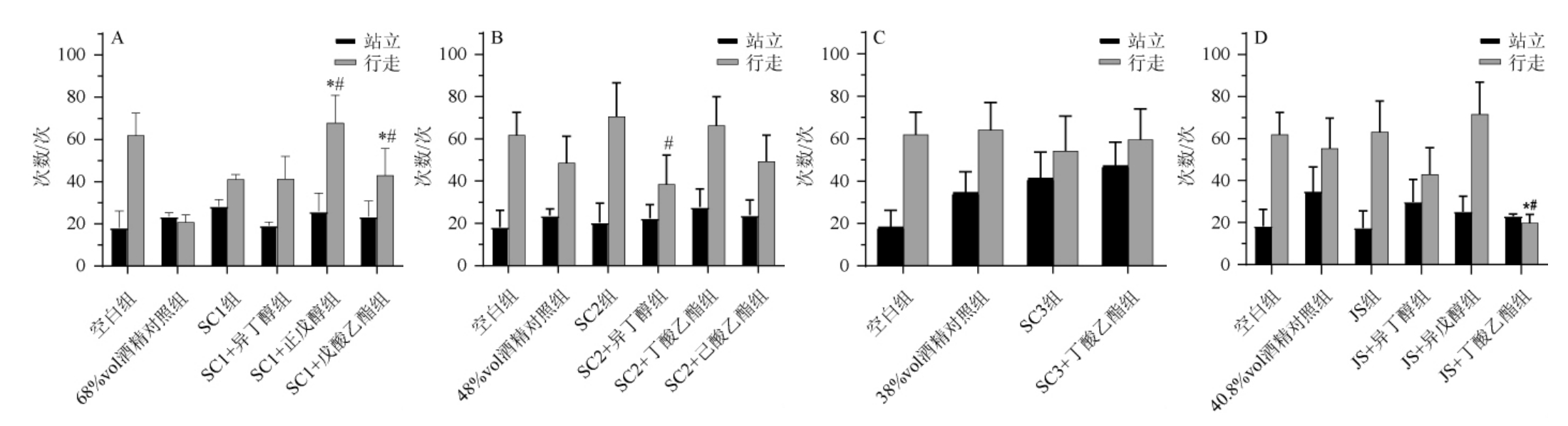
图1 小鼠旷场实验行为指标测定结果
Fig.1 Determination results of behavioral indicators by open field test of mice
“*”表示与同浓度酒精溶液相比有显著差异(P<0.05);“#”表示与同组原酒样相比有显著差异(P<0.05)。下同。
平衡木是测试小鼠的平衡能力、肌肉力量和运动协调性,急性酒精过量会导致共济失调,表现为身体运动不协调和平衡障碍[31],分数越高表示共济失调越严重。小鼠平衡木实验行为指标测定结果见图2。由图2可知,与空白组相比,酒样组和酒精对照组均表现出轻微甚至明显的身体不协调,且酒样组的行走得分高于酒精对照组,表明酒精会引起共济失调,而白酒中的风味成分会加剧这种现象。由图2A可知,SC1+异丁醇组的小鼠行走评分最高,造成的共济失调最严重。由图2B可知,SC2+异丁醇组小鼠行走评分高于48%vol酒精溶液组,差异显著(P<0.05);SC2+丁酸乙酯组小鼠行走评分减小。由图2C可知,SC3+丁酸乙酯组小鼠行走评分低于SC3酒样组,差异显著(P<0.05)。由图2D可知,JS酒样组、JS+异丁醇组、JS+异戊醇组、JS+丁酸乙酯组小鼠行走评分均高于40.8%vol酒精溶液组。
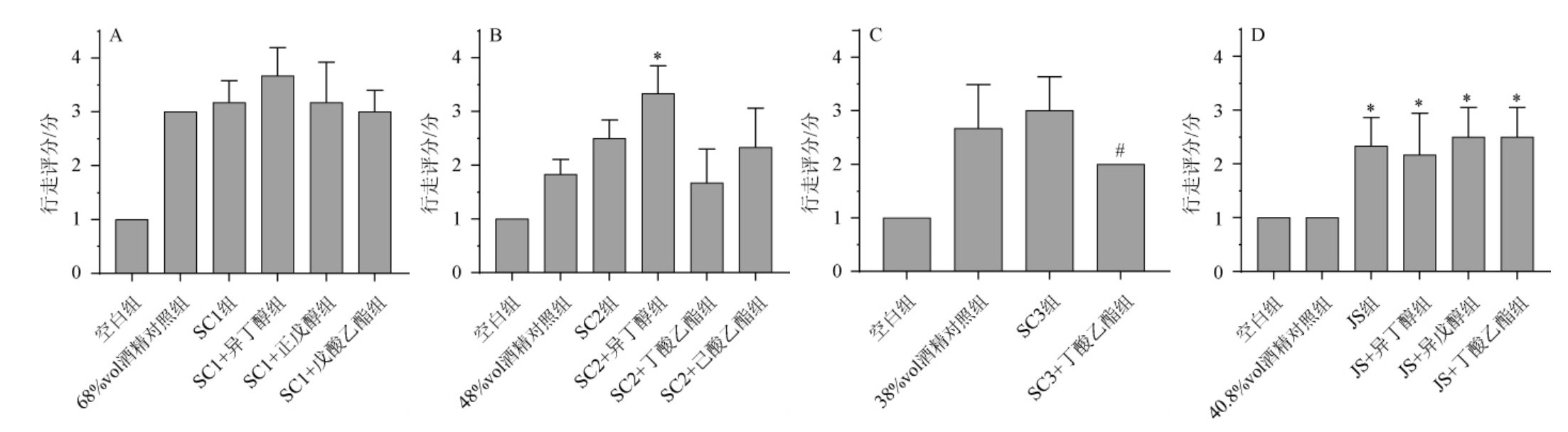
图2 小鼠平衡木实验行为指标测定结果
Fig.2 Determination results of behavioral indicators by balance beam test of mice
在白酒醇类物质中,高级醇对人体的麻醉作用高于乙醇,高级醇可抑制神经中枢,饮后易出现神经系统充血、头痛等症状[32]。谢佳等[24]发现白酒中的异丁醇、异戊醇会抑制乙醇代谢,从而增加醉度,表现出共济失调。徐佳楠等[33]推断引起小鼠饮酒后舒适度降低,行为受到抑制的原因与酒体中高级醇含量过高、酸酯比例不协调有关。
2.2 白酒中的醇类和酯类对血液中乙醇和乙醛含量的影响
小鼠灌胃模型采用逐渐增加白酒剂量的方法,是为了降低小鼠突然摄入高浓度乙醇导致急性损伤甚至死亡。小鼠血液中乙醇和乙醛含量测定结果见图3。由图3A可知,SC1+异丁醇组、SC1+正戊醇组小鼠血液乙醇浓度高于68%vol酒精溶液组、SC1酒样组,差异显著(P<0.05);SC1酒样组、SC1+戊酸乙酯组小鼠血液乙醇含量高于68%vol酒精溶液组,差异显著(P<0.05);SC1+异丁醇组、SC1+正戊醇组小鼠血液乙醛含量高于68%vol酒精溶液组,差异显著(P<0.05)。由图3B可知,SC2+异丁醇组、SC2+丁酸乙酯组、SC2+己酸乙酯组小鼠血液乙醇含量均高于48%vol酒精溶液组、SC2酒样组,差异显著(P<0.05);SC2酒样组小鼠血液乙醇含量高于48%vol酒精溶液组,差异显著(P<0.05);SC2+丁酸乙酯组小鼠血液乙醛含量高于48%vol酒精溶液组、SC2酒样组,差异显著(P<0.05)。由图3C可知,SC3+丁酸乙酯组小鼠血液乙醇含量高于SC3酒样组,差异显著(P<0.05);SC3+丁酸乙酯组小鼠血液乙醛含量高于38%vol酒精溶液组,差异显著(P<0.05)。由图3D可知,JS+异戊醇组小鼠血液乙醛含量高于40.8%vol酒精溶液组,差异显著(P<0.05)。
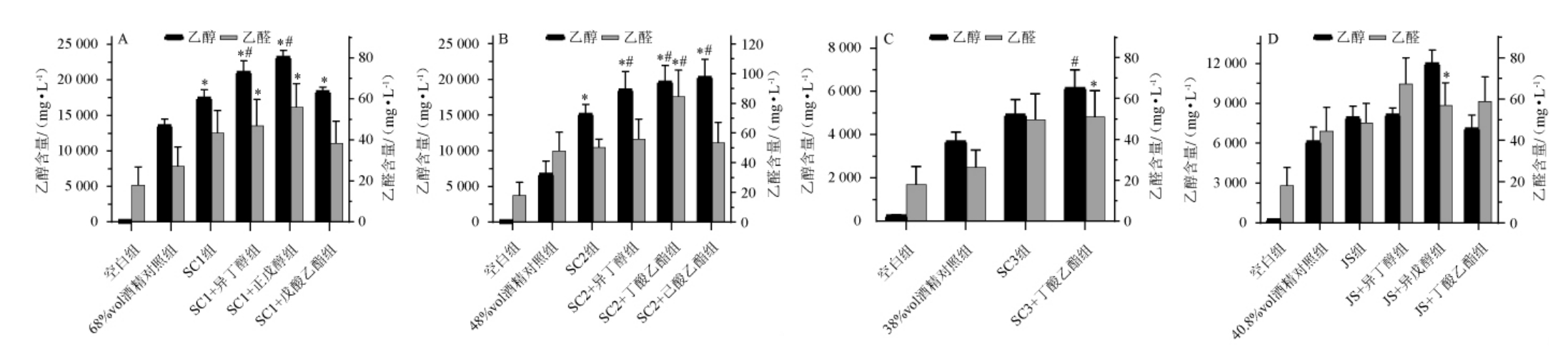
图3 小鼠血液中乙醇和乙醛含量测定结果
Fig.3 Determination results of ethanol and acetaldehyde contents in mice blood
研究表明,高级醇类物质在体内的氧化分解速度比乙醇慢,在体内停留时间较长[34],对人体具有一定毒性,是引起不良醉酒反应潜在的有害物质[35]。同时,在相同的乙醇含量下,酒精饮料比酒精溶液对人体肝脏组织造成的损害更大,因为乙醇及其同系物之间的相互作用增强了肝脏的氧化特性[36],或高级醇可以抑制三羧酸循环[37],降低乙醇的氧化速率[38],进而影响乙醇的代谢,导致有害物积累,最终对机体造成损伤。本研究结果发现,分别灌胃含有高浓度异丁醇、异戊醇的白酒会增加小鼠血液中乙醇和乙醛的含量,降低小鼠的协调能力。但也有研究指出威士忌中适量的高级醇具有减轻宿醉症状的作用[39],说明不同白酒饮用舒适度的差异与其所含的成分密切相关。
2.3 白酒中醇类和酯类对肝脏中ADH和ALDH活性的影响
ADH分解乙醇的速度主要与ADH的活性有关,小鼠肝脏中乙醇脱氢酶和乙醛脱氢酶活性测定结果见图4。由图4A可知,SC1酒样组、SC1+正戊醇组、SC1+戊酸乙酯组小鼠肝脏ADH活性与68%vol酒精溶液组相比有显著差异(P<0.05);SC1+异丁醇组小鼠肝脏ADH活性低于SC1酒样组,差异显著(P<0.05);SC1+异丁醇组、SC1+正戊醇组、SC1+戊酸乙酯组小鼠肝脏ALDH活性低于68%vol酒精溶液组、SC1酒样组,差异显著(P<0.05)。由图4B可知,SC2+异丁醇组、SC2+己酸乙酯组小鼠肝脏ALDH活性低于48%vol酒精溶液组,差异显著(P<0.05);SC2+丁酸乙酯组小鼠肝脏ALDH活性高于48%vol酒精溶液组、SC2酒样组,差异显著(P<0.05)。由图4C可知,SC3酒样组小鼠肝脏ALDH活性低于38%vol酒精溶液组,差异显著(P<0.05);SC3+丁酸乙酯组小鼠肝脏ALDH活性高于SC3酒样组,差异显著(P<0.05)。由图4D可知,JS+异戊醇组小鼠肝脏ADH活性高于40.8%vol酒精溶液组,差异显著(P<0.05);JS酒样组、JS+异丁醇组小鼠肝脏ALDH活性与40.8%vol酒精溶液组相比有显著差异(P<0.05);JS+异戊醇组小鼠肝脏ALDH活性低于JS酒样组,差异显著(P<0.05)。
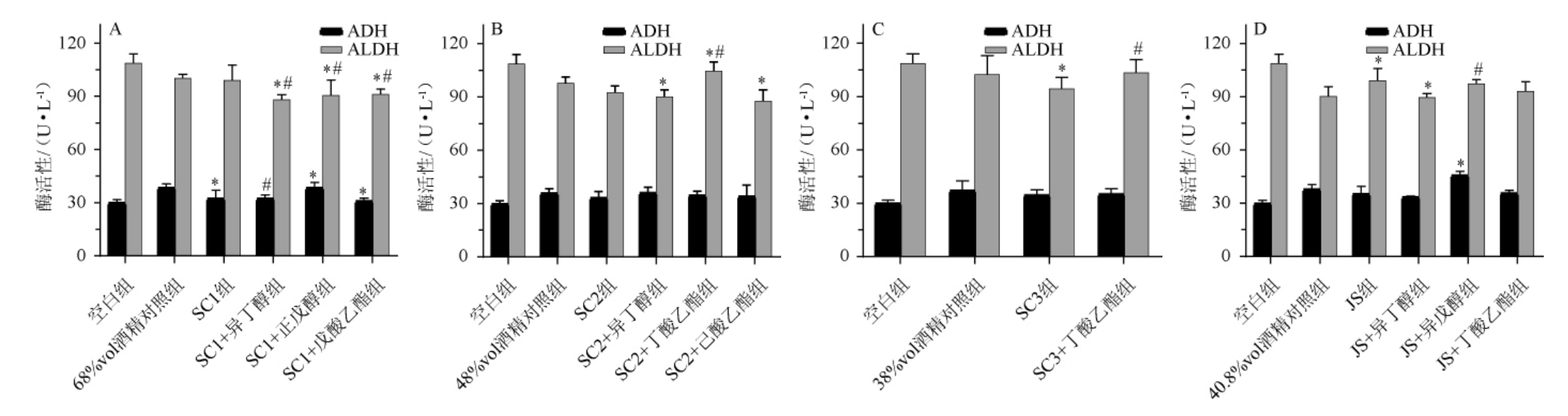
图4 小鼠肝脏中乙醇脱氢酶和乙醛脱氢酶活性测定结果
Fig.4 Determination results of activities of alcohol dehydrogenase and acetaldehyde dehydrogenase in mice liver
适量的酯类使白酒口感醇厚,香气持久,回味甘甜。相关研究发现,乙酸乙酯可以促进乙醇代谢,显著降低白酒的醉酒程度[24]。然而,在本研究中,虽然在SC2和SC3酒样中添加丁酸乙酯可以增强ADH和ALDH酶活性,但它也增加了血液中乙醇和乙醛的含量。值得注意的是,本研究是从风味成分的整体和系统层面出发,采用增量法添加白酒固有风味成分的浓度,进一步阐明其浓度对乙醇代谢途径的影响。
总的来说,小鼠灌胃实验中风味成分对肝脏ADH和ALDH活性的影响可分为三类:①大多数风味成分同时抑制ADH和ALDH活性;②促进ADH活性而抑制ALDH活性,如SC1酒样中添加异丁醇,SC2酒样中添加异丁醇和己酸乙酯,JS酒样中添加异戊醇和丁酸乙酯;③同时促进ADH和ALDH的活性,如向SC2和SC3酒样中添加丁酸乙酯。
2.4 小鼠血液中乙醇、乙醛含量与肝脏中ADH、ALDH活性相关性分析
由图5A可知,小鼠肝脏中ADH活性与与血液中的乙醇含量之间没有相关性(相关系数R2=0.005 2,P>0.05);由图5B可知,小鼠肝脏中ADH活性与血液中乙醛含量之间没有相关性(相关系数R2=0.032 1,P>0.05);由图5C可知,小鼠肝脏中ALDH活性与血液中的乙醛含量没有相关性(R2=0.086 3,P>0.05);由图5D可知,小鼠肝脏中ALDH活性与血液中乙醇含量弱相关(相关系数R2=0.236 1,P<0.05),即分别灌胃白酒、高醇白酒、高酯白酒和相同浓度的酒精溶液后,小鼠肝脏中ALDH活性与血液中乙醇含量的变化有一定的联系,但联系的紧密程度较低。
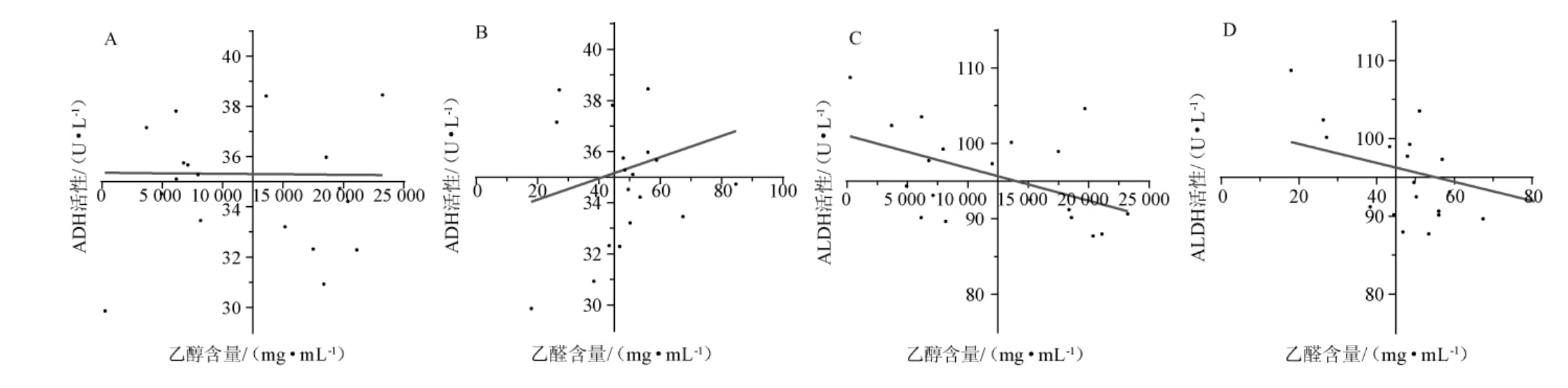
图5 小鼠血液中乙醇、乙醛含量与肝脏中乙醇脱氢酶、乙醛脱氢酶活性之间的关系
Fig.5 Relationship between the contents of ethanol,acetaldehyde in blood and activities of alcohol dehydrogenase and acetaldehyde dehydrogenase in liver of mice
本研究中,在白酒中加入某几类醇类和酯类物质,对ADH和ALDH的抑制作用增强,且对ADH的抑制作用更为显著。然而,经过相关性分析发现,白酒和风味成分的变化对乙醇和乙醛含量的影响并不完全取决于ADH和ALDH的活性。一项研究报告称,缺少某一类酸和酯的白酒对ADH和ALDH酶活性的影响不能作为乙醇和乙醛含量变化的原因[24];也有研究指出,影响血液中乙醇和乙醛含量的饮料[40]和水果[41]不是通过改变ADH和ALDH的活性,可能是通过非酶促方式,如改变乙醇在胃和肠中的吸收或通过呼吸和尿液介导乙醇的排泄。而且,与ADH相比,微粒体乙醇氧化系统对乙醇的亲和力较低,因此,在酒精浓度低到中等时,乙醇的代谢主要由ADH催化,而当酒精浓度过高时,微粒体乙醇氧化系统被诱导激活,导致更多的乙醇被氧化成乙醛[42]。
3 结论
最近关于风味成分对乙醇代谢和人体健康影响的研究仍集中在表型研究上,缺乏有效的体内实验来验证这些成分的生理功能。因此,本研究采用增量法增加白酒中典型高级醇类和酯类的浓度,构建小鼠灌胃模型,结合乙醇代谢相关酶的分析,在不变动酒样中复杂成分的绝对浓度的前提下初步论证了白酒中主要风味成分对有关酶系的整体效果。本研究仅以浓香型白酒为材料,以乙醇脱氢酶系统为研究对象展开初步研究,之后的实验将扩展到其他品类的白酒以及肝脏中其他相关代谢酶,这将有助于系统研究白酒中风味成分对乙醇代谢的影响,让消费者科学认识白酒对人体健康的利弊关系,促进行业在提高风味品质和减少对饮用者健康的负面影响之间寻求平衡并持续努力。
[1]ZHU M,CHEN P,HU X J,et al.Rapid determination of pit mud moisture content using hyperspectral imaging[J].Food Sci Nutr,2019,8(1):179-189.
[2]国家市场监督管理总局,国家标准化管理委员会.GB/T 15109—2021白酒工业术语[S].北京:中国标准出版社,2021.
[3]SHAI I,RIMM E B,SCHULZE M B,et al.Moderate alcohol intake and markers of inflammation and endothelial dysfunction among diabetic men[J].Diabetologia,2004,47(10):1760-1767.
[4]DENG J,ZHOU D H D,LI J C,et al.A 2-year follow-up study of alcohol consumption and risk of dementia[J].Clin Neurol Neurosurg,2006,108(4):378-383.
[5]RONKSLEY P E,BRIEN S E,TURNER B J,et al.Association of alcohol consumption with selected cardiovascular disease outcomes:a systematic review and meta-analysis[J].BMJ,2011,342:d671.
[6]AMES N J,BARB J J,SCHUEBEL K,et al.Longitudinal gut microbiome changes in alcohol use disorder are influenced by abstinence and drinking quantity[J].Gut Microbes,2020,11(6):1608-1631.
[7]ASKGAARD G,GRØNBÆK M,KJÆR M S,et al.Alcohol drinking pattern and risk of alcoholic liver cirrhosis:a prospective cohort study[J].J Hepatol,2015,62(5):1061-1067.
[8]HUSAIN K,ANSARI R A,FERDER L.Alcohol-induced hypertension:Mechanism and prevention[J].World J Cardiol,2014,6(5):245-252.
[9]MATTA B,GOUGOL A,GAO X T,et al.Worldwide variations in demographics,management,and outcomes of acute pancreatitis[J].Clin Gastroenterol Hepatol,2020,18(7):1567-1575.
[10]ROSOFF D B,SMITH G D,MEHTA N,et al.Evaluating the relationship between alcohol consumption,tobacco use,and cardiovascular disease:A multivariable Mendelian randomization study[J].PLoS Med,2020,17(12):e1003410.
[11]UCCELLA L,BONGETTA D,FUMAGALLI L,et al.Acute alcohol intoxication as a confounding factor for mild traumatic brain injury[J].Neurol Sci,2020,41(8):2127-2134.
[12]SEITZ H K,BATALLER R,CORTEZ-PINTO H,et al.Alcoholic liver disease[J].Nat Rev Dis Primers,2018,4(1):16.
[13]SEITZ H K,NEUMAN M G.The History of alcoholic liver disease:from an unrecognized disease to one of the most frequent diseases in hepatology[J].J Clin Med,2021,10(4):858.
[14]HEIER C,XIE H,ZIMMERMANN R.Nonoxidative ethanol metabolism in humans-from biomarkers to bioactive lipids[J].IUBMB Life,2016,68(12):916-923.
[15]PAPALIMPERI A H,ATHANASELIS S A,MINA A D,et al.Incidence of fatalities of road traffic accidents associated with alcohol consumption and the use of psychoactive drugs:A 7-year survey(2011-2017)[J].Exp Ther Med,2019,18(3):2299-2306.
[16]KANZAKI N,KATAOKA T,ETANI R,et al.Analysis of liver damage from radon,X-ray,or alcohol treatments in mice using a self-organizing map[J].J Radiat Res,2017,58(1):33-40.
[17]PYUN C W,SEO T S,KIM D J,et al.Protective effects of Ligularia fischeri and Aronia melanocarpa extracts on alcoholic liver disease(in vitro and in vivo study)[J].Biomed Res Int,2020,2020(2):1-11.
[18]ZHANG H Y,WANG H L,ZHONG G Y,et al.Molecular mechanism and research progress on pharmacology of traditional Chinese medicine in liver injury[J].Pharm Biol,2018,56(1):594-611.
[19]ERIKSSON C J.Genetic-epidemiological evidence for the role of acetaldehyde in cancers related to alcohol drinking[J].Adv Exp Med Biol,2015,815:41-58.
[20]ANDRICI J,HU S X H,ESLICK G D.Facial flushing response to alcohol and the risk of esophageal squamous cell carcinoma:A comprehensive systematic review and meta-analysis[J].Cancer Epidemiol,2016,40:31-38.
[21]CHEN X,CAI F,GUO S,et al.Protective effect of Flos puerariae extract following acute alcohol intoxication in mice[J].Alcohol Clin Exp Res,2014,38(7):1839-1846.
[22]SUNG C K,KIM S M,OH C J,et al.Taraxerone enhances alcohol oxidation via increases of alcohol dehyderogenase(ADH)and acetaldehyde dehydrogenase(ALDH)activities and gene expressions[J].Food Chem Toxicol,2012,50(7):2508-2514.
[23]LOUIS C A,WOOD S G,KOSTRUBSKY V,et al.Synergistic increases in rat hepatic cytochrome P450s by ethanol and isopentanol[J].J Pharmacol Exp Ther,1994,269(2):838-845.
[24]谢佳,彭斌,何松贵,等.白酒关键微量成分对醉度及小鼠乙醇代谢和急性酒精性肝损伤的影响[J].中国酿造,2018,37(6):155-160.
[25]汤道文,谢玉球,朱法余,等.白酒中的微量成分及与白酒风味技术发展的关系[J].酿酒科技,2010(5):78-81.
[26]曾礼兰,刘嫒春,方帅,等.基于香气活力值分析白酒风味化合物对乙醇代谢关键酶的影响[J].中国酿造,2021,40(2):170-174.
[27]LUO J,WANG T,LIANG S,et al.Experimental gastritis leads to anxiety-and depression-like behaviors in female but not male rats[J].Behav Brain Funct,2013,9(1):46-57.
[28]CRABBE J C,METTEN P,YU C H,et al.Genotypic differences in ethanol sensitivity in two tests of motor incoordination[J].J Appl Physiol,2003,95(4):1338-1351.
[29]SHIN J,GIREESH G,KIM S W,et al.Phospholipase C beta 4 in the medial septum controls cholinergic theta oscillations and anxiety behaviors[J].J Neurosci,2009,29(49):15375-15385.
[30]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
[31]WU M C,BING Y H,CHU C P,et al.Ethanol modulates facial stimulation-evoked outward currents in cerebellar Purkinje cells in vivo in mice[J].Sci Rep,2016,6(1):30857.
[32]产锦,方尚玲,蒋威,等.降低小曲酒中杂醇油含量的研究进展[J].酿酒,2012,39(6):32-35.
[33]徐佳楠,杨帅,倪永培,等.影响迎驾贡酒饮后舒适度的关键酒体成分研究[J].酿酒科技,2019(12):23-28,31.
[34]LACHENMEIER D W,HAUPT S,SCHULZ K.Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products[J].Regul Toxicol Pharmacol,2008,50(3):313-321.
[35]HAN Q A,SHI J L,ZHU J,et al.Enzymes extracted from apple peels have activity in reducing higher alcohols in Chinese liquors[J].J Agr Food Chem,2014,62(39):9529-9538.
[36]PENEDA J,BAPTISTA A,LOPES J M.Interaction of the constituents of alcoholic beverages in the promotion of liver damage[J].Acta Med Port,1994,7(1):S51-S55.
[37]FORSANDEROA.Influence ofsome aliphatic alcoholson the metabolism of rat liver slices[J].Biochem J,1967,105(1):93-97.
[38]罗杰,敖宗华,王松涛,等.浓香型白酒不同类别基酒中杂醇油相关性研究[J].酿酒科技,2015(1):43-44,47.
[39]HORI H,FUJII W,HATANAKA Y,et al.Effects of fusel oil on animal hangover models[J].Alcohol Clin Exp Res,2003,27(8):37S-41S.
[40]WANG F,ZHANG Y J,ZHOU Y,et al.Effects of beverages on alcohol metabolism:potential health benefits and harmful impacts[J].Int J Mol Sci,2016,17(3):354.
[41]ZHANG Y J,WANG F,ZHOU Y,et al.Effects of 20 selected fruits on ethanol metabolism:potential health benefits and harmful impacts[J].Int J Environ Res Public Health,2016,13(4):399.
[42]KISHIMOTO R,FUJIWARA I,KITAYAMA S,et al.Changes in hepatic enzyme activities related to ethanol metabolism in mice following chronic ethanol administration[J].J Nutr Sci Vitaminol,1995,41(5):527-543.