随着社会的发展与进步,人们的生活水平不断的提高,加之工作生活节奏的加快、膳食营养的过剩及运动的缺乏,导致越来越多的人的血清中胆固醇含量偏高,过量的胆固醇摄入会导致心脑血管各类疾病的发生[1-2]。世界卫生组织预测,未来几十年心血管疾病仍然是威胁人类生命安全的疾病之一,而高胆固醇是引发该疾病的重要因素之一[3]。目前,药物治疗是高胆固醇血症患者采用的主要治疗方法,但药物治疗费用高,且存在副作用[4]。因此,从我国传统发酵乳酸菌食品中发掘安全、高效降胆固醇的食品成为研究热点,对于预防和辅助治疗高胆固醇血症具有重要的意义。
有研究表明,经常食用乳酸菌发酵食品可降低人体血液中的胆固醇含量,进而降低心血管疾病发生的几率[5]。传统发酵食品是乳酸菌的主要来源,马长路等[6]从东北酸菜中分离纯化出10株乳杆菌,其中干酪乳杆菌(Lactobacillus casei)的胆固醇降解率达到52.84%;国立东等[7]从东北酸菜中分离纯化出一株植物乳杆菌(Lactobacillus plantarum)HUCM115,胆固醇去除率达20.6%;任大勇等[8]从东北黏面子、辣白菜、辣酱分离纯化出6株乳酸菌,胆固醇清除率达到85%以上;李雅迪等[9]从传统发酵食品中分离筛选出一株Lactobacillus plantarum S11,胆固醇降解率达44.34%;云月英等[10]从发酵肉制品中获得弯曲乳杆菌(Lactobacillus curvatus)和戊糖片球菌(Pediococcus pentosaceus),胆固醇去除率分别为56.05%和58.49%。此外,国内也有报道不同来源的益生菌在胆固醇降解方面的应用[11-20]。
酒糟酸菜作为广西来宾地区的一种传统发酵蔬菜,以其特殊的制作工艺而出名,且营养丰富、酸脆可口、解腻开胃,是来宾地区餐桌上常见的菜品。本研究从来宾市场的酒糟酸菜中分离筛选具有去除胆固醇能力的乳酸菌,通过形态观察和分子生物学技术对其进行菌种鉴定,同时研究其耐酸性及耐胆盐性,并以胆固醇去除率为考察指标,通过单因素试验及正交试验对其发酵工艺进行优化,探究其体外胆固醇降解能力,旨在丰富降胆固醇益生菌菌种资源库,也为传统益生菌功能食品的开发提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酸菜汁:采自广西来宾市场酒糟发酵酸菜汁,于-20 ℃保存备用。
1.1.2 培养基MRS液体培养基:广东环凯微生物科技有限公司。
MRS-CaCO3培养基[21]:在MRS液体培养基的基础上添加2%的琼脂和1%的CaCO3,调节pH为6.0。121 ℃高压蒸汽灭菌20 min。
MRS-胆固醇(cholesterol,CHOL)培养基[22]:称取0.1 g胆固醇,0.2 g牛胆盐,0.1 g蔗糖酯,加入1 mL吐温80,搅匀,再加入5 mL冰乙酸,超声振荡至完全溶解,趁热用0.45 μm的滤膜过滤,加入1 L MRS液体培养基中,调pH至6.0~7.0,121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
牛胆盐、胆固醇(纯度均为99%):合肥博美生物科技有限责任公司;冰乙酸、氯化钠、邻苯二甲醛、氢氧化钠、盐酸、无水乙醇、正己烷等(均为分析纯):国药集团化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
UV1050紫外可见分光光度计:上海天美科学仪器有限公司;HH-S数显恒温水浴锅:江苏省金坛市医疗仪器厂;PHS-3E pH计:上海雷磁仪电科学仪器股份有限公司;ZSD-1090型生化培养箱:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 乳酸菌菌株的分离[22]
采用生理盐水将酸菜汁进行10倍梯度稀释,分别吸取稀释度为10-4、10-5、10-6的稀释液100 μL均匀涂布于MRSCaCO3固体培养基平板上,于37 ℃条件下厌氧培养48 h。挑取具有明显溶钙圈的单菌落划线于MRS固体培养基中进行分离纯化至菌落形态单一,将纯化后的菌株于4 ℃保存备用。
1.3.2 降胆固醇乳酸菌菌株的筛选[23]
将分离得到的菌种置于MRS液体培养基中,于37 ℃条件下培养12~14 h,进行活化。按3%(V/V)的接种量将活化的菌种接种到MRS-CHOL培养基中,于37 ℃条件下培养72 h后测定胆固醇含量[24-25],并计算胆固醇去除率,其计算公式如下[26-27]:
式中:A为空白MRS-CHOL培养基中的胆固醇含量,μg/mL;C为菌株培养72 h后胆固醇的含量,μg/mL。
1.3.3 降胆固醇菌株的鉴定
形态观察:将筛选菌株划线接种于MRS培养基平板上,于37 ℃条件下培养48 h,观察菌落形态。通过革兰氏染色,镜检观察菌体细胞形态特征。
分子生物学鉴定:将筛选得到的菌种委托上海美吉生物医药科有限公司进行测序,将测序得到的结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树[28]。
1.3.4 菌株的耐酸性试验[6]
将活化的菌株按4%(V/V)的接种量接种于pH值分别为2.0、3.0、4.0、5.0的MRS液体培养基中,以接种于pH值为6.0的MRS液体培养基为对照,37 ℃条件下静置培养24 h,试验重复3次,测定各培养液的OD600nm值,并计算菌株存活率,其计算公式如下:
式中:B、B0分别为试验组和对照组培养液的OD600nm值。
1.3.5 菌株的耐胆盐性试验[6]
将活化的菌株按4%(V/V)的接种量接种于胆盐含量分别为0.1%、0.2%、0.3%的MRS液体培养基中,以接种于不加胆盐的MRS液体培养基为对照组,37 ℃条件下静置培养24 h,试验重复3次,测定各培养液的OD600nm值,并计算菌株存活率,其计算公式如下:
式中:C、C0分别为试验组和对照组培养液的OD600nm值。
1.3.6 筛选菌株去除胆固醇培养条件优化
发酵初始条件为初始pH值6.0、发酵温度37 ℃、接种量4%、发酵时间36 h。
单因素试验:采用控制变量法[29],以胆固醇去除率为考察指标,考察初始pH值(5.0、5.5、6.0、6.5、7.0)、接种量(1%、2%、3%、4%、5%)、发酵时间(36 h、48 h、60 h、72 h、84 h)和发酵温度(33 ℃、35 ℃、37 ℃、39 ℃、41 ℃)4个因素对筛选菌株去除胆固醇的影响。
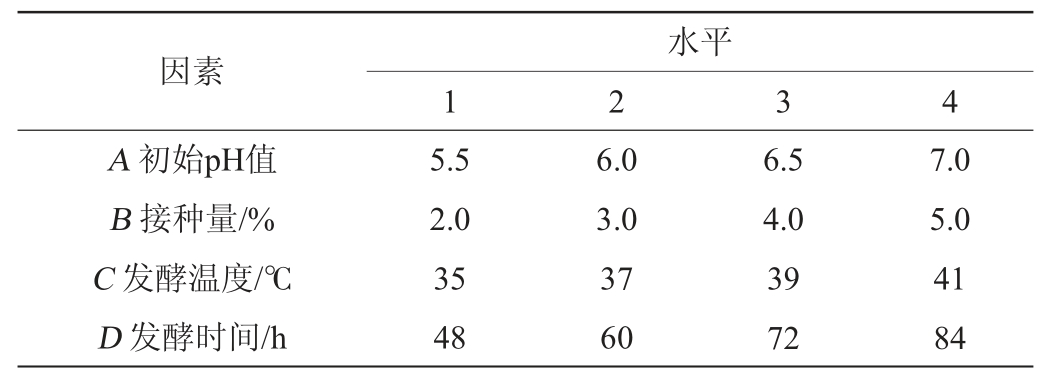
正交试验:在单因素试验的基础上,以胆固醇去除率为考察指标,初始pH值(A)、接种量(B)、发酵温度(C)、发酵时间(D)为考察因素进行4因素4水平正交试验,试验因素与水平见表1。
表1 菌株去除胆固醇培养条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments optimization of strain culture conditions for removing cholesterol
1.3.7 数据处理
作图和数据处理采用Origin 8.5软件进行。
2 结果与分析
2.1 降胆固醇乳酸菌菌株的分离及筛选
将酸菜汁稀释涂布于MRS-CaCO3固体培养基中,培养48 h后,分离得到20株有明显溶钙圈的菌株,其中胆固醇去除率>15%的菌株有5株,其胆固醇去除率见表2。
表2 筛选菌株的胆固醇去除率
Table 2 Cholesterol removal rates of selected strains

由表2可知,菌株XL-02的胆固醇去除率最高,为(21.3±1.4)%,菌株XL-03次之(17.6±1.1)%,所以后续试验以菌株XL-02作为研究对象。
2.2 菌株XL-02的鉴定
2.2.1 形态观察
菌株XL-02在MRS培养基平板上的菌落形态及细胞形态见图1。
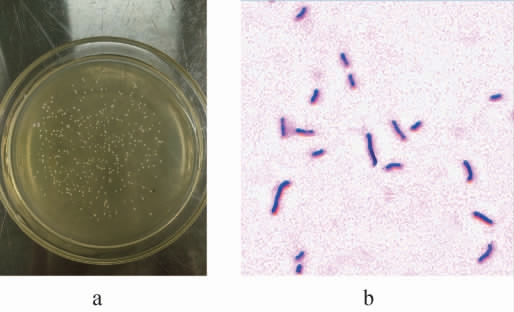
图1 菌株XL-02的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain XL-02
由图1可知,菌株XL-02的菌落表面圆滑,形态较小,呈乳白色凸起状的菌落;在光学显微镜下观察菌株呈短杆状,无芽孢,革兰氏染色为阳性。
2.2.2 分子生物学鉴定
基于16SrDNA基因序列菌株XL-02的系统发育树见图2。
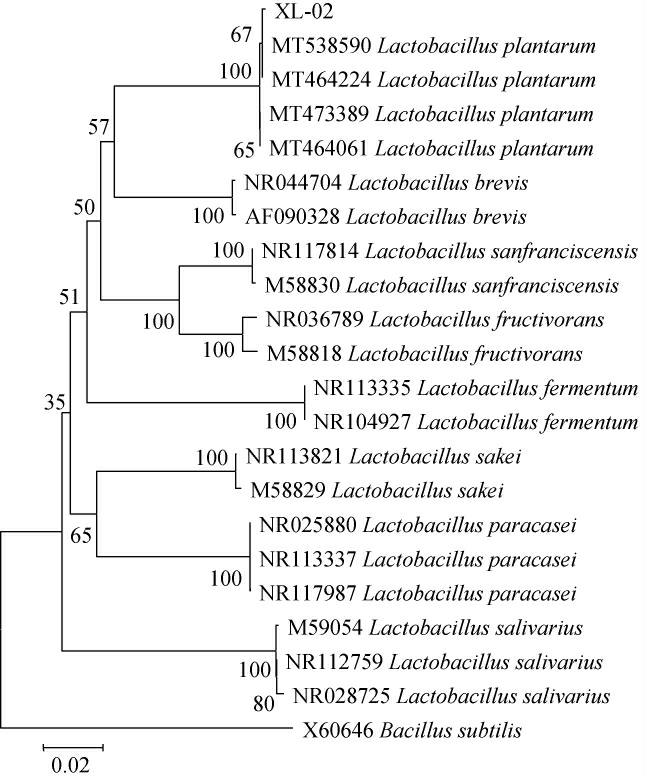
图2 基于16S rDNA基因序列菌株XL-02的系统发育树
Fig.2 Phylogenetic tree of strain XL-02 based on 16S rDNA gene sequence
由图2可知,菌株XL-02与植物乳杆菌(Lactobacillus plantarum)16S rDNA基因序列同源性达100%,聚于一支,亲缘关系最近,因此确定该菌株为植物乳杆菌(Lactobacillus plantarum)。
2.3 菌株XL-02的耐酸性试验结果
菌株XL-02的耐酸性试验结果见图3。
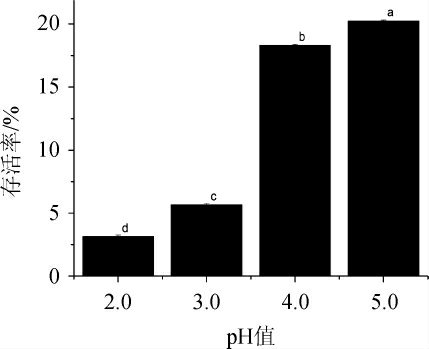
图3 菌株XL-02的耐酸性试验结果
Fig.3 Acid tolerance tests results of strain XL-02
益生菌要发挥益生功能必须定殖于肠道中,必须具有耐受胃部强酸环境的能力[30]。由图3可知,菌株XL-02在pH 2.0和pH3.0的环境下培养24 h,存活率分别为3.14%和5.65%,而在pH4.0和pH5.0的环境下培养24 h后存活率分别达到18.31%和20.25%,说明菌株XL-02的耐酸性较好,能够耐受胃部的强酸性环境,可以进入肠道。
2.4 菌株XL-02的耐胆盐性试验结果
菌株XL-02的胆盐耐受性试验结果见图4。
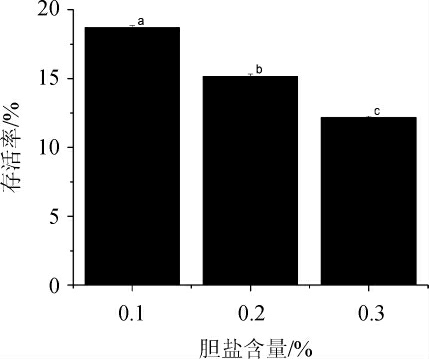
图4 菌株XL-02的胆盐耐受性试验结果
Fig.4 Bile salt tolerance tests results of strain XL-02
由图4可知,当胆盐含量为0.3%时,菌株XL-02培养24 h后,存活率达到12.17%,表明该菌株对胆盐具有较强的耐受性,说明菌株XL-02在人体肠道胆盐含量为0.03%~0.3%的环境中可以存活并增殖[31-32]。
2.5 菌株XL-02降胆固醇培养条件优化单因素试验结果
2.5.1 初始pH值对菌株XL-02去除胆固醇的影响
初始pH值对菌株XL-02去除胆固醇的影响结果见图5。
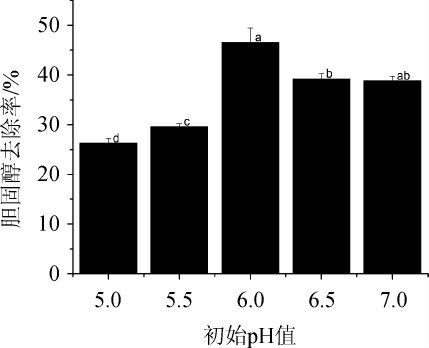
图5 初始pH对菌株XL-02去除胆固醇的影响
Fig.5 Effect of initial pH on cholesterol removal by strain XL-02
有研究表明,初始pH影响培养基成分的解离,也影响菌株细胞膜的带电情况,进而影响菌株对营养成分的吸收,最终影响菌株的生长和代谢情况[33]。由图5可知,当初始pH值<6.0之前,随着初始pH值的升高,菌株XL-02对胆固醇的去除率逐渐增加;当初始pH值为6.0时,胆固醇去除率最高,达到46.53%;当初始pH值继续升高,胆固醇去除率开始下降,原因可能是pH影响到菌株胆盐水解酶的分泌[1]。故确定最适初始pH值为6.0。
2.5.2 接种量对菌株XL-02去除胆固醇的影响
接种量对菌株XL-02去除胆固醇的影响结果见图6。
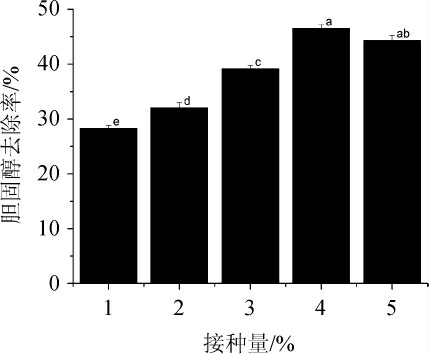
图6 接种量对菌株XL-02去除胆固醇的影响
Fig.6 Effect of inoculum on cholesterol removal by strain XL-02
由图6可知,当接种量<4%之前,随着菌株XL-02接种量的增加,胆固醇的去除率也增加;当接种量为4%时,胆固醇去除率最高,可达46.51%;当接种量进一步增加时,胆固醇去除率反而降低。分析原因可能是接种量的多少,影响微生物进入快速生长期的快慢,但接种量过高时,养分消耗过快,菌种老化速度加快,产生自溶,影响到代谢产物的分泌[34]。故确定最适接种量为4%。
2.5.3 发酵时间对菌株XL-02去除胆固醇的影响
发酵时间对菌株XL-02去除胆固醇的影响结果见图7。
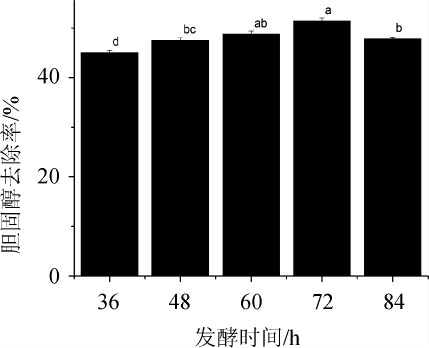
图7 发酵时间对菌株XL-02去除胆固醇的影响
Fig.7 Effect of fermentation time on cholesterol removal by strain XL-02
由图7可知,当发酵时间36~72 h时,随着发酵时间的延长,胆固醇去除率的逐渐增加;当发酵时间为72 h时,胆固醇去除率达到最大,为51.41%;当发酵时间继续延长,胆固醇去除率开始下降。分析原因可能是培养时间不仅影响菌株的生长速率和生长量,且影响菌种代谢产物的多少;菌种在生长初期数量少,随后大量繁殖,胆固醇去除率快速增加;发酵后期,营养成分剩余量较少,菌种代谢营养需求得不到满足,导致部分菌种衰亡[35-36]。故确定最适发酵时间为72 h。
2.5.4 发酵温度对菌株XL-02去除胆固醇的影响
发酵温度对菌株XL-02去除胆固醇的影响见图8。
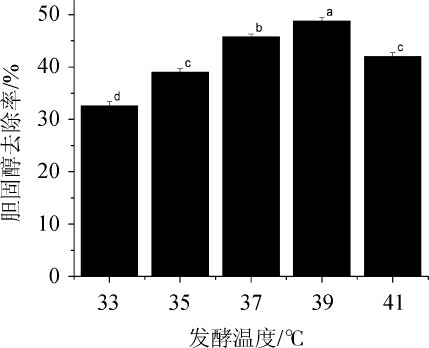
图8 发酵温度对菌株XL-02去除胆固醇的影响
Fig.8 Effect of fermentation temperature on cholesterol removal by strain XL-02
温度影响微生物的生长,温度低菌株生长繁殖慢,代谢产物分泌延迟;温度高则生长启动快,但营养成分消耗快,发酵周期缩短[37]。由图8可知,随着发酵温度的升高,胆固醇去除率呈先升高后下降的趋势,当发酵温度为39 ℃,发酵36 h时,胆固醇去除率最高,达到48.77%。故确定最适发酵温度为39 ℃。
2.6 菌株XL-02去除胆固醇培养条件优化正交试验结果
发酵条件优化正交试验结果与分析见表3,方差分析结果见表4。
表3 发酵条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal test for fermentation conditions optimization
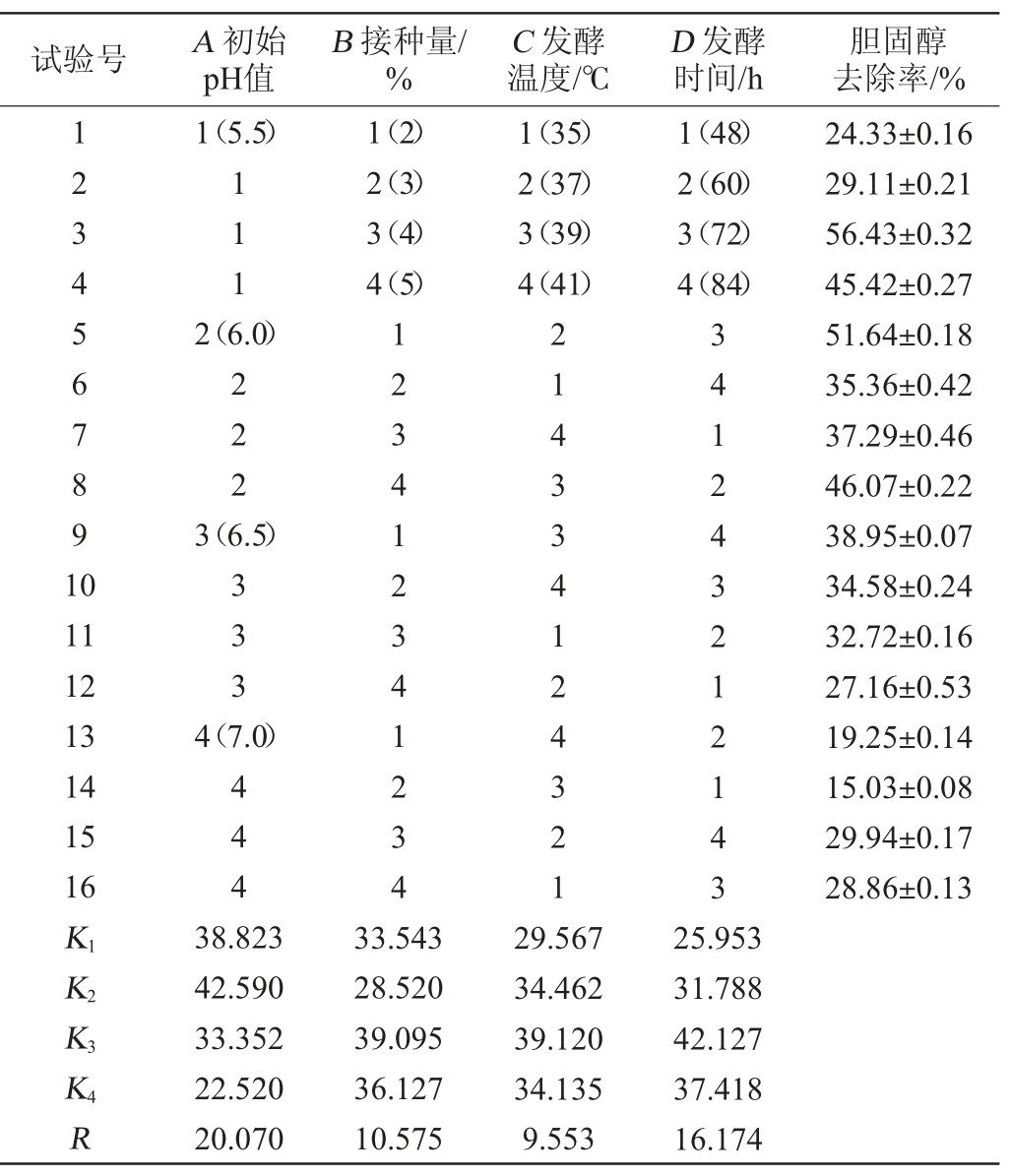
表4 正交试验结果方差分析
Table 4 Analysis of variance of orthogonal tests results
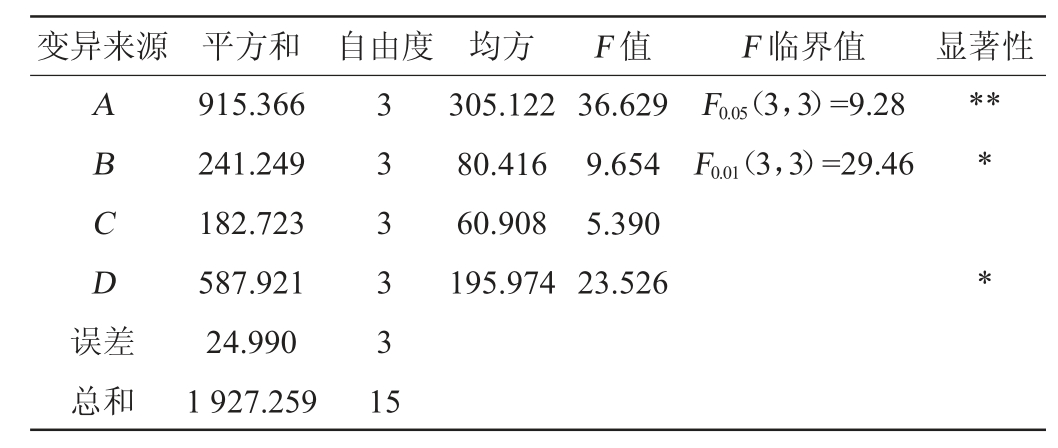
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表3及表4可知,对菌株XL-02去除胆固醇能力影响因素的次序为A>D>B>C,即初始pH值>发酵时间>接种量>发酵温度。其中因素A(初始pH)对结果影响极显著(P<0.01),因素B(接种量)和因素D(发酵时间)对结果影响显著(P<0.05),因素C(发酵温度)对结果影响不显著(P>0.05)。由表3亦可知,菌株XL-02去除胆固醇的最优培养条件组合为A2B3C3D3,即初始pH值6.0,接种量4%,发酵温度39 ℃,发酵时间72 h。在此最优条件下,胆固醇去除率最高达(61.56±0.08)%,高于试验组3的去除率(56.43%)。
3 结论
本研究采用钙溶圈法及MRS-胆固醇培养基从广西来宾酒糟酸菜汁中分离筛选出一株胆固醇去除能力较高的乳酸菌菌株,编号为XL-02,通过形态观察及分子生物学技术鉴定其为植物乳杆菌(Lactobacillus plantarum),具有较好的耐酸能力和胆盐耐受性,在pH2.0的酸性环境下培养24 h,菌株存活率为3.14%;在胆盐含量为0.3%条件下培养24 h,菌株存活率为12.17%。通过单因素和正交试验确定菌株XL-02去除胆固醇的最优发酵条件为:以MRS液体培养基为发酵培养基,初始pH值6.0,接种量4%,发酵温度39 ℃,发酵时间72 h。在此最优条件下,胆固醇去除率最高达(61.56±0.08)%。本研究为丰富益生菌种质资源提供新的候选菌株,为发展地方特色发酵蔬菜的工业化生产提供科学依据。
[1]刘孝芳,雷文平,迟珺曦,等.乳酸菌降胆固醇作用及降解机制研究进展[J].中国酿造,2020,39(6):22-25.
[2]陈霞,熊智强,夏永军,等.益生菌体外降解胆固醇的研究进展[J].工业微生物,2020,50(4):52-58.
[3]WHO.WHO cardiovascular diseases (CVDs) factsheet[R].2013.DOI:10.3390/ijms11041679Sep07,2014.
[4]GOEDEKE L,FERNÁNDEZ-HERNANDO C.Regulation of cholesterol homeostasis[J].Cell Mol Life Sci,2012,69(6):915-930.
[5]林龙镇,邹卫玲,李安章,等.产酸、耐酸乳酸菌的分离鉴定及益生特性[J].华南农业大学学报,2018,39(2):95-102.
[6]马长路,焦梦丽,罗红霞,等.传统东北酸菜中乳杆菌的分离鉴定及其降胆固醇特性研究[J].食品研究与开发,2019,40(21):209-213.
[7]国立东,张文文,刘艳,等.传统发酵东北酸菜中植物乳杆菌HUCM115的分离及益生特性[J].食品科学,2020,41(18):140-145.
[8]任大勇,曲天铭,杨柳,等.东北传统发酵食品中降胆固醇乳酸菌的筛选及其降解机制[J].食品科学,2019,40(22):119-206.
[9]李雅迪,柳陈坚,龚福明,等.具有降胆固醇功能益生菌的筛选及其体外降胆固醇机制初探[J].食品与生物技术学报,2019,38(2):153-159.
[10]云月英,马宇南,王文龙.自然发酵肉制品中乳酸菌的体外降胆固醇特性[J].中国酿造,2018,37(1):125-128.
[11]张娟,李文苑,高利娥,等.青藏高原牦牛酸奶中降胆固醇乳酸菌的筛选及特性研究[J].中国食品工业,2019,10:72-77.
[12]李杰.降胆固醇乳酸菌的筛选及其对高脂模型大鼠的影响[D].太原:山西大学,2020.
[13]丁淑娟.降胆固醇乳酸菌筛选及其在高脂大鼠模型上的应用评价[D].广州:华南理工大学,2019.
[14]杨晓艳.降胆固醇乳酸菌的筛选及其在低脂沙拉酱中的应用[D].邯郸:河北工程大学,2019.
[15]迟乃玉,希伦,刘洋,等.海洋中产胆固醇氧化酶细菌的筛选及其发酵条件优化[J].中国酿造,2019,38(4):36-41.
[16]印伯星,瓦云超,黄玉军,等.不同乳酸菌菌株及混合菌株体外降胆固醇的研究[J].扬州大学学报(农业与生命科学版),2020,41(1):44-49,61.
[17]卢佳音.发酵蔬菜中乳酸菌的分离鉴定及其益生性的研究[D].哈尔滨:东北农业大学,2018.
[18]曲天铭.东北传统发酵食品中降胆固醇乳酸菌的筛选及降解机制的研究[D].长春:吉林农业大学,2019.
[19]郭晶晶,张鹏飞,曹承旭,等.自然发酵豆酱中降胆固醇乳酸菌的筛选鉴定及对大鼠血清胆固醇的影响[J].食品与发酵工业,2019,45(2):15-24.
[20]贺珊珊,鲍志宁,林伟锋,等.降胆固醇和耐酸耐胆盐益生菌的筛选研究[J].现代食品科技,2019,35(8):198-206,219.
[21]施渺筱,洪蕴,汤鑫鑫,等.自然发酵泡菜中乳酸菌的分离鉴定及其在金刺梨汁发酵中的应用[J].中国酿造,2022,41(1):109-115.
[22]姜美娜.朝鲜族传统发酵食品中耐酸乳酸菌的分离筛选及益生特性研究[D].延吉:延边大学,2020.
[23]朱奇奇,蒲博,王周,等.一株降胆固醇乳酸菌的筛选、鉴定及在发酵泡菜中的应用[J].中国调味品,2016,41(5):16-22,29.
[24]范颖,陈思涵,党芳芳,等.一株降胆固醇乳酸菌的筛选及其在模拟消化环境活性的研究[J].中国乳品工业,2018,46(9):4-7.
[25]陈珂可,朱建国,姜甜,等.具有降解胆固醇能力的益生菌菌株筛选[J].食品科技,2018,43(11):7-11.
[26]万婧倞,罗曼,吴鹏,等.具降胆固醇功能的海洋源乳酸菌的筛选及发酵条件工艺优化[J].应用海洋学学报,2021,40(2):220-230.
[27]付永岩,赵悦含,王毅超,等.降胆固醇乳酸菌的益生特性及其作用机理[J].中国乳品工业,2019,47(7):23-27.
[28]KUMAR S,STECHERE G,TAMURA K.MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Mol Biol Evol,2016,33(7):1870-1874.
[29]杨天予,刘一倩,马挺军.富含γ-氨基丁酸藜麦发酵饮料工艺优化[J].食品工业科技,2019,40(16):169-175,180.
[30]VÁZQUEZ J.Human physiology[J].Am Biol Teach,2006,68(3):169-169.
[31]KULLAK-UBLICK G A,STIEGER B,MEIER P J.Enterohepaticbile salt transporters in normal physiology and liver disease[J].Gastroenterology,2004,126(1):322-342.
[32]TSAI C C,LIN P P,HSIEH Y M,et al.Cholesterol-lowering potentials of lactic acid bacteria based on bile-salt hydrolase activity and effect of potent strains on cholesterol metabolism in vitro and in vivo[J].Sci World J,2014,2014(5):690752.
[33]李达,苗欣宇,孙慕白,等.满意度函数-响应面法优化枯草芽孢杆菌发酵工艺[J].中国酿造,2021,40(2):40-46.
[34]伍玉春,陈显玲,苏龙.产柚苷酶黑曲霉SL2K发酵条件优化[J].中国酿造,2018,37(6):125-130.
[35]丁钦然,陈亚楠,张娇娇,等.紫甘蓝-葡萄汁复合乳饮品发酵工艺优化及其抗氧化性研究[J].中国酿造,2020,39(1):203-208.
[36]郑苗,何佳,吕丹丹,等.复合乳酸菌发酵怀山药工艺及其抗氧化活性[J].中国酿造,2018,37(2):106-110.
[37]李敏杰,熊亚.柚子酒发酵条件优化[J].中国酿造,2019,38(4):198-202.