剁辣椒是湖南省最常见的特色腌制食品,因其简便易制、口感鲜辣以及丰富的营养价值深受大家青睐[1]。据统计,湖南有超100家辣椒加工企业年销售额达40亿元。剁辣椒加工工艺较为简单,多以家庭制作和小规模的工业化生产为主。在辣椒基本成熟后,将其清洗干净,去蒂晾干,切碎后加入高盐和酒或姜蒜等香辛料拌匀,放入陶瓷容器中密封腌制,待其自然发酵而成[2-3]。剁辣椒在发酵过程中,起主导作用的乳酸菌、酵母菌等各种有益微生物经发酵和生理生化反应产生的呈味物质,赋予了剁辣椒酯香浓郁、滋味鲜美的独特风味[4-5]。
酵母菌是一种典型的兼性厌氧微生物,在有氧和无氧条件下都能存活[6],尤其适应于含糖量较高的偏酸性环境。目前对发酵蔬菜中微生物的探究主要集中于两大优势菌种:乳酸菌和酵母菌。其中酵母菌作为功能菌种的应用研究较少。有研究指出,蔬菜发酵中的酵母菌主要有异常汉逊酵母(Hansenula anomala)、亚膜汉逊酵母(Hansenula subpolliculosa)、罗斯酵母(Ascomycetes)、易变球拟酵母(Torulopsis versatilis)等[7]。目前对发酵蔬菜中酵母菌的研究较多集中在泡菜类产品。张鹏[8]从四川泡菜中分离出13株酵母菌,通过筛选得到两株发酵性能良好且符合四川泡菜发酵要求的酵母菌,经鉴定为粗状假丝酵母(Candida valida)、近平滑假丝酵母(Candida parapsilosis)。刘春燕[9]利用传统的分离培养方法对四川泡萝卜发酵过程中的酵母菌进行分离鉴定,共得到清酒假丝酵母(Candida sake)、胶红酵母(Rhodotorulamucilaginosa)、毕赤酵母(Pichi agaleiformis)、酒酵母(Kazachstania exigua)四种酵母菌,且在自然发酵泡菜过程中,酵母菌的数量最终稳定在104~105 CFU/mL左右。
目前研究结果表明,发酵剁辣椒中主要的香气物质是酯类和醛类,且酯类物质的相对含量在发酵后期表现出增长趋势,说明可能是由有机酸与醇类生化反应生成[10-11]。本课题组在前期对传统剁辣椒发酵过程中菌群的研究时发现,酵母菌能以较高的数量(约105 CFU/g)与乳酸菌一同生长,说明酵母菌在剁辣椒发酵过程中同样起着重要的作用,其代谢产物对剁辣椒的风味具有重要的影响。
本研究以自然发酵剁辣椒中分离出的酵母菌为研究对象,通过比较产醇、产酯、耐盐、耐酸等发酵特性及耐受性指标筛选出优良酵母菌菌株。进而利用分子生物学方法并结合菌株形态特征、细胞结构对分离筛选出的优良酵母菌株进行种属鉴定,以期能够应用于剁辣椒接种强化发酵,提高产品风味及品质。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
剁辣椒样品:本实验室采用自然发酵自制,并保存于-80 ℃冰箱。
1.1.2 化学试剂
乙醇、重铬酸钾溶液、酚酞、氯化钠、氢氧化钠、盐酸(均为分析纯)、马铃薯浸粉、琼脂(均为生化试剂)、葡萄糖、氯霉素(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖嘌呤硫酸盐(yeast peptone dextrose adenine sulfate,YPDA)培养基:蛋白胨20 g/L,酵母膏10 g/L,蒸馏水定容至900 mL,调pH值至5.8,121 ℃灭菌20 min,冷却至55 ℃时加入100 mL 20%葡萄糖溶液(过滤除菌),0.003%腺嘌呤硫酸盐。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:将马铃薯去皮切块300 g,加1 000 mL蒸馏水,煮沸10~20 min。用纱布过滤,补加蒸馏水至1 000 mL。加入葡萄糖和琼脂各20 g/L,加热溶化,分装,121 ℃高压灭菌20 min。
1.2 仪器与设备
WPX精密恒温培养箱:上海科恒实业发展有限公司;SW-CJ-1FD超净工作台:苏州净化设备有限公司;FI-01620全波长酶标仪:赛默飞世尔科技有限公司;LMQJ压力蒸汽灭菌锅:山东新华医疗器械股份有限公司。
1.3 方法
1.3.1 菌种纯化与保存
将于-80 ℃冰箱冻藏的菌株解冻后,无菌操作下将其转移至YPDA液体培养基中,于28 ℃条件下连续传代两次。采用平板划线法分离菌株,得到的单菌落接种于PDA斜面固体培养基中,置于28 ℃培养,待其长出明显菌落后,放置于4 ℃冰箱中低温保藏。
1.3.2 酵母菌的初筛
(1)产香能力试验:通过划线法分离酵母菌,28 ℃培养3 d后进行感官评定试验。采用嗅闻法,对酵母菌产香能力进行测定[12-13]。
(2)产醇试验:参照李岭卓等[14]的方法测定酵母菌的产醇能力。
表1 筛选酵母菌株感官评定标准
Table 1 Sensory assessment standards of screened yeast strains

注:“+”越多表示香气越强。下同。
(3)产酯试验:参照国标GB/T 10345—2007《白酒分析方法》[15]测定酵母菌的产酯能力。发酵液中总酯含量(以乙酸乙酯计)的计算公式如下:
式中:X为总酯含量,g/L;C为氧氧化钠标准溶液的摩尔浓度,mol/L;V 为加入0.1 mol/L氧氧化钠标准溶液的体积,mL;C1为盐酸标准溶液的摩尔浓度,mol/L;V1为滴定时消耗盐酸标准溶液的体积,mL;5.0为取样体积,mL;0.088为乙酸乙酯的摩尔质量,g/mol。
(4)耐盐酵母菌初筛:无菌操作下挑取冰箱斜面保存的酵母菌株活化24 h,之后按1%的接种量将活化后的菌悬液接种到100 mL YPDA液体培养基中,其中含NaCl质量分数为6%,28 ℃条件下培养24 h后,参照国标GB 4789.35—2016《食品微生物学检验乳酸菌检验》测定其活菌数[16]。
1.3.3 酵母菌的复筛
(1)耐酸性试验:用1 mol/L的乳酸溶液[17]分别配制pH为3.0、3.5、4.0、4.5、5.0的YPDA 液体培养基。将活化24 h后具有一定活力的酵母菌悬液,按1%的接种量转移至上述溶液中,28 ℃培养24 h后,测定其OD600nm值。
(2)耐盐度试验[18]:将活化后的酵母菌液分别接种到8%、10%、12%、14%4个不同NaCl浓度的YPDA液体培养基中,28 ℃培养24 h,接种量均为1%,以不含NaCl的培养基作为对照。参照国标GB 4789.35—2016《食品微生物学检验乳酸菌检验》对菌悬液进行活菌计数。
(3)菌株生长曲线的测定:将于4 ℃冰箱保存的斜面菌株活化,28 ℃条件下培养24 h后接种至YPDA培养基中继续培养,接种量为1%,之后每隔4 h取一次样,于波长600 nm处测定各菌株细胞浓度的OD600nm值,绘制各菌株的生长曲线。
1.3.4 优良酵母菌的鉴定
(1)酵母菌的形态学观察:将筛选获得的较优良菌株纯化后划线于PDA平板上,28 ℃条件下培养3 d,观察菌落形态。挑取少量平板上的单菌落均匀涂布在载玻片上,采用结晶紫染色液染色后进行镜检。
(2)26S rDNA 序列的扩增测序及比对:离心收集纯化好的菌体,提交给湖南光凌锋生物科技有限公司进行基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取,然后经聚合酶链式反应(polymerase chain reaction,PCR)扩增后测序,将得到的26S rDNA序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank基因库中进行序列比对,并用MEGA4.0构建系统发育树进行菌株同源性分析。
1.3.5 数据统计分析
实验结果采用Excel 2016和Origin 9.0软件进行分析,显著性分析采用最小显著差异(least significant difference,LSD)法。
2 结果与分析
2.1 酵母菌的初筛结果
酵母菌在发酵过程中能够产生大量的醇类、酯类等风味物质,通过嗅闻法可以筛选出香气浓郁的酵母菌株。从表2可以看出,所有酵母菌都能产生特殊的香气,但香气程度有所差异。其中能产生较明显的酯香、醇香或其他香气的酵母菌株为D-17和H-37,且酯香香气浓郁。而菌株Y-3、H-23、H-33香气强度稍弱,持续性一般。通过感官评定进行初步判断后,再结合理化试验测定菌株发酵产物的具体含量,进而筛选出较优良酵母菌株。
表2 筛选菌株产香、产酯、产醇以及6% NaCl耐受性的测定
Table 2 Determination of aroma,ester,alcohol production and 6% NaCl tolerance of screened strains
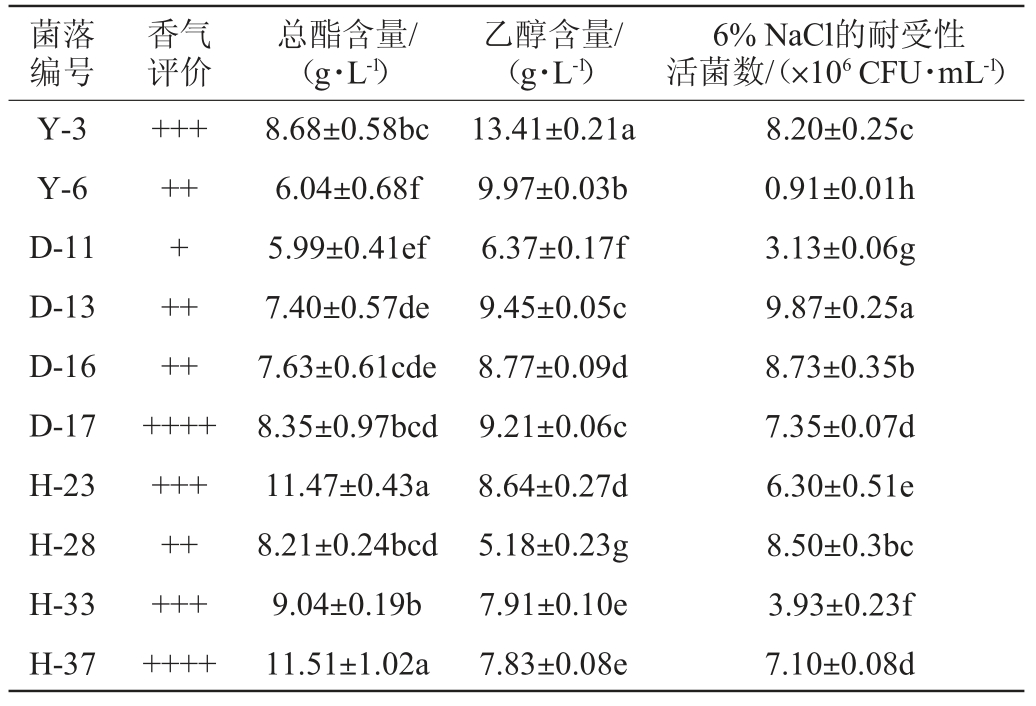
注:同列不同字母表示差异显著(P<0.05)。
产酯酵母多用于酒类发酵,有增酯、提香的作用[19-20]。常见的产酯酵母有汉逊酵母、球拟酵母、假丝酵母属、毕赤氏酵母属等[21],在适宜的条件下可生成乙酸酯类,特别是乙酸乙酯。由表2可知,在相同培养条件下,酵母菌株H-23、H-37的产酯效果表现较好,其产酯量分别为11.47 g/L、11.51 g/L,与其余菌株产酯量有显著差异(P<0.05);其余菌株发酵液中总酯含量为5.99~9.04 g/L。
本试验利用K2Cr2O7比色法测定发酵液中乙醇含量,取相同培养条件下的酵母菌株各发酵液10 mL稀释2倍。考虑到在发酵液中,除乙醇外还含有其他还原性物质干扰该方法测定的准确性,为了排除干扰,采用煮沸的方式除去发酵液中的乙醇,加水平衡后,将原发酵液和除去乙醇的发酵液都与重铬酸钾反应,分别测定其吸光度值,两者之差表示乙醇的实际含量,乙醇含量的标准曲线回归方程为:y=7.511 9x-0.346 0(相关系数R2=0.998 9)。
酵母菌在发酵过程中会产生酒香味,主要是乙醇等醇类化合物,对发酵蔬菜的风味有着重要的作用,且在发酵后期,乙醇与有机酸发生酯化反应形成的酯类物质,是发酵蔬菜香气成分的来源之一[22]。由表2可知,在相同培养条件下,菌株Y-3的产醇能力显著高于其他菌株(P<0.05),乙醇产量为13.41 g/L,约是菌株28乙醇产量的3倍;其次是菌株Y-6,乙醇产量为10 g/L;而菌株D-13与D-17之间乙醇产量无显著性差异(P>0.05),产醇含量均接近9.5 g/L。
发酵蔬菜在腌制过程中,有害微生物的生长繁殖会降低腌菜的品质与口感,为了保证良好的发酵环境,通常会加入一定浓度的食盐,一般NaCl含量在5%~10%之间,对于高盐腌制的蔬菜甚至会更高[23]。同时高浓度的含盐量也会抑制有益微生物的生长,因此在接种发酵时,需要菌种具有一定的盐耐受性。为了更好的适应发酵环境,先对菌株进行低浓度耐盐性测试。由表2可知,在6%NaCl浓度下培养24 h,菌株D-13的耐受性较好,菌体数量>9×106CFU/mL,显著高于其他菌株(P<0.05);菌株D-16、Y-3、H-28活菌数也都达到了8×106 CFU/mL,菌株D-17、H-37活菌数分别为(7.35±0.07)×106 CFU/mL、(7.1±0.08)×106 CFU/mL。
筛选菌株发酵特性及耐受性热图分析结果见图1。由图1可知,菌株Y-3、D-17、H-23、H-37相关信息在产香方面相对比较丰富,菌株Y-3、H-23、H-33、H-37相关信息在产酯方面相对比较丰富,菌株Y-3、Y-6、D-13、D-17相关信息在产醇方面相对比较丰富,菌株H-28、D-16、D-13、Y-3相关信息在6%NaCl耐受性方面相对比较丰富。结果表明,酵母菌株的表现功能在不同菌株中的丰度有所不同。在感官评定中产香表现较优良的菌株有Y-3、D-17、H-23、H-37,能产生较为明显的酯香或醇香等香气成分。在发酵特性试验中,菌株Y-3、H-23、H-33、H-37表现出了较好的产酯能力,其产酯量都在10 g/L以上;乙醇含量的测定中,菌株Y-3产乙醇量超过了13 g/L,约为菌株Y-6的1.4倍。在6%NaCl耐受试验中,菌株Y-3、D-13、D-16、H-28的活菌数含量较高,都超过了8×106 CFU/mL。
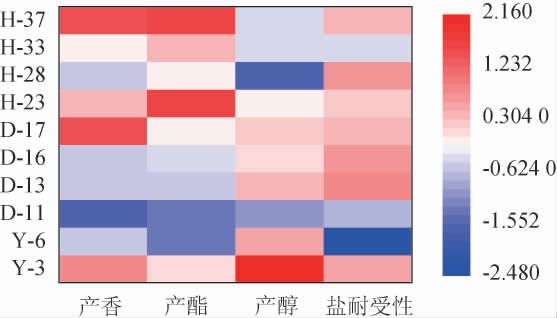
图1 筛选菌株发酵特性及耐受性热图分析
Fig.1 Heatmap analysis of fermentation characteristics and tolerance of screened strains
综上,在发酵特性和耐盐方面综合表现较优良的菌株为Y-3、D-17、H-23、H-37。因此,对这4株菌进行进一步复筛试验。
2.2 酵母菌复筛结果
2.2.1 耐乳酸性能
乳酸是发酵蔬菜中的主要有机酸,在发酵初期由于大量有机酸的生成其pH不断下降,对发酵菌株的生长有较大的影响[24-25],但是较低的pH值可以抑制杂菌的生长,因此菌种具有良好的耐酸性能对于发酵工艺来讲有较大的意义。本实验将菌株Y-3、D-17、H-23、H-37悬液接种于pH值分别为3.0、3.5、4.0、4.5、5.0的YPDA液体培养基中28 ℃培养24 h 后,测定其活菌数,结果见图2。
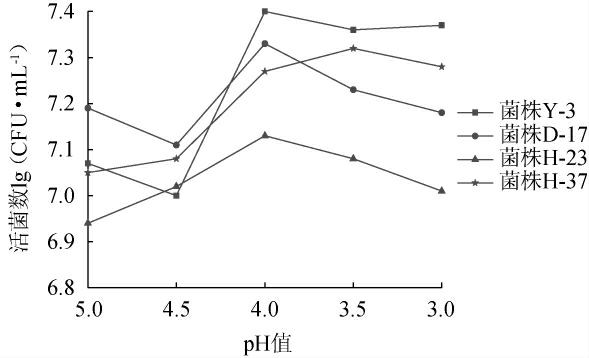
图2 不同pH值对筛选菌株的影响
Fig.2 Effects of different pH value on screened strains
由图2可知,筛选菌株在偏酸性环境中的生长较好,菌株Y-3在pH为4时,其生长能力增长较快,在pH继续下降时,其活菌数没有出现明显下降趋势;菌株D-17、H-23的最适pH为4,之后随着pH下降,其生长能力减弱;而菌株H-37的最适pH为3.5,pH继续下降时,其活菌数开始下降。结果表明,当pH逐渐降低时,菌株Y-3的生长能力整体表现较好。
2.2.2 耐盐性能
由图3可知,当NaCl含量为8%,4株菌的生长能力出现明显下降,当NaCl含量增大到12%时,菌株H-23、H-37的活菌数继续呈下降趋势,而菌株Y-3、D-17基本保持稳定;当NaCl含量增大到14%时,菌株D-17的活菌数开始出现下降趋势,而菌株Y-3、H-23、H-37的活菌数开始出现回升的情况,可能是因为菌株产生了一定的耐受性。结果表明,在8%~14%的NaCl含量下,菌株Y-3的生长能力保持了相对比较稳定的趋势,而且活菌数相对表现较好。
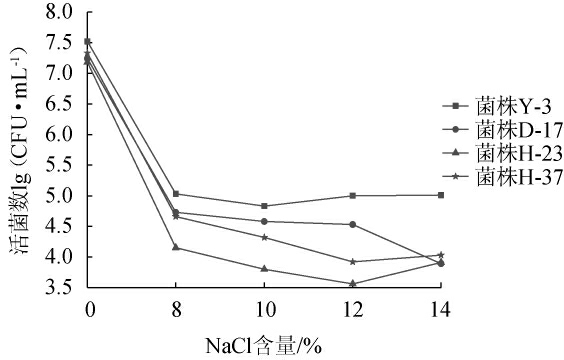
图3 不同NaCl含量对筛选菌株的影响
Fig.3 Effects of different NaCl concentrations on screened strains
2.2.3 生长曲线的测定
4株酵母菌株的生长曲线见图4。由图4可知,4株菌在YPDA液体培养基中的生长情况没有经历延滞期,接种后直接进入了对数生长期,说明以上菌株的生长力都比较旺盛。其中菌株H-37在12 h即进入了稳定期,另外三株菌生长趋势相似,都在24 h左右进入发酵稳定期;在0~12 h,菌株Y-3的发酵速率最快。
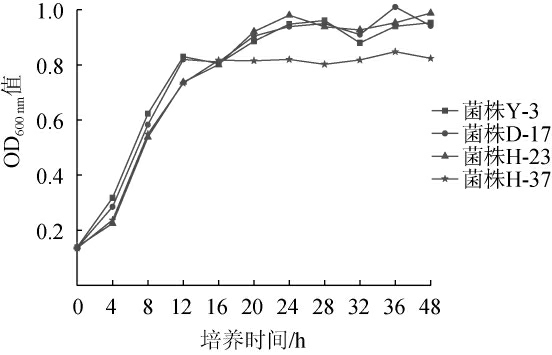
图4 筛选菌株的生长曲线
Fig.4 Growth curves of screened strains
通过初筛和复筛试验结果并经分析后得出:菌株Y-3生长能力较强,且在耐盐耐乳酸方面表现优良,更能适应蔬菜的发酵环境,而且菌株本身在产醇、产香等发酵性能上综合表现突出,因此,对菌株Y-3进行形态学观察及26S rDNA分子生物学鉴定。
2.3 菌株Y-3的鉴定
2.3.1 菌株Y-3的形态学观察
菌株Y-3的菌落及细胞形态结果见图5。由图5a可知,菌落呈圆形,乳白色,中间凸起,菌落质地均匀,表面光滑、湿润、粘稠,易挑起,且边缘规整,有明显的醇香气味。由图5b可知,在光学显微镜下,菌体细胞为椭圆形,生殖方式为芽殖,无菌丝。
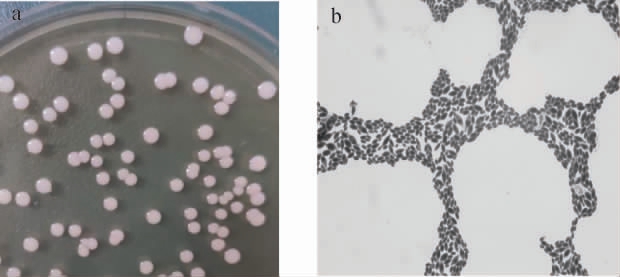
图5 菌株Y-3的菌落(a)和细胞(b)形态
Fig.5 Colony (a) and cell (b) morphology of strain Y-3
2.3.2 菌株Y-3的分子生物学鉴定结果
将菌株Y-3的26S rDNA序列在NCBI-GenBank数据库中与已知酵母菌的对应序列进行分析对比,找出与其相似性最高的已知菌种,结果见图6。由图6可知,菌株Y-3与Hanseniaspora pseudoguilliermondii[26]的同源性达到98%以上,菌株Y-3被鉴定为Hanseniaspora pseudoguilliermondii。

图6 基于26S rDNA序列分析菌株Y-3的系统发育树
Fig.6 Phylogenetic tree of strain Y-3 based on 26S rDNA sequence analysis
3 结论
通过不断对发酵食品中微生物的研究探索,人们逐渐认识到酵母菌在食品中的重要作用。本试验经过对前期实验室从自然发酵剁辣椒中分离的10株酵母菌进行感官及理化测定的筛选,评价比较了酵母菌在产香、产酯、产醇以及耐盐耐酸等特性,最终获得一株具有良好生长能力及发酵性能的酵母菌株Y-3,经鉴定为Hanseniaspora pseudoguilliermondii,该种酵母属于典型的生香酵母。有研究表示生香酵母是酒类发酵产香的主要菌种,近年来也逐渐应用于泡菜、酱油等发酵食品以此提高产品的香气风味。因此认为该菌株作为发酵菌剂可能会带来良好的发酵效果,对于发酵蔬菜产品的开发具有进一步研究意义。
[1]张毅,杨成聪,佘雅倩,等.市售剁辣椒风味品质的评价[J].食品研究与开发,2018,39(23):129-133.
[2]甘曾鹏,蒋立文,吴章华,等.剁辣椒加工的研究进展[J].食品安全质量检测学报,2019,10(13):4278-4283.
[3]白露露,胡文忠,姜爱丽,等.辣椒加工工艺及其设备的应用现状[J].食品工业科技,2014,35(15):369-376.
[4]REBOUCAS T N H,VALVERD R M V,TEIXEIRA H L.Bromatology of fresh and processed chili pepper[J].Horticultura Brasileira,2013,31(1):163-165.
[5]WANG J,WANG R,XIAO Q,et al.Analysis of bacterial diversity during fermentation of Chinese traditional fermented chopped pepper[J].Lett Appl Microbiol,2019,69(5):346-352.
[6]TORRES S,VERÓN H,CONTRERAS L,et al.An overview of plant-autochthonous microorganisms and fermented vegetable foods[J].Food Sci Human Wellness,2020,9(2):112-123.
[7]鄯晋晓.四川泡菜菌系分离、筛选及发酵剂的研究[D].重庆:西南大学,2008.
[8]张鹏.四川泡菜中酵母菌的分离筛选及其应用研究[D].哈尔滨:东北农业大学,2007.
[9]刘春燕.传统四川泡萝卜发酵过程中酵母菌分离鉴定及其对泡菜风味的影响[D].成都:四川农业大学,2015.
[10]WANG J J,WANG R R,XIAO Q,et al.SPME/GC-MS characterization of volatile compounds of Chinese traditional-chopped pepper during fermentation[J].Int J Food Propert,2019,22(1):1863-1872.
[11]欧阳晶,陶湘林,李梓铭,等.高盐辣椒发酵过程中主要成分及风味的变化[J].食品科学,2014,35(4):174-178.
[12]龚加路,吴华昌,邓静,等.泡菜生香酵母的分离鉴定与挥发性香气成分分析[J].生物技术,2015,25(1):75-78.
[13]张俊杰,尚益民,彭姗姗,等.产香酵母的筛选及其苹果酒发酵特性[J].中国酿造,2019,38(8):31-35.
[14]李岭卓,李锐,熊小毛,等.发酵液中乙醇含量的测定方法[J].酿酒科技,2018(4):126-128,133.
[15]国家标准化管理委员会,国家质量监督检验检疫总局.GBT10345—2007白酒分析方法[S].北京:中国标准出版社,2007.
[16]国家食品药品监督管理总局,国家卫生和计划生育委员会.GB 4789.2—2016食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2016.
[17]李默,曹凯欣,任广钰,等.自然发酵锦州小菜中优良酵母菌的筛选及鉴定[J].中国食品学报,2021,21(4):277-285.
[18]张彪燕,吕嘉枥,郑欣欣.发酵蔬菜中酵母菌的特性及其发酵果渣性能初探[J].中国调味品,2015,40(1):9-13.
[19]KAPSOPOULOU K,KAPAKLIS A,SPYROPOULOS H.Growth and fermentation characteristics of astrain of the wine yeast Kluyveromyces thermotolerans isolated in Greece[J].World J Microbiol Biotechn,2005,21(8/9):1599-1602.
[20]蒲春,胡沂淮,贾亚伟,等.产酯酵母的筛选及其发酵特性研究[J].酿酒科技,2013(3):47-49,53.
[21]陆振群.产酯类酵母菌的选育[D].芜湖:安徽工程大学,2012.
[22]王刚,邢家溧,印伯星,等.泡菜、豆酱中产香酵母菌的筛选及其在面包制作中的应用[J].食品科学,2014,35(23):155-160.
[23]GU Q H,LIU S X,LI C F.Isolation and identification of aroma-producing yeast for Papaya wine[J].Food Sci,2013,34(21):193-197.
[24]WU R N,YU M L,LIU X Y,et al.Changes in flavour and microbial diversity during natural fermentation of suan-cai,a traditional food made in Northeast China[J].Int J Food Microbiol,2015,211:23-31.
[25]屠梦婷.发酵黄瓜中酵母的分离鉴定及其对发酵黄瓜风味的影响[D].杭州:浙江农林大学,2019.
[26]高健,许爱清,唐新科.一株莴苣内生产香酵母菌的分离、鉴定及挥发性香气成分分析[J].食品科学,2011,32(23):162-166.