白酒是中国特有的蒸馏酒,是我国悠久历史、传统民族工艺传承的载体,在世界蒸馏酒中独树一帜[1]。乳酸是白酒中重要的呈香呈味物质,其自身的微酸、微甜、微涩等口味特点,可有效减少白酒的刺激感,增加酒体的醇厚感,还能与多种成分形成胶体,促进酒体的稳定,直接影响白酒的品质[2]。此外,乳酸还可以与乙醇酯化生成白酒中的重要香味物质乳酸乙酯,其香味弱,味微甜,可以增加酒体的醇甜感和醇厚度,同时因其不挥发性,能延长酒体的后味[3]。
传统固态法白酒酿造过程中,乳酸是由发酵中后期大量繁殖的乳酸菌代谢产生[4-5]。但是,这种半开放的生产方式受环境和季节影响较大,导致发酵过程中微生物群落结构存在差异,冬季较低的地温和气温常使基酒中乳酸含量较低且不稳定;另一方面,在酿酒的蒸馏过程中,乳酸是不挥发性酸,只有极少部分通过夹雾拖带能随乙醇一同进入酒体中,大部分乳酸因其不挥发、沸点较高的物理性质,仍留在酒醅中[6]。因此,在酿酒过程中常出现基酒中酸、酯不够的现象,严重影响基酒的质量。目前,乳酸来源主要有三种:发酵法[7]、化学合成法[8]和酶法[9],其中发酵法由于生产成本低、安全性高等优点,是乳酸生产的主要方法,因此,从酒醅中筛选出高效产乳酸的乳酸菌,并将其用于酿酒发酵过程具有重要的意义。赵东等[10-12]从五粮液酒厂窖池发酵酒醅、汾酒酒醅中分离到多株产乳酸乳酸菌。
将纯度较高的乳酸直接用于酒体结构的调制,可增加白酒的风味和品质。因此,提取纯度较高的乳酸具有重要的意义。利用吸附和离子交换法从发酵液中提纯乳酸,具有操作简单便捷、无污染、安全性高等优势[13]。李坤朋等[14-15]利用活性炭和离子交换柱成功从发酵液中提纯乳酸,乳酸收率可达60%以上。
本研究以分离自清香型白酒酒醅的10株乳酸菌为研究对象,采用溶钙圈法和液体发酵法从中筛选高产乳酸菌株,并对其产乳酸条件进行考察;然后通过活性炭和离子交换柱对乳酸进行分离纯化,并通过高效液相色谱(high performance liquid chromatography,HPLC)法检测乳酸纯度,以期为其应用于白酒酿造及酒体调制,以改善成品酒品质提供思路和依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
布氏乳杆菌(Lactobacillus buchneri)SL45、短乳杆菌(Lactobacillus brevis)SL61、SL21、MC46和MC46-2、植物乳杆菌(Lactobacillus plantarum)Y37、Y15、Y36和SL32-2、戊糖乳杆菌(Lactobacillus pentosus)LB27:分离自清香型白酒酒醅,保藏于本实验室;高粱:山西某酒厂。
1.1.2 化学试剂
蛋白胨、酵母膏、牛肉膏(均为生化试剂):北京奥博星生物技术有限责任公司;对羟基联苯(纯度99%):阿拉丁试剂(上海)有限公司;活性炭粉末、考马斯亮蓝G-250、α-淀粉酶(40 000 U/g)、糖化酶(100 000 U/mL):合肥博美生物科技有限责任公司;柠檬酸氢二胺、无水乙酸钠、Ca(OH)2、K2HPO4、MnSO4、CuSO4、CaCO3、MgSO4(均为分析纯):天津市科密欧化学试剂有限公司;磷酸(色谱纯):东京化成工业株式会社;甲醇(色谱纯):默克股份两合公司;乳酸标准品(纯度99.9%):美国SIGMA公司。
1.1.3 培养基
MRS固(液)体培养基:北京奥博星生物技术有限责任公司。
改良MRS固体培养基[16]:MRS固体培养基中添加1%碳酸钙,121 ℃高压蒸汽灭菌15 min。
高粱糖化液[12]:取高粱粉15 g,加蒸馏水70 mL,蒸煮1 h,加入1.2 g α-淀粉酶40 ℃液化1 h,液化后补加15 mL 60 ℃温水,同时加入200 μL糖化酶,搅拌均匀,在60 ℃恒温水浴锅中糖化4 h,稀碘液试纸不变蓝色,再加热至90 ℃,用三层白纱布过滤,测量溶液的糖度为7°Bx,121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
SW-CJ-2D型双人单面净化工作台:苏州净化设备有限公司;HH-6数显恒温水浴锅:常州荣华仪器制造有限公司;PHS-3C型pH计:上海雷磁仪器厂;V-1800PC型可见分光光度计:上海美谱达仪器有限公司;GI80DS立式压力蒸汽灭菌锅:致微(厦门)仪器有限公司;ZXMP-R1230恒温培养箱:上海智城分析仪器制造有限公司;D-37520离心机:赛默飞世尔科技(中国)有限公司;Waters Acquity UPLC H Class型高效液相色谱仪(配自动进样器、紫外检测器):美国Waters公司;BSA124S分析天平(感量0.000 1 g):瑞士METTLER TOLEDO公司;001×7阳离子交换柱:北京索莱宝科技有限公司;201×7阴离子交换柱:天津市科密欧化学试剂有限公司。
1.3 试验方法
1.3.1 高产乳酸乳酸菌的筛选
初筛:将10株乳酸菌斜面菌种转接到MRS固体培养基中连续活化培养2代,将其划线接种于含有改良MRS固体培养基,37 ℃静置培养48 h,测量单菌落直径(d)和其周围透明圈的直径(D),计算两者比值(D/d)。通过比较D/d的大小,对高产乳酸能力的菌株进行初步判定筛选[17]。
复筛:将活化后的10株乳酸菌接种于MRS液体培养基中,37 ℃条件下培养24 h后,将发酵液分别稀释到OD600nm值为0.6作为种子液。按照2%(V/V)的接种量将种子液接种于MRS液体培养基中,37 ℃恒温静置培养24 h,3 000 r/min离心10 min,弃沉淀,收集发酵上清液。测定发酵上清液中的乳酸含量,进一步对高产乳酸能力的菌株进行筛选。
1.3.2 植物乳杆菌SL32-2发酵高粱糖化液产乳酸条件研究
初始pH值:将种子液按2%(V/V)的接种量接种于初始pH值分别为4.0、5.0、6.0、7.0、8.0、9.0的高粱糖化液中,37 ℃静置培养24 h,测定发酵液中的乳酸含量,考察不同初始pH值对L.plantarum SL32-2产乳酸能力的影响。
发酵温度:将种子液按2%(V/V)的接种量接种于高粱糖化液中,分别在25 ℃、30 ℃、35 ℃、40 ℃、45 ℃条件下恒温静置培养24 h,测定发酵液中的乳酸含量,考察不同发酵温度对L.plantarum SL32-2产乳酸能力的影响。
1.3.3 乳酸的分离纯化
(1)发酵液预处理
将植物乳杆菌SL32-2种子液按2%(V/V)的接种量接种于MRS液体培养基中,37 ℃恒温静置培养24 h,3 000 r/min离心10 min,收集发酵上清液,参考李坤朋[14]的方法对发酵上清液进行预处理,采用HPLC法测定乳酸纯度。
(2)活性炭纯化乳酸条件优化
采用60 ℃去离子水处理活性炭粉末20 min,去除上层漂浮杂质,再用去离子水清洗2~3次,备用。将预处理后的活性炭按2 g/100 L的添加量添加到预处理的发酵上清液中,在80 ℃条件下作用2 h后,趁热过滤除去活性炭,从预处理后的发酵上清液中提纯乳酸,获得粗乳酸溶液,测定脱色率、脱蛋白率、脱糖率以及乳酸损失率。在此基础上,依次考察活性炭添加量(0.5 g/100 mL、1.0 g/100 mL、1.5 g/100 mL、2.0 g/100 mL、2.5 g/100 mL、3.0 g/100 mL)、处理温度(40 ℃、50 ℃、60 ℃、70 ℃、80 ℃和90 ℃)和处理时间(0.5 h、1 h、2 h、3 h和4 h)对脱色率、脱蛋白率、脱糖率以及乳酸损失率的影响,优化活性炭纯化条件。
(3)离子交换法纯化乳酸
参考李坤朋[14]的方法对树脂进行预处理,将活性炭处理后的粗乳酸溶液依次经过001×7阳离子交换柱和201×7阴离子交换柱进行纯化,流速均控制在3 mL/min,收集流出液。用80 ℃去离子水洗脱201×7阴离子交换柱,收集洗脱液。采用高效液相色谱分析流出液和洗脱液中乳酸的含量,并分析其纯度。
1.3.4 分析及检测方法
乳酸含量的测定:采用对羟基联苯比色法[18]及高效液相色谱法[19];乳酸纯度的测定:采用高效液相色谱法[19];还原糖含量的测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法[20];色素含量的测定:采用分光光度法[14];蛋白含量的测定:采用考马斯亮蓝G-250法[21];脱糖率、脱色率和脱蛋白率的计算:参考李坤朋[14]的方法;乳酸损失率计算公式如下:

1.3.5 数据处理
试验测得的所有数据均利用Microsoft Excel 2016进行处理,数据的显著性及相关性用SPSS 20.0软件处理分析。
2 结果与分析
2.1 高产乳酸乳酸菌的筛选
2.1.1 高产乳酸乳酸菌的初筛
10株乳酸菌在改良MRS固体培养基上的生长情况见图1。
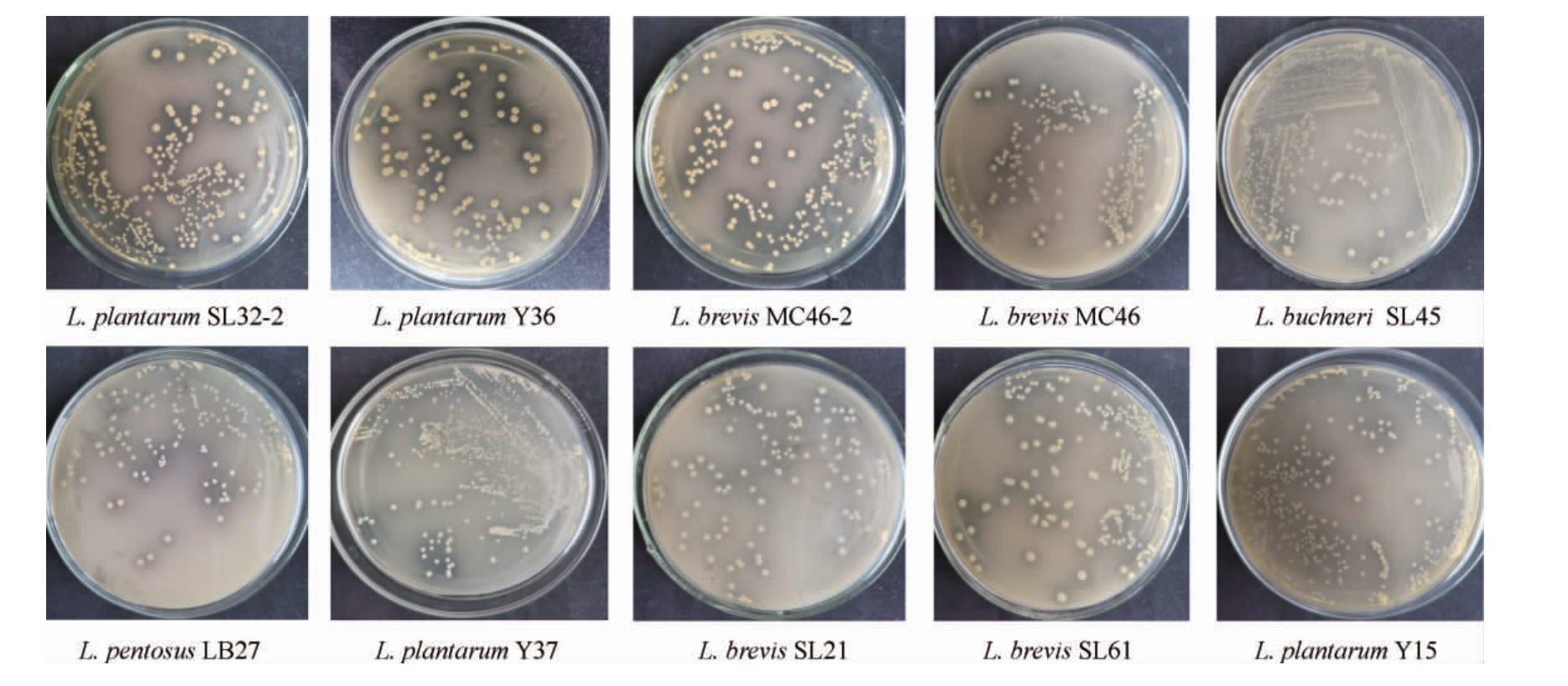
图1 10株乳酸菌在改良MRS固体培养基上的生长情况
Fig.1 Growth of 10 strains of lactic acid bacteria on modified MRS solid medium
由图1可知,L.plantarum SL32-2、L.plantarum Y36和L.brevis MC46-2的单菌落周围的溶钙圈透明且边缘整齐清晰,说明这3株菌的产酸能力较高,其他7株菌的单菌落周围的溶钙圈透明度较低,说明其产酸的能力较低,不足以将培养基底部的碳酸钙溶解,无法准确测量菌落和透明圈的直径。因此,测定L.plantarum SL32-2、L.plantarum Y36和L.brevis MC46-2的单菌落直径(D)和透明圈直径(d),并计算D/d值,结果见表1。
表1 3株有明显溶钙圈的乳酸菌的产酸能力分析结果
Table 1 Analysis results of acid production ability of 3 strains of lactic acid bacteria with obvious calcification zone
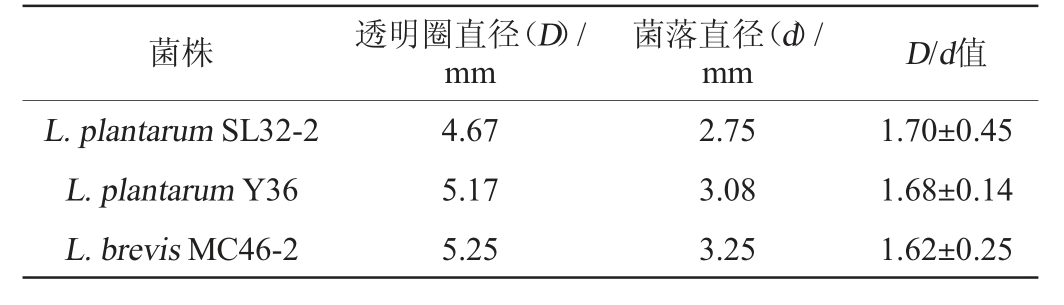
由表1可知,3株菌株中,L.plantarum SL32-2的产酸能力最强,D/d值为1.70,其次为L.plantarumY36(D/d值为1.68),L.brevis MC46-2的产酸能力最差,D/d值为1.62。
2.1.2 高产乳酸乳酸菌的复筛
由图2可知,10株乳酸菌产乳酸能力从大到小依次为SL32-2、Y36、MC46-2、Y37、MC46、SL21、YP15、SL61、SL45、LB27,其中L.plantarum SL32-2的产乳酸能力最强,其发酵上清中的乳酸含量为6.16 mg/mL,L.pentosus LB27的产乳酸能力最弱,其发酵上清中乳酸的含量为1.07 mg/mL。初筛时溶钙圈明显的3株乳酸菌(L.plantarum SL32-2、L.plantarum Y36和L.brevis MC46-2)在定量分析其发酵液中乳酸含量较其他菌株同样更高,这一结果与初筛结果相符。高若珊等[22]研究发现,鼠李糖乳杆菌(Lactobacillus rhamnosus)HCUL 1.1801-1912发酵酸浆时,其乳酸产量为2.37 mg/mL;高擎燏[23]研究发现,41株猪源乳酸菌在MRS培养基中发酵90 h后,产乳酸的能力各有差异,其中唾液乳杆菌(Lacto-bacillus salivarius)L26的产乳酸量最高为13.97 mg/mL;杜仁鹏等[24]研究发现,干酪乳杆菌(Lactobacillus casei)在MRS培养基中发酵72 h,乳酸含量达25.23 mg/mL;莫祺红[25]研究发现,凝结芽孢杆菌(Bacillus coagulans)在蔗糖培养基中发酵72 h时,乳酸含量为20 mg/mL;赵东等[10]研究发现,五粮液酒厂窖池发酵酒醅中的嗜酸乳杆菌(Lactobacillus acidophilus)在MRS培养基中发酵48 h,其产乳酸量为15.07 mg/mL;罗青春等[11]研究发现,分离自五粮液发酵酒醅中的布氏乳杆菌(Lactobacillus buchneri)R62和耐酸乳杆菌(Lactobacillus acetotolerans)R73在五粮粉液体培养基中发酵15 d,乳酸含量分别为11.79 mg/mL和11.64 mg/mL;雷振河[12]研究发现,汾酒酒醅中的蚯蚓状乳杆菌(Lactobacillus vermiforme)R-2、希氏乳杆菌(Lactobacillus hilgradii)R-7和R-8在高粱培养基中室温培养7 d后,乳酸含量分别为16.61 mg/mL、15.43 mg/mL和12.35 mg/mL。与文献报道菌株相比,本研究清香酒醅中的L.plantarum SL32-2的产乳酸能力虽然适中,但相较酒醅来源的其他乳酸菌,其产酸能力较高。
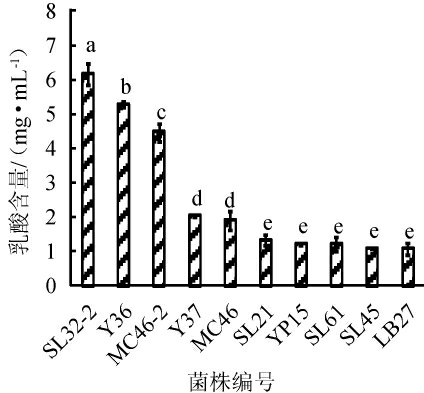
图2 10株乳酸菌产乳酸能力分析结果
Fig.2 Analysis results of acid production ability of 10 strains of lactic acid bacteria
不同小写字母表示差异显著(P<0.05)。下同。
2.2 L.plantarum SL32-2发酵高粱糖化液产乳酸条件研究
不同发酵温度和初始pH值对L.plantarum SL32-2产乳酸能力的影响见图3。
由图3可知,随着发酵温度和初始pH值的升高,L.plantarum SL32-2产乳酸的含量均呈现先增加后下降的趋势,当发酵温度和初始pH值分别为35 ℃和7.0时,L.plantarum SL32-2产乳酸能力均最强,其发酵上清液中的乳酸含量分别为2.74 mg/mL和3.77 mg/mL。高粱糖化液中含糖量较高,但是相较MRS培养基缺乏生长的盐离子、蛋白质、氮源等适宜乳酸菌生长的物质,所以当发酵培养基发生变化时,L.plantarum SL32-2产乳酸的含量也大幅下降。综上,确定L.plantarum SL32-2发酵高粱糖化液的最适温度和初始pH值分别为35 ℃和7.0。
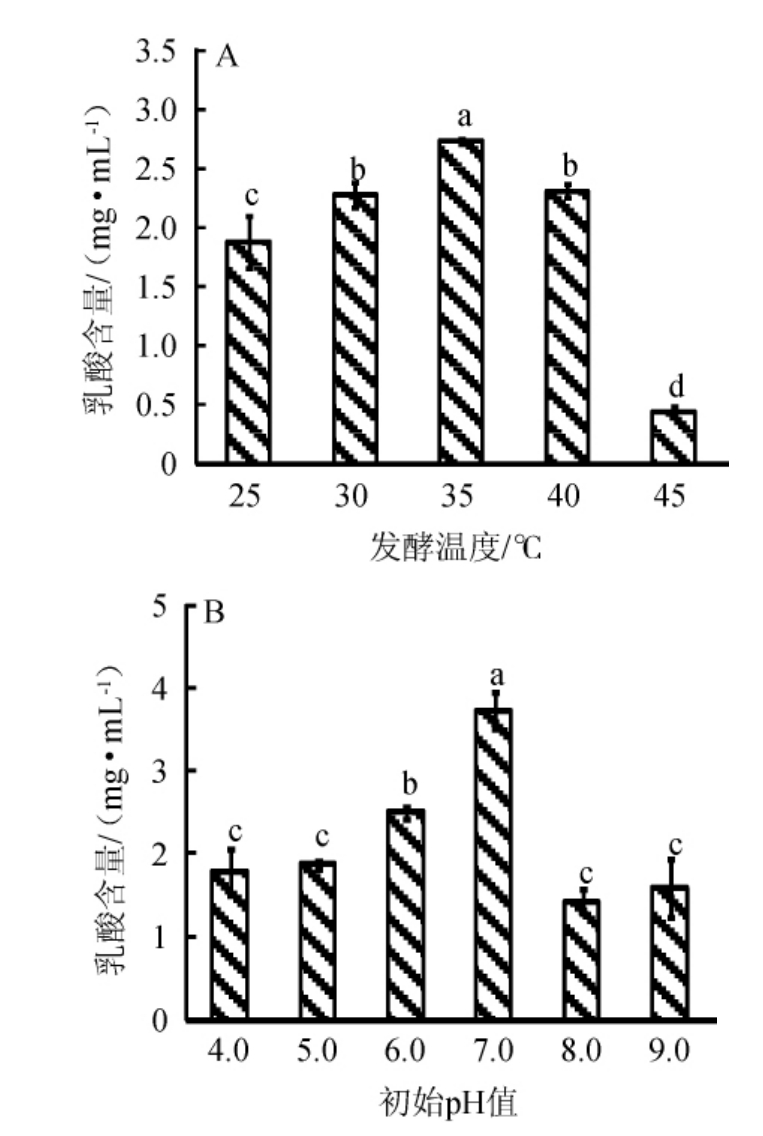
图3 发酵温度(A)及初始pH值(B)对植物乳杆菌SL32-2产乳酸能力的影响
Fig.3 Effect of fermentation temperature (A) and initial pH (B) on lactic acid production ability of Lactobacillus plantarum SL32-2
2.3 乳酸的分离纯化
2.3.1 活性炭纯化乳酸
在发酵结束后,采用高温对发酵上清液进行预处理,其中的蛋白质变性凝固,通过离心和过滤后将大量蛋白质去除,灭菌离心后蛋白质含量为0.08 mg/mL。发酵液中糖几乎被耗尽,灭菌离心后还原糖含量为0.82 mg/mL。但是经高温预处理后,发酵液颜色稍有加深。活性炭是常用的发酵液脱色剂,在提纯乳酸的过程中用于发酵液脱色、脱糖、脱蛋白。周丽亚等[15]采用活性炭提取乳酸乳杆菌(Lacto bacillus lactis)BME5-18M发酵液中的乳酸,发现粉末状活性炭的脱色效果要明显好于颗粒状活性炭。因此,本试验选用粉末活性炭对发酵上清液中的乳酸进行初步分离纯化,获得粗乳酸溶液,并考察不同活性炭添加量、处理温度和时间对脱糖率、脱色率和脱蛋白率以及乳酸损失率的影响,结果见图4。
由图4A可知,随着活性炭添加量的增加,脱糖率没有显著性变化(P>0.05),脱色率、脱蛋白率和乳酸损失率均呈现上升趋势。当活性炭添加量为3.0 g/100 mL时,脱色率(79.82%)、脱蛋白率(89.89%)较高,乳酸损失率(42.18%)也最大。相较活性炭添加量3.0 g/100 mL,当活性炭添加量为2.5 g/100 mL和2.0 g/100 mL时,脱色率均显著下降(P<0.05),分别为71.35%和73.86%,但是相较活性炭添加量2.5 g/100 mL,当活性炭添加量为2.0 g/100 mL时,乳酸损失率和脱蛋白率显著下降(P<0.05),分别为20.19%和81.73%。相较活性炭添加量2.0%,当活性炭添加量为1.5%时,脱色率和乳酸损失率均显著下降(P<0.05),分别为65.45%和8.53%,乳酸损失率比脱色率下降更多,考虑到活性炭对乳酸也有吸附作用,同时应用于工业生产中增加活性炭用量也会提高成本,将活性炭添加量确定为1.5 g/100 mL。

图4 活性炭添加量(A)、处理温度(B)和处理时间(C)对脱糖率、脱色率、脱蛋白率和乳酸损失率的影响
Fig.4 Effect of activated carbon addition (A),treatment temperature(B) and treatment time (C) on sugar removal,decolorization,deproteinization and lactic acid loss ratio
由图4B可知,由于还原糖在发酵过程中几乎被耗尽,所以随着处理温度的升高,脱糖率没有显著变化(P>0.05)。当处理温度为40 ℃时,发酵上清液中的残留蛋白几乎被大量去除,随着处理温度的升高,脱蛋白率没有显著变化(P>0.05)。随着处理温度的升高,脱色率呈现先上升后下降的趋势,当处理温度为60 ℃时,脱色率最高(69.62%),当处理温度高于60 ℃后,随着处理温度的升高脱色率反而下降。随着处理温度的升高,乳酸损失率在60 ℃之后呈现下降趋势,在80 ℃(2.47%)和90 ℃(2.58%)显著下降,说明随着处理温度升高,活性炭处理的发酵上清液乳酸含量有所增加。一般来说,温度升高,分子运动速度加快,吸附物质进入吸附剂小孔的机会增加,有利于物质被吸附,但如果温度过高,物质的解吸附速度也会增大,所以随着温度的升高脱色效果会下降,乳酸的损失率也有所降低[26]。综合考虑,确定活性炭的最佳处理温度为60 ℃。
由图4C可知,随着活性炭处理时间的延长,脱糖率、脱蛋白率和乳酸的损失率均没有显著变化(P>0.05)。脱色率随着处理时间的延长呈现上升趋势,直至2 h后趋于平衡。综合考虑,确定活性炭的最佳处理时间为2 h。
2.3.2 离子交换法纯化乳酸
在活性炭添加量为1.5 g/100 mL,处理时间为2 h,处理温度为60 ℃的条件下初步分离纯化发酵上清液中的乳酸,获得粗乳酸溶液。采用离子交换法对粗乳酸溶液进行进一步纯化,经001×7阳离子和201×7阴离子交换柱分离得到乳酸溶液(即流出液),以及用80 ℃去离子洗脱201×7阴离子交换柱得到的乳酸溶液(即洗脱液),不同处理后的乳酸含量及得率见表2。
表2 不同处理后乳酸的含量及得率
Table 2 Contents and yield of lactic acid after different treatments
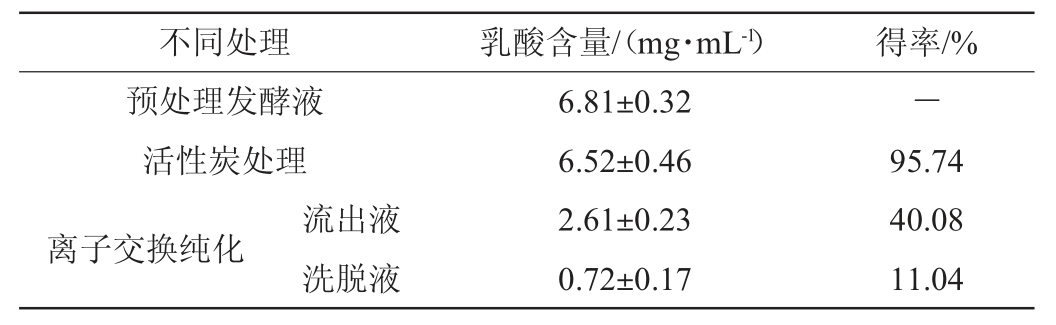
由表2可知,经活性炭分离纯化后,乳酸得率为95.74%;经离子交换柱纯化后的流出液中乳酸得率为40.08%,经高温去离子水洗脱阴离子交换柱后的洗脱液中乳酸得率为11.04%,经离子交换柱纯化后的乳酸总得率为51.12%。李坤朋[14]利用活性炭和离子交换柱从L-乳酸大肠杆菌工程菌发酵液中提纯乳酸时,乳酸的总收率为64%;周丽亚等[15]利用活性炭和离子交换柱从乳酸乳杆菌(Lactobacillus lactis)BME5-18M发酵液中提取乳酸,在最佳处理条件下乳酸收率可达65.8%。相较而言,本研究中离子交换纯化后乳酸的总收率低于文献报道,在进一步研究中仍需要继续优化其纯化条件。
2.3.3 乳酸纯度的检测
进一步利用HPLC法检测预处理后发酵上清液、粗乳酸溶液、流出液和洗脱液中乳酸的纯度,结果见图5。
由图5可知,阴离子交换柱洗脱液中杂峰较少,说明用高温去离子水洗脱阴离子交换柱时的洗脱液中乳酸的纯度较高。
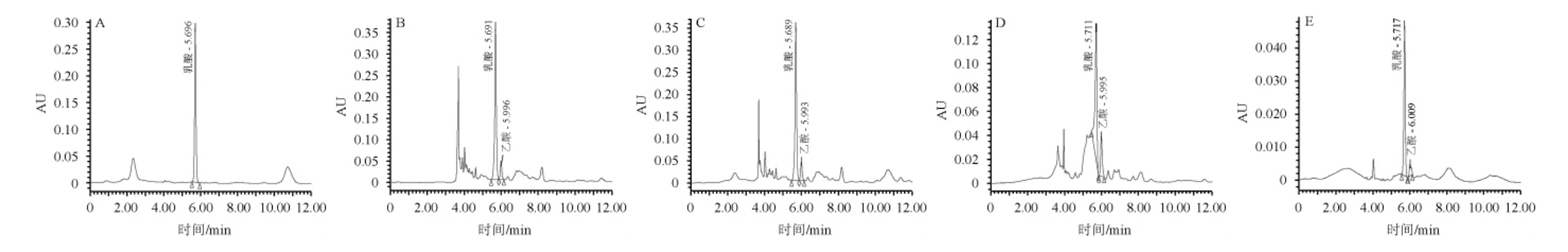
图5 乳酸标品及不同处理后乳酸溶液的高效液相色谱图
Fig.5 High performance liquid chromatograms of lactic acid standards and lactic acid solutions after different treatments
A:乳酸标品;B:预处理发酵液;C:活性炭处理后粗乳酸溶液;D:流出液;E:洗脱液。
3 结论
本研究采用溶钙圈法和液体发酵法从清香型白酒酒醅来源的10株乳酸菌中筛选得到一株高产乳酸的L.plantarum SL32-2,其发酵高粱糖化液产乳酸的最优发酵温度和初始pH值分别为35 ℃、7.0。使用活性炭对其发酵液中的乳酸进行纯化,最适处理条件为活性炭添加量1.5 g/100 mL、处理温度60 ℃、处理时间2 h,此时脱色率、脱糖率和脱蛋白率分别为72.65%、3.75%和85.81%。经离子交换柱进一步纯化后,乳酸总得率为51.12%,其中阴离子交换柱的洗脱液中乳酸纯度较高。本研究结果为高品质清香型白酒的工业化生产提供思路和实验基础。
[1]张治刚,张彪.中国白酒香型演变及发展趋势[J].中国酿造,2018,37(2):15-18.
[2]王梦菡.超高效液相色谱法测定不同香型白酒中乳酸和乙酸的含量[J].食品安全导刊,2021(28):75-76.
[3]邓世彬.降低浓香型白酒中乳酸乙酯含量的研究[J].现代食品,2019(18):84-85.
[4]陈申习,唐洁,张龙,等.清香型小曲白酒机械化生产中微生物动态变化研究[J].中国酿造,2018,37(6):68-72.
[5]杜海,邢敏钰,徐岩.芝麻香型白酒酿造过程中乳酸菌分离及其碳源利用特征[J].食品与发酵工业,2018,44(1):13-18.
[6]谢玉球,钟雨,谢旭,等.乳酸菌在固态法白酒生产中的地位与作用[J].酿酒科技,2008(11):83-86.
[7]董玲,李露,郭云建,等.一株高产乳酸菌株的鉴定及其发酵特性研究[J].中国酿造,2021,40(2):128-132.
[8]孙浩轩,周卫强,杨硕,等.微生物制备高光学纯度L-乳酸的研究进展[J].食品与发酵科技,2021,57(5):91-96,112.
[9]梁诚.乳酸生产、应用及市场前景[J].广西化工,2000,29(4):37-38,55.
[10]赵东,杨蓉,彭志云,等.五粮液酒醅中乳酸菌的分离鉴定[J].酿酒科技,2013(6):54-56,60.
[11]罗青春,郑佳,赵东,等.浓香型白酒中优势乳酸菌和酵母菌间的相互关系[J].应用与环境生物学报,2019,25(5):1192-1199.
[12]雷振河.汾酒发酵主要有机酸成分分析与产酸细菌的鉴定[J].酿酒,2011,38(4):24-28.
[13]吕哲,周卫强,田博,等.乳酸分离技术研究进展[J].当代化工,2021,50(4):917-923.
[14]李坤朋.大肠杆菌工程菌HBUT-L的构建、发酵及其乳酸分离研究[D].武汉:湖北工业大学,2013.
[15]周丽亚,高静,黄志红,等.由乳酸铵发酵液提取乳酸的研究[J].河北工业大学学报,2005,34(2):9-13.
[16]李肖,李海洋,房艳华,等.饲用优良乳酸菌鉴定及生物学特性研究[J].西北农业学报,2017,26(11):1655-1663.
[17]郭延清.溶钙圈法对浆水中乳酸菌的筛选[J].生物学教学,2020,45(8):58-59.
[18]卢艳丽.酵母发酵麦麸生产乳酸的研究[D].天津:天津科技大学,2018.
[19]白丽真,刘洪银,刘伟,等.超高效液相色谱法检测白酒中乳酸含量的方法及方法确认[J].酿酒科技,2020(1):75-77.
[20]王俊丽,聂国兴,李素贞,等.DNS法测定还原糖含量时最适波长的确定[J].河南农业科学,2010,39(4):15-118.
[21]赵彤彤.植物乳杆菌p-8羟基脂肪酸脱氢酶的原核异源表达与生物信息学分析及其酶学性质研究[D].呼和浩特:内蒙古农业大学,2019.
[22]高若珊,杨春华,王冰,等.一株耐高温诱变鼠李糖乳杆菌产酸条件优化及其特性分析[J].中国食品学报,2022,22(4):208-216.
[23]高擎燏.猪源益生性乳酸菌分离筛选及其在发酵饲料中的应用研究[D].南京:南京农业大学,2015.
[24]杜仁鹏,赵丹,王晓宇,等.1株乳酸高产菌的分离鉴定与系统发育分析[J].中国食品学报,2017,17(9):243-250.
[25]莫祺红.优良泡菜乳酸菌的筛选及其发酵性能研究[D].南宁:广西大学,2008.
[26]陈超,沐万孟,江波,等.苯乳酸发酵液脱色工艺及吸附方程的探讨[J].化学工程,2009,37(7):4-8.